鞘脂代谢在非酒精性脂肪性肝病中的作用及机制研究
2022-11-19郑素军
梁 晨, 白 丽, 郑素军
1.首都医科大学附属北京佑安医院肝病中心,北京 100069; 2.肝衰竭与人工肝治疗研究北京市重点实验室
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是我国乃至全球最常见的慢性肝脏疾病,发病率高达25%,可能由单纯肝脏脂肪变性进展为非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)、肝纤维化、肝硬化,甚至肝癌[1-2]。当前,NAFLD年轻化、大众化趋势日益显著,已成为重要的公共健康问题之一。因此,深入探究NAFLD的发病新机制,以期获得新的有效治疗策略已成为目前亟待解决的问题。鞘脂(sphingolipids, SLs),特别是神经酰胺(ceramide,Cer)和1-磷酸鞘氨醇(sphingosine-1-phosphate,S1P),参与细胞增殖、分化、基因表达及凋亡等生理过程,具有重要的生物活性[3-4]。目前已有研究利用NAFLD的细胞和动物模型证明,鞘脂参与了NAFLD的发生发展过程,调控鞘脂代谢可以减轻或延缓NAFLD病理学改变或进展[5]。铁死亡是铁依赖的脂质过氧化物过量蓄积诱发的细胞死亡,已被证明参与NAFLD的发生发展。鞘脂是否通过铁死亡调控NAFLD尚不清楚。本文将对鞘脂代谢及其在NAFLD中的作用,以及铁死亡与鞘脂、NAFLD的关系作一概述,以期为开发NAFLD新的治疗策略提供思路。
1 鞘脂结构及代谢过程
鞘脂是一种以鞘氨醇为骨架、结构复杂的两性脂类,在真核生物的细胞膜中普遍存在,也是调控细胞生长、分化、衰老和凋亡的信号分子。鞘脂主要包括神经酰胺类、鞘氨醇(sphingosine,Sph)类、鞘磷脂(sphingomyelin,SM)等。神经酰胺是鞘脂生物合成、分解代谢的中心,主要通过从头合成、补救合成、神经鞘磷脂水解三种途径产生,可被神经酰胺合成酶(CerS1、CerS2、CerS3、CerS4、CerS5和CerS6)、鞘氨醇激酶、鞘氨醇裂解酶等催化分解,形成各种复杂鞘脂(如鞘磷脂等)。从头合成途径开始于内质网,丝氨酸和棕榈酰辅酶A在丝氨酸棕榈酰转移酶催化下缩合生成3-酮-二氢鞘氨醇,随后被还原成二氢鞘氨醇(dihydrosphingosine, dhSph),在神经酰胺合成酶作用下连接长链或超长链脂肪酸后形成二氢神经酰胺(dihydroceramide,dhCer),再被二氢神经酰胺脱氢酶还原生成神经酰胺。补救合成途径是指复杂鞘脂在溶酶体内被降解为鞘氨醇,鞘氨醇通过与替代酰基辅酶A进行再酰化合成神经酰胺。神经鞘磷脂水解途径是指鞘磷脂在碱性、中性和酸性鞘磷脂酶的作用下水解为神经酰胺。其中,酸性鞘磷脂酶占总神经酰胺酶活性的90%,在多种病理生理功能中起着重要作用[3-4](见图1)。
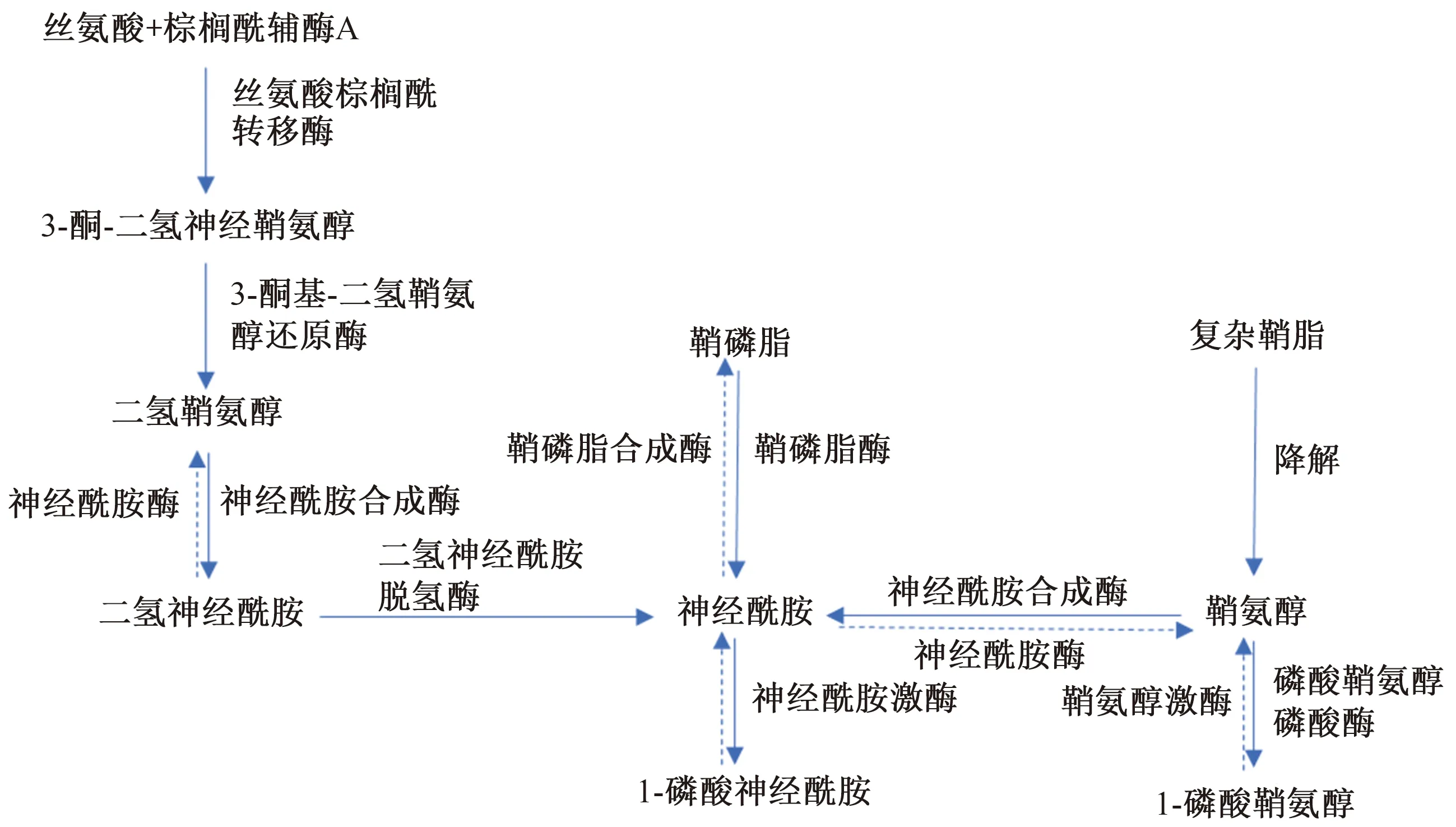
图1 鞘脂类化合物的代谢过程
2 鞘脂代谢在NAFLD中的作用
NAFLD是代谢综合征的肝脏表现,其主要特征是肝脏脂质合成(即游离脂肪酸摄取和脂质从头合成)的能力超过了脂质水解和利用(即脂肪酸氧化和极低密度脂蛋白产生)的能力,最终导致肝脏游离脂肪酸慢性过度蓄积。NAFLD的不同阶段涉及多种生物学过程,包括脂质代谢、细胞增殖与凋亡、胰岛素抵抗(insulin resistance, IR)、炎症、纤维化等[6]。近年研究显示,鞘脂及其相关产物参与NAFLD上述生物学过程的调节,具体如下。
2.1 脂质代谢基础方面有学者报道[7-8],在高脂饲料(high fat diet group,HFD)喂养的NAFLD大鼠模型中,肝脏鞘脂含量显著增加,其中,有研究[7]认为,肝脏鞘脂含量增加与神经酰胺代谢相关的酶的表达增加有关,与酸性鞘磷脂酶无关;另一研究[8]证明,肝脏鞘脂的积累是由于PI3K/Akt/mTOR信号通路的激活所引起的。临床方面,本团队分析了慢性丙型肝炎病毒(hepatitis C virus,HCV)相关脂肪变性与血浆鞘脂的关系,发现在慢性丙型肝炎(chronic hepatitis C,CHC)(尤其是基因型2型)患者中,血浆鞘磷脂(d18∶1/22∶0)水平与肝脏脂肪变性成正相关[9]。这表明,鞘脂可能与NAFLD密切相关。FFA可通过扩散作用进入细胞,但部分长链脂肪酸(如棕榈酸)需要由脂肪酸转运蛋白家族(fatty acid transport protein,FATPs)、脂肪型脂肪酸结合蛋白(adipocyte fatty acid binding protein,FABPM)、脂肪酸转位酶(CD36/FAT)等蛋白质介导转运[10]。值得注意的是,不同CerS合成的神经酰胺在碳链长度、组织分布和功能上均有差异。CerS2是CerS生成超长链神经酰胺(C22-24)的主要亚型[11]。研究[12]显示,提高CerS2表达水平或外源性予以C22-24治疗,可以恢复CD36/FAT对游离脂肪酸的正常摄取,并纠正CD36/FAT的错误定位。CerS2表达不足可导致CerS6代偿性上调,使长链神经酰胺C16代偿性增加,通过抑制线粒体β-氧化加重脂肪变性[13]。相反,CerS6+/-小鼠中C16表达减少,线粒体β-氧化增加,CD36/FAT表达减少,肝脏脂质的利用率增加[14]。因此,不同长度神经酰胺间的平衡对于肝脏中游离脂肪酸摄取、储存和代谢稳态至关重要,CerS2和CerS6可能成为治疗饮食诱导的代谢性疾病的靶点。
2.2 细胞增殖与凋亡NAFLD进展的病理生理机制主要涉及内质网应激(endoplasmic reticulum stress,ERS)、伴随的未折叠蛋白反应(unfolded protein response,UPR)失调、自噬(autophagy)和凋亡(apoptosis)[15]。酸性鞘磷脂酶可通过破坏Ca2+稳态来诱导ERS,还可以通过作用于自噬以及调节溶酶体膜通透性增加(lysosomal membrane permeabilization,LMP)调节脂质和葡萄糖的代谢[16]。dhCer抑制了游离脂肪酸介导的人肝细胞的自噬水平,导致TG在肝脏中蓄积[17]。酸性鞘磷脂酶和神经酰胺被证明是肿瘤坏死因子(tumor necrosis factor,TNF)介导的肝细胞凋亡信号通路的关键酶,抑制酸性鞘磷脂酶和CerS2的活性可以减弱细胞凋亡[18-19]。一些鞘脂,如S1P,除通过Ras/Raf/MEK/ERK、PI3K/Akt等途径发挥抗凋亡作用外,还可以通过上调人肝窦内皮细胞产生IL-6和血管内皮生长因子,促进肝细胞增殖[20]。另外,我们之前的研究发现,糖鞘脂代谢的关键酶-葡萄糖神经酰胺合成酶(glucosylceramide synthase,GCS)可以通过bcl-2/bax通路调控体外肝细胞(HL-7702)的增殖和凋亡[21]。
2.3 IRIR是NAFLD发生发展的关键过程之一。IR可抑制线粒体β氧化,导致脂肪在肝脏沉积,促进NAFLD发生。近年来一些学者对不同种类鞘脂和IR的关系进行了研究。Zhou和Summers团队用含短链神经酰胺(C2)的培养液培养肝细胞后发现,C2通过抑制Akt激酶的活性,除了可以抑制神经酰胺诱导的细胞凋亡外,还能导致IR[22-23]。Sztolsztener等[8]发现,Sph和dhSph(而非神经酰胺)的过度积累导致了HFD诱导的时间依赖性IR。随后有学者对鞘脂代谢途径相关的酶和IR之间关系进行研究。结果[13]表明,CerS2缺乏造成CerS6代偿性升高,特异性增加了C16和C18的表达,并导致HFD诱导的IR,而CerS6缺乏能减轻HFD诱导的IR。上述研究均表明,鞘脂及其衍生物影响了IR的稳态水平。
2.4 炎症20%~30%的NAFLD患者会进展到NASH,其进展的关键病理改变是肝细胞在脂肪变性的基础上出现炎症和坏死。目前的动物及细胞研究均已证实,S1P是与NAFLD炎症最直接相关的鞘脂代谢产物,调控其代谢的酶为鞘氨醇激酶(sphingosine kinase,SphK)。研究[24]显示,在NAFLD患者和经高饱和脂肪酸(saturated fatty acids,SFA)饮食喂养的NAFLD小鼠模型中,肝脏SphK水平升高了2倍,且伴有NF-κB激活、促炎细胞因子表达增加及免疫细胞浸润;而SphK1基因敲除小鼠的促炎因子水平较低,免疫细胞浸润减少。体外细胞实验证明,敲除SphK1可减弱SFA诱导的NF-κB激活、促炎细胞因子TNF-α和MCP1 mRNA表达下调;利用SphK1抑制剂(FTY720)预处理可抑制炎症的发展,进一步支持了SphK1信号通路在NAFLD炎症中的作用。不同的神经酰胺对NAFLD炎症也会产生不同的作用。有研究通过动物及体外细胞实验发现,碱性神经酰胺酶3(alkaline ceramidase 3,ACER3)缺乏可抑制CerS分解代谢,使CerS1的产物C18∶1水平增高,减轻NASH中的炎性反应,但不能减轻脂肪变性[25]。另外,本团队前期验证了慢性乙型肝炎(chronic hepatitis B, CHB)患者血清鞘脂表达水平与肝组织活检炎症分级的关系,发现在CHB患者中,血清鞘磷脂(d18∶1/24∶0)水平与肝组织炎症程度呈负相关[26]。
2.5 纤维化纤维化是具有不良肝脏结局的NAFLD患者的主要病理学改变。近年研究报道,鞘脂参与NAFLD的纤维化。酸性鞘磷脂酶通过调节肝星状细胞中的溶酶体组织蛋白酶促进肝纤维化,而阿米替林可抑制溶酶体中酸性鞘磷脂酶,从而减轻肝纤维化。另外,酸性鞘磷脂酶还被发现通过作用于TNF/Fas诱导的肝细胞凋亡以促进肝纤维化[27]。诸多研究表明,S1P可通过趋化免疫细胞和骨髓间充质干细胞改善肝纤维化。S1P/S1P(3)信号通路通过介导骨髓间充质干细胞的归巢,在胆汁淤积诱导的肝纤维化中发挥重要作用[28]。有学者[29]将肝癌及肝转移瘤患者的非肿瘤肝组织按不同纤维化程度进行分组并对比,发现S1P可能在肝脏中生成,后转运到细胞外,并与其特异性受体结合,在肝脏纤维化或炎症中发挥作用。本团队前期基础研究[30]发现,S1P/S1P受体通过诱导肝内肌成纤维细胞的定向迁移参与人肝纤维化的发生发展;临床研究[31]发现,血浆HexCer(d18∶1/12∶0)与CHC重度肝纤维化密切相关,可能是CHC重度肝纤维化的潜在标志物。另外,研究证明dhCer通过抑制自噬促进肝纤维化[17]。此外,有学者[32-33]对NAFLD患者的肝组织进行了鞘脂谱分析,结果发现神经酰胺含量普遍增加,且单纯脂肪变性和NASH患者中Cer的差异存在统计学意义。增加的神经酰胺均来自于鞘脂从头合成途径,由dhCer浓度决定。研究提示丝氨酸棕榈酰转移酶的异常可能在脂肪变性引起的NASH的进展中发挥作用。
3 鞘脂、NAFLD与铁死亡的关系
铁死亡是一种非凋亡调节性细胞死亡形式,其特征是铁依赖的活性氧(reactive oxygen species,ROS)产生过多,导致谷胱甘肽(reduced glutathione,GSH)依赖的脂质过氧化物蓄积。铁死亡可通过抑制胱氨酸/谷氨酸逆向转运体系统或谷胱甘肽过氧化物酶4(glutathione peroxidase 4, GPX4)活性被诱发[34]。
Novgorodov等[35]的研究发现,谷氨酸诱导的细胞内GSH下降可导致酸性鞘磷脂酶激活和鞘氨醇水平上调,进而抑制线粒体呼吸链,促使ROS生成、线粒体通透性转换孔开放和铁死亡。而SIRT3作为一种多效性基因,可通过刺激和特异性靶向底物的方式调控多种细胞死亡途径(包括酸性鞘磷脂酶/鞘氨醇介导的铁死亡途径),发挥保护作用。另有学者[36]对鞘脂和铁死亡间的关系进行了研究,结果发现,酸性鞘磷脂酶介导的氧化还原激活了GPX4的自噬降解,最终导致了脂质过氧化和铁死亡,并且NADPH氧化酶依赖的ROS蓄积和酸性鞘磷脂酶激活之间存在正反馈调节环路,进一步加重铁死亡。
约1/3的NAFLD患者的肝脏中存在铁超载。代谢功能障碍引起的铁超载可加重NASH患者的肝损伤,而减轻铁超载后可以改善肝损伤。铁超载被认为是铁死亡的生化特征,而铁死亡的标志之一—ROS相关的氧化应激已被证实在NASH发生发展中起着重要作用[37]。这些结果提示,铁死亡可能在NAFLD患者向NASH转换中发挥重要作用。下列研究结果支持该推测:(1)日本学者[38]利用胆碱缺乏同时补充蛋氨酸饮食建立了NAFLD小鼠模型,他们发现在NAFLD向NASH发展的初始阶段,抑制铁死亡引起的炎症和脂质过氧化能改善肝功能,阻止NASH的发生;(2)Valenti等[39]利用蛋氨酸-胆碱缺乏(methionine-choline-deficient,MCD)饲料喂养小鼠构建NASH小鼠模型,并发现其肝脏中存在多不饱和脂肪酸代谢增强、铁蓄积、ROS蓄积、线粒体异常和铁代谢相关基因表达增加。而应用铁死亡抑制剂(Fer-1)可以抑制上述表现,减轻肝脏脂肪变性、肝脏损伤、炎症和纤维化;(3)机制上,GPX4抑制剂(RSL-3)能够诱导MCD-NASH小鼠的铁死亡以促进NASH的进展,而GPX4激活剂(亚硒酸钠)可改善NASH的严重程度[40]。另外,Tβ4可以通过上调GPX4表达、抑制铁死亡,从而减轻NAFLD。Fer-1可增强Tβ4对肝细胞的保护作用,而铁死亡激活剂(erastin)则减弱了Tβ4的保护作用[41]。
由上可知,鞘脂可以激活铁死亡信号通路,铁死亡又在NAFLD疾病进展中起着重要作用。因此,铁死亡可能是鞘脂调控NAFLD的一个潜在通路(见图2)。
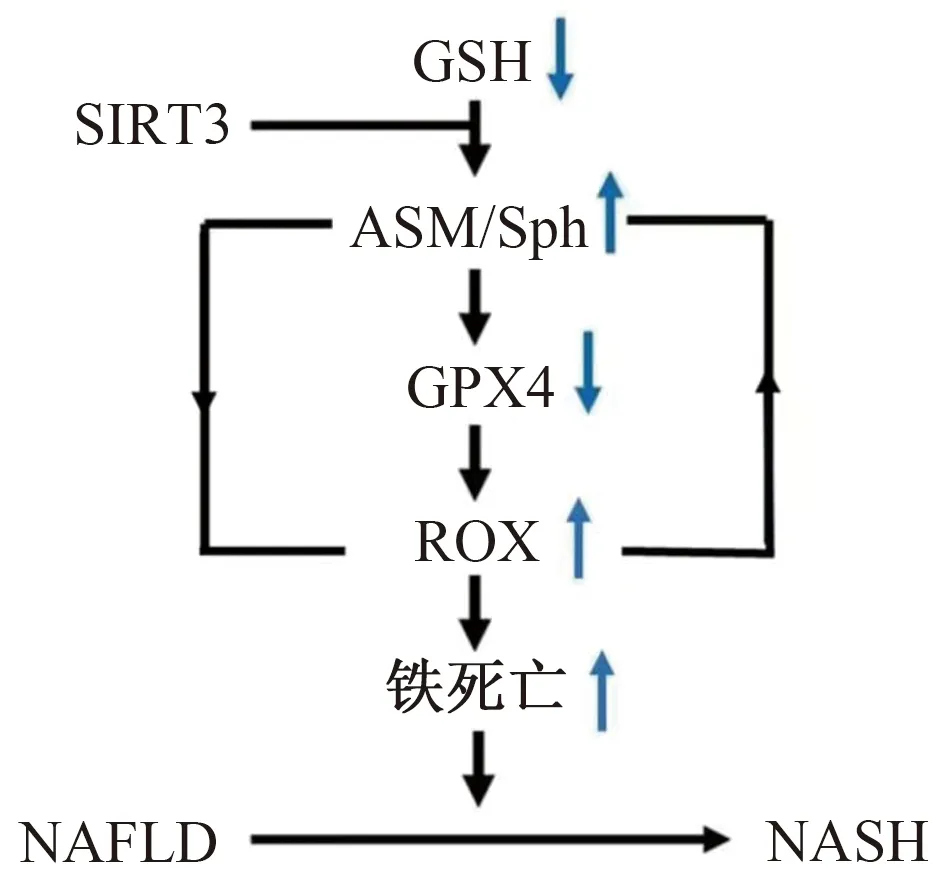
图2 鞘脂和铁死亡在NAFLD进展中的潜在机制
4 结语与展望
综上,过量FFA诱导的鞘脂代谢和鞘脂谱的改变可能在NAFLD的各个过程发挥作用。不同鞘脂及其代谢关键酶对NALFD的作用不同。除了目前已经报道的鞘脂代谢通路外,酸性鞘磷脂酶还可能通过调控GPX4的表达抑制铁死亡,进而减轻NAFLD,从而有望成为未来治疗NAFLD的新靶点。准确理解鞘脂代谢在NAFLD中的作用,铁死亡与鞘脂、NAFLD间的关系,有利于寻找并发现NAFLD的治疗新策略。
