3D打印纯钛骨支架表面掺银介孔生物活性玻璃涂层的性能研究
2022-11-18赵雪阳尤德强于振涛王小健
陈 倩,赵雪阳,尤德强*,曾 戎,于振涛,李 卫,王小健*
(1 暨南大学 先进耐磨蚀及功能材料研究院,广州 510632;2 暨南大学 化学与材料学院,广州 510632)
钛及钛合金具有密度小、力学性能优异、耐腐蚀性能优异、良好的生物相容性以及较低的弹性模量(仅约为不锈钢的53%,与人体自然骨的弹性模量更为接近)等优点[1],广泛应用于牙科和骨科等医用领域[2-5]。然而钛及钛合金的弹性模量为55~117 GPa,而人骨的弹性模量为10~30 GPa,不匹配的弹性模量会造成“应力屏蔽”效应,导致种植体周围出现骨吸收,最终导致种植体松动或断裂[6-9]。同时,致密金属与人体组织之间的界面结合较弱,缩短了植入物的使用寿命。
为了解决上述问题,设计具有多孔结构的植入物是一种有效的策略。不同于传统制造技术,增材制造(additive manufacturing,AM)技术,又称3D打印,不仅能精确控制植入体内部多孔结构,同时能制备复杂结构的外形,缩短加工周期及减少环节,因而在个性化定制方面具有独特优势[10]。采用AM技术制备的多孔钛植入体具有低弹性模量、质轻及促进骨组织向内生长等一系列优点[11-12]。目前,AM技术主要包括激光选区熔化(SLM),电子束熔化(EBM),熔融沉积成形(FDM),选择性激光烧结(SLS),光固化立体成形(SLA)等。其中,SLM所制造的金属零件具有较高的表面质量及制件致密度高等优点,尺寸精度可达20~50 μm,致密度近乎100%[13]。
然而,通过SLM技术制备的钛及钛合金支架表面仍为生物惰性,支架表面覆盖着一层致密的TiO2薄膜,阻碍了与骨组织的直接结合[14-15]。因此,有必要对钛及钛合金种植体进行改性,以提高表面生物活性。研究表明,改变钛植入体表面形貌使其变得粗糙有利于生物矿化以及成骨细胞的附着、增殖和分化,但粗糙的表面也为细菌生长提供了一个良好的环境。此外,材料的表面形态结构的改变并不能赋予材料生物活性。另外一些研究利用酸或碱处理,在多孔钛合金表面生成一层生物活性良好的氧化钛层[16],但酸处理会减弱多孔钛的力学性能[16-17],而碱热处理使钛表面的改性层易产生裂纹[18]。陶瓷涂层常常被用来提高钛植入体的生物活性[19]。由于独特的结构和组成,介孔(mesoporous 2~50 nm)生物活性玻璃(MBG)被认为是一种很有前途的无机生物材料,它满足骨再生的三个关键条件:骨传导性、骨诱导性和骨整合性,可以直接和骨结合并生长。同时,由于MBG具有大的比表面积、有序的介孔结构、可控的孔径和孔体积,可用作控制药物和生长因子释放的载体[20]。因此,本研究采用MBG作为涂层对钛合金支架进行表面改性。
钛合金植入体在手术后的细菌感染问题在临床上是一个不容忽视的问题。一旦感染发生,细菌迅速黏附于种植体表面并迅速增殖,形成致密的生物膜,阻止后续的骨组织生长[21-22]。致密的生物膜已被证实能极大地抑制抗生素在体内对细菌的杀灭作用。但如果植入物本身具有较强的抗菌能力,在植入初期就能有效杀灭细菌,有望提高因细菌感染引起的翻修手术的成功率。在众多抗菌金属元素中,银具有广谱抗菌,能高效杀菌以及不易产生抗药性等优点受到广泛关注[23]。因此,在钛及钛合金支架上引入Ag掺杂的介孔生物活性玻璃涂层有望提高支架的抗菌性及生物活性,延长植入物的使用寿命。
本工作设计并制备了一种金刚石结构3D打印钛支架(孔隙率68%,孔径650 μm)。采用浸渍提拉法将掺杂Ag的MBG涂层涂覆在3D打印钛支架上。研究不同Ag含量MBG涂层多孔支架的理化性能、体外矿化性能、抗菌性能以及细胞相容性。
1 实验材料与方法
1.1 多孔钛支架的设计与制备
本实验设计并制备了一种孔隙率为68%,孔径为650 μm[24]的钛支架,通过Solidworks设计了金刚石结构的支架微元,再导入Magics进行阵列得到支架模型(如图1所示),对支架模型进行逐层剖分后将剖分完成后的数据包导入3D打印机。
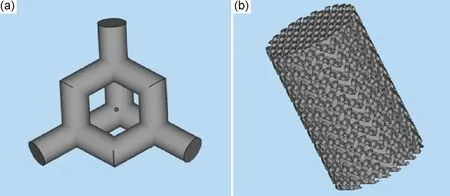
图1 支架的金刚石结构微元(a)和阵列得到的支架模型(b)
实验中使用的纯钛粉由西安铂力特有限公司提供,粉末的粒度分别为d0.1= 25.1 μm,d0.5= 37.8 μm,d0.9= 56.5 μm,化学成分如表1所示。所使用的设备为西安铂力特公司的BLT-S200金属3D打印机设备,该设备配备了Ytterbium (Yb)光纤激光器。
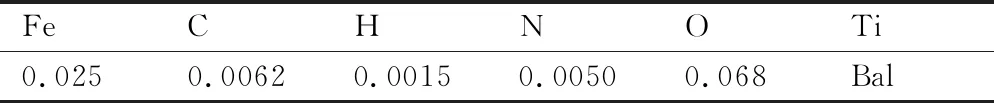
表1 CP-Ti粉末的化学成分(质量分数/%)
在制备钛支架时,通入氩气作为保护气,当氧含量下降到0.08%以下时开始打印。具体工艺参数如表2所示。本实验制备的钛支架直径10 mm,高度为20 mm,打印完成后,使用线切割将试样从基板上切下来,然后将支架切割成厚度为2 mm的圆片。为了去除未熔化的粉末,使用Kroll试剂(2% HF和3% HNO3)对圆片进行超声清洗,清洗时间为15 min,之后不停使用无水乙醇(≥99.9%)进行超声清洗,直到酒精中没有未熔化的粉末颗粒。

表2 SLM选用的技术参数
1.2 介孔生物活性玻璃的合成
采用蒸发诱导自组装法(EISA)合成了摩尔分数为80%SiO2-15%CaO-5% P2O5的介孔生物活性玻璃(MBG)。非离子表面活性剂Pluronic F127 (EO106PO70EO106,Mn=12600,Sigma)被用作结构导向剂,正硅酸乙酯(TEOS,Casmart),磷酸三乙酯(TEP,Casmart)和四水合硝酸钙(Ca(NO3)2·4H2O,广州东巨实验仪器有限公司)作为SiO2,P2O5和CaO的来源。将7 g F127以及60 g无水乙醇置于250 mL的烧杯中,在60 ℃恒温磁力搅拌器中搅拌直到F127完全溶解,然后将磁力搅拌器温度下调至35 ℃。温度稳定到35 ℃后,加入1 g 2 mol/L的硝酸以及6.7 g TEOS,搅拌反应30 min,加入0.73 g TEP,继续搅拌30 min,最后加入1.4 g Ca(NO3)2·4H2O,在35 ℃下持续搅拌24 h,最终得到透明澄清的溶胶。将溶胶密封静置在室温下老化24 h,最后将其敞口置于60 ℃烘箱中干燥24 h,得到MBG凝胶。将得到的凝胶在700 ℃煅烧去除模板剂,升温速度为2 ℃/min,之后在玛瑙研磨钵中将粉末研细,用于后续表征。生物玻璃(BG)的制备方法与MBG相似,不同的是,合成BG不需要加入结构导向剂F127,同时将无水乙醇替换成去离子水。
1.3 涂层支架的制备
为了制备具有抗菌性的介孔生物玻璃,在合成掺杂Ag/MBG的过程中,以Ag取代部分Si,保持Ca/P的摩尔比不变。其中Ag是以AgNO3的形式引入的,步骤与制备MBG一致,在添加完Ca(NO3)2·4H2O后加入AgNO3,整个过程需要避光以防止AgNO3见光分解。Ag/MBG的具体成分如表3所示。搅拌24 h 后得到掺杂Ag的溶胶,将2 mm厚的支架圆片放置于浸渍提拉仪上,以200 μm/s的速度进行提拉,提拉后将样品置于样品吹干机上干燥15 min,为了获得厚度均匀适中的涂层,进行2次提拉。之后将得到的涂层支架于室温密封老化一天,再在60 ℃干燥箱中敞口干燥一天,最后对支架进行煅烧处理,煅烧温度为700 ℃,升温速度为2 ℃/min。未添加模板剂的生物玻璃记作BG,添加了模板剂并掺杂摩尔分数分别为0%, 0.5%,1%,1.5% Ag的生物玻璃依次记作MBG,0.5Ag,1Ag,1.5Ag。

表3 介孔生物玻璃的成分
1.4 测试与性能表征
采用JEM 2100F透射电子显微镜(TEM)观测生物玻璃粉末的微观形貌,采用PhenomXL扫描电子显微镜(SEM)观察涂层支架的形貌,并使用配套的EDS能谱进行元素分析,采用UltimaIV X射线衍射仪(XRD)对生物活性玻璃进行物相分析,采用NOVA 2000e多点氮吸附仪测试生物玻璃粉末的比表面积、孔径以及孔体积,采用Thermo ScientificTMK-AlphaTMX射线光电子能谱仪(XPS)分析Ag在生物玻璃粉末的存在形式。
1.5 润湿性及体外矿化表征
使用DSA100接触角测量仪测试不同涂层涂覆在平板上的水接触角的变化。将涂层支架浸没在20 mL的SBF中,于37 ℃静置1,3,7天,去离子水冲洗后干燥,使用SEM对支架进行观察,同时采用XRD进行物相分析。
1.6 涂层支架的抗菌性能及离子释放
采用平板计数法测试涂层支架的抗菌率,选取大肠杆菌和金色葡萄球菌为测试菌种,使用接种环刮取少量细菌放入30 mL肉汤,在摇床上培养12 h对细菌进行活化,将活化后的细菌于转速3000 r/min的离心机中离心5 min,之后使用PBS漂洗两次,使用酶标仪对细菌浓度进行定标,调整细菌浓度为1×108CFU/mL(OD600 nm=0.1),将菌液稀释到2×107CFU/mL。
将涂层支架与菌液共培养24 h涂板,计算抗菌率。
W=[(A-B)/A]×100%
(1)
式中:W为抗菌率;A为对照组菌落数;B为实验组菌落数。为了测定Ag的释放,将涂层支架浸泡在20 mL PBS中,并设置3个平行样,于恒温培养箱内静态培养 28 天,温度控制在37 ℃,分别在1,7,14,21,28天取出所有的PBS,并重新加入20 mL PBS。使用ICP-MS电感耦合质谱仪(ICP)测量每个时间段的离子释放量。
1.7 细胞黏附和增殖
调整MC3T3-E1细胞浓度为1×105cell/mL,将样品放置于24孔板中,每孔加入1 mL的细胞悬浮液,设置3个不加样品的空白孔作为对照组(control)。为了观察与支架共培养1,3,7天的细胞形态,用PBS将培养后的支架洗涤1次,然后用质量分数为4%多聚甲醛固定20 min,之后再用PBS洗涤1次,依次加入质量分数为20%,40%,60%,70%,80%,90%,95%,100%的梯度酒精进行脱水,脱水间隔为10 min。将共培养后的支架37 ℃干燥12 h,对支架进行喷金,扫描电镜观察细胞形态。
使用Cell Counting Kit-8 (CCK-8, Dojindo, Japan)检测MC3T3-E1细胞的增殖能力。以24孔板中不加样品的细胞数为对照组,计算细胞相对增殖速率。培养皿在细胞培养箱中孵育1,3,7天后,按10∶1的比例加入CCK-8。每孔收集上清液100 μL,避光培养2 h后转入96孔板。MC3T3-E1细胞的相对增殖速率M由式(2)计算:
M=(ODsample/ODcontrol) × 100%
(2)
式中:OD为光密度,用酶标仪(MK3, Thermo MULTISKAN)在450 nm的吸光度下测量。
2 结果与分析
2.1 介孔生物玻璃粉末的理化特性
生物活性玻璃的透射电镜图如图2所示,由结构导向剂F127制备的介孔生物活性玻璃呈现出蠕虫状结构,而传统的生物活性玻璃内部孔隙结构不明显。

图2 MBG (a)和BG(b)的TEM图像
为了研究涂层的厚度和结合力,将MBG支架封样,打磨抛光之后观察截面,可以看出,涂层的厚度约为4~5 μm(图3(a),(b)),根据ASTM标准D3359-02[25],使用横切胶带法测试了浸渍提拉2次的MBG涂层在纯钛板(10 mm×15 mm)上的结合力,结果表明,涂层与支架结合良好,属于5B的最高等级(图3(c))。
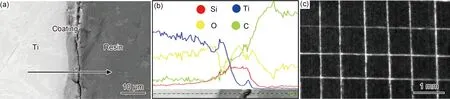
图3 MBG涂层的横截面(a)和对应的线扫EDS(b)以及涂层与基体的结合力测试结果(c)
涂层支架的表面形貌如图4所示。从宏观形貌图可以看出,制备的支架孔径约为600~700 μm,符合设计要求;从对应的SEM照片可以看出,MBG以及掺Ag的MBG涂层都比较均匀,没有开裂,而BG涂层开裂严重。

图4 MBG(a),BG(b),0.5Ag(c),1Ag(d),1.5Ag(e)支架的宏观形貌(1)和对应的(白色区域)SEM照片(2)
图5为1.5Ag的面扫结果,可以看出,Ag在涂层中分布均匀,没有团聚。为了研究涂层的相组成,使用XRD测试了MBG,BG,0.5Ag,1Ag以及1.5Ag的物相,结果显示,涂层在2θ为15°~30°的范围内有一个明显的包峰,呈现非晶物质的特征(图6(a))。添加Ag之后,出现了银的峰,表明在MBG涂层中存在着单质银。对涂层进行氮气吸脱附测试, MBG,BG,0.5Ag,1Ag和1.5Ag的氮气吸脱附等温线是Langmuir Ⅳ型曲线,为典型的介孔材料的吸脱附特征曲线(图6(b))。BJH孔径分布曲线进一步验证了试样的孔径在介孔范畴且孔径分布较窄(图6(c))。所有样品由于毛细凝聚现象可以观察到滞后环,其中MBG,0.5Ag,1Ag和1.5Ag的滞后环属于H1型滞后环,表明材料的孔具有圆柱形孔的特征。而BG的滞后环属于H3型滞后环,表明材料的孔为不均匀的狭缝状孔。

图5 1.5Ag的面扫结果
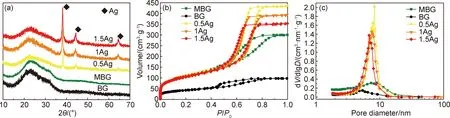
图6 粉末的XRD结果(a)和氮气吸脱附等温线(b)以及粉末的孔径分布(c)
表4为氮气吸脱附实验的结果,SBET为粉末的比表面积,采用BET法计算得到。Vp为粉末的孔体积。Dp为粉末的孔径,采用BJH法计算得到。从表4可以看出,随着Ag含量的增加,比表面积从377.6 m2/g下降到363.35 m2/g,比表面积减小并不明显。

表4 氮气吸脱附实验的结果
图7(a),(b)分别为1.5Ag的XPS全谱以及Ag3d的XPS拟合后的谱图。其中,Ag的3d轨道经拟合得到了两个峰,分别为Ag3d5/2和Ag3d3/2,对应结合能为368.3 eV和374.3 eV。根据文献[26]所述的Ag3d结合能数值可以确定,Ag在Ag/MBG样品中以单质Ag的形式存在。
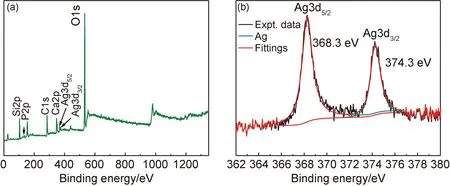
图7 1.5Ag的XPS全谱图(a)和Ag3d的XPS精细谱图(b)
2.2 介孔生物玻璃支架的矿化性能
将涂层支架在SBF溶液中分别浸泡1,3,7天,观察支架的体外生物活性。图8为MBG,BG,0.5Ag,1Ag,1.5Ag支架原始和浸泡在SBF中1,3,7天的SEM照片,从图中可以看出,浸泡前MBG以及Ag/MBG系列支架表面均匀光滑,BG支架开裂严重。1天后,MBG以及Ag/MBG系列支架样品表面形成磷酸钙小球,BG支架表面没有变化。3天后,各组支架表面均有磷酸钙层形成,但BG明显少于其他支架。浸泡7天后,MBG以及Ag/MBG支架表面有花椰菜形状的羟基磷灰石(HAp)沉积并且铺满整个表面,BG支架的沉积较少。
支架在模拟体液中浸泡1,3,7天的XRD结果如图9所示。结果表明,浸泡在SBF中1天后,MBG和Ag/MBG支架的XRD图谱在2θ=31.77°处出现了一个较弱的特征衍射峰,属于羟基磷灰石相的特征峰(PDF# 09-0432),而在BG支架上未见该衍射峰,说明MBG和Ag/MBG支架形成羟基磷灰石(HAp)的能力都强于BG支架。浸泡3天后,BG支架始终未出现HAp的衍射峰。随着浸泡时间的延长,7天后几乎所有支架都能检测到HAp的衍射峰。其中,MBG以及Ag/MBG支架相较于第1天和第3天,在2θ=31.77°处的HAp峰强更为剧烈明显,且在2θ≈26°出现了一个新的HAp衍射峰。而BG支架仅在2θ=31.77°出现了一个微弱的HAp衍射峰。结合图8浸泡7天的SEM结果可以看出,MBG和Ag/MBG系列支架表面都被HAp连续覆盖,沉积的HAp呈现典型的花椰菜状。总的来说,MBG以及Ag/MBG支架的矿化能力都显著强于BG支架,Ag的添加对HAp形成的阻碍作用并不明显,但随着Ag含量的增加,其比表面积略有下降,离子交换面积减少,支架的矿化能力略微下降。

图8 MBG(a),BG(b),0.5Ag(c),1Ag(d),1.5Ag(e)支架原始(1)和浸泡在SBF中1天(2)、3天(3)及7天(4)的SEM照片
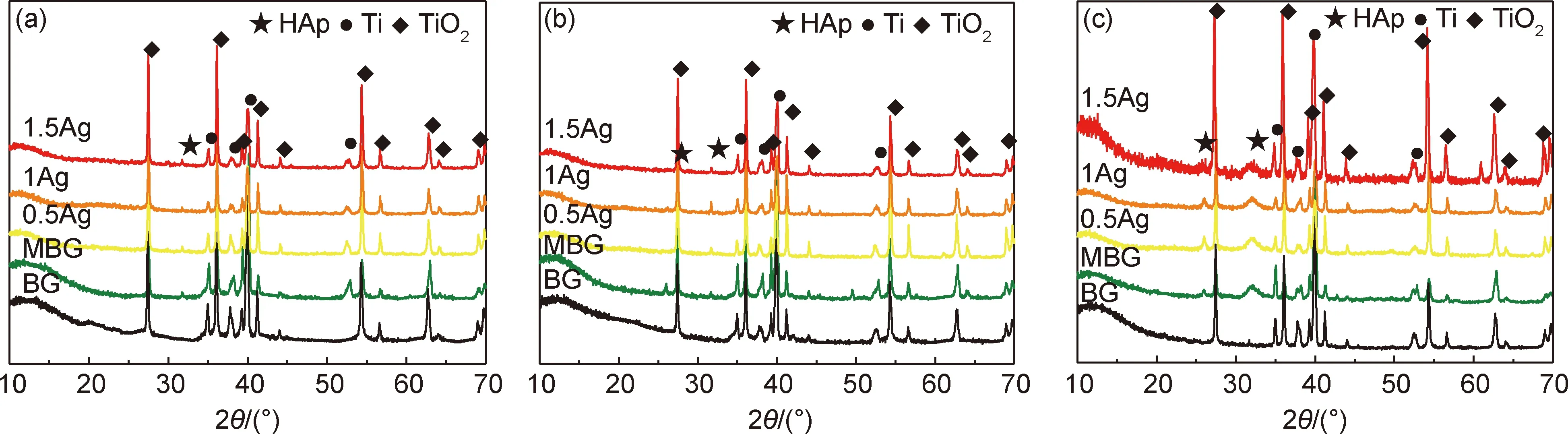
图9 支架在SBF中浸泡1天(a)、3天(b)和7天(c)的XRD结果
2.3 介孔生物玻璃涂层的表面润湿性
表面润湿性是影响植入材料生物反应(如蛋白质吸附、血小板黏附/激活、血液凝固与细胞黏附、细菌黏附等)的一个重要参数[27]。为了确定涂层的表面润湿性,将涂层涂覆于钛板(15 mm×10 mm)上进行接触角测量。图10为接触角测试结果。结果表明,纯钛板的水接触角约为84.9°。采用MBG或BG涂层改性后,水接触角迅速减小至15.4°/19.6°左右,亲水性显著提高。同时可以看出,Ag的添加对表面润湿性没有显著影响。因此,BG,MBG及Ag/MBG涂层可显著提高基体的表面润湿性,而涂层的高润湿性归因于涂层表面的介孔结构和丰富的硅醇基团[28-29]。
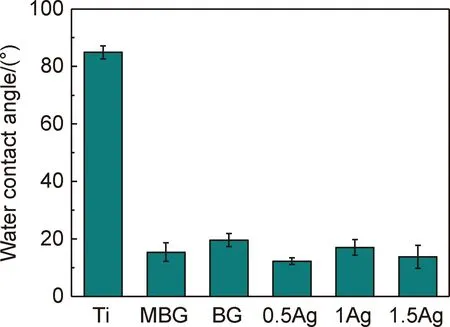
图10 水接触角测量结果
2.4 介孔生物玻璃支架的抗菌性
为了测试涂层支架的抗菌性能,将大肠杆菌和金色葡萄球菌作为细菌模型,涂层支架与细菌共培养24 h,利用平板计数法测定支架的抗菌率。可以看出,BG和MBG支架具有一定的抗菌作用(图11),加入Ag之后,对大肠杆菌和金色葡萄球菌抗菌率全都达到了100%,细菌被全部杀灭(图12)。

图11 支架的抗菌率

图12 支架与大肠杆菌(a)和金色葡萄球菌(b)共培养24 h的代表性琼脂板培养照片
2.5 介孔生物玻璃支架的离子释放
将涂层支架在PBS浸泡1,7,14,21,28天后测试Ag的累积释放量,从释放曲线可以看出,Ag的释放浓度随着浸泡时间的延长而增加。在前14天,Ag的释放维持在较高水平,浸泡28天曲线也并未出现平台,说明即使到了28天,Ag的释放仍处于相对连续且稳定的状态,证明了在MBG中添加Ag可以达到缓释Ag的效果,能够起到长效抗菌的作用。
2.6 介孔生物玻璃支架的细胞相容性
为了探究支架的细胞相容性,选取MC3T3-E1细胞作为实验细胞,通过扫描电镜观察涂层支架表面细胞形貌,CCK-8法测量涂层支架的细胞相对增殖率。图14为共培养7天后,支架表面MC3T3-E1细胞形貌。经过7天的共培养,在MBG,0.5Ag,1Ag,1.5Ag支架上可以观察到MC3T3-E1细胞分化,形态饱满,具有大量长而细的树突结构和明显的伪足,而在传统的BG支架也可以观察到MC3T3-E1细胞分化,但数量相对较少,形态不够饱满,伪足伸展相对不明显。
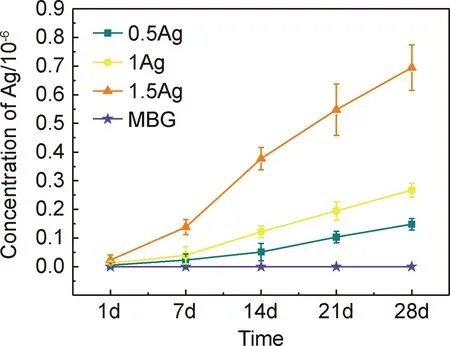
图13 支架在20 mL PBS中浸泡的ICP结果

图14 支架与MC3T3-E1细胞共培养7天后的细胞SEM照片(虚线为MC3T3-E1细胞,黑色箭头为伪足)
图15为支架与MC3T3-E1细胞共培养1,3,7天的细胞相对增殖率结果。在第1天,BG支架的细胞相对增殖率都高于纯钛支架,而在第3天和第7天,BG支架与纯钛的细胞相对增殖率无明显差异。在培养的整个过程中,MBG支架的细胞相对增殖率都高于纯钛支架,这表明BG和MBG涂层支架都能够促进成骨细胞的黏附和增殖,其中,相较于BG涂层支架,MBG涂层支架的促进作用更好。此外,观察到在1天和3天时,0.5Ag支架的细胞相对增殖率与纯钛组无明显差异,在7天时,0.5Ag支架明显高于纯钛组。1.5Ag支架在1天低于纯钛组,在3天时,与纯钛组持平,在7天时,略高于纯钛组,说明1.5Ag的支架在早期的细胞相容性相对较差,但随着培养时间的延长,也出现了促进了细胞黏附增殖的现象。1Ag支架在1,3,7天都明显高于纯钛组,表明1Ag具有最好的促进细胞黏附和增殖的作用。图15结果表明,大比表面积的表面为细胞生长提供了更大的区域,促进了细胞黏附和早期扩散。Ag的引入促进了细胞增殖,这与文献[30]报道的结果类似,其中,1Ag支架表现出最好的促进细胞增殖和黏附的作用,表明添加一定含量的Ag有利于细胞增殖。
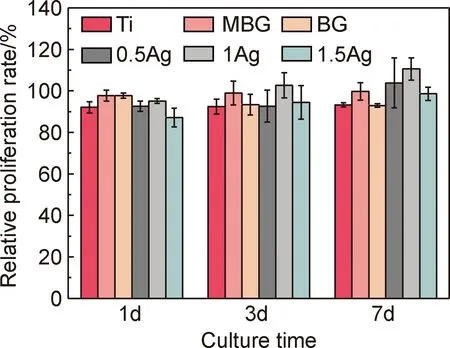
图15 支架与MC3T3-E1细胞共培养1,3,7天后的相对增殖率
本工作通过简单的溶胶凝胶法制备了掺杂Ag的介孔生物活性玻璃凝胶,运用浸渍提拉法将介孔生物活性玻璃作为涂层应用到具有复杂拓扑结构的3D打印纯钛支架上,支架表现出良好的体外矿化性能,Ag的增加并没有显著减弱支架的矿化性能。在以大肠杆菌以及金黄色葡萄球菌为模型的抗菌实验中,观察到掺杂少量的Ag即可达到100%的杀菌效果。同时,体外细胞实验表明,少量的Ag可以显著促进MC3T3-E1细胞的增殖黏附,1Ag支架表现出最好的体外细胞相容性。
Ag作为一种无机抗菌剂,广泛应用于牙科以及骨科植入方面,Ag对细菌、真菌和病毒病原体都具有很强的抑制和杀菌作用。银的杀菌机理一直以来都没有得到明确的定论,目前普遍认为,银离子通过静电吸附与细菌的细胞膜结合,使细胞膜通透性增加,导致细菌死亡。此外,纳米银和银离子可以诱导活性氧的产生,高浓度的银离子和ROS进一步使蛋白质失活,破坏DNA的结构,抑制RNA的复制。银离子还可以破坏电子传递链,最终导致细菌死亡[31]。
银的浓度阈值是一个值得讨论的问题,据报道,低浓度银对体外成骨细胞无细胞毒性[32],但银的浓度过高会导致细胞毒性。据文献报道,Ag+浓度造成人体细胞毒性的阈值为10×10-6[33]。而当Ag+的浓度达到3.5 μmol/L时,不会引起小鼠成纤维细胞L929的细胞毒性[34]。银离子浓度处于30~70 μmol/L的范围内时,细胞的活力和形貌受到影响[35]。但当银离子浓度超过1.6×10-6时,对正常细胞有毒性[36]。在本工作中,在28天内累计释放的银都未达到1.6×10-6,不会引起细胞毒性,且发现低浓度的银具有促进MC3T3-E1细胞增殖黏附的作用。
3 结论
(1) MBG涂层的厚度约为4~5 μm,MBG以及Ag/MBG涂层与支架结合良好,而BG涂层严重开裂。
(2) 在MBG涂层中掺杂Ag并不会显著影响MBG的比表面积、孔体积和孔径。Ag在玻璃中以单质形式存在,不会明显影响Ag/MBG支架的矿化能力。
(3) 体外抗菌实验表明,Ag对大肠杆菌和金色葡萄球菌具有强烈的杀菌作用,在少量Ag的存在下(0.5Ag),即可达到100%的杀菌效果。在PBS溶液中Ag的连续释放长达28天,预计可以达到长期杀菌的效果。
(4) Ag/MBG支架都能促进MC3T3-E1细胞的黏附和增殖,其中,1Ag支架对MC3T3-E1细胞黏附增殖的促进效果最好。
