Ⅰ型胶原/海藻酸钠/透明质酸复合水凝胶用于血管组织工程细胞负载与3D培养
2022-11-18王志伟
谢 航,刘 纯,胡 灏,王志伟*
(1 暨南大学 口腔医学院,广州510632;2 中山大学 附属第一医院骨科研究所,广州510632;3 中山大学 附属第一医院精准医学研究院转化医学研究中心,广州 510632;4 广东省骨科学重点实验室,广州510632)
水凝胶的高含水量可以为细胞生存提供理想的环境[1],可作为细胞培养理想的支架材料。越来越多的研究发现,培养器皿表面2D培养细胞的生理状态难以反映细胞在体内三维生长的真实状态[2-3],细胞2D培养的研究结果有时甚至会与动物实验和临床实验的结果相矛盾。近年来,3D细胞培养技术兴起[4],3D培养下的细胞营养物质交换、信号传导更加接近体内的真实情况。水凝胶广泛用于生物医学研究与应用,通过模拟细胞生长的基质环境,可作为3D细胞培养的生物支架。
胶原蛋白是哺乳动物中最丰富的蛋白质[5],广泛存在于骨骼、肝脏、肾脏、心脏、牙齿和皮肤等器官中。Ⅰ型胶原是细胞外基质的主要组成成分[6],由于来源丰富以及具有可控制的力学性能、生物降解性和细胞信号识别方面的固有特性等,被广泛用作组织工程和细胞培养的支架材料[7]。以往研究[8-9]常使用胶原水凝胶作为细胞外基质的模拟物,用于细胞培养等。Zheng等[10]使用人脐静脉内皮细胞植入Ⅰ型胶原凝胶中,通过软光刻形成的微流控电路构建了微流体血管网络,进行了血管重塑、血管内皮细胞和血管周细胞相互作用的研究。这些结果证实了,Ⅰ型胶原在构建血管新生与内皮细胞相关研究模型中的可行性。纯胶原蛋白力学性能和结构稳定性较差[11],一定程度上限制了其在生物体内的应用。通过物理方法处理或化学改性,虽可实现胶原蛋白的分子间交联,从而改善胶原蛋白支架的性能,但也可能存在一些负面的影响[12],因此采用天然或合成聚合物与Ⅰ型胶原形成混合支架材料是理想的办法。透明质酸和海藻酸钠属于天然高分子聚合物,具有良好的生物安全性,在血管组织工程和骨组织工程中表现出了很大的应用潜力[13-14]。通过调节海藻酸钠的交联程度[15],可以改变Ⅰ型胶原/海藻酸钠/透明质酸复合水凝胶的局部杨氏模量,研究不同杨氏模量对细胞形态、增殖和迁移的影响。
本研究将Ⅰ型胶原、海藻酸钠、CaCl2、透明质酸制备成复合水凝胶,用作细胞3D培养的支架材料。通过Ⅰ型胶原/海藻酸钠/透明质酸水凝胶为小鼠脑微血管内皮细胞(murine brain endothelial cells.3, bEnd.3)与小鼠骨髓间充质干细胞(mesenchymal stem cells,MSCs)3D培养提供基质微环境,研究了Ⅰ型胶原/海藻酸钠/透明质酸水凝胶的细胞相容性。使用Ⅰ型胶原/海藻酸钠/透明质酸水凝胶作为MSCs和bEnd.3 3D培养的支架载体,倒置荧光显微镜观察培养0,3,5,7 d时的细胞活力状况,并在培养1,4,6 d时观察bEnd.3的迁移与成血管网情况,培养1,6,9 d时观察bEnd.3的生长扩散情况。
1 实验材料与方法
1.1 材料与试剂
Ⅰ型胶原、10×DMEM培养基、海藻酸钠、透明质酸、CaCl2,与细胞培养材料DMEM基础培养基、MEM-α基础培养基、PBS缓冲液、胎牛血清、青霉素/链霉素双抗溶液、0.25%胰蛋白酶,均购自Gibco公司;超低吸附384孔板、T25培养瓶、各种型号EP管购自Corning公司;细胞MSC-GFP购自广州赛业生物科学有限公司;细胞bEnd.3购自ATCC公司;bEnd.3-RFP由中山大学附属第一医院转染。
1.2 Ⅰ型胶原/海藻酸钠/透明质酸水凝胶制备
水凝胶各组分与添加顺序见表1。使用超纯水和碳酸氢钠重组了10×DMEM培养基,然后将Ⅰ型胶原、透明质酸、海藻酸钠原液混合,并将pH调至中性,最后加入CaCl2溶液。为了保证各组分的混合均匀,在Vortex涡旋仪上振荡充分,分装水凝胶预混液到10 mm培养皿[16]。培养箱内37 ℃下孵育20 min后,添加培养基,隔日进行换液。根据需要,本研究制备了空载水凝胶以及载bEnd.3-RFP或MSC-GFP的水凝胶,进行细胞3D培养(图1)。
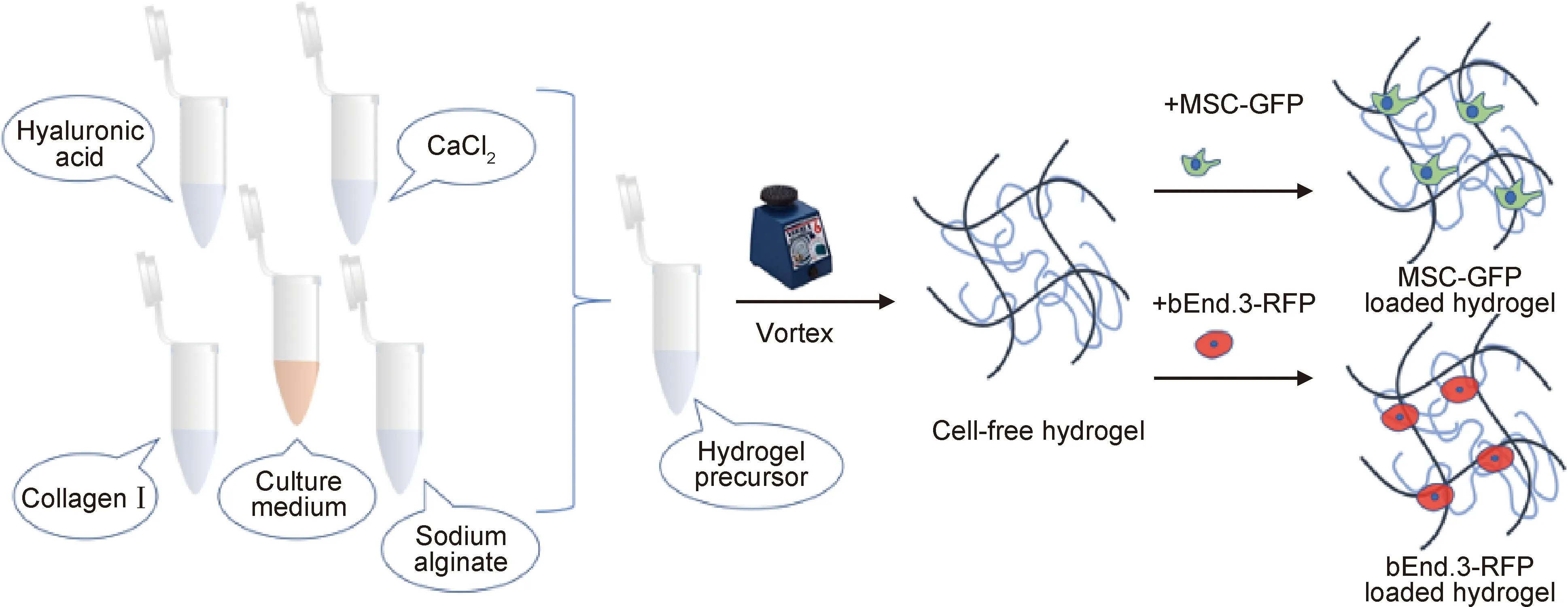
图1 Ⅰ型胶原/海藻酸钠/透明质酸复合水凝胶合成示意图

表1 Ⅰ型胶原/海藻酸钠/透明质酸复合水凝胶的成分添加顺序
1.3 水凝胶预混液小振幅变温测试
利用DHR流变仪对水凝胶预混液进行小振幅变温测试,升温速率设置为5 ℃/min、采集点间隔时间为6 s、应变为0.1%、频率为1 Hz,测定储能模量(G′)和损耗模量(G″)随温度变化关系。G′与G″的交点即水凝胶的溶胶-凝胶转变温度[17]。
1.4 纳米压痕仪表征水凝胶杨氏模量
利用PIUMA生物纳米压痕仪,选用0.025 N/m的探针定标后,压在样品上的停留时间设置为5 s,XY点数设置为4 × 4矩阵,X间距和Y间距均设置为100 μm,开始扫描,表征水凝胶的杨氏模量。
1.5 细胞培养与传代
为了便于后续细胞行为的观察,实验采用了表达红色荧光蛋白的bEnd.3-RFP和表达绿色荧光蛋白的MSC-GFP。bEnd.3-RFP使用DMEM完全培养基培养,MSC-GFP使用MEM-α完全培养基培养,培养箱环境为37 ℃,5%(体积分数)CO2浓度,饱和湿度。细胞生长融合达70%~80%进行传代。
1.6 水凝胶的细胞相容性
将bEnd.3-RFP和MSC-GFP细胞悬液混入水凝胶中,培养第0,3,5,7 d,Olympus倒置荧光显微镜选择4倍物镜,观察细胞形态、增殖情况,荧光信号强度高表示细胞活力好。
1.7 细胞球状体制备
取消化后的bEnd.3-RFP和MSC-GFP,重悬计数。根据目标接种密度进行稀释。将细胞悬液吹打均匀后,吸取细胞悬液进行种板。种板完成后,移入培养箱,培养24 h后,补充培养基,继续培养至48 h,取此时的细胞球体进行后续实验。
1.8 水凝胶接种细胞球状体
用移液枪头吸出孔板内的细胞球体,分装于1.5 mL EP管中备用。制备水凝胶预混液,将细胞球体接种到水凝胶预混液,然后将移入培养箱内孵育20 min成胶,添加培养基,隔日换液。
1.9 水凝胶细胞负载与3D培养观测
使用Olympus倒置荧光显微镜选择4倍物镜,TRICT以及FITC通道分别捕捉bEnd.3-RFP和MSC-GFP的荧光图像。在水凝胶内的细胞培养1,6,9 d时观察bEnd.3-RFP球体生长扩散情况,在水凝胶内的细胞培养0,1,4,6 d时观察bEnd.3-RFP迁移以及成小管情况。
2 结果与分析
2.1 水凝胶制备
制胶过程如1.2所述,在涡旋仪上充分涡旋后,将消化重悬的细胞悬液与水凝胶预混液混合,形成空载水凝胶或负载细胞的水凝胶。维持4 ℃的温度下,按顺序加入10×DMEM培养基、海藻酸钠,在涡旋仪上涡旋5 s,然后缓慢吸取透明质酸打入管底并停留片刻后,继续在涡旋仪上涡旋5 s,吸取胶原打入管底,涡旋10 s,最后吸取细胞悬液和CaCl2溶液涡旋。最终CaCl2浓度达到3.75 mmol/L,Ⅰ型胶原浓度为3 mg/mL,海藻酸钠为5 mg/mL。移入培养箱,37 ℃环境下放置20 min后成胶。水凝胶制备过程中,要注意始终维持水凝胶各组分4 ℃低温环境。
水凝胶的力学性能参与细胞生物学行为的调节[18],Ⅰ型胶原/海藻酸钠/透明质酸水凝胶中的Ca2+与海藻酸钠结合后,形成大分子网络结构,通过改变水凝胶的Ca2+的化学交联程度,可以调节水凝胶的杨氏模量,适用于不同类型细胞培养对基质力学性能的要求。用于细胞培养的支架材料必须具有良好的细胞相容性与生物安全性[19],在细胞负载过程中,应该尽量避免对细胞活力的损害。Ⅰ型胶原具有温敏成胶的特点,成胶温度低于细胞培养的温度,为细胞的黏附以及培养创造了条件。Ⅰ型胶原是细胞外基质的主要组成成分,为细胞附着提供了位点。Ⅰ型胶原/海藻酸钠/透明质酸水凝胶的这些特点为细胞负载与3D培养提供了潜在的价值。
2.2 水凝胶杨氏模量表征
先前的研究[16]证实,在3.75 ~15 mmol/L浓度范围内,加入CaCl2浓度越低,则水凝胶杨氏模量越低,有利于细胞增殖。通过改变Ca2+浓度,可改变Ⅰ型胶原/海藻酸钠/透明质酸水凝胶的孔隙率,由于多孔结构的存在,Ⅰ型胶原/海藻酸钠/透明质酸水凝胶为细胞的3D培养提供了黏附的位点和营养、氧气交换的生存空间。Ca2+的交联程度影响水凝胶的孔隙大小与形状,3.75 mmol/L Ca2+浓度交联的水凝胶中,水凝胶的结构由Ⅰ型胶原主导,此时圆形孔洞较多。当Ca2+浓度达到8.5 mmol/L和15 mmol/L时,水凝胶中扁平的孔洞较多,随着Ca2+浓度增加,水凝胶的结构将由海藻酸钠主导。
水凝胶的杨氏模量表征如图2所示,水凝胶的杨氏模量主要取决于海藻酸盐和Ⅰ型胶原蛋白。海藻酸钠是一种天然高分子,通过—COO-与Ca2+交联形成大分子网络结构,改变Ca2+的浓度,可以调节水凝胶的力学性能。由于人体组织杨氏模量变化范围很大,通过改变水凝胶海藻酸钠与Ca2+的交联程度,可以模拟不同的细胞培养力学微环境。Ⅰ型胶原蛋白浓度的变化也会影响水凝胶的杨氏模量、通透性以及细胞黏附的位点,从而影响细胞与水凝胶微环境的相互作用。水凝胶的杨氏模量影响细胞黏附、增殖和分化,Robinson等[20]研究发现软的基质环境更加适合内皮细胞的生存,研究者测试了人主动脉外膜成纤维细胞、人脐静脉内皮细胞、人主动脉血管平滑肌细胞对0.3,5.2 kPa和13.7 kPa三种杨氏模量的水凝胶的反应,结果显示人脐静脉内皮细胞优先在最低杨氏模量的水凝胶上生长。本研究选用了3.75 mmol/ Ca2+浓度的Ⅰ型胶原/海藻酸钠/透明质酸水凝胶进行内皮细胞培养的相关实验。图2为纳米压痕仪测试水凝胶表面的杨氏模量,结果显示:水凝胶的杨氏模量为(600±81) Pa,适合作为内皮细胞生长的软基质微环境。
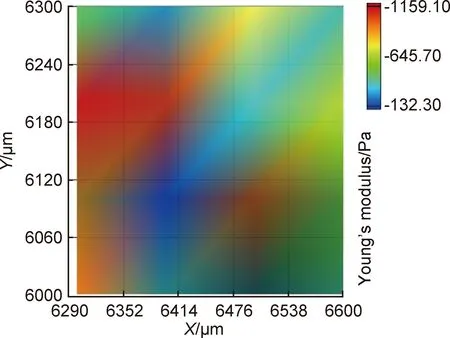
图2 Ⅰ型胶原/海藻酸钠/透明质酸复合水凝胶的杨氏模量表征
2.3 水凝胶溶胶-凝胶转变温度
水凝胶可视为一种多相材料,既包含固相网络也包括液相,在水凝胶固化前表现为黏弹性。采用DHR流变仪进行温度扫描,温度从0 ℃快速升高到4 ℃时进行预振荡步骤,然后在4 ℃到40 ℃温度范围内进行扫描,以5 ℃/min的升温速率,1 Hz的频率进行扫描。图3显示了水凝胶的G′和G″随温度变化的曲线,G′与G″的交点表示水凝胶的溶胶-凝胶转变温度。水凝胶的溶胶-凝胶转变温度为23.2 ℃,当温度低于23.2 ℃时,水凝胶的G′低于G″,水凝胶以黏性形变为主,呈溶液态;随着温度升高,G′超过G″,材料以弹性形变为主,呈凝胶态。
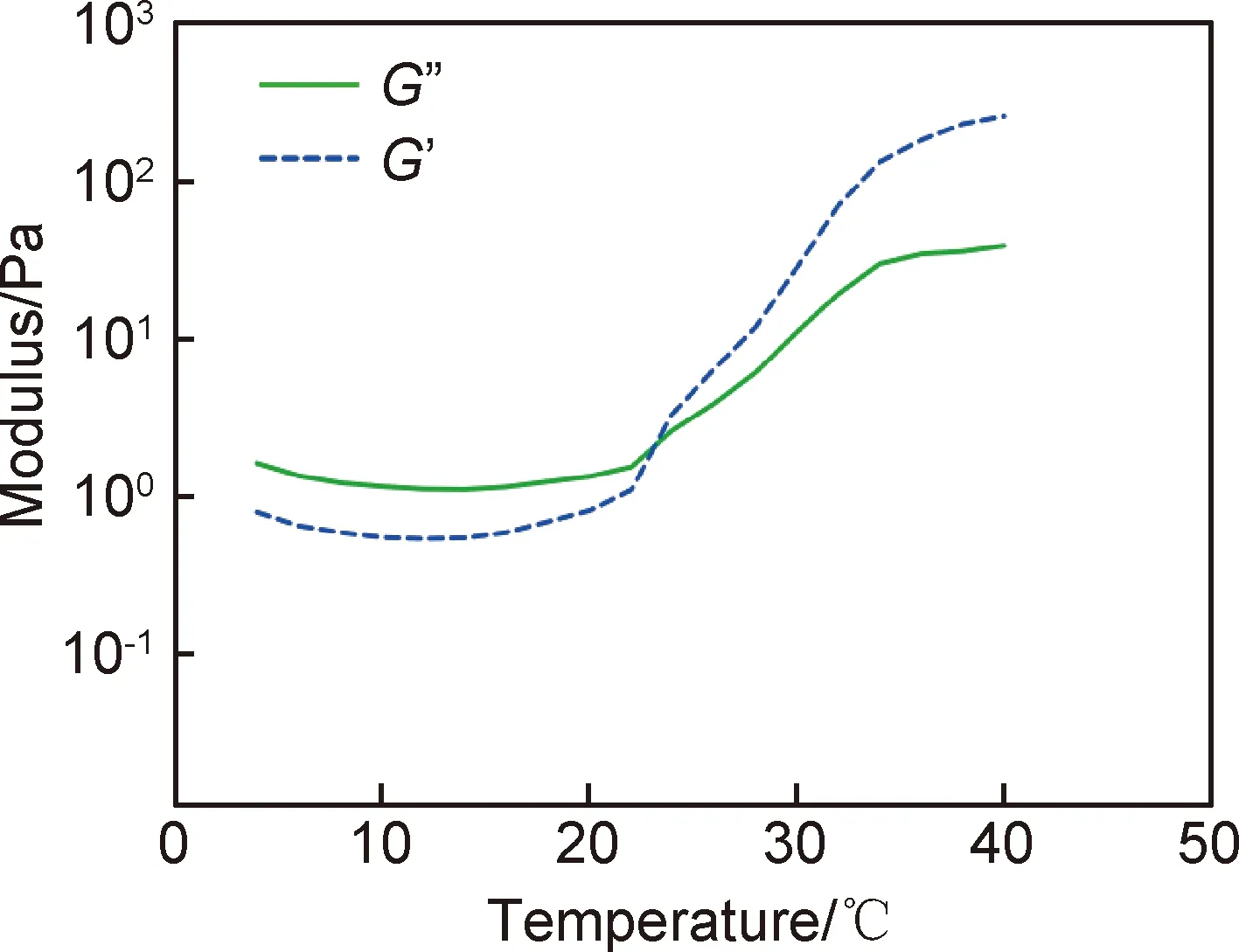
图3 Ⅰ型胶原/海藻酸钠/透明质酸水凝胶的温度依赖性流变行为
通常,细胞培养的温度为37 ℃,由于水凝胶溶胶-凝胶转变温度低于细胞培养温度,因此避免了成胶过程中温度对细胞活力的损害。Ⅰ型胶原/海藻酸钠/透明质酸水凝胶成胶条件温和,不需额外的光交联引发成胶过程,避免了紫外光照对细胞活力的损害,适合细胞负载与相关生物学研究。
2.4 水凝胶细胞相容性
为了证实水凝胶的细胞相容性,使用水凝胶负载表达红色荧光蛋白的bEnd.3-RFP和表达绿色荧光蛋白的MSC-GFP,进行细胞3D培养,荧光显微镜实时观测细胞状态。当水凝胶内细胞增殖时,表现为荧光信号持续增强,并出现细胞形态的变化。
图4(a-1)~(a-4)反映了水凝胶中bEnd.3-RFP培养0,3,5,7 d时荧光信号表达,图4(b-1)~(b-4)则反映了水凝胶中MSC-GFP培养0,3,5,7 d时荧光信号表达。随着细胞时间的延长,水凝胶内荧光信号持续增强,说明细胞生长活跃,证实Ⅰ型胶原/海藻酸钠/透明质酸水凝胶具有良好的细胞相容性。如图5所示,细胞在Ⅰ型胶原/海藻酸钠/透明质酸水凝胶中培养0,3,5,7 d的细胞数量,随着培养时间的延长,细胞数量增加,表现为增殖。如图6所示,细胞在Ⅰ型胶原/海藻酸钠/透明质酸水凝胶中培养0,3,5,7 d后,细胞表达荧光信号表达持续增强。
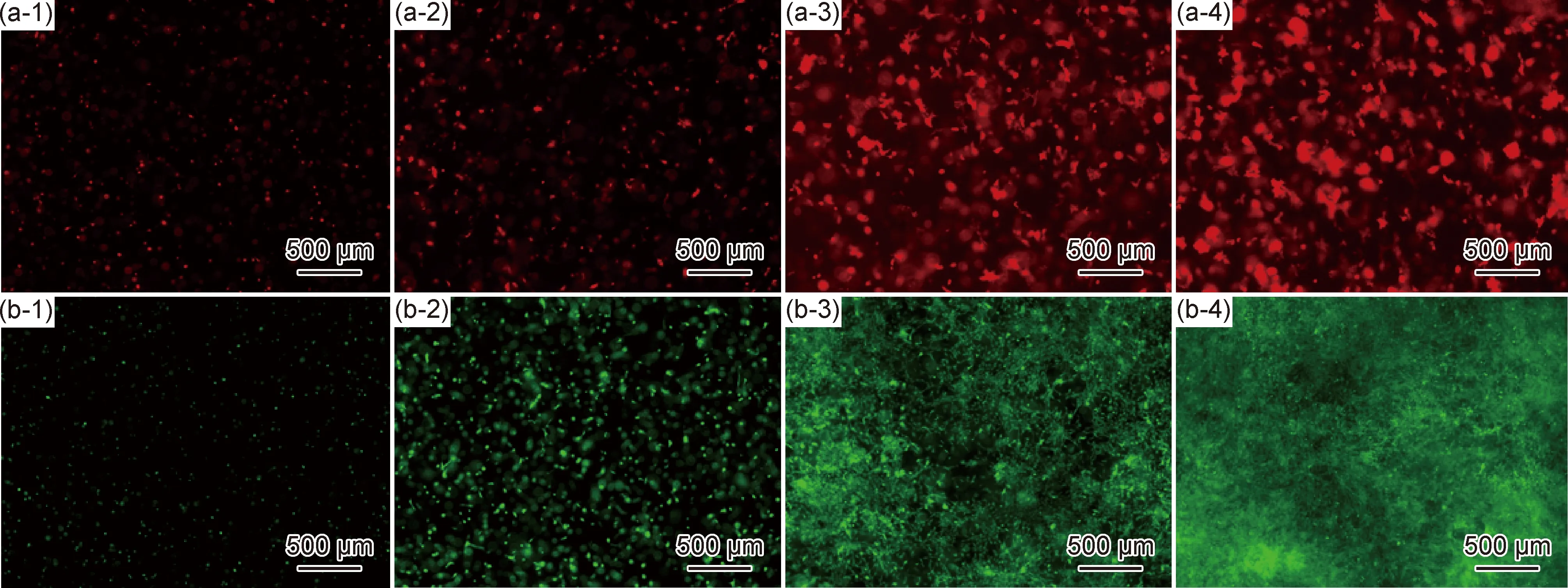
图4 载细胞水凝胶中细胞培养0 d(1),3 d(2),5 d(3),7 d(4)表达荧光信号强度
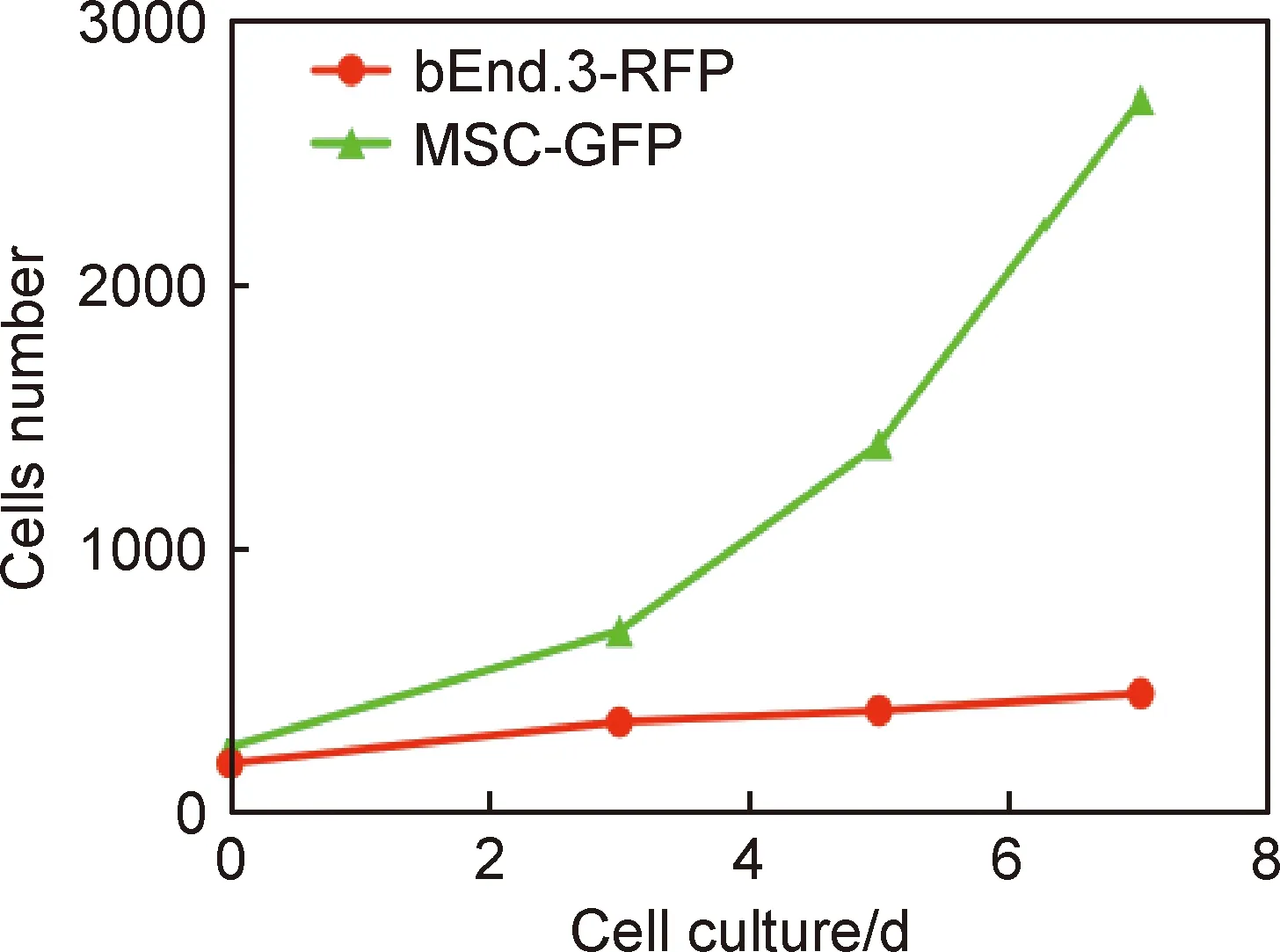
图5 水凝胶内3D培养0,3,5,7 d后细胞数定量
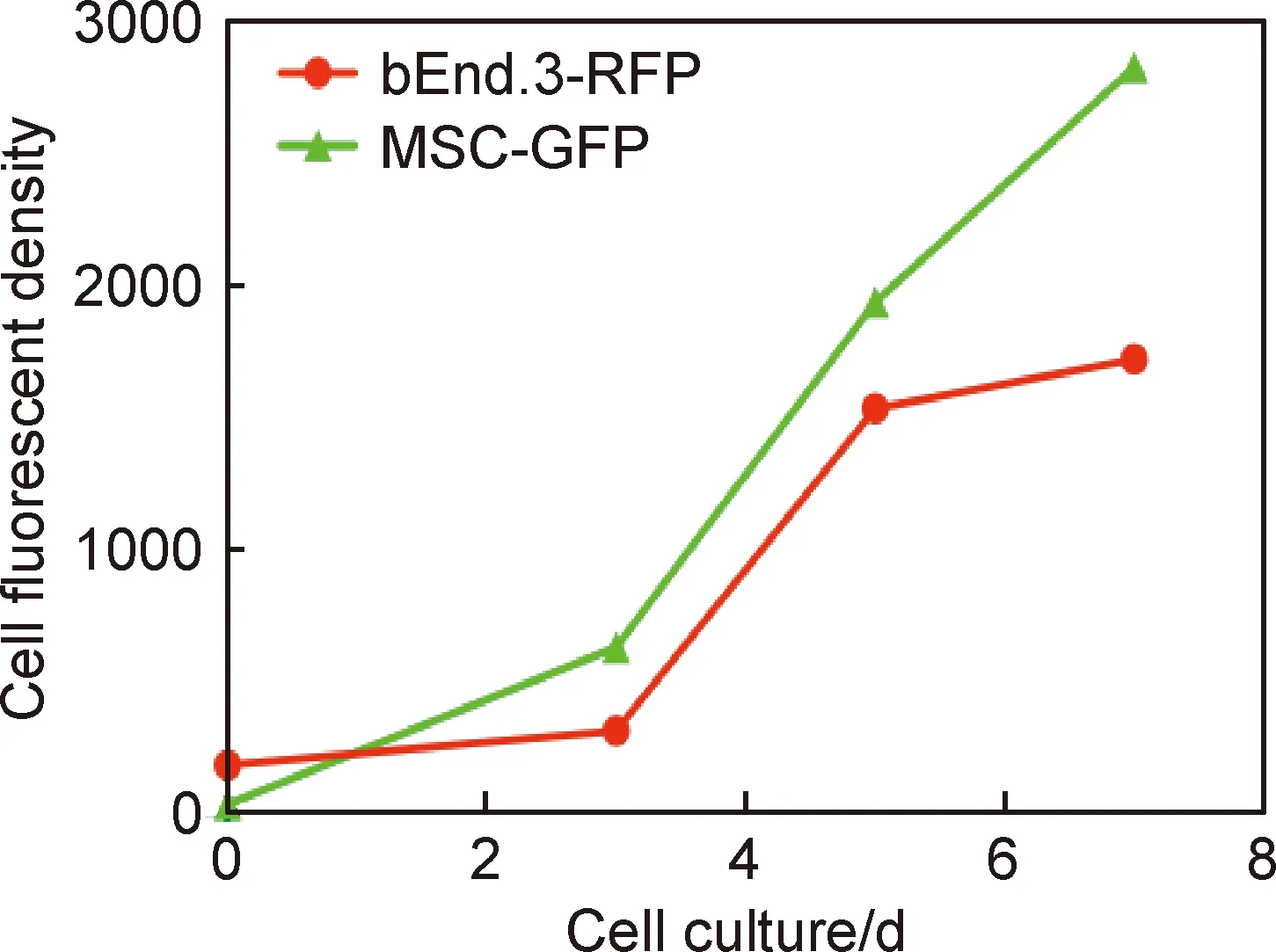
图6 水凝胶内3D培养0,3,5,7 d后细胞荧光强度定量
2.5 水凝胶负载MSCs/bEnd.3细胞3D培养实时观测
为了进一步证实水凝胶用于血管组织工程种子细胞负载与3D培养的可行性,采用荧光显微镜观测了水凝胶内3D培养的内皮细胞生长扩散、迁移与成血管网络行为。
图7结果显示了水凝胶内bEnd.3-RFP球体向MSC-GFP迁移的情况。内皮细胞迁移是血管新生过程中的关键环节[21]。值得注意的是,划痕实验是研究细胞迁移功能的经典手段,然而划痕实验体现的是培养器皿表面2D培养的细胞迁移结果。内皮细胞3D培养需要合适的体外研究模型,基于此,Ⅰ胶原/海藻酸钠水凝胶为研究3D培养下内皮细胞迁移提供了重要研究手段,具有一定的应用价值。
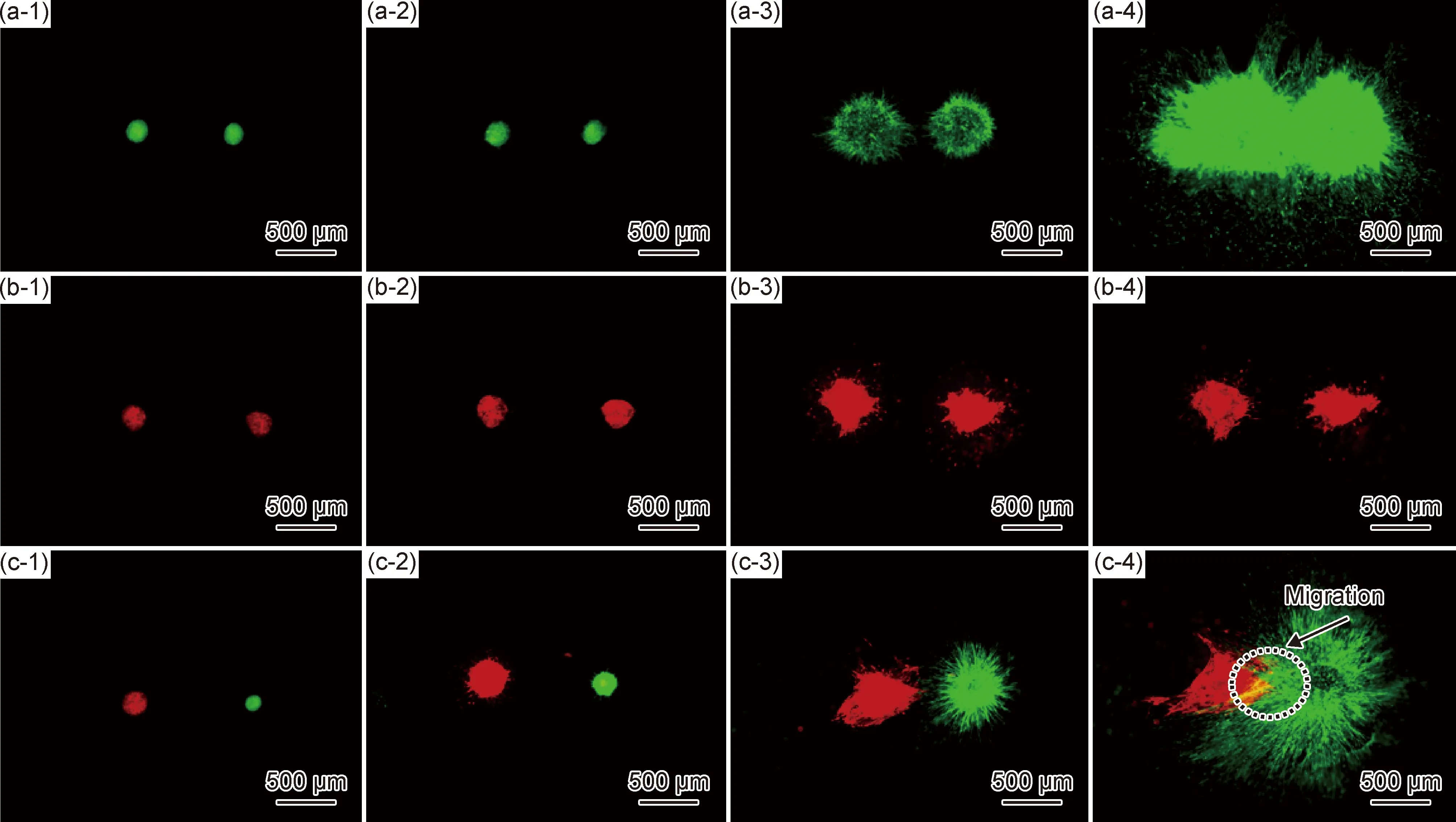
图7 培养0 d(1),1 d(2),4 d(3),6 d(4)时内皮细胞球状体迁移情况
Matrigel常用作体外3D细胞培养的底物和血管生成测试[22]。然而成小管实验使用Matrigel存在一些固有缺陷,例如内皮细胞以外的其他细胞也能形成小管[23]。同时,Matrigel价格昂贵,批次之间也存在较大的差异。寻找替代Matrigel的材料是十分必要的。Ⅰ型胶原/海藻酸钠/透明质酸水凝胶的制备过程简单,不同批次间性能稳定,可以通过改变水凝胶杨氏模量和负载不同细胞的水凝胶,来模拟细胞生长的3D微环境。图8结果显示,Ⅰ型胶原/海藻酸钠/透明质酸水凝胶的内皮细胞并未观察到成血管网。
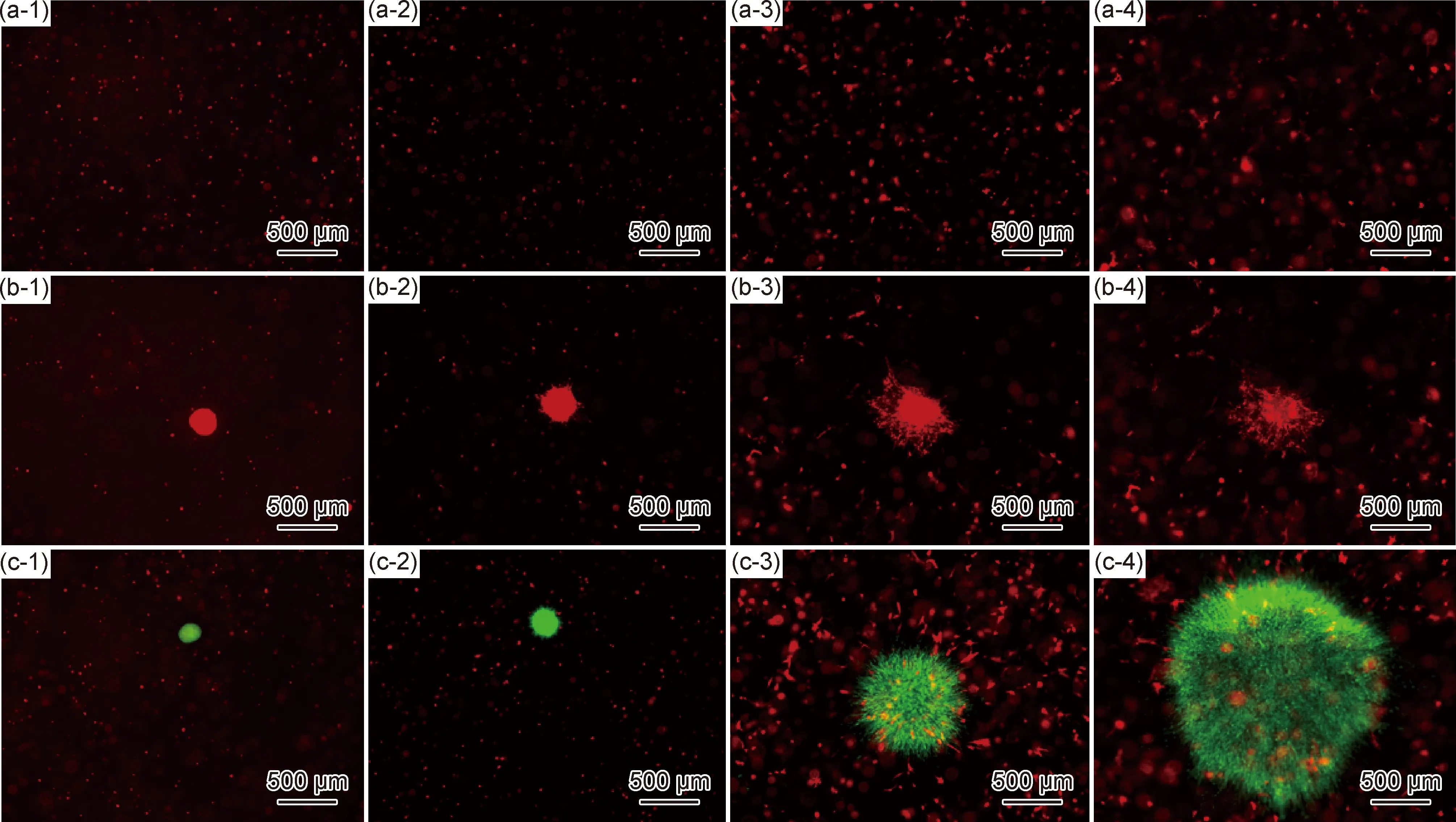
图8 载bEnd.3-RFP水凝胶培养0 d(1),1 d(2),4 d(3),6 d(4)时bEnd.3-RFP未见小管形成
图9为不同水凝胶环境下,内皮细胞球体的生长扩散规律,证实了Ⅰ型胶原/海藻酸钠/透明质酸水凝胶用作研究内皮细胞生长扩散模型的可行性。水凝胶通过负载MSCs,模拟细胞培养的微环境,可以研究MSCs对bEnd.3生长扩散的影响。
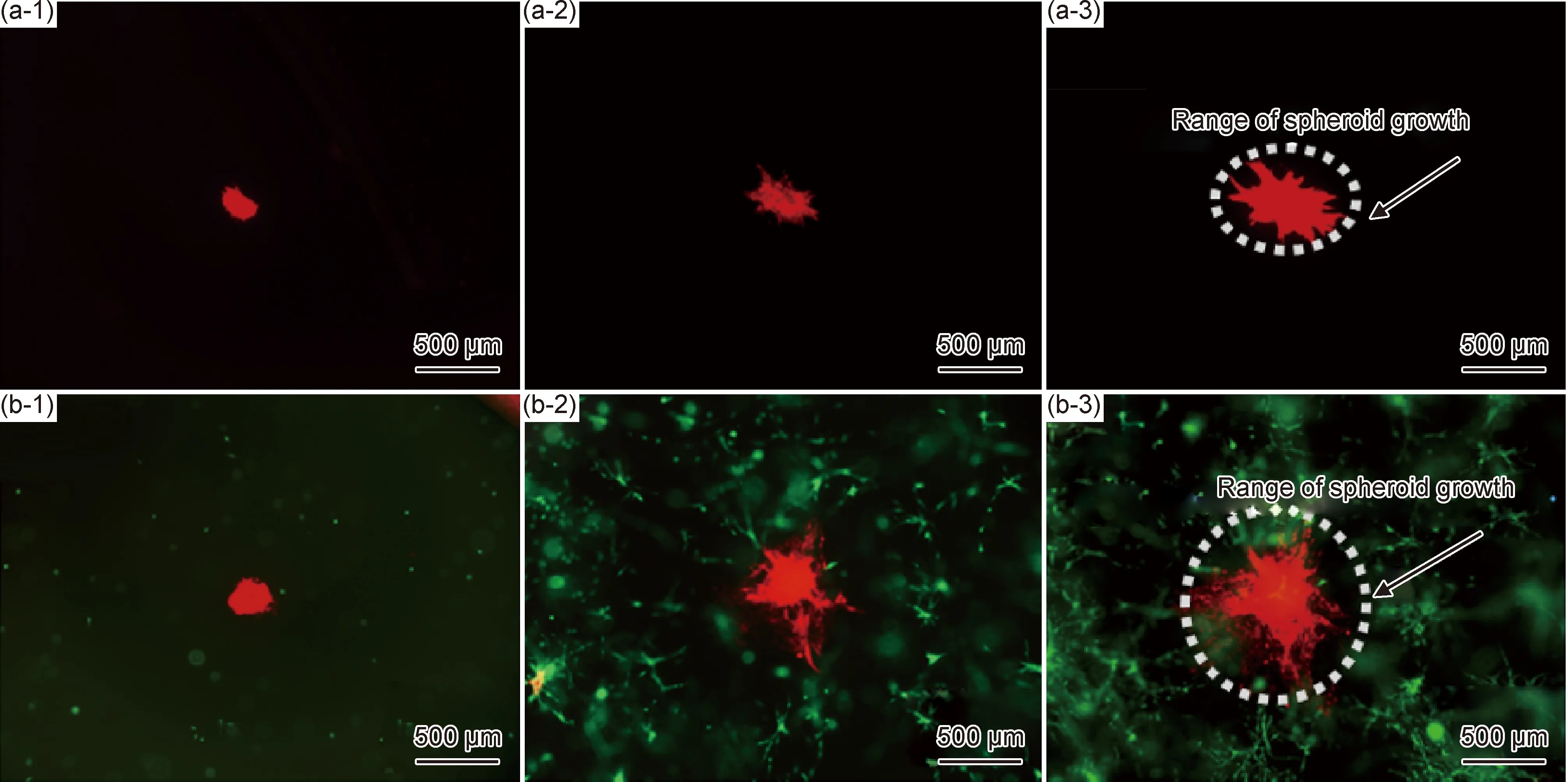
图9 bEnd.3-RFP球状体在空载水凝胶和载MSC-GFP水凝胶中培养1 d(1),6 d(2),9 d(3)时的生长扩散情况
3 结论
(1)合成的Ⅰ型胶原/海藻酸钠/透明质酸水凝胶能模拟细胞生长的基质微环境,可用于组织工程种子细胞负载。Ⅰ型胶原/海藻酸钠/透明质酸水凝胶成胶条件温和,在23.2 ℃时即可成胶,避免了温度对负载细胞活力的损害,适用于间充质干细胞与内皮细胞的体外3D培养与扩增。荧光显微镜成像结果显示,直至细胞培养第7 d,细胞荧光信号持续增强,说明Ⅰ型胶原/海藻酸钠/透明质酸水凝胶具有良好的细胞相容性。
(2)水凝胶的杨氏模量为(600±81) Pa,为细胞生长提供了软的基质环境。Ⅰ型胶原/海藻酸钠/透明质酸水凝胶的力学性能可通过海藻酸钠与Ca2+交联的程度来调节,模拟不同的细胞外基质杨氏模量,可用于研究基质杨氏模量对细胞生物学行为的影响。
(3)Ⅰ型胶原/海藻酸钠/透明质酸水凝胶体外模型具有力学性能可调节、成胶条件温和的特点,可用作观测内皮细胞迁移、增殖等血管新生过程体外模型,在血管组织工程细胞负载与3D培养相关研究中具有良好的应用前景。
