异秦皮素腹腔注射对脑梗死大鼠的治疗作用及其作用机制
2022-11-15陈历季一飞尹书斌赵玉萍
陈历,季一飞,尹书斌,赵玉萍
南充市中心医院神经内科,四川南充637000
脑梗死是指由于大脑供血异常而引起脑组织缺血、缺氧坏死,梗死后急性期存在如神经炎症、氧化应激、神经元凋亡等许多病理过程[1]。尽管目前已经探索了一些治疗脑梗死的分子靶点,但其临床应用仍不尽人意。因此,迫切需要开发能够抑制梗死脑组织中神经炎症、氧化应激、神经元凋亡等临床可行的药物。NLRP3炎症小体是一种亚细胞多蛋白复合物[2],包括NLRP3和凋亡相关斑点样蛋白(ASC)等重要蛋白,其活化后促进IL-18和IL-1β的产生[3]。研究表明,抑制NLRP3表达可降低脑损伤后氧化应激水平及炎症损伤程度,从而显著减少梗死面积[4]。因此,我们推测一些阻止NLRP3炎症小体激活的药物可能有助于减弱脑梗死。异秦皮素(ISO)是从刺五加提取的一种香豆素类化合物,具有抗肿瘤、抗炎、抗氧化等作用。近期研究发现,在体内和体外实验中,ISO可以抑制NLRP3炎症小体激活,从而改善心肌梗死预后[5]。然而,ISO在脑梗死中的具体功能及其与NLRP3炎症小体之间的相互作用尚不清楚。2021年11月—12月,我们初步观察了ISO对大鼠脑梗死损伤的治疗作用,并从细胞学角度分析ISO对NLRP3炎症小体的调控关系,旨在为脑梗死的临床治疗提供一种新药物。
1 材料与方法
1.1 主要材料雄性SD大鼠(220~240 g)购自川北医学院实验动物中心,适应实验环境1周;本研究严格按照《实验动物护理使用指南》进行,并经我院伦理委员会批准。主要试剂:异秦皮素购自武汉远成共创科技有限公司;DMEM培养基、ROS试剂盒、MDA试剂盒、SOD试剂盒、BCA法蛋白定量试剂盒购自南京建成生物工程研究所;TNF-α试剂盒、IL-6试剂盒、IL-10试剂盒、IL-1β试剂盒、IL-18试剂盒、凋亡检测试剂盒、NLRP3抗体试剂盒、ASC抗体试剂盒、GAPDH抗体试剂盒、NLRP3激动剂Nigericin购自Abcam公司;SDSPAGE凝胶制、PVDF膜、ECL检测试剂盒购自北京索莱宝科技有限公司;戊巴比妥钠、神经细胞株PC-12细胞购自武汉普诺赛生命科技有限公司。
1.2 ISO对脑梗死大鼠的治疗作用观察
1.2.1 脑梗死模型建立及ISO处理将SD大鼠随机分为假手术组、模型组、药物1组和药物2组,每组均8只。药物1、2组及模型组均采用线栓法建立大鼠右侧大脑中动脉栓塞(MCAO)模型[6]。药物1、2组分别腹腔注射10、20 mg/kg的ISO,1次/d,假手术组、模型组腹腔注射相同体积生理盐水,1次/d,持续8周。取相应标本做后续的研究。
1.2.2 神经行为评估再灌注1 d及8周后,由两位实验人员参照Zea-Longa神经功能障碍评分。其中评分为1~4分且无蛛网膜下腔出血的大鼠进入实验,评分为5分的大鼠剔除,并随机补充。
1.2.3梗死侧脑水肿观察大鼠麻醉后,每组取6只断头取脑,去除小脑、脑干及嗅球;用电子分析天平(精确度为0.01 mg)测定大脑湿重(ww),将其包入锡箔纸放置烤箱中72 h后称取大脑干重(dw),以干湿比重法评估梗死侧脑水肿变化[7]。脑组织含水量=(ww-dw)/ww×100%。
1.2.4 脑组织病理学观察神经功能评估后,每组取6只腹腔注射戊巴比妥钠5 mg/kg。麻醉成功后将大鼠仰卧位固定于木板上,剪开腹腔,暴露心脏;经左心室灌流至肉眼观察到生理盐水基本无色和肝脏完全变黄后停止冲洗,再以4%多聚甲醛灌注固定;大鼠全身僵硬后断头取脑组织,在视交叉后1 mm及5 mm处冠状切面切开,取中间脑组织。将其置于4%多聚甲醛固定液4℃下固定24 h,石蜡包埋后以4 μm厚切片,分别行HE、TUNEL、Nissl染色观察神经元损伤情况。
1.2.5 脑组织中氧化应激指标ROS、MDA、SOD检测采用ELISA法检测脑组织中的ROS、MDA、SOD,按试剂盒说明书操作。
1.2.6 血清及脑组织中炎症因子TNF-α、IL-6、IL-10检测大鼠麻醉后腹主动脉采血,采用ELISA法检测血清及脑组织中TNF-α、IL-6、IL-10,按试剂盒说明书操作。
1.2.7 脑组织中NLRP3炎症小体关键蛋白NLRP3、ASC及其活化标志IL-18、IL-1β检测采用Western blotting法。将脑组织用RIPA缓冲液裂解,再用快速金BCA蛋白测定试剂盒测定浓度,以10%SDS-PAGE分离蛋白产物并转移到PVDF膜上。在PVDF膜中分别加入NLRP3、ASC和GAPDH的一抗4℃下孵育过夜,再分别将二抗在室温下孵化1 h。用化学发光法显色,以凝胶图像处理系统分析目标条带的分子量和净光密度值。以GAPDH为内参,计算目标蛋白的相对表达量。
1.3 ISO对氧葡萄糖剥夺/复氧(OGD/R)细胞活力、凋亡及NLRP3炎症小体的作用观察
1.3.1 细胞分组、建模与ISO处理将PC12细胞接种在含10%胎牛血清的DMEM培养基中,置于5%CO2、37℃温箱培养,培养液2 d更换1次。待细胞覆盖培养瓶壁70%~80%时,按照1∶4传代,将细胞分为模型组、对照组及干预组。模型组及干预组制作OGD/R细胞模型时,先将细胞在37℃、5%CO2、95% N2无糖DMEM培养基中培养4 h,加入完整的DMEM后暴露在95%空气、5%CO2的常氧环境中24 h,同时干预组分别给予ISO 10、50、100 μmol/L处理。对照组不进行氧葡萄糖剥夺过程,其与OGD/R组滴加等体积培养液。
1.3.2 细胞活力观察采用MTT法。37℃下将各组细胞接种96孔板(2×105/孔),培养24 h后每孔加20 μL MTT,2 h后用Multiskan Spectrum酶标仪进行细胞活力测定,以细胞存活率表示细胞活力。细胞存活率=OD干预组/OD对照组×100%。选取干预组中细胞活力最早出现统计学意义的ISO处理浓度,作为后续细胞实验中干预组的处理浓度。
1.3.3 细胞凋亡观察采用流式细胞仪。收集各组细胞,以1×105/孔接种96孔板;培养24 h后用凋亡检测试剂盒进行V-FITC和PI染色,25℃黑暗20 min,采用流式细胞仪测算细胞凋亡率。
1.3.4 细胞中氧化应激标志物ROS、MDA、LDH检测ROS、MDA检测方法同“1.2.5”,用LDH测定试剂盒测以Multiskan Spectrum酶标仪分析LDH水平。
1.3.5 细胞中NLRP3炎症小体关键蛋白NLRP3、ASC及其活化标志IL-18、IL-1β检测细胞培养同“1.3.1”,将细胞分为四组。模型组和对照组处理同“1.3.1”,干预组予以“1.3.2”筛选的ISO浓度处理,干预+激动剂组在加入ISO的同时加NLRP3激动剂Nigericin至终浓度为5 μmol/L;NLRP3、ASC及IL-18、IL-1β检测方法同“1.2.7”。
1.4 统计学方法采用SPSS20.0软件。以W-S法检验计量资料正态分布情况,如呈正态分布以±s表示,多组间比较行单因素方差分析,组间两两比较行LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 ISO对脑梗死大鼠的治疗作用
2.1.1 各组神经功能评分和脑水肿比较与假手术组比较,模型组及药物1、2组神经功能评分升高,脑组织含水量增加(P均<0.01);与模型组比较,药物1、2组神经功能评分降低,药物2组脑组织含水量减少(P均<0.05);与药物1组比较,药物2组神经功能评分降低(P<0.05)。见表1。
表1 各组神经功能评分和脑水肿比较(±s)

表1 各组神经功能评分和脑水肿比较(±s)
注:与假手术组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01;与药物1组比较,eP<0.05。
?
2.1.2 各组脑组织损伤情况比较HE染色显示,假手术组细胞轮廓清晰,核仁明显;模型组及药物1、2组均出现细胞轮廓模糊、细胞变形和水肿等异常;但药物1、2组较模型组细胞病理状态改善,尤其是药物2组改善较明显。TUNEL染色显示,模型组和药物1、2组TUNEL阳性细胞率分别为45.62%±7.34%、26.48%±3.15%、18.46%±2.47%,均高于假手术组的0.50%±0.06%(P均<0.01),药物1、2组TUNEL阳性细胞率低于模型组(P均<0.01)。Nissl染色显示,假手术组的神经元完好无损,而模型组及药物1、2组神经元损伤伴随细胞体和核仁萎缩,药物1、2组特别是药物2组神经元损伤表现减少较明显。见OSID码图1。
2.1.3 各组脑组织中氧化应激指标ROS、MDA、SOD比较与假手术组比较,模型组和药物1、2组脑组织中ROS、MDA升高而SOD降低;与模型组比较,药物1、2组脑组织中ROS、MDA降低而SOD升高;与药物1组比较,药物2组脑组织中ROS、MDA降低而SOD升高(P均<0.05)。见表2。1组比较,cP<0.05。
表2 各组脑组织中氧化应激指标ROS、MDA、SOD比较(相对表达量,±s)
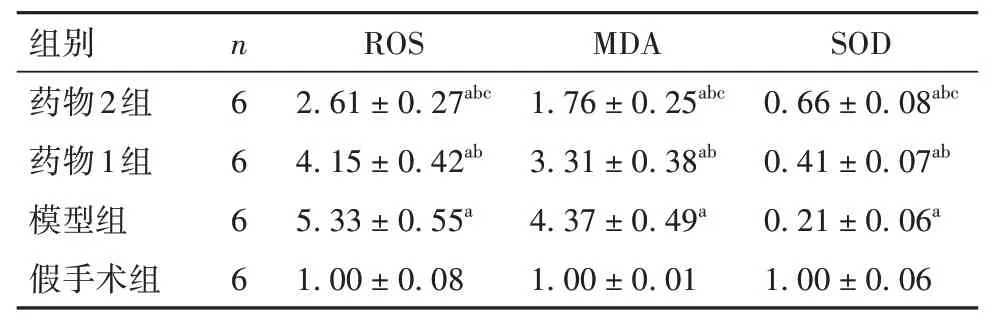
表2 各组脑组织中氧化应激指标ROS、MDA、SOD比较(相对表达量,±s)
注:与假手术组比较,aP<0.01;与模型组比较,bP<0.01;与药物
?
2.1.4 各组血清及脑组织中炎症因子TNF-α、IL-6、IL-10比较与假手术组比较,模型组及药物1、2组血清和脑组织促炎因子TNF-α和IL-6水平升高,药物1、2组血清和脑组织抗炎因子IL-10升高(P均<0.01);与模型组比较,药物1、2组血清和脑组织TNF-α、IL-6降低而IL-10升高(P均<0.01);与药物1组比较,药物2组血清和脑组织中TNF-α、IL-6降低而IL-10升高(P均<0.05)。见表3。
表3 各组血清及脑组织中炎症因子TNF-α、IL-6、IL-10比较(pg/mL,±s)

表3 各组血清及脑组织中炎症因子TNF-α、IL-6、IL-10比较(pg/mL,±s)
注:与假手术组比较,aP<0.01;与模型组比较,bP<0.01;与药物1组比较,cP<0.05,dP<0.01。
?
2.1.5 各组脑组织中NLRP3、ASC、IL-18、IL-1β比较与假手术组比较,模型组及药物1、2组脑组织中NLRP3、ASC、IL-18、IL-1β表达升高;与模型组比较,药物1、2组脑组织中NLRP3、ASC、IL-18、IL-1β表达降低;与药物1组比较,药物2组脑组织中ASC、IL-18、IL-1β表达降低(P均<0.01)。见表4。
表4 各组脑组织中NLRP3、ASC、IL-18、IL-1β比较(±s)

表4 各组脑组织中NLRP3、ASC、IL-18、IL-1β比较(±s)
注:与假手术组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.01;与药物1组比较,dP<0.01。
?
2.2 ISO对氧葡萄糖剥夺/复氧(OGD/R)细胞活力、凋亡及NLRP3炎症小体的作用
2.2.1 各组细胞活力比较模型组细胞活力为56.6%±2.2%,干预组ISO 10、50、100 μmol/L处理后分别为42.3%±1.9%、67.8%±5.4%、66.9%±1.1%;模型组和干预组细胞活力均低于对照组(P均<0.01),干预组ISO 50、100 μmol/L处理细胞活力高于模型组(P均<0.01);干预组ISO 50、100 μmol/L处理细胞活力差异无统计学意义,故选取50 μmol/L作为后续的细胞实验ISO的干预浓度。
2.2.2 各组细胞凋亡率比较模型组、干预组细胞凋亡率分为22.34%±2.42%、15.26%±1.91%,均高于对照组的5.87%±0.55%(P均<0.01),干预组细胞凋亡率低于模型组(P<0.01)。
2.2.3 各组细胞中氧化应激标志物ROS、MDA、LDH比较与对照组比较,模型组和干预组细胞LDH、ROS、MDA均升高;与模型组比较,干预组细胞LDH、ROS、MDA均降低(P均<0.01)。见表5。
表5 各组细胞中氧化应激标志物ROS、MDA、LDH比较(±s)
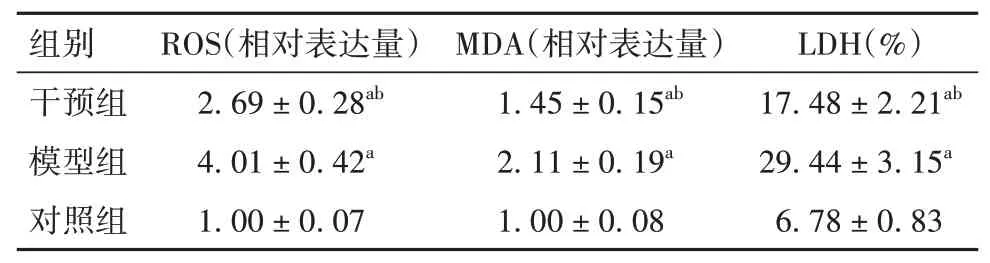
表5 各组细胞中氧化应激标志物ROS、MDA、LDH比较(±s)
注:与对照组比较,aP<0.01;与模型组比较,bP<0.01。
?
2.2.4 各组细胞中NLRP3、ASC、IL-18、IL-1β比较细胞中NLRP3、ASC、IL-1β、IL-18模型组、干预+模型组>干预组>对照组(P均<0.01)。见表6。
表6 各组细胞中NLRP3、ASC、IL-18、IL-1β比较(,±s)
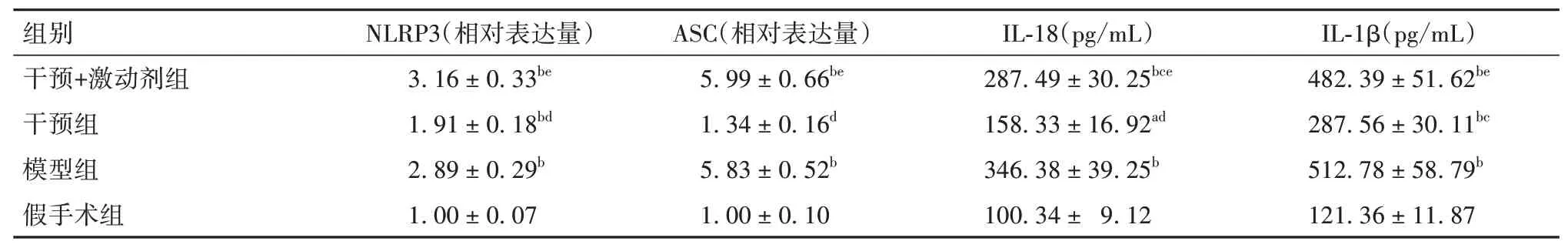
表6 各组细胞中NLRP3、ASC、IL-18、IL-1β比较(,±s)
注:与对照组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01;与干预组比较,eP<0.01。
?
3 讨论
脑梗死是一种常见的脑血管疾病,在世界范围内病死率和致残率都很高。脑梗死的临床管理仍然具有挑战性,目前仍无令人满意的临床防治药物。缺氧和神经炎症引起的脑损伤贯穿于脑梗死急性期整个过程[1],故采取各种措施抑制神经炎症和氧化应激成为脑梗死治疗的主要手段。
研究表明,ISO在多种人类疾病中发挥保护作用,如肺癌、肝癌、骨关节炎和白血病。HE等[8]认为,ISO可能是一种天然单胺氧化酶B抑制剂,通过抑制一氧化氮和TNF-α的释放,在神经退行性疾病中发挥神经保护作用;BAI等[9]报道,ISO对神经细胞轴突和树突的萎缩具有保护作用。本研究首先建立模拟人脑梗死的MCAO大鼠模型,发现ISO能降低脑梗死神经功能评分和脑组织含水量,可改善脑脑梗死后出现的神经元凋亡、核仁萎缩、水肿等病理表现。因此,我们推测ISO对脑梗死大鼠具有保护作用,提示ISO可能是一种治疗脑梗死的有效药物。
脑组织容易受到氧化应激的影响,其主要原因有神经递质自动氧化、线粒体功能紊乱和不饱和脂质的富集[10-11]。HEMMATI-DINARVAND等[10]发现,在帕金森病患者的脑组织中,ROS增加,线粒体功能发生紊乱。研究发现,脑组织中ROS和MDA的表达增加,加速了β-淀粉样蛋白(Aβ)的积累和tau的过度磷酸化,最终促进阿尔茨海默病(AD)的发展。ZHAO等[11]认为,在大鼠脑梗死模型中,脑组织中MDA增加而SOD下降。因此,ROS、MDA与SOD的平衡被用来评估氧化应激对脑损伤的影响。本研究结果显示,在实验动物层面,ISO可以降低脑组织中的ROS、MDA并提高SOD;在细胞水平上,我们进一步发现,由OGD/R所致ROS、MDA、LDH升高,可在被ISO处理后降低。此时,我们推测ISO对梗死脑组织的保护作用可与其抗氧化功能有关。此外,氧化应激是导致神经退行性疾病中神经元凋亡的重要因素[12]。因此,我们认为ISO可能参与了神经元的增殖和凋亡过程,以减轻脑梗死的症状。在本研究中,我们发现ISO处理能明显抑制细胞凋亡,并促进OGD/R诱导的PC-12细胞的活力,这表明ISO能抑制神经细胞凋亡,减轻脑梗死引起的氧化应激损伤。此外,在损伤的脑组织中,氧化应激常伴有神经炎症的发生。研究表明,促炎因子(如TNF-α、IL-6等)及抗炎因子(如IL-10)参与了脑梗死后炎症调节过程[13]。本研究结果显示,在血清、脑组织中,ISO抑制了TNF-α和IL-6的分泌,但促进了IL-10的释放,表明ISO可能是一种用于脑梗死治疗的抗炎药。
研究发现,在脑梗死的发生和发展中,NLRP3炎症小体与神经炎症调节密切相关[14]。MILNER等[15]认为,NLRP3炎症小体可通过Aβ的积累和tau蛋白的过度磷酸化而被激活,从而触发神经炎症,最终导致AD的认知功能逐渐下降。YANG等[4]在NLRP3敲除小鼠中进行MCAO再灌注实验,发现下调NLRP3可通过抑制IL-1β分泌以减少梗死区域,并减轻血脑屏障损伤。研究表明,NLRP3炎症小体失活可降低脑损伤后氧化应激水平,在脑缺血/再灌注损伤模型中注射NLRP3抑制剂MCC950可降低脑组织的过氧化作用[16-17]。基于上述ISO能抑制脑梗死后炎症反应的结果,我们推测ISO可能直接与NLRP3炎症小体产生相互作用,调控脑梗死后炎症反应。本研究结果显示,在大鼠脑组织和神经细胞中,ISO不仅抑制了NLRP3、ASC蛋白表达,还减少了IL-18和IL-1β的产生。为进一步验证该假设,我们加入了NLRP3激动剂Nigericin进行反馈验证实验,发现Nigericin减轻了ISO处理对OGD/R诱导的PC-12细胞中NLRP3、ASC、IL-18、IL-1β表达的抑制作用,提示NLRP3炎症小体是ISO治疗脑梗死的靶点。
综上所述,本研究揭示了ISO在脑梗死中对脑组织的保护作用,该作用与其调控NLRP3炎症小体进而抑制氧化应激和炎症损伤有关。这提示ISO可能成为临床治疗脑梗死的潜在有效药物,本研究为其临床应用提供了一定的理论基础。
