CACNA1D基因突变大鼠血压变化及其与血浆Th1、Th2细胞因子的关系
2022-11-15吴小盈陈慧林鹏程王欢毛高伟
吴小盈,陈慧,林鹏程,王欢,毛高伟
1福建医科大学省立临床医学院,福州 350001;2福建省立医院心血管内二科
高血压是最常见的慢性病之一,其发病机制复杂,与高血压相关的基因多态性及其异常调控是研究的热点。本课题组在前期高血压家系调查中发现了一个新的高血压相关位点:CACNA1D基因c.920A>G[1]。CACNA1D基因编码Cav1.3钙通道α1亚基,Cav1.3是L-型电压门控钙通道,参与神经递质释放,激素分泌及平滑肌收缩等多项生理功能[2-3]。据此,我们推测CACNA1D基因c.920A>G很可能与高血压发病有关。免疫系统激活在高血压的发生和发展过程中扮演了重要角色,其中T淋巴细胞功能及其分泌的细胞因子异常,尤其是两种重要的辅助性T淋巴细胞亚群Th1、Th2之间的失衡可能与高血压的靶器官损害有关[4-5]。Th1细胞合成和分泌白细胞介素2(IL-2)、干扰素γ(IFN-γ)等细胞因子,Th2细胞合成和分泌IL-4、IL-5、IL-6、IL-10等细胞因子。Th1型和Th2型细胞因子在分别促进自身增殖活化的同时抑制对方增殖活化,使机体维持Th1/Th2细胞功能平衡,避免发生免疫偏离或免疫功能紊乱。2018年6月—2021年6月,本研究应用CRISPR-Cas9基因编辑技术构建了与人CACNA1D基因对应的点突变p.D307G(c.920A>G)SD大鼠,观察其血压变化并分析这种变化是否与血浆Th1、Th2细胞因子有关。现报告如下。
1 材料与方法
1.1 主要材料实验动物:通过CRISPR/Cas9基因编辑技术创建CACNA1D基因c.920A>G突变SD大鼠(广州赛业生物科技有限公司)。采用PCR法鉴定F0代大鼠后,进行序列分析并与野生型SD大鼠杂交,检测种系传播。取20日龄F1代大鼠部分鼠尾样本,测序后进行标记。将上述2~4个月龄的雌性和雄性F1代杂合子大鼠在同一笼中饲养,繁殖F2代大鼠,对所有F2代大鼠基因型进行鉴定(福州博尚生物有限公司)。分别抽取野生型(AA型)、杂合突变型(AG型)、纯合突变型(GG型)SD大鼠14、22、12只,均雌雄各半,用于后续研究。大鼠饲养于福建医科大学动物实验中心,自由饮水、摄食,给予相同标准的动物饲料。动物实验遵从《中华人民共和国动物实验管理条例》并经福建医科大学实验动物伦理委员会批准。仪器及试剂:SoftronTM智能无创血压计BP-98A(北京软隆科技有限责任公司),电子秤(上海精密科学仪器有限公司);IL-2、IFN-γ、IL-4、IL-5、IL-6、IL-10 ELISA反应试剂盒(云南沃森生物技术有限公司)。
1.2 血压测量方法分别于F2代大鼠鼠龄第8、9、10、17、21、26、28、32周时通过SoftronTM智能无创血压计采用尾袖法检测大鼠的收缩压,自动连续测量血压3次,去除极值后取平均值。将32周时收缩压≥140 mmHg的大鼠判定为高血压大鼠,收缩压<140 mmHg的大鼠判定为正常血压大鼠。
1.3 血浆Th1、Th2细胞因子水平检测方法采用ELISA双抗体夹心法。各基因型大鼠32周龄时,使用电子秤记录大鼠体质量,按0.5 mL/kg给予20%乌拉坦腹腔麻醉,使用一次性采血针行腹主动脉采血,快速注入抗凝管中,充分摇匀,3 000 r/min低温离心10 min,取上层血浆置于-80℃冰箱中冷冻保存。使用相应ELISA反应试剂盒测定血浆Th1、Th2细胞因子IL-2、IFN-γ、IL-4、IL-5、IL-6、IL-10,严格按照试剂盒说明书操作。
1.4 统计学方法采用SPSS22.0统计软件。计量资料采用Shapiro-Wilk法行正态性检验,符合正态分布且方差齐性的计量资料以±s表示,组间比较行独立样本t检验,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 三种基因型大鼠各时点收缩压比较见图1。
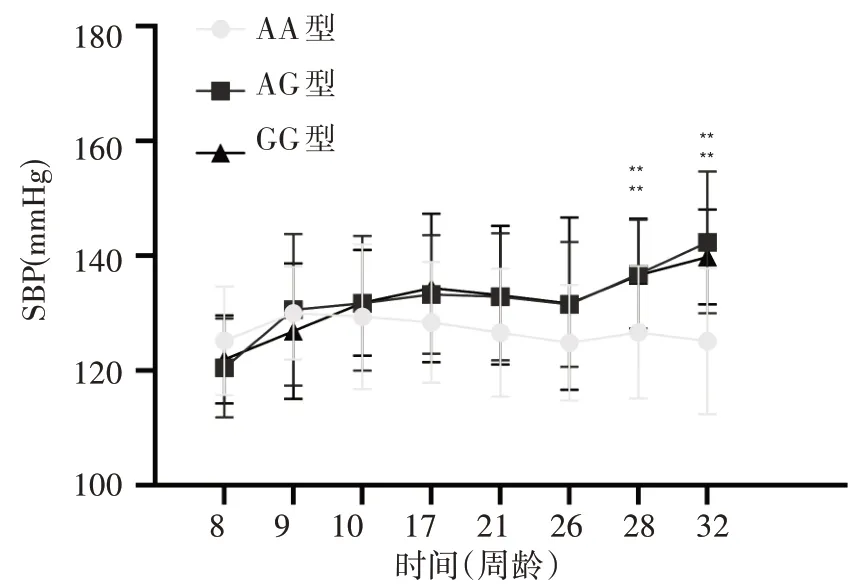
图1 三种基因型大鼠收缩压比较趋势图
2.2三种基因型大鼠32周龄时收缩压比较32周龄时,AA型、AG型、GG型雄性大鼠收缩压分别为(124.57±12.97)、(143.00±11.08)、(141.67±13.10)mmHg,雌性大鼠收缩压分别为(121.67±15.36)、(139.80±14.33)、(138.17±9.20)mmHg;AG型、GG型大鼠收缩压均高于同性别AA型大鼠(P均<0.05),各基因型大鼠不同性别间收缩压比较差异均无统计学意义。
2.3 三种基因型大鼠32周龄时血浆IL-2、IL-4、IL-5、IL-6、IL-10、IFN-γ及IFN-γ/IL-4比较见表1。
表1 三种基因型大鼠32周龄时血浆IL-2、IL-4、IL-5、IL-6、IL-10、IFN-γ及IFN-γ/IL-4比较(±s)
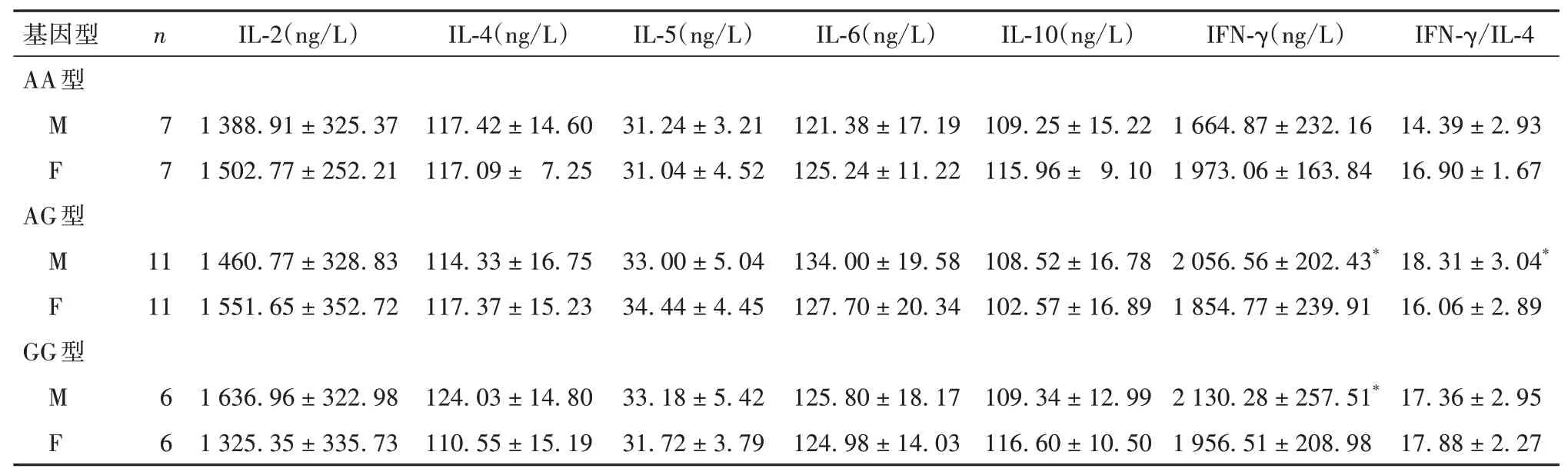
表1 三种基因型大鼠32周龄时血浆IL-2、IL-4、IL-5、IL-6、IL-10、IFN-γ及IFN-γ/IL-4比较(±s)
注:M为雄性,F为雌性;与同性别AA型比较,*P<0.05。
?
2.4 高血压与正常血压大鼠血浆IL-2、IL-4、IL-5、IL-6、IL-10、IFN-γ及IFN-γ/IL-4比较32周龄时,共有高血压大鼠17例,收缩压为(150.93±7.28)mmHg;正常血压大鼠31例,收缩压为(126.89±10.03)mmHg。高血压与正常血压大鼠血浆IL-2、IL-4、IL-5、IL-6、IL-10、IFN-γ及IFN-γ/IL-4比较。见表2。
表2 高血压与正常血压大鼠血浆IL-2、IL-4、IL-5、IL-6、IL-10、IFN-γ及IFN-γ/IL-4比较(±s)

表2 高血压与正常血压大鼠血浆IL-2、IL-4、IL-5、IL-6、IL-10、IFN-γ及IFN-γ/IL-4比较(±s)
注:与正常血压大鼠比较,*P<0.05。
?
3 讨论
各种原因造成的血管壁炎症和损伤激活机体免疫反应,损伤血管内皮,导致血管壁重构,促使高血压发生。应用血管紧张素Ⅱ(AngⅡ)受体阻滞剂不仅能有效降低血压,还可以通过调节免疫反应达到治疗效果[6-7]。高血压发病多基于遗传因素和环境因素,目前较普遍的观点认为其是一种在环境致病因素影响下的多基因关联遗传性疾病,超过一半的高血压病患者存在高血压病家族史。高血压动物模型的应用对于阐明高血压发病机制,尤其是研究遗传因素对高血压发病的作用有非常重要的地位。
在本课题组的前期研究中发现,CACNA1D基因c.920A>G位点可能是一个新的高血压相关位点。在我们调查的高血压家系中,先证者为29岁女性,其11名家庭成员中有10名携带CACNA1D基因杂合错义突变,8名成年携带者中6名患有慢性高血压,其中包括先证者的双胞胎姐妹[1]。CACNA1D基因是编码L型钙通道ɑ1亚单位家族的一员,研究显示其可能是一个新的高血压相关区域[8]。L型钙通道是三类电压门控钙离子通道之一,在神经内分泌细胞、血管平滑肌细胞及心肌细胞中广泛表达,通过调节细胞内钙离子浓度改变血管平滑肌的收缩及舒张,从而调节血压[9]。LU等[10]在中国成人中发现CACNA1D(rs9810888)基因与血压相关,YANG等[11]研究发现CACNA1D(rs9810888)GG基因型和不良生活方式对中国儿童血压升高有联合效应。以上研究均提示,CACNA1D基因可能和血压调节有关并可能是L型钙通道阻滞剂降压作用的靶点。
本研究采用CRISPR/Cas9技术创建了CACNA1D基因c.920A>G单位点突变的SD大鼠(专利号:No.202011326345.8),并对其F2代大鼠进行了32周的血压监测。结果显示,与野生型比较,突变型大鼠自10周龄后收缩压出现随时间逐步升高的趋势,到28~32周龄时,血压显著高于野生型大鼠。32周龄大鼠对应的人类年龄大致为22岁,此时突变型大鼠平均收缩压大致相当于人类1级高血压的血压水平。这提示CACNA1D基因c.920A>G单位点突变可能导致大鼠发生高血压。
高血压免疫机制相关研究发现,T淋巴细胞及其分泌的免疫活性物质和高血压的发病及其靶器官损害存在密切关系[5]。Th1和Th2是两个重要的辅助性T淋巴细胞亚群,Th1细胞介导的免疫反应对于AngⅡ诱导的血压升高、血管炎症和血管功能障碍有促进作用。Th1细胞主要分泌IL-2及IFN-γ,高血压患者中IFN-γ水平升高,且和血压分级呈正相关。SALEH等[12]研究发现,敲除IFN-γ基因可抑制小鼠AngⅡ诱导的近端小管钠重吸收,从而降低AngⅡ诱发的高血压。本研究结果显示,CACNA1D基因突变的雄性大鼠IFN-γ水平显著高于野生型大鼠,高血压大鼠IFN-γ水平虽然高于正常血压大鼠,但没有有统计学意义,提示CACNA1D基因c.920A>G突变导致的高血压可能与Th1细胞功能异常有关。Th2细胞主要分泌IL-4、IL-5、IL-6和IL-10,正常情况下,Th1和Th2细胞因子相互作用,处于动态平衡。当机体在炎症因子的刺激下出现Th0细胞向Th1和Th2细胞转化时,作为Th1和Th2细胞分泌的代表性细胞因子,IFN-γ和IL-4起到了重要的调节作用,分别促进自身细胞的分化成熟并抑制对方细胞的分化成熟。有研究发现,高血压伴左心室肥厚患者Th1细胞比例明显升高,Th1/Th2细胞比值大于单纯高血压组和对照组[13]。IFN-γ/IL-4可以反映机体内Th1/Th2细胞的情况,本研究中AG型杂合突变雄性大鼠血浆IFN-γ/IL-4细高于野生型大鼠,高血压组大鼠IL-4低于、IFN-γ/IL-4高于正常血压大鼠。这提示CACNA1D基因c.920A>G突变大鼠模型中,高血压的发生可能与Th1/Th2细胞失衡有关。
在CACNA1D基因突变的雌性大鼠中,未观察到IFN-γ或IFN-γ/IL-4与野生型之间的差异,考虑原因有二。①可能与高血压的性别差异有关。刘欣[14]对人重组激活基因1(Rag-1)敲除小鼠进行研究时发现,将雄性C57小鼠的CD3+T淋巴细胞移植给Rag-1敲除小鼠,给予AngⅡ干预后,雄性Rag-1敲除小鼠的血压明显高于雌性Rag-1敲除小鼠。同时,对于雄性Rag-1敲除小鼠,接受雄性C57小鼠的CD3+T淋巴细胞移植,给予AngⅡ干预后,其血浆IL-17A和肿瘤坏死因子TNF明显高于、血浆IL-10明显低于接受雌性C57小鼠的CD3+T淋巴细胞移植者。这提示高血压及其相关T淋巴细胞分化可能存在性别差异。②可能与本实验大鼠高血压病程较短有关。本研究中,实验大鼠32周龄相当于人类22岁,血压水平相当于1级高血压,处于早发高血压的早期阶段;并且本实验中雌性GG型大鼠平均血压为138 mmHg,略低于140 mmHg。这些可能是造成在雌性大鼠中未观察到IFN-γ或IFN-γ/IL-4与野生型之间差异的原因。
综上所述,本研究通过CRISPR/Cas9技术创建了CACNA1D基因c.920A>G单位点突变的SD大鼠,发现纯合及杂合的突变大鼠血压高于未发生突变的野生型大鼠,其高血压的发生可能与Th1/Th2细胞功能失衡有关。
