猫须草无菌短枝组织培养与快速繁殖体系的建立
2022-11-11李佳慧叶维雁朱鹏锦庞新华唐毓玮韦俏宇
李佳慧,叶维雁,朱鹏锦*,庞新华,张 继,唐毓玮,韦俏宇
猫须草无菌短枝组织培养与快速繁殖体系的建立
李佳慧1,叶维雁1,朱鹏锦1*,庞新华1,张 继1,唐毓玮1,韦俏宇2
1. 广西壮族自治区亚热带作物研究所,广西南宁 530001;2. 广西壮族自治区人民医院,广西南宁 530000
猫须草又称作“肾茶”,是一种生长在热带和亚热带地区的多年生草本植物,有一定的药用价值和观赏价值。在东南亚,猫须草作为一种传统的茶饮而深受人们喜爱,在我国则更多是作为一种中草药用于治疗肾脏疾病。然而猫须草野生药材资源日趋枯竭,传统生产繁殖方式难以满足市场需求,因此采用植物组织培养快速繁殖技术,为猫须草大规模种植提供种苗已成为急需解决的问题。为了研究适合猫须草的无菌短枝组织培养快速繁殖体系,本研究以带一对腋芽的猫须草幼嫩茎段为外植体,探究不同消毒方法、激素类型与浓度及培养基配方对猫须草无菌短枝组织培养的影响。结果表明,猫须草无菌短枝组织培养的最佳消毒方法为75%酒精浸泡10 s或15 s+0.1%升汞浸泡6 min,当0.1%升汞消毒时间为8 min时,猫须草无菌短枝的萌芽率显著下降,当0.1%升汞消毒时间为4 min时,猫须草无菌短枝的污染率显著提高。最佳初代培养基配方为MS+6-BA 1.0 mg/L+NAA 0.5 mg/L或MS+6-BA 0.5 mg/L+NAA 0.2 mg/L;但当6-BA的浓度达2.0 mg/L时,组培苗长势细弱,叶片发黄,并有玻璃化发生。最佳继代培养基配方为MS+TDZ 0.05 mg/L+IBA 0.2 mg/L;与添加6-BA相比,添加TDZ更有利于猫须草无菌短枝继代组培苗的生长。最佳生根培养基配方为1/2MS+NAA 1.0 mg/L+IBA 1.0 mg/L+活性炭3 g/L,组培苗生根率可达95%。培养基配方及不同激素组合均会影响猫须草无菌短枝组培苗的生根,1/2MS培养基明显优于MS培养基,同时添加NAA和IBA比单独添加NAA的效果好。将组培苗移栽至珍珠岩、细河沙、泥炭土的体积比为1∶1∶1的混合基质中,植株生长良好,成活率高。研究结果可为猫须草大规模工厂化生产提供科学可行的技术支持。
猫须草;无菌短枝;组织培养;快速繁殖
猫须草是唇形科肾茶属多年生草本植物,茎直立,具四棱,花冠浅紫或白色,在东南亚地区广泛种植,我国主要分布于广东、海南、广西南部、云南南部、台湾及福建等地[1];喜温暖湿润的气候,常生于海拔700~1000 m的林下潮湿处,对光照要求不严,在全光照下或一定荫蔽的环境下均可较好生长[2]。猫须草作为一种传统中草药,其地上部分入药,能治疗急慢性肾炎、膀胱炎、尿路结石,对风湿性关节炎也有一定疗效[3]。在许多东南亚国家,如马来西亚、菲律宾、印度尼西亚,人们常把猫须草当作日常茶饮。现代医学研究表明,猫须草主要含有萜类、黄酮类和酚酸类等化学成分[4-5],具有利尿、排石、抗菌、消炎、健肾、改善慢性肾功能衰竭和提高免疫力等医疗保健作用[6-7]。因猫须草具有重要的药理作用,发展前景广阔,其市场需求日益扩大。
猫须草的繁殖方式有扦插繁殖、种子繁殖以及组培繁殖等方法。但猫须草结实率低,且种子寿命只有15 d,发芽率仅为40%[8],种子繁殖难以满足市场需求。扦插繁殖是目前猫须草应用最广泛的繁殖方式,操作简单且成本较低,但扦插繁殖存在所需材料多、繁殖速度慢、繁殖系数低、对外界环境要求高等问题。组培繁殖技术具有所需繁殖材料少、繁殖系数高、能保持母株的优良特性、不受季节限制等优点,已广泛应用于生物学和农业科学,在生产上发挥重要作用[9]。因此利用植物组织培养技术快速繁殖猫须草,对促进猫须草大规模种植、满足市场需求具有重要意义。
近年来国内已有关于猫须草组织培养的研究(如莫昭展等[10],王连翠等[11],李纲[12],李任珠等[13]),但通常是通过愈伤组织发生或丛生芽发生途径再生植株这一技术路线,而采用无菌短枝快繁技术进行猫须草离体快速繁殖的研究尚未报道。无菌短枝快繁技术类似于微型扦插,指外植体携带的带腋芽茎段,在人工培养基和合适的条件下进行离体培养,使其长出新的枝条,再将其剪成带腋芽茎段,继代再生根成苗的繁殖方法[14]。无菌短枝快繁技术成苗快,不经过愈伤组织诱导阶段,遗传性状稳定,培养过程简单,移裁容易成活,因此可能更适合大规模工厂化生产。本研究以带一对腋芽的猫须草幼嫩茎段为外植体,进行猫须草无菌短枝组织培养研究,建立较完善的猫须草无菌短枝快速繁殖体系,旨在为猫须草大规模工厂化育苗提供科学可行的技术支持,以满足市场需求。
1 材料与方法
1.1 材料
供试材料为2019年种植于广西壮族自治区亚热带作物研究所第三科研基地资源圃的野生猫须草,外植体材料为经过预处理培育的猫须草幼嫩枝条。
1.2 方法
1.2.1 材料预处理 预处理方法如下:选取健壮无病虫害的猫须草,小心挖起,抖掉根部的土壤并用清水冲洗,在枝条离根部3~4 cm处修剪及剪去老叶保留叶柄,将修剪好的枝条用0.4%咪酰胺或者0.2%代森锰锌药液浸泡消毒1~2 h;浸泡后移栽到装有50%水溶代森铵350倍液消毒基质的花盆里(花盆规格16 cm×14 cm×12 cm),并移入密闭塑料大棚中(塑料大棚提前用0.4%咪酰胺和0.2%代森锰锌消毒地面和四周);移栽苗定植后,每隔7 d交替使用0.4%咪酰胺和0.2%代森锰锌或单用0.4%咪酰胺或单用0.2%代森锰锌药液喷洒植株、地面以及塑料大棚四周一次。当猫须草顶部新抽出幼嫩芽段长至8~10 cm时,将其从基部剪断,作为无菌短枝快速繁殖的外植体材料,参照朱鹏锦等[15]的方法。
1.2.2 外植体处理及消毒 将通过预处理培养得到的猫须草外植体带回实验室,剪去叶片,剪成2~3 cm带有一对腋芽的茎段,用洗洁精洗净表面灰尘,浸泡15 min,流水冲洗20 min。控干水分后装进已灭菌的空瓶中,放入超净工作台备用。在超净工作台中,将外植体转移至已灭菌的空瓶中,倒入75%酒精,浸泡外植体,浸泡外植体10 s或15 s,用灭菌水冲洗;后用0.1%升汞溶液浸泡,期间不断摇动,用无菌水冲洗,用灭菌纸吸干后接种。
1.2.3 接种方法及培养条件 在超净工作台中将已消毒的无菌短枝用接种刀切掉外部边缘部分,用镊子接种于不同种类的培养基中,每瓶接种1~2个无菌短枝茎段,于培养室中培养20~30 d。培养基在121℃条件下灭菌20 min,高温灭菌前pH调至5.8左右;接种后组培苗培养条件均为培养温度为25~28℃,光照强度为2000~2500 Lx,每天连续光照12 h。
1.2.4 外植体消毒试验 以MS+1.0 mg/L 6-BA+ 0.5 mg/L NAA+7 g/L琼脂+30 g/L蔗糖为猫须草无菌短枝培养基,按下列方法进行外植体消毒处理:(1)75%酒精10 s+0.1%升汞4 min;(2)75%酒精10 s+0.1%升汞6 min;(3)75%酒精10 s+0.1%升汞8 min;(4)75%酒精15 s+0.1%升汞4 min;(5)75%酒精15 s+0.1%升汞6 min;(6)75%酒精15 s+0.1%升汞8 min。每个处理在75%酒精处理后用无菌水冲洗2次,每次1 min,在0.1%升汞处理后用无菌水冲洗3次,每次1 min,后放灭菌纸上吸干水分,接入培养基中。每组处理接种30瓶,每瓶1个无菌短枝茎段。每隔5 d观察1次,30 d后统计结果,期间观察记录每个处理的细菌污染情况。
1.2.5 初代培养试验 初代培养基以MS+7 g/L琼脂+30 g/L蔗糖为基本培养基,分别添加不同浓度的6-BA(0.5、1.0、1.5、2.0 mg/L)和NAA(0.2、0.5 mg/L),将经过消毒处理的外植体切掉外部边缘褐变部分,接种于不同类型初代培养基中,每个处理接种20瓶,每瓶接种1个无菌短枝茎段,共接种20个无菌短枝茎段。每隔5 d观察1次,25 d后统计无菌短枝生长情况。
1.2.6 继代培养试验 继代培养基以MS+7 g/L琼脂+30 g/L蔗糖为基本培养基,分别添加不同浓度的TDZ(0.02、0.05 mg/L)、6-BA(0.2、0.5 mg/L)、IBA(0.1、0.2 mg/L)、NAA(0.1、0.2 mg/L),将经过初代培养的组培苗剪成带有一对腋芽的无菌短枝茎段,接种于不同类型的继代培养基中,每个处理接种20瓶,每瓶接种1个无菌短枝茎段,共接种20个无菌短枝茎段。每隔5 d观察1次,20 d后统计结果。
1.2.7 生根培养试验 生根培养基以MS+蔗糖30 g/L+琼脂7 g/L+活性炭3 g/L或1/2MS+蔗糖30 g/L+琼脂7 g/L+活性炭3 g/L为基本培养基,附加NAA(0.5、1.0、1.5 mg/L)、IBA(0.5、1.0、1.5 mg/L)。将继代培养组培苗从基部剪下,移入不同类型的生根培养基中,每个处理接种20瓶,每瓶接入1棵无菌短枝组培苗。每隔5 d观察1次,30 d后统计结果。
1.2.8 练苗与移栽 待组培苗根长达3 cm,苗高3~5 cm时,将其移至顶部覆盖有遮阴网的温室大棚中,自然光下练苗7 d左右;将其从培养瓶中取出,洗净其底部培养基,置于多菌灵溶液中浸泡5~7 min,后移栽至已消毒培养基质中,观察幼苗生长情况。基质预先使用50%水溶代森铵350倍液,按每平方米培养基质用3 kg稀释液喷洒均匀进行消毒处理。
1.3 数据处理
利用以下公式计算相关指标,污染率=(污染数/接种数)×100%;萌芽率=(萌芽数/接种数)×100%;增殖倍数=(成苗数/接种数)×100%;生根率=(生根数/接种数)×100%。
采用Microsoft Excel 2010和SPSS 19.0软件对试验数据进行处理与统计分析。
2 结果与分析
2.1 不同消毒方法下猫须草无菌短枝组织培养特性
用0.1%升汞和75%酒精不同消毒方法处理猫须草无菌短枝外植体。结果如表1所示,0.1%升汞消毒4~8 min可对猫须草无菌短枝的萌芽率或污染率产生显著影响,而75%酒精消毒10 s或15 s对猫须草无菌短枝的污染率无显著影响,对萌芽率产生显著影响。当75%酒精消毒10 s或15 s,0.1%升汞消毒4 min或6 min(处理1、2、4、5)时,猫须草无菌短枝的萌芽率均是100%,无显著差异;75%酒精消毒10 s或15 s,0.1%升汞消毒8 min(处理3、6)时,猫须草无菌短枝萌芽率分别为87.3%和83.3%,显著低于0.1%升汞消毒4 min或6 min时的萌芽率。当75%酒精消毒10 s或15 s时,0.1%升汞消毒4 min(处理1、4)时猫须草无菌短枝污染率最高,分别为16.7%、13.3%,显著高于0.1%升汞消毒6 min或8 min时;而75%酒精消毒10 s或15 s,0.1%升汞消毒6 min或8 min(处理2、3、5、6)时,猫须草无菌短枝的污染率无显著差异。因此,处理5(75%酒精15 s+0.1%升汞6 min)和处理2(75%酒精10 s+0.1%升汞6 min)为最适合猫须草无菌短枝快速繁殖最的消毒方法,即用75%酒精消毒10 s或15 s,用0.1%升汞消毒6 min。当0.1%升汞消毒时间为8 min时,猫须草无菌短枝的萌芽率显著下降,当0.1%升汞消毒时间为4 min时,猫须草无菌短枝的污染率显著升高。
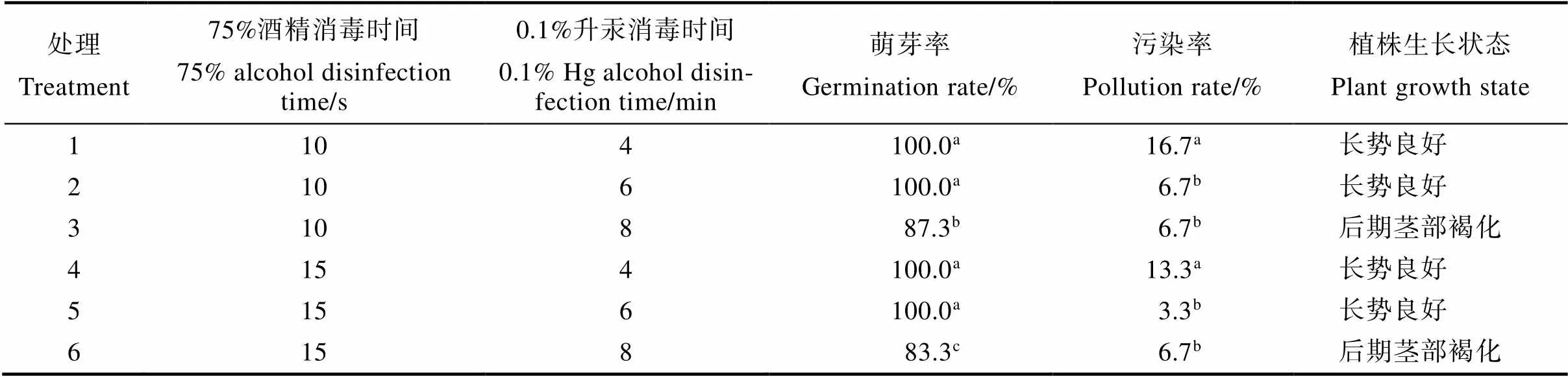
表1 不同消毒方法下猫须草无菌短枝组织培养特性
注:同列不同小写字母表示处理间差异显著(<0.05)。
Note: Different lowercase letters in the same column indicate significant difference between treatments (<0.05).
2.2 不同激素处理下猫须草无菌短枝初代培养特性
为了确定适合猫须草无菌短枝初代培养的激素配方,将经过消毒的猫须草无菌短枝接种到不同激素配比的MS培养基中。无菌短枝在培养基中生长7 d左右时即可萌发出腋芽(图1A),且接种在不同激素配比培养基上的无菌短枝均能萌发腋芽。如表2所示,培养25 d后猫须草无菌短枝在处理6(添加6-BA 1.0 mg/L、NAA 0.5 mg/L)及处理1(添加6-BA 0.5 mg/L、NAA 0.2 mg/L)的初代培养基上培养效果较好,总成苗数分别为63和60,增殖倍数分别为3.15和3.00,显著高于接种于其他激素配比培养基中的成苗数及增值倍数,且猫须草组培苗生长情况良好、无玻璃化、叶片绿色(图1B,图1C)。另外,6-BA的浓度对猫须草无菌短枝组织培养存在较大影响,当NAA浓度为0.2 mg/L或0.5 mg/L时,猫须草无菌短枝在添加不同浓度6-BA的初代培养基中成苗数及增值倍数差异显著(表2),且当6-BA的浓度达2.0 mg/L时,猫须草无菌短枝组培苗长势细弱,叶片发黄,并有玻璃化发生。因此,MS+6- BA 1.0 mg/L+NAA 0.5 mg/L或MS+6-BA 0.5 mg/ L+NAA 0.2 mg/L为最适合猫须草无菌短枝快速繁殖的初代培养基。

A:初代培养萌发的腋芽;B、C:初代培养组培苗。
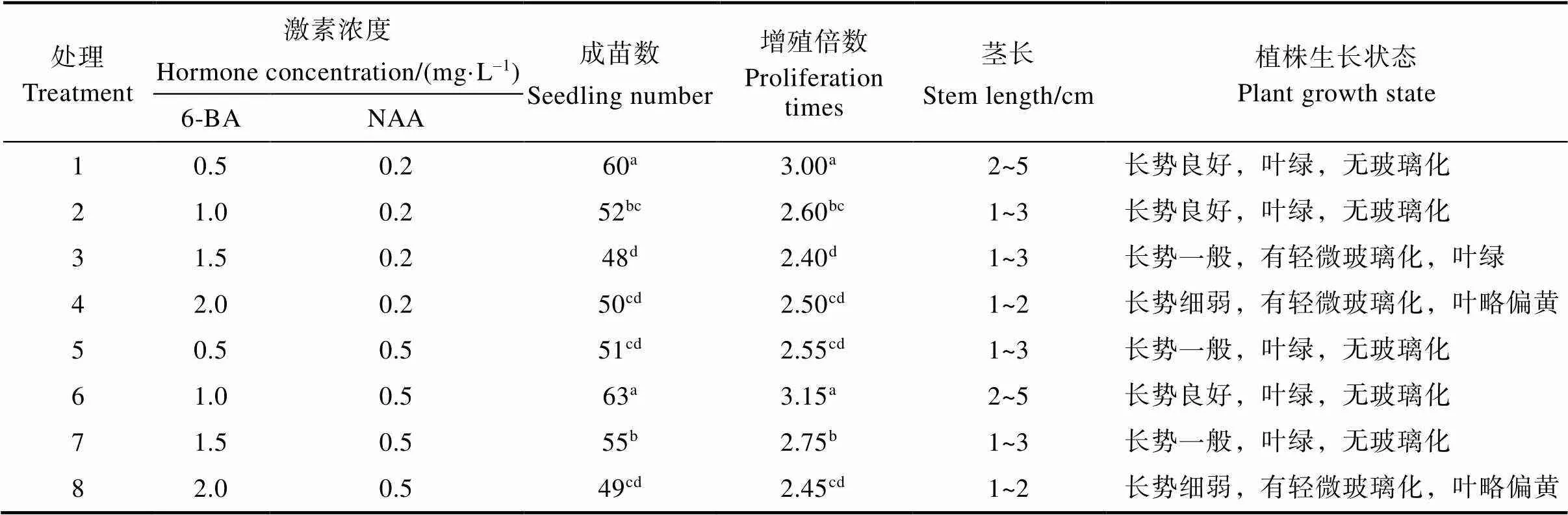
表2 不同激素处理下猫须草无菌短枝初代培养特性
注:同列不同小写字母表示处理间差异显著(<0.05)。
Note: Different lowercase letters in the same column indicate significant difference between treatments (<0.05).
2.3 不同激素处理下猫须草无菌短枝继代培养特性
如表3所示,培养20 d后,不同激素处理对猫须草无菌短枝继代组培苗的成苗数及增值倍数影响不大,但对继代组培苗的茎长及生长状态存在较大影响。猫须草无菌短枝继代培养在处理7(TDZ 0.05 mg/L、IBA 0.2 mg/L)培养基中的增值倍数显著高于处理4(6-BA 0.5 mg/L、NAA 0.2 mg/L),且组培苗生长情况最好,茎长较长,无玻璃化,叶片绿色(图2)。其他激素组合处理下猫须草无菌短枝继代组培苗虽然增值倍数与处理7无显著性差异,但其组培苗整体生长状态比处理7的差。此外,由表3还可看出,与6-BA相比,TDZ更有利于猫须草无菌短枝继代组培苗的生长,在添加TDZ的培养基中,继代组培苗的茎长及生长状态较好。因此,本研究中MS+TDZ 0.05 mg/L+IBA 0.2 mg/L为猫须草无菌短枝的最佳继代培养基。

图2 猫须草无菌短枝继代培养组培苗
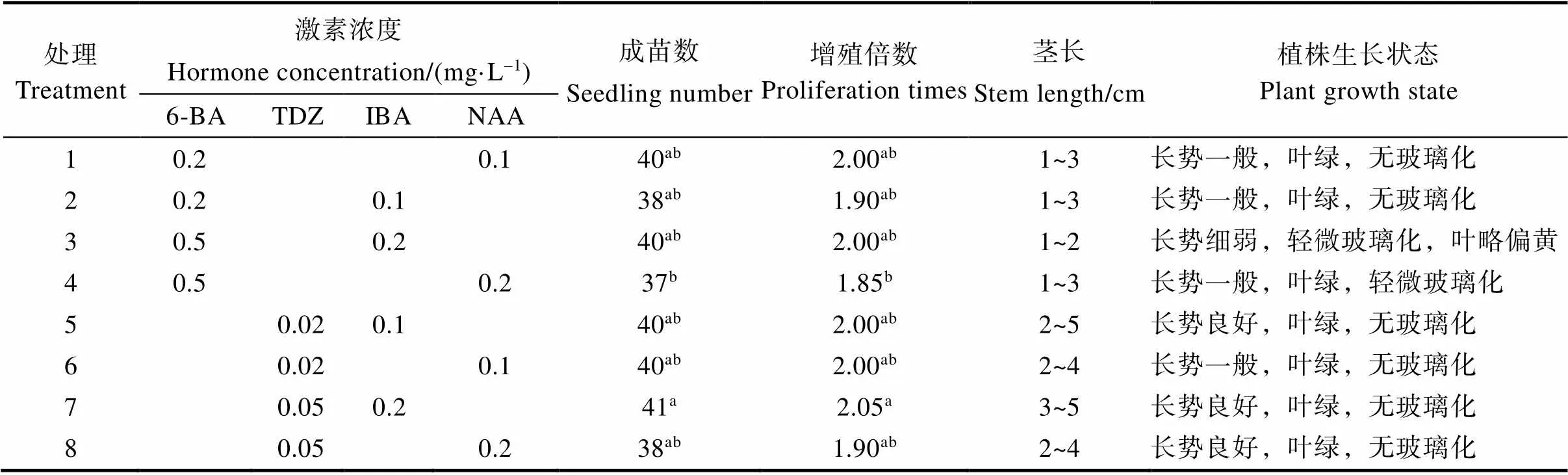
表3 不同激素处理下猫须草无菌短枝继代培养特性
注:同列不同小写字母表示处理间差异显著(<0.05)。
Note: Different lowercase letters in the same column indicate significant difference between treatments (<0.05).
2.4 不同培养基及激素处理下猫须草无菌短枝生根培养特性
将继代培养获得的组培苗移栽到添加有活性炭及不同激素、不同培养基配方的生根培养基中。接种5 d后,部分幼苗开始生根,且根系呈黄白色辐射状(图3)。如表4所示,接种30 d后,处理6(1/2MS++NAA 1.0 mg/L+IBA 1.0 mg/L)的猫须草无菌短枝生根率最高,达到95%,显著高于其他处理的生根率,且其生根数较多(6~10条),根长较长(4~6 cm)。此外,由表4还可看出,培养基的类型对生根率、平均生根数、平均根长存在较大影响,1/2MS培养基明显优于MS培养基。1/2MS培养基中猫须草无菌短枝的生根率显著高于MS培养基。不同激素处理对猫须草无菌短枝生根也存在较大影响,同时添加NAA和IBA比单独添加NAA的效果好。因此,最适合猫须草无菌短枝生根的培养基是1/2MS+NAA1.0 mg/L+IBA 1.0 mg/L+活性炭3 g/L。

图3 猫须草无菌短枝的组培苗生根培养
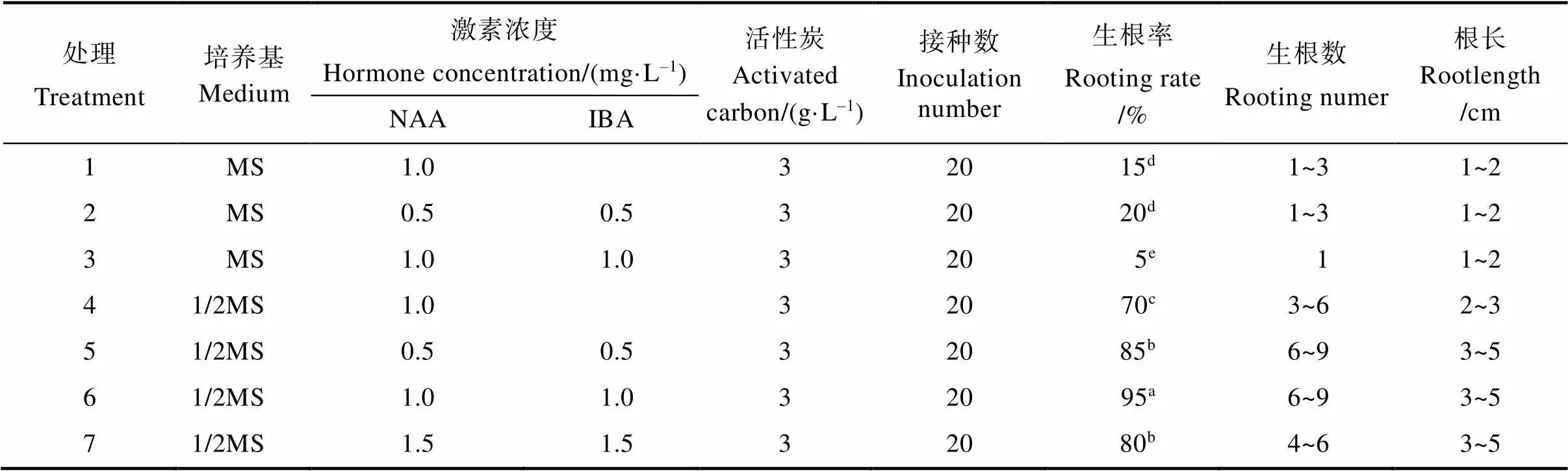
表4 不同培养基及激素处理下猫须草无菌短枝生根培养特性
注:同列不同小写字母表示处理间差异显著(<0.05)。
Note: Different lowercase letters in the same column indicate significant difference between treatments (<0.05).
2.5 组培苗的练苗与移栽
待苗高3 cm左右时,将生根组培苗打开瓶盖练苗7 d,后移栽到珍珠岩、细河沙、泥炭土的体积比为1∶1∶1的混合基质上。移栽30 d后,猫须草无菌短枝幼苗毛叶片舒展,并有新叶长出,表明移栽成活(图4)。
3 讨论
植物组织培养是指在无菌条件下,将离体的植物器官、组织、细胞、胚胎、原生质体培养在人工配制的培养基上,给予适宜的培养条件,诱发产生愈伤组织或潜伏芽等,或长成完整的植株的过程[16],可用于植物体规模化、企业化的脱毒及离体快速繁殖。无菌短枝扦插途径是植物组织培养的一种,它是在无菌条件下对带芽的外植体材料进行培养,施加适量植物生长调节物质使芽萌发长出,再进一步培养使芽增殖,最后对增殖获得的芽进行生根培养。无菌短枝扦插途径不经过愈伤组织诱导阶段,操作相对简单,可在短时间内得到大量的无菌幼苗,因此本研究采用无菌短枝扦插的方法建立猫须草快速繁殖体系。结果表明,外植体消毒方法、激素浓度及类型、培养基配方是建立猫须草无菌短枝快速繁殖体系的关键技术环节。

图4 猫须草无菌短枝移栽成活
植物组织培养过程中,造成污染的原因很多,其中外植体带菌是培养过程中污染的主要原因之一[17]。建立无菌外植体,获得无菌材料是植物组织培养成败的第一步。本研究中在猫须草外植体生长阶段,就对其生长的温室大棚、移栽基质及植株本身进行了消毒预处理,降低了外植体的污染概率。在外植体消毒试验中,本研究发现0.1%升汞消毒时间4~8 min可对猫须草无菌短枝的萌芽率或污染率产生显著影响,当0.1%升汞消毒时间为8 min时,猫须草无菌短枝的萌芽率显著下降,当0.1%升汞消毒时间为4 min时,猫须草无菌短枝的污染率显著升高。而75%酒精消毒时间为10 s或15 s对猫须草无菌短枝的萌芽率产生显著影响,对污染率无显著影响。
植物激素的选择和用量对植物组织培养的成败具有决定性的影响,植物组织培养中常用的植物激素主要有细胞分裂素类和生长素类[18],细胞分裂素类包括6-BA、TDZ等,生长素类包括NAA、IBA、2,4-D等。本研究的不同激素处理试验表明,猫须草无菌短枝初代培养在添加6-BA 1.0 mg/L、NAA 0.5 mg/L或添加6-BA 0.5 mg/L、NAA 0.2 mg/L的MS培养基中组培苗生长状况较好,当培养基中6-BA的浓度达2.0 mg/L时,猫须草无菌短枝组培苗长势细弱,叶片发黄,且有玻璃化发生。莫昭展等[10]也研究发现在猫须草组织培养中随着6-BA浓度的增加,萌发腋芽的数量反而减少,当6-BA的浓度大于2.5 mg/L时,茎段便不再长出腋芽,而是在其顶端出现愈伤组织。另外在本研究中,猫须草无菌短枝在添加TDZ 0.05 mg/L、IBA 0.2 mg/L的MS继代培养基中生长情况最好,并且与6-BA相比,添加TDZ更有利于猫须草无菌短枝继代组培苗的生长。而莫昭展等[10]认为适宜猫须草的组培诱导培养基为MS+6-BA 1.0 mg/L+NAA 0.1 mg/L,继代增殖培养基为MS+2,4-D 2.0 mg/L。王连翠等[11]认为适合猫须草组培初代诱导芽和继代增殖的培养基均为MS+6-BA 1.0 mg/L+NAA 0.1 mg/L。在本研究中同样选择了6-BA和NAA作为猫须草无菌短枝初代诱导培养基中的添加激素,但继代培养激素种类却有所不同,可能与本研究的培养方式不同有关。
一般来讲,无机盐浓度高,有利于植株的茎叶生长,无机盐浓度低,有利于根的生长[19]。本研究中的生根试验表明,基本培养基类型是影响猫须草无菌短枝生根的重要因素,1/2MS培养基中无菌短枝的生根率、生根数及根长明显优于MS培养基,这可能是因为基本培养基中无机盐浓度不同造成的。李任珠等[13]也研究表明,不同无机盐浓度对诱导肾茶根的分化有不同的影响,1/2MS诱导出的根最长,且重复间较稳定。此外在本研究中激素种类及浓度也会影响猫须草无菌短枝生根,同时添加NAA和IBA比单独添加NAA的效果好,在同时添加NAA 1.0 mg/L、IBA 1.0 mg/L的1/2MS培养基中猫须草无菌短枝组织培养的生根率最高。
综上所述,本研究筛选了适合猫须草无菌短枝组织培养的消毒时间、激素类型及浓度、培养基类型,建立了猫须草无菌短枝快速繁殖体系,为猫须草大规模工厂化生产提供理论基础和技术支持。具体研究结果如下:最佳消毒方法为75%酒精浸泡10 s或15 s+0.1%升汞浸泡6 min,当0.1%升汞消毒时间为8 min时,猫须草无菌短枝的萌芽率显著下降,当0.1%升汞消毒时间为4 min时,猫须草无菌短枝的污染率显著升高;最佳初代培养基配方为MS+6-BA 1.0 mg/L+NAA 0.5 mg/L或MS+6-BA 0.5 mg/L+NAA 0.2 mg/L;但当6-BA浓度达2.0 mg/L时,组培苗长势细弱,叶片发黄,并有玻璃化发生;最佳继代培养基配方为MS+TDZ 0.05 mg/L+IBA 0.2 mg/L;与添加6-BA相比,添加TDZ更有利于猫须草无菌短枝继代组培苗的生长;最佳生根培养基配方为1/2MS+NAA 1.0 mg/L+IBA 1.0 mg/L+活性炭3 g/L,在1/2MS培养基上猫须草无菌短枝的生根效果优于MS培养基,且同时添加NAA和IBA比单独添加NAA的效果好。
[1] 许 娜, 许旭东, 杨峻山. 猫须草的研究进展[J]. 中草药, 2010, 41(5): 848-852.
XU N, XU X D, YANG J S. Advances in studies on(Thunb.) C. Y. Wu[J]. Chinese Traditional and Herbal Drugs, 2010, 41(5): 848-852. (in Chinese)
[2] 罗 灿. 87份肾荼属植物种质资源亲缘关系研究[D]. 海口: 海南大学, 2015.
LUO C. Analysis of relationships 87germplasm resources[D]. Haikou: Hainan University, 2015. (in Chinese)
[3] 姜 帅, 邹德志, 徐建平, 白小荣, 赵冬冬, 李旻辉, 和彦苓, 肖培根. 肾茶的传统应用调查与研究进展[J].中国现代中药, 2015, 17(09):980-987.
JIANG S, ZOU D Z, XU J P, BAI X R, ZHAO D D, LI Y H, HE Y L, XIAO P G. Ethnopharmacological investigation and research progress of(Thunb.) C. Y. Wu[J]. Modern Chinese Medicine, 2015, 17(9): 980-987. (in Chinese)
[4] 李小珍, 晏永明, 程永现. 肾茶化学成分研究[J]. 天然产物研究与开发, 2017, 29(2): 183-189.
LI X Z, YAN Y M, CHENG Y X. Compounds from[J]Natural Product Research and Development, 2017, 29(2): 183-189. (in Chinese)
[5] YAM M F, BASIR R, ASMAWI M Z, ISMAIL Z. Antioxidant and hepatoprotective effects ofBenth. standardized extract[J]. The American Journal of Chinese Medicine, 2007, 35(1): 115-126.
[6] NANCY D Y, AIF I K, ANNE M L, ADRIAAN P I, ZAKARIA F R, YONG H C, ROBERT V. Adenosine A1 receptor binding activity of methoxy flavonoids from[J]. Planta Medica, 2009, 75(2): 132-136.
[7] ZHONG Y S, YU C H, YING H Z, WANG Z Y, FANG H C. Prophylactic effects ofBenth. extracts on experimental induction of calcium oxalate nephrolithiasis in rats[J]. Journal of Ethnopharmacology, 2012, 144(3): 761-767.
[8] 李金雨, 康龙泉. 猫须草的研究和开发利用进展[J]. 江西农业学报, 2010, 22(3): 99-104.
LI J Y, KANG L Q. Research progress in exploitation and utilization of[J]Acta Agriculturae Jiangxi, 2010, 22(3): 99-104. (in Chinese)
[9] 李青林, 邹永田, 刘广林, 黄晓光. 木本观赏植物组织培养技术[J]. 河北农业科学, 2010, 14(6): 38-41.
LI Q L, ZOU Y T, LIU G L, HUANG X G. Tissue culture technology of woody ornamental plants[J]. Journal of Hebei Agricultural Sciences, 2010, 14(6): 38-41. (in Chinese)
[10] 莫昭展, 梁海清, 马华材, 韦江萍. 猫须草组织培养研究[J]. 安徽农业科学, 2007, 35(32): 10348-10349.
MO Z Z, LIANG H Q, MA H C, WEI J P. Study on tissue culture of[J]. Journal of Anhui Agricultural Sciences, 2007, 35(32): 10348- 10349. (in Chinese)
[11] 王连翠, 张玉翠. 猫须草的组织培养与植株再生[J]. 中国农村小康科技, 2005(12): 32.
WANG L C, ZHANG Y C. Tissue culture and plantlet regeneration of[J]. Journal of Agriculture, 2005(12): 32. (in Chinese)
[12] 李 纲. 猫须草的组织培养及添加物研究[J]. 吉林农业, 2019(20): 60-61.
LI G. Study on tissue culture and additives of[J]Agriculture of Jilin, 2019(20): 60-61. (in Chinese)
[13] 李任珠, 丁之福, 林 培. 组织培养快速繁殖肾茶的研究[J]. 海南大学学报自然科学版, 1998, 16(3): 239-246.
LI R Z, DING Z F, LIN P. Study on rapid propagation ofthrough tissue culture[J]. Natural Science Journal of Hainan University, 1998, 16(3): 239-246. (in Chinese)
[14] 李 胜. 植物组织培养原理与技术[M]. 北京: 化学工业出版社, 2009.
LI S. Theory and techniques of plant tissue culture[M]. Beijing: Chemical Industry Press, 2009. (in Chinese)
[15] 朱鹏锦, 庞新华, 韦俏宇, 梁 春, 严 霖, 吕 平, 周全光, 王丽萍. 一种猫须草无菌短枝快速繁殖前的外植体预处理方法: CN109496706B[P]. 2021-06-01.
ZHU P J, PANG X H,WEI Q Y, LIANG C, YAN L, LV P, ZHOU Q G, WANG L P. The present invention relates to a method of explants pretreatment before rapid propagation of aseptic short twigs of: CN109496706B[P]. 2021-06-01. (in Chinese)
[16] 梁茂厂. 桂花组织培养快繁技术的研究[D]. 长沙: 中南林业科技大学, 2008.
LIANG M C. The research of tissue culture in fast breeding technology forLour[D]. Changsha: Central South University of Forestry and Technology, 2008. (in Chinese)
[17] 陈振光. 园艺植物离体培养学[M]. 北京: 中国农业出版社, 1996.
CHEN Z G.culture of horticultural plants[M]. Beijing: China Agriculture Press,1996. (in Chinese)
[18] 陈 毅. 蓝雪花()植物组织培养技术研究[D]. 成都: 四川农业大学, 2013.
CHEN Y. Research of plant tissue culture technology of[D]. Chengdu: Sichuan Agriculture University, 2003. (in Chinese)
[19] 吴丽君. 木本植物组织培养技术在林业科研与生产中的应用与局限[J]. 福建林业科技, 2003, 30(1): 67-70.
WU L J. Application and limitation of woody plant tissue culture technology in forestry research and production[J]. Journal of Fujian Forestry Science and Technology, 2003, 30(1): 67-70. (in Chinese)
Establishment of a Sterile Short Shoot Tissue Culture and Rapid Propagation System for
LI Jiahui1, YE Weiyan1, ZHU Pengjin1*, PANG Xinhua1, ZHANG Ji1, TANG Yuwei1, WEI Qiaoyu2
1. Guangxi Subtropical Crops Research Institute, Nanning, Guangxi 530001, China; 2.The People’s Hospital of Guangxi Zhuang Autonomous Region, Nanning, Guangxi 530000, China
also known as(Thunb.) C. Y. Wuis a perennial herb growing in tropical and subtropical regions, with certain medicinal and ornamental value. In Southeast Asia,is deeply loved by people as a traditional tea, but in China, it is more used as a Chinese herbal medicine to treat kidney diseases.However, the wild medicinal material resources ofare increasingly exhausted, and the traditional production and reproduction methods are difficult to meet the market demand. Therefore, it has become an urgent problem to adopt the rapid propagation technology of plant tissue culture to provide the seedlings needed for large-scale cultivation of. In order to study the suitable rapid propagation system of sterile short shoot tissue culture for, the tender stem segment with a pair of axillary buds was used as the explants to explore the effects of different disinfection methods, hormone types and concentrations and medium types on the sterile short shoot tissue culture ofThe results showed that the best disinfection method for the sterile short shoot tissue culture ofwas 75% alcohol immersion for 10 s or 15 s +0.1% mercury chloride immersion for 6 min. When the disinfection time of 0.1% mercuric chloride was 8 min, the germination rate of the sterile short shoot ofdecreased significantly, and when the disinfection time of 0.1% mercuric chloride was 4 min, the pollution rate ofthesterile short shoot ofincreased significantly. The best initial medium tissue culture was MS+6-BA 1.0 mg/L+NAA 0.5 mg/L orMS+6-BA 0.5 mg/L+NAA 0.2 mg/L. However, when the concentration of 6-BA was 2.0 mg/L, the growth of the tissue cultured seedlings was weak, the leaves turned yellow and vitrification occurred. The optimal subculture medium was MS+TDZ 0.05 mg/L+IBA 0.2mg/L. Compared with the addition of 6-BA, the addition of TDZ was more beneficial to the growth of subcultured seedlings. The optimal rooting medium was 1/2MS+NAA 1.0 mg/L+IBA 1.0 mg/L+ activated carbon 3 g/L, and the rooting rate of tissue culture seedlings was 95%. The type of culture medium and different hormone combinations would affect the rooting of the sterile short shoot tissue culture seedlings of. 1/2MS medium was obviously better than MS medium, and the effect of adding NAA and IBA at the same time was better than adding NAA alone. When the tissue culture seedlings were transplanted in the mixed matrix with the volume ratio of perlite, river sand and peat soil with a volume ratio of 1∶1∶1, the plants grew well and the survival rate was high. The results of this study could provide a scientific and feasible technical basis for the large-scale industrialized production of.
; sterile short shoot; tissue culture; rapid propagation
S31
A
10.3969/j.issn.1000-2561.2022.10.012
2021-12-01;
2022-03-08
广西重点研发计划项目(桂科AB21220003)。
李佳慧(1991—),女,硕士,农艺师,研究方向:植物生理生化。*通信作者(Corresponding author):朱鹏锦(ZHU Pengjin),E-mail:zhupengjin04@163.com。
