不同植被对煤矿复垦区域土壤真菌多样性和酶活性的影响
2022-11-11肖群英薛晓辉戴志东
游 萍,肖群英,薛晓辉,刘 贤,戴志东
不同植被对煤矿复垦区域土壤真菌多样性和酶活性的影响
游 萍1,2,肖群英1,2,薛晓辉1,2,刘 贤1,2,戴志东3
1. 贵州工程应用技术学院生态工程学院,贵州毕节 551700;2. 贵州省典型高原湿地生态保护与修复重点实验室,贵州毕节 551700;3. 贵州康腾能源集团有限公司,贵州金沙 551800
为了评价不同植被对煤矿废弃地复垦区土壤生态修复的效果,本研究开展了桃树、杉树、李树等植被对复垦区土壤酶活性和真菌种群多样性的影响分析。结果表明:(1)不同植被下,脲酶、酸性磷酸酶和转化酶的活性差异显著。脲酶在对照中最高,桃树最低;酸性磷酸酶活性对照最高,杉树(0~20、40~60 cm)和桃树(20~40 cm)土壤中最低,且一般情况下酶活性随土层加深而降低,具有表聚性,但不同植被和不同土层的转化酶活性的变化表现不同;该区域土壤的pH随土层加深增高,最高为5.67,均呈酸性,除对照外,均表现出一定程度的差异性。(2)不同植被下,所有土壤样品的真菌种群优势门均为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、毛霉菌门(Mucoromycota),季也蒙酵母属()和芽枝霉属()为所有土壤样品都具有的优势属,而孢霉属()仅在柳树土壤中不是优势属,青霉菌属()绿核菌属()是李树土壤中的优势属;盘菌属()是杉树土壤中的优势属;刺毛四枝孢()是对照土壤中的优势属。通过综合非度量多维尺度分析(Non-metric multidimensional scaling, NMDS)表明,不同植被的土壤真菌群落组成差异较大,柳树0~20 cm、杉树20~40 cm、对照40~60 cm土壤中的真菌数量和多样性较丰富,其中桃树土壤中的真菌丰富度和多样性相对较低。本研究结果可以为其他煤矿复垦区域土壤生态修复研究提供借鉴。
煤矿废弃地;高通量测序;真菌;多样性;群落组成;土壤酶
土壤微生物是自然界中重要的生物类群,同时也是土壤中最活跃的成员,参与了土壤生态系统中有机物质的分解和养分的吸收利用[1],改善和调节植物营养,促进植物生长[2],是实现生态净化功能及其物质和能量转化的重要组成部分。大量的有机物和氮素均可通过微生物作用去除[3-4],有些微生物还具有富集重金属的能力,推动了生物的地球化学循环[5]。与土壤的健康状况密切相关,可以作为土壤质量变化的检测指标[6-8],在土壤生态系统中发挥着非常重要的作用。土壤中几乎所有的生化反应都是由酶驱动的[9],土壤酶源自土壤微生物和动植物,是土壤新陈代谢的重要因素,与土壤养分矿化与循环密切相关,其活性可以用来评估土壤质量水平[10],土壤脲酶活性表征土壤的氮素状况,过氧化氢酶在一定程度上反映了土壤微生物过程的强度,土壤磷酸酶(碱性磷酸酶、中性磷酸酶和酸性磷酸酶)的活性可表征土壤的肥力状况,土壤转化酶的活性常用来表征土壤的熟化程度和肥力水平[9]。
土壤微生物的数量和分布受营养物、含水量、氧、温度、pH等因子的影响[11]。土地利用方式和植物物种,均会导致微生物种群结构和多样性的变化。不同陆地生态系统的自然变异、人为干扰、环境条件、历史进化因素以及研究的时空尺度不同,均会影响土壤微生物群落的地理空间分布;植物通过光合作用增加生物量,微生物通过促进土壤中营养物质的释放来影响植物多样性和生产力,因此植物物种不同,输入的营养数量和种类不同,引起土壤微生物群落结构和多样性的变化[12]。路颖等[13]研究认为,影响土壤微生物群落结构和多样性的因素在于植被类型不同,凋落物的性质、数量和分解速度等不同。张坤等[14]认为林下植被通过分泌物和凋落物影响土壤微生物群落结构和组成,同时也通过影响土壤微气候环境、营养有效性、pH和其他土壤微生物类群,间接影响土壤微生物组成。宋贤冲等[15]对猫儿山亚热带常绿阔叶林的研究结果表明,不同土层深度的土壤微生物群落功能多样性差异显著,而造成这种结果的主要原因在于总有机碳、速效氨、速效磷和速效钾的差异。不同林型间土壤微生物群落结构存在显著差异,姜雪薇等[16]的研究表明,大兴安岭不同林型间土壤优势微生物丰度差异较大,担子菌门(Basidiomycota)和子囊菌门(Ascomycota)为土壤优势真菌门,而属水平上属、威氏盘菌属()和空团菌属()相对丰度较高。不同生境不同植被的土壤水分、营养元素及孔隙结构等土壤环境因素影响土壤优势真菌属的代谢过程和功能特征,导致真菌群落结构及多样性呈显著差异[17]。
煤矿区是当今世界陆地生物圈最典型、退化最严重的生态系统之一[18],采矿活动及其废弃物的排放不仅破坏和占用大量的土地资源,且矿山废弃物的排放和堆存也带来一系列影响深远的环境问题,制约了当地社会经济的发展并危害人体健康[19-21]。随着煤炭的开采,矿区排放的大量尾矿和矿渣占用了大量土地,严重污染水土资源,导致耕地面积进一步减少。受资金和技术的限制,在矿区开采中主要以破坏性开采为主,忽视了对矿区生态环境的保护[22],矿产开采在污染土壤的同时,还直接破坏了一些地区的原生生境,导致生物多样性丧失,改变了土壤的理化性质,影响土壤的微生物组成和菌落结构[23-25]。作为生态系统中的关键组分,微生物在全球生态修复方面具有重要的价值[2-3]。马静等[26]研究认为微生物是矿山土壤质量提升、生物多样性恢复的重要手段,对矿山生态恢复至关重要。
针对矿区开采遗留的一系列问题,金沙化竹煤矿采取了采空区台阶式开挖→回收残煤→采空区积水抽排到矿山污水处理池处理→分层次回填(中部用粘土层夯实防渗)→表层覆土→植树种草恢复植被等一系列工程治理措施,回填的土壤均来自邻近农田,并采取相同处理。本研究对回填后覆土深度为60 cm的植树区域,使用高通量测序技术对土壤真菌多样性进行研究,目前采用该技术研究煤矿废弃地复垦区域土壤真菌的研究较少。通过高通量测序分析不同植被对煤矿废弃地复垦区域土壤真菌群落组成和土壤酶的影响,研究结果将为矿区复垦地生态修复策略的制订和实施提供理论依据。
1 材料与方法
1.1 土壤样品的采集
土壤样品采自贵州省毕节市金沙化竹煤矿矿区废弃地生态治理土壤修复的第一期工程(106°04¢55²~106°05¢54²E, 27°24¢46²~27°25¢43²N),采集时间为2020年10月17日,分别以修复后覆土深度为60 cm的桃树[L. var.f.(Lindl.) Schneid]、杉树()、柳树(Koidz)和李树(L.)种植区域土壤作为采样区,各植被种植时间为2018年,以临近地区农田(耕作模式为玉米和辣椒间作)土壤为对照。在每个采样区随机设置5个采样点,每个采样点分别采取0~20、20~40、40~60 cm 3个土层深度的土样,剔除石块和杂物,混合后分为2份,1份过2 mm筛,装入灭菌采样袋,低温保存送检,另一份自然风干后用于检测土壤酶活性。具体样点情况见表1。
1.2 土壤酶活性检测
土壤过氧化氢酶(CAT, BC0105)、脲酶(UE, BC0125)、酸性磷酸酶(ACP, BC0140)和酸性转化酶(AI, BC3075)等活性检测采用土壤酶活性试剂盒进行,试剂盒均来自南昌科畅生物科技有限公司。
1.3 土壤真菌高通量测序
采用E.Z.N.A™ Mag-Bind Soil DNA Kit试剂盒提取土壤微生物总DNA,采用引物ITS1F(5-CTTGGTCATTTAGAGGAAGTAA-3)和ITS2(5-GCTGCGTTCTTCATCGATGC-3)对土壤真菌基因中的ITS1可变区进行PCR扩增。扩增产物回收后用Illumina HiSeq测序平台构建文库并进行高通量测序。
获得测序结果后,利用Trimmomatic v0.33软件[27]对测序得到的raw reads进行质量过滤,利用cutadapt 1.9.1软件[28]进行引物序列的识别与去除,利用FLASH v1.2.7软件[29]对高质量的reads进行拼接,得到clean reads,再用UCHIME v4.2软件[30]去除嵌合体有效数据(effective reads)。使用Usearch软件[31]在97.0%的相似度水平下进行OTU聚类并进行统计分析。通过QIIME2软件,对样品Alpha多样性指数进行评估,利用Mothur软件和R语言工具依据各样品的测序量在不同测序深度时的Shannon指数(反映样品中微生物多样性的指数)绘制Shannon多样性指数稀释曲线,以此反映各样本在不同测序数量时的微生物多样性。根据每个样品的物种组成和相对丰度进行物种热图分析,提取每个分类学水平上的物种,利用R语言工具进行作图,分别在门、纲、目、科、属、种分类水平上进行Heatmap聚类分析。

表1 金沙县化竹煤矿复垦区试验地概况
1.4 数据处理
实验数据采用Excel和SPSS 21软件进行统计与分析。
2 结果与分析
2.1 不同植被对煤矿复垦区土壤酶活性的影响
pH在同一土层不同植被中,桃树与李树间差异不显著,但均显著低于杉树、柳树和对照,并且杉树、柳树和对照三者间无显著差异;同一植被下,不同土层除对照pH无显著差异外,其余均表现为随着土层加深,pH增大,且40~60 cm土层显著高于0~20 cm(表2)。这可能与农田耕作模式有关系,因为对照农田会作翻耕处理。
脲酶活性在同一土层不同植被中均表现为对照显著高于桃树、杉树、李树和柳树,桃树最低,在0~20 cm和20~40 cm土层中,桃树显著低于杉树、李树和柳树;同一植被不同土层中,脲酶活性均表现为0~20 cm显著高于20~40 cm和40~60 cm土层,除对照外,脲酶活性均随着土层加深而下降(表2)。
过氧化氢酶在不同土层和不同植被下均无显著性差异(表2)。
酸性磷酸酶活性在同一土层不同植被中,各土层的对照显著高于桃树、杉树、李树和柳树;0~20 cm土层中,桃树显著高于杉树、李树和柳树;20~40 cm土层中,杉树和李树均显著高于桃树与柳树;40~60 cm土层的各植被间差异显著。酸性磷酸酶活性在同一植被不同土层中,0~20 cm土层显著高于20~40 cm和40~60 cm土层,除桃树外,均表现为随着土层加深活性下降,且杉树和李树的各土层间差异显著(表2)。
转化酶活性在同一土层不同植被下的表现有差异,0~20 cm土层中,桃树与柳树间无显著差异,但二者均显著高于杉树、李树和对照;在20~ 40 cm和40~60 cm土层中,各植被间均存在显著差异。在同一植被不同土层中,杉树、李树、柳树和对照均存在显著差异;桃树0~20 cm与40~ 60 cm间无显著差异,均显著高于20~40 cm(表2)。
本研究表明,该煤矿复垦区域不同植被对不同土层脲酶、酸性磷酸酶和转化酶活性的影响不同,对照相对较高,可能与人为的耕作模式有关,但对过氧化氢酶的影响均较小。
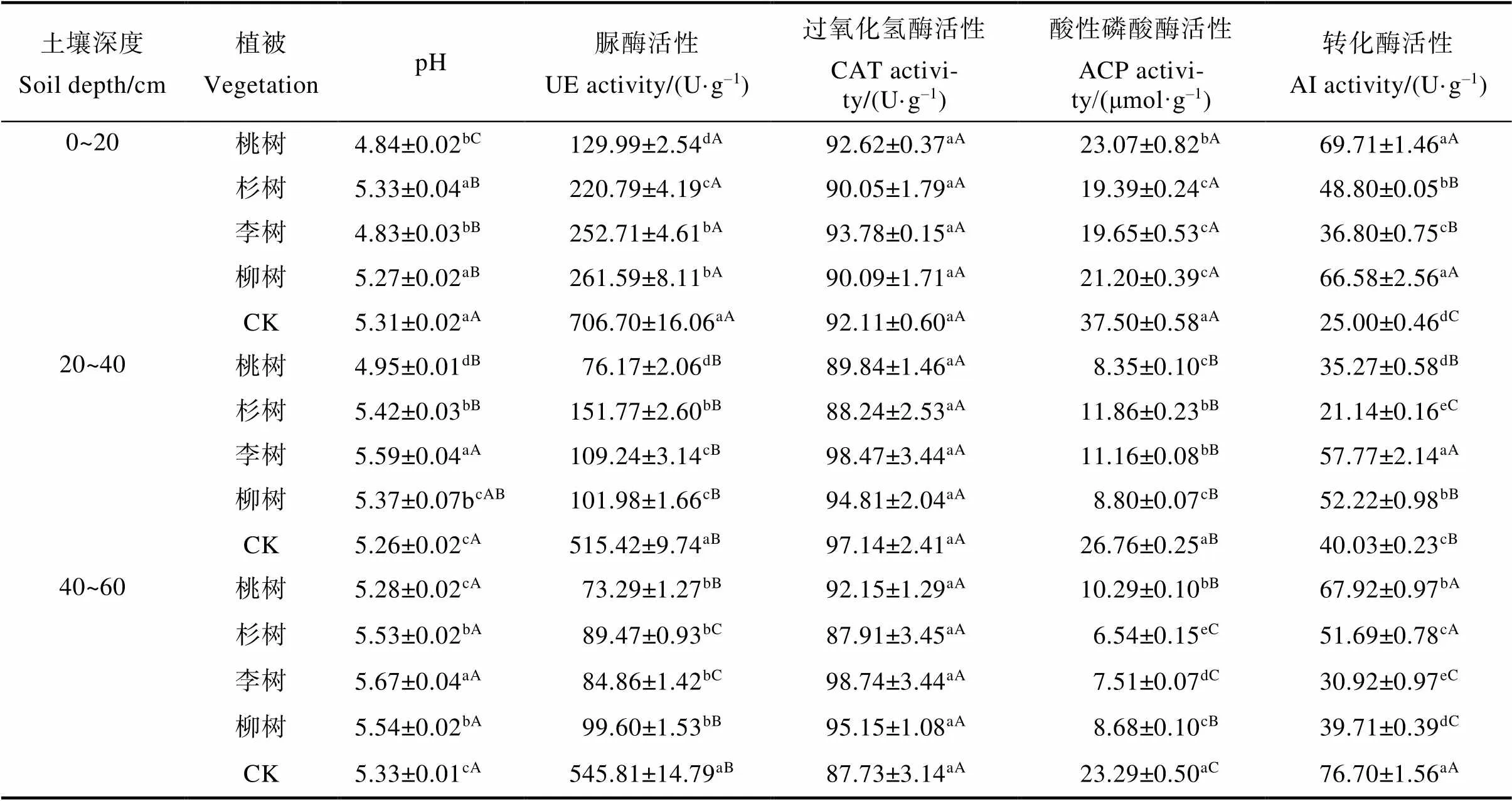
表2 不同植被、不同土壤深度的土壤酶活性
注:同列不同小写字母表示同一土层不同植间差异显著(<0.05);同列不同大写字母表示同一植被不同土层间差异显著(<0.05)。
Note: Different lowercase letters in the same column indicate significant differences among different plants in the same soil layer (<0.05); Different capital letters in the same column indicate significant differences among different soil layers of the same plants (<0.05).
2.2 不同植被对煤矿复垦区土壤真菌群落的影响
2.2.1 样品测序数据质量评估 本研究采用高通量技术对桃树、杉树、李树、柳树和对照5种不同植被下3个土层深度(0~20、20~40、40~60 cm)的土壤进行了土壤真菌群落结构研究,共获得746 531条raw reads,质控后共产生743 367条clean reads,每个样品至少产生46 354条clean reads,平均产生49 558条clean reads。优化后的序列长度均占原始数据的99%以上,Q20(质量值大于等于20的碱基百分)均在99%以上,Q30(质量值大于等于30的碱基百分比)为95%以上,满足试验分析要求(表3)。
样本测序数量达到5万条时,曲线趋于平坦,说明测序数据量足够大,能反映样品中绝大多数土壤真菌信息,特征种类不会随测序量增加而增长(图1,图2),所以测序数据具有较高的可信度。
在5种不同植被的土壤样本中,共测到土壤真菌8门28纲70目125科201属259种,还有大量的菌属于没有分类的。

表3 真菌测序结果
a: 0-20 cm; b: 20-40 cm; c: 40-60 cm.
2.2.2 不同植被对煤矿复垦区土壤真菌群落多样性的影响 由表4可知,各样本的覆盖率均在99%以上,指数信息能较好地反映真菌群落多样性。Chao1和Ace指数用来衡量物种丰度,即物种数量的多少。Shannon和Simpson指数用于衡量物种多样性,受样品群落中物种丰度和物种均匀度的影响[11]。Shannon和Chao1指数越大,说明样品的物种多样性也高[32]。研究表明,0~20 cm土层中,柳树的真菌群落丰富度和多样性最高,而李树最低;20~40 cm土层中各指数表现不一,可能均匀度差别较大,但除了Chao1指数外,均为杉树中的指数最高,相对丰富度和多样性较高,而桃树较低;40~60 cm土层中对照的Chao1和Ace指数指数最大,真菌群落丰富度高,而柳树较小,Shannon和Simpson指数表现为对照最高,真菌群落多样性最大,而桃树多样性最小(表4)。总体来说,柳树0~20 cm、杉树20~40 cm、对照40~60 cm的土壤真菌群落数量和多样性较丰富。

a: 0-20 cm; b: 20-40 cm; c: 40-60 cm.
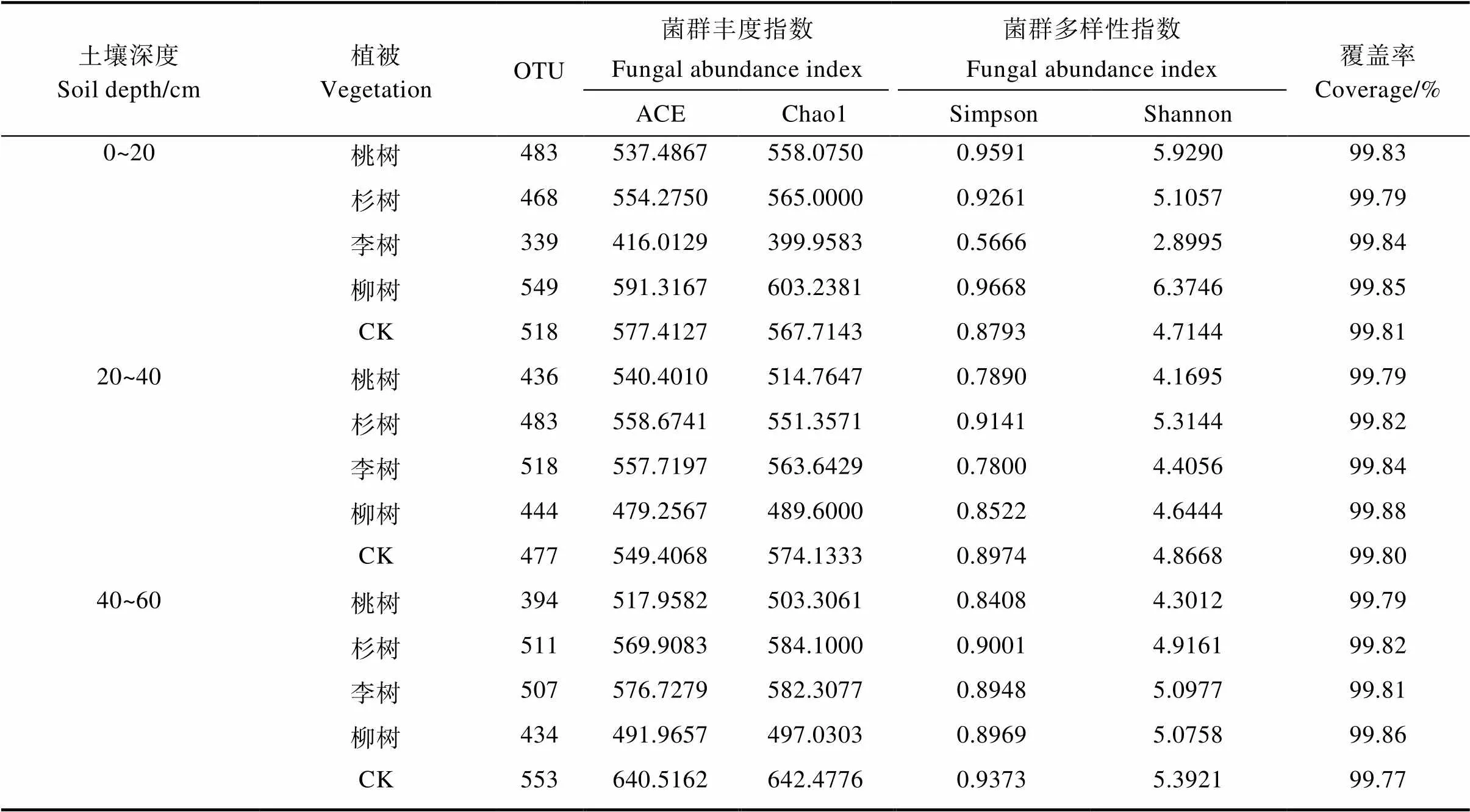
表4 不同植被真菌群落多样性分析
2.2.3 不同植被对煤矿复垦区土壤真菌群落结构的影响 不同植被土壤真菌类群中,子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、毛霉菌门(Mucoromycota)(李树0~20 cm除外)和未分类(Unclassified)为所有样本都具有的优势真菌门类(相对丰度大于1%),这与靳东升等[33]的研究结果一致。比较不同分类水平各真菌群落相对丰度发现:不同植被及其各土层的真菌群落组成和分布有差异。其中子囊菌门的平均丰度最高,依次为李树(78.40%)>杉树(61.80%)>桃树(56.20%)>柳树(56.16%)>对照(53.02%)(图3),李树土壤的平均相对丰度远高于对照,说明李树根系分泌物有利于子囊菌门种群的生存。子囊菌门多为腐生菌,能够促进动植物遗骸的腐烂和分解而被重吸收[34],对降解复杂有机物起关键作用[35]。毛霉菌门的平均丰度依次为桃树(6.79%)>对照(6.61%)>杉树(6.30%)>柳树(4.76%)>李树(1.76%)(图3)。担子菌门的平均丰度依次为桃树(6.82%)>李树(3.77%)>杉树(3.61%)>柳树(2.34%)>对照(2.03%)(图3)。担子菌门是真菌中高等菌门,可以与植物形成共生菌根,有利于作物的栽培和造林[36],分解木质素的能力较强。所有土壤样品中未分类的平均丰度仅次于子囊菌门,依次为对照(35.82%)>柳树(35.12%)>桃树(26.25%)>杉树(25.88%)>李树(14.40%),在对照(农田)中的相对丰度最高。
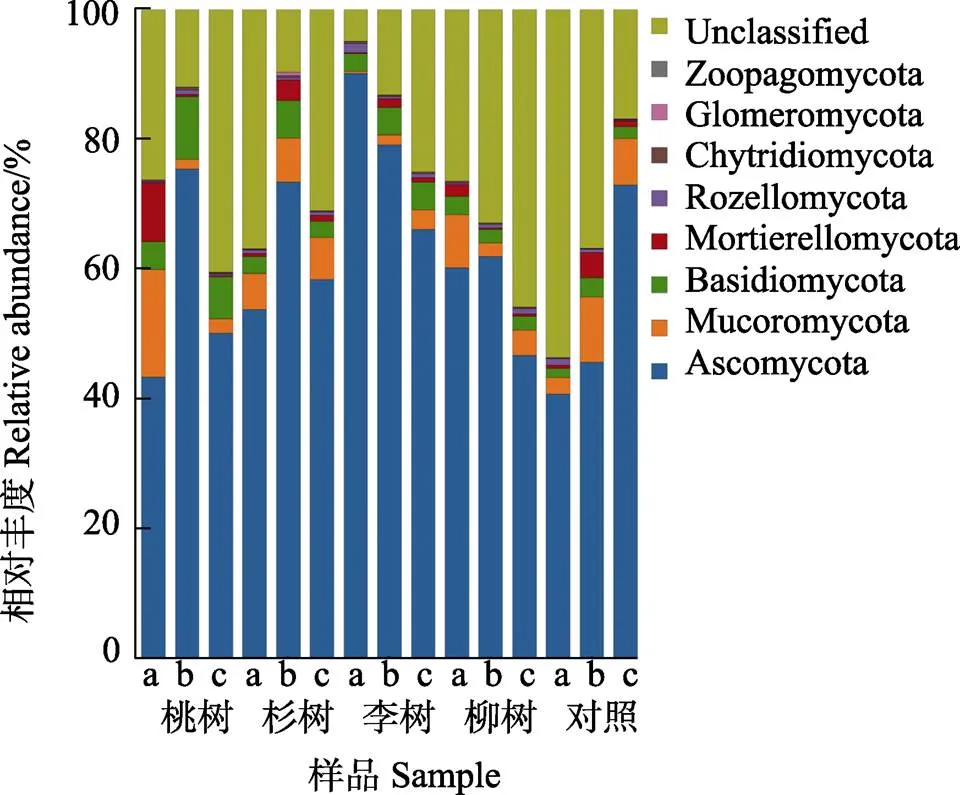
a: 0‒20 cm; b: 20‒40 cm; c: 40‒60 cm.
在门水平上将样品中的真菌相对丰度情况聚类后绘制热图(图4),结果显示,根据土壤真菌各物种相对丰度的相似情况分为两簇:球囊菌门(Glomeromycota)、捕虫霉门Zoopagomycota、毛霉门(Mucoromycota)、被孢霉门(Mortierellomycota)等4个门聚为一簇,罗兹菌门(Rozellomycota)、担子菌门(Basidiomycota)、子囊菌门(Ascomycota)、壶菌门(Chytridiomycota)等聚为另一簇;根据不同样品土壤中真菌群落的组成情况聚为两簇:桃树0~20 cm单独聚为一簇,而其余样品聚为另一簇,且同一土层5种不同植被的土壤真菌在门水平上的群落组成不同,且同一植被不同土层的群落组成也不同。

左侧聚类树为物种聚类树,上方聚类树为样品聚类树;a: 0~20 cm; b: 20~40 cm; c: 40~60 cm。
为进一步区分5种植被土壤样品的差异,对总相对丰度排名前10的属进行分析,不同植被真菌群落的丰度情况见图5。未分类(Unclassified)、季也蒙酵母属()和芽枝霉属()3个属均为各植被土壤中的优势属,孢霉属()仅在柳树土壤中不是优势属,青霉菌属()绿核菌属()在李树土壤中为优势属;盘菌属()在杉树土壤中为优势属;刺毛四枝孢()在对照中为优势属。季也蒙酵母属在桃树土壤中的相对丰度为7.30%~ 44.47%,而在李树土壤中为26.76%~65.30%,对照中为9.71%~19.40%。孢霉属在桃树土壤中相对丰度为1.91%~25.67%,李树中为0.43%~3.76%,对照中为3.10%~14.01%(图5)。在0~20 cm和20~40 cm土层中,对照的未分类在属水平上的相对丰度大于桃树、杉树、李树和柳树,而40~60 cm土层中,对照小于桃树、杉树、李树和柳树。
在属水平上将相对丰度排名前100的真菌根据相对丰度情况进行聚类后绘制热图(图6),结果显示,根据样品中的丰度相似情况将真菌群落聚为两簇,蓝状菌属()、柄孢壳属()绿核菌属()等50个属聚为一簇,暗球腔菌属()、红曲菌属()掷孢酵母属()等50个属聚为另一簇;不同样品中真菌的组成情况聚为两簇,桃树0~20 cm、柳树0~ 20 cm和对照40~60 cm聚为一簇,而其余样品聚为另一簇。

a: 0‒20 cm; b: 20‒40 cm; c: 40‒60 cm.
采用NMDS分析土壤真菌群落组成的相似度,除李树外,桃树、杉树、柳树和对照各土层土壤的真菌群落组成均聚类于相同的象限,说明同一植被下各土层的真菌组成差异较小,但不同植被的土壤真菌群落组成均位于不同象限内,说明不同植被下的差异较大(图7)。

左侧聚类树为物种聚类树,上方聚类树为样品聚类树;a: 0~20 cm; b: 20~40 cm; c: 40~60 cm。
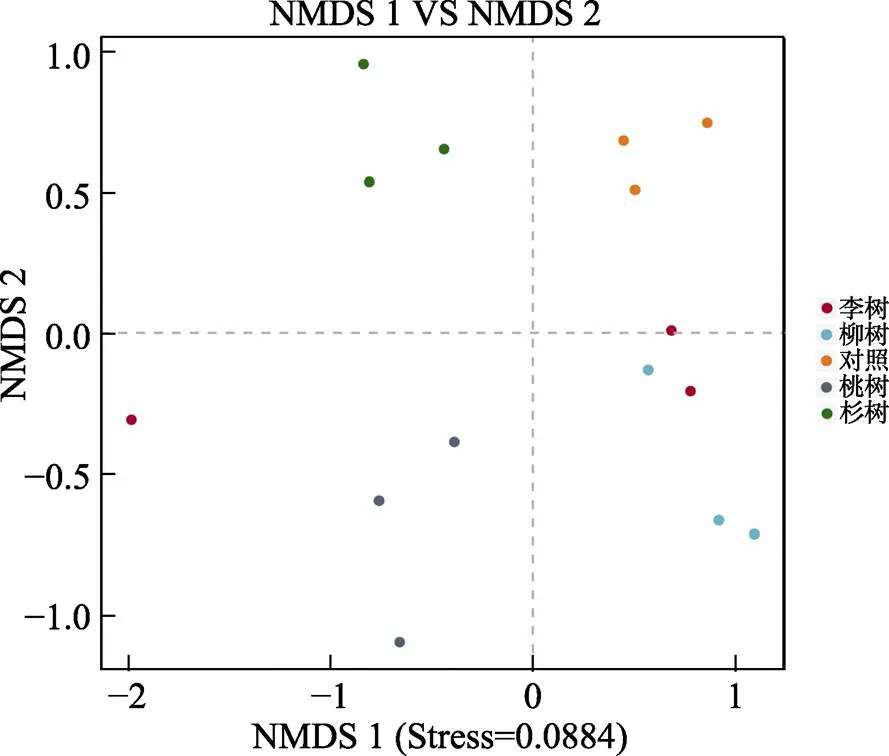
图7 不同样品真菌群落NMDS分析
3 讨论
煤矿区是当今世界陆地生物圈最典型、退化最严重的生态系统之一[18]。针对煤矿开采遗留的一系列问题,根据矿区的具体情况,煤矿区采取采空区台阶式开挖→回收残煤→采空区积水抽排到矿山污水处理池处理→分层次回填(中部用粘土层夯实防渗)→表层覆土→植树种草恢复植被等一系列治理措施,用于回填的土壤均来自邻近农田,并采取相同处理。本研究对回填后覆土(覆土深度60 cm)植树区域,开展了桃树、杉树、李树等植被对复垦区土壤酶活性和真菌种群多样性的影响分析,发现不同植被的脲酶、酸性磷酸酶和转化酶活性差异显著,脲酶和酸性磷酸酶活性在对照土壤中最高,而桃树最低,且一般情况下酶活性随土层加深而降低,具有表聚性,但不同植被和不同土层转化酶活性的变化有差异;土壤pH随土层加深而增高,均呈酸性。样本中所含真菌OTU隶属于8个门,共有201属,优势真菌种群门均为子囊菌门、担子菌门、毛霉菌门,不同植被土壤的优势属存在一定差异;不同植被土壤真菌的群落组成差异较大,物种数量和物种多样性也有差异。该煤矿废弃地修复时间仅2 a左右,长期的修复效果有待进一步研究。
脲酶与土壤微生物数量、有机质含量、全氮和速效氮含量呈正相关,常用来表征土壤的氮素状况;土壤酸性磷酸酶主要来源于植物根系,其活性可以表征土壤的肥力情况,特别是磷的状况[37-38]。本研究发现,各土壤酶活性在0~20 cm土层中普遍高于其余2个土层,这与曹越等[39]研究认为的土壤酶活性具有很强的表聚性结果一致。其主要原因在于表层土壤透气性较好,植物残留物也多位于土壤表层,易形成腐殖质,有利于微生物的生长。但不同植被下,除过氧化氢酶外,其余几种土壤酶活性存在显著差异。脲酶和酸性磷酸酶活性在对照各土层中均显著高于桃树、杉树、李树和柳树,可能与对照耕地施用氮肥有一定关系,二者之间是否能相互促进有待进一步研究。本研究中桃树土壤中的脲酶活性最低,复垦区的桃树长势较差,病虫害较严重,而李树、柳树和杉树没有这种现象。桃树的最适生长pH为6.0~6.5,而复垦区桃树土壤的pH均低于5.3,说明煤矿废弃地复垦区域的土壤不利于桃树的生长。转化酶活性在不同植被下的差异较大,具体原因有待进一步研究。
由于不同植被类型输入到土壤中的有机物质不同,从而影响了土壤微生物群落结构及其多样性[36, 40]。植物通过根系向土壤输入各种次生代谢产物,对微生物的种类、数量等产生促进或抑制作用[13]。微生物群落结构受土壤理化性质、季节变化、海拔、植被类型等综合因素的影响,在相同气候条件和土壤类型下,土壤微生物的群落结构仍存在差异[41-43]。本研究分析了煤矿复垦区域不同植被下土壤真菌多样性和群落结构的差异,结果表明,0~20 cm土层中,对照的真菌群落多样性低于桃树、柳树和杉树;40~60 cm土层中的真菌群落多样性最高。其原因可能是耕地施用大量肥料,而肥料基本施于土壤表层,由于氮含量偏高,反而抑制了真菌生长。在20~40 cm和40~60 cm土层中,桃树土壤中的真菌群落多样性最低。
5种植被土壤均含有的优势真菌门为子囊菌门、担子菌门、毛霉菌门和未分类,与靳东升等[33]的研究结果一致。不同土壤生境会对微生物群落的整体组成产生一定影响,但优势菌群较为相似[44-45]。陈秀波等[46]、郭雄飞等[47]、沈清清等[48]研究表明,子囊菌门和担子菌门真菌是土壤真菌群落中排在前两名的优势菌群,这与本研究结果相似。本研究中,李树、桃树、柳树和杉树土壤中的子囊菌门、担子菌门的平均相对丰度均大于对照,且李树土壤中的相对丰度远高于对照,表明李树能促进土壤中子囊菌门的生长。子囊菌门主要分解植物残体,促进动植物遗骸的腐烂和分解而被重吸收,对降解复杂有机物起关键作用[48-51];担子菌门可以与植物形成共生菌根,有利于作物的栽培和造林[36],担子菌门分解木质素的能力较强[49-50];同时不同的植被类型凋落物的养分分解与归还也不同,凋落物的养分分解与归还会改变根际土壤理化性质和酶活性进而影响真菌群落结构组成及其多样性[35]。本研究的土样采自煤矿废弃地生态修复过程中经过土壤剥离和回填后的样地,土壤的原始结构已发生改变,同时由于耕作模式不同,对照为耕地,管理比较精细,在作物种植过程中会施以各种肥料,而李树、桃树、柳树、杉树等为木本植物,管理比较粗放,没有施以任何肥料,加上植物种类不同,分泌的化学物质也有差异,导致土壤理化性质的差异,以及土壤真菌群落多样性发生变化。由于子囊菌门的适应性较广[52],试验区中几种木本植物的种植年限不长,土壤中落叶居多,而枝条等含木质素的凋落物较少,对照中作物秸秆的木质素含量也偏低,有利于子囊菌门的生长和繁殖,致使所有样地中子囊菌门平均丰度远高于担子菌门,但对于李树土壤样品中的子囊菌门平均丰度最高的原因有待于进一步研究。
[1] STEENWERTHA K L, JACKSONA L E, CALDERO F J, STROMBERG M R, SCOW K M. Soil microbial community composition and land use history in cultivated and grassland ecosystems of coastal California[J]. Soil Biology and Biochemistry, 2002, 34(11): 1599-1611.
[2] 孙 波, 赵其国, 张桃林, 俞 慎. 土壤质量与持续环境Ⅲ. 土壤质量评价的生物学指标[J].土壤, 1997(5): 225-234.
SUN B, ZHAO Q G, ZHANG T L, YU S. Soil quality and sustainable environment Ⅲ. Biological indicators for soil quality assessment[J]. Soils, 1997(5): 225-234. (in Chinese)
[3] 朱海平, 姚槐应, 张勇勇, 吴愉萍. 不同培肥管理措施对土壤微生物生态特征的影响[J]. 土壤通报, 2003, 34(2): 140-142.
ZHU H P, YAO H Y, ZHANG Y Y, WU Y P. Effect of fertilizer system on soil microbial ecology[J]. Chinese Journal of Soil Science, 2003, 34(2): 140-142. (in Chinese)
[4] 李阜棣. 当代土壤微生物学的活跃研究领域[J]. 土壤学报, 1993, 30(3): 229-236.
LI F D. Prosperous areas of current soil microbiology[J]. Acta Pedologica Sinica, 1993, 30(3): 229-236. (in Chinese)
[5] 宋长青, 吴金水, 陆雅海, 沈其荣, 贺纪正, 黄巧云, 贾仲君, 冷疏影, 朱永官. 中国土壤微生物学研究10年回顾[J]. 地球科学进展, 2013, 28(10): 1087-1105.
SONG C Q, WU J S, LU Y H, SHEN Q R, HE J Z, HUANG Q Y, JIA Z J, LENG S Y, ZHU Y G. Advances of soil microbiology in the last decade in China[J]. Advances in Earth Science, 2013, 28(10): 1087-1105. (in Chinese)
[6] 周旭丹, 孙晓刚, 赵春莉, 王 薇, 杨立红. 人工湿地植被根区土壤性质及其净化水质季节效应分析[J]. 生态环境学报, 2015, 24(6): 1043-1049.
ZHOU X D, SUN X G, ZHAO C L, WANG W, YANG H L. Research on enzymatic activities in the hizosphere of constructed wetland plants and purificati on of wastewater in seasonal[J]. Ecology and Environmental Sciences, 2015, 24(6): 1043-1049. (in Chinese)
[7] TANNER C C, KADLEC R H, GIBBS M M, SUKIAS J P S, NGUYEN M L. Nitrogen processing gradients in subsurface-flow treatment wetlands -influence of wastewater characteristics[J]. Ecological Engineering, 2002, 18(4): 499-518.
[8] ABE K, KOMADA M, OOKUMA A, ITAHASHI S, BANZAI K. Purification performance of a shallow free-water-surface constructed wetland receiving secondary effluent for about 5 years[J]. Ecological Engineering, 2014, 69(5): 126-133.
[9] 林先贵. 土壤微生物研究原理与方法[M]. 北京: 高等教育出版社, 2010: 53.
LIN X G. Principles and methods of soil microbiology research[M]. Beijing: Higher Education Press, 2010: 53. (in Chinese)
[10] 韩忠明, 杨 颂, 韩 梅, 杨利民. 不同菌剂对人参连作土壤酶活性的影响[J]. 东北农业科学, 2016, 41(1): 50-53.
HAN Z M, YANG S, HAN M, YANG L M. Effects of different microbial agents on enzymes activity of soil incontinuous cultivating field[J]. Journal of Northeast Agricultural Sciences, 2016, 41(1): 50-53. (in Chinese)
[11] LOVELLA R D, JARVISA S C, BARDGETTB R D. Soil microbial biomass and activity inlong-term grassland: effects of management changes[J]. Soil Biology and Biochemistry, 1995, 27(7): 969-975.
[12] 褚海燕, 王艳芬, 时 玉, 吕晓涛, 朱永官, 韩兴国. 土壤微生物生物地理学研究现状与发展态势[J]. 中国科学院院刊, 2017, 32(6): 585-592.
CHU H Y, WANG Y F, SHI Y, LV X T, ZHU Y G, HAN X G. Current status and development trend of soil microbial biogeography[J]. Bulletin of Chinese Academy of Sciences, 2017, 32(6): 585-592. (in Chinese)
[13] 路 颖, 李 坤, 梁 强, 李传荣, 张彩虹. 泰山4种优势造林树种叶片凋落物分解对凋落物内细菌群落结构的影响[J]. 生态学报, 2019, 39(9): 3175-3186.
LU Y, LI K, LIANG Q, LI C R, ZHANG C H. Effects of leaf litter decomposition on bacterial community structure in the leaf litter of four dominant tree species in Mount Tai[J]. Acta Ecologica Sinica, 2019, 39(9): 3175-3186. (in Chinese)
[14] 张 坤, 包维楷, 杨 兵, 胡 斌. 林下植被对土壤微生物群落组成与结构的影响[J]. 应用与环境生物学报, 2017, 23(6): 1178-1184.
ZHANG K, BAO W K, YANG B, HU B. The effects of understory vegetation on soil microbial community composition and structure[J]. Chinese Journal of Applied and Environmental Biology, 2017, 23(6): 1178-1184. (in Chinese)
[15] 宋贤冲, 曾继钊, 唐 健, 邓小军, 覃祚玉. 猫儿山常绿阔叶林不同土层土壤微生物群落功能多样性[J]. 生态科学, 2015, 34(6): 93-99.
SONG X H, ZENG J Z, TANG J, DENG X J, QIN Z Y. Soil microbial functional diversity of subtropical evergreen broad-leaved forest in Maoer Mountain[J]. Ecological Science, 2015, 34(6): 93-99. (in Chinese)
[16] 姜雪薇, 马大龙, 臧淑英, 张冬有, 孙弘哲. 高通量测序分析大兴安岭典型森林土壤细菌和真菌群落特征[J]. 微生物学通报, 2021, 48(4): 1093-1105.
JIANG X W, MA D L, ZANG S Y, ZHANG D Y, SUN H Z. Characteristics of soil bacterial and fungal community of typical forest in the Greater Khingan Mountains based on high-throughput sequencing[J]. Microbiology China, 2021, 48(4):1093-1105. (in Chinese)
[17] 曹红雨, 高广磊, 丁国栋, 张 英, 赵媛媛, 任 悦, 陈宇轩, 郭米山. 呼伦贝尔沙4种生境土壤真菌群落结构和多样性[J]. 林业科学, 2019, 55(8): 118-127.
CAO H Y, GAO G L, DING G D, ZHANG Y, ZHAO Y Y, REN Y, CHEN Y X, GUO M S. Community structure and diversity of soil fungi in four habitats in Hulun Buir Sandy Land[J]. Scientia Silvae Sinicae, 2019, 55(8): 118-127. (in Chinese)
[18] CHEN H B, BOUTROS P C. VennDiagram: a package for the generation of highly-customizable Venn and Euler diagrams in R[J]. BMC bioinformatics, 2011, 12: 35.
[19] 束文圣, 张志权, 蓝崇钰. 中国矿业废弃地的复垦对策研究(I)[J]. 生态科学, 2000, 19(2): 24-29.
SHU W S, ZHANG Z Q, LAN C Y. Strategies for restoration of mining wastelands in China(I)[J]. Ecologie Science, 2000, 19 (2): 24-29. (in Chinese)
[20] 戴苏伟. 加强设备检修与改造技术 提升煤矿机电设备的使用率[J]. 科技资讯, 2012, 21(28): 55, 57.
DAI S W. Strengthening the technology of equipment maintenance and transformation to improve the utilization rate of mechanical and electrical equipment in coal mine[J]. Technology Information, 2012, 21(28): 55, 57. (in Chinese)
[21] 王慧卿. 煤矿环境污染分析及对策探讨[J]. 能源与节能, 2014(7): 99-100, 135.
WANG H Q. On the environmental pollution of coal mines and the countermeasures[J]. Energy and Energy Conservation, 2014(7): 99-100, 135. (in Chinese)
[22] 贾同福. 矿山边坡及排土场生态修复[J]. 生态与环境工程, 2018(21): 123-124.
JIA T F. Ecological restoration of mine slope and dumping site[J]. New Technology & New Products of China, 2018(21): 123-124. (in Chinese)
[23] 刘海龙. 采矿废弃地的生态恢复与可持续景观设计[J]. 生态学报, 2004, 2(24): 323-329. (in Chinese)
LIU H L. Ecological restoration and sustainable landscape design of mining wastelands[J]. Acta Ecologica Sinica, 2004, 24(2): 323-329.
[24] 谭文雄. 广东矿区生态环境问题及生态恢复的探讨[J]. 黑龙江生态工程职业学院学报, 2008, 21(4): 1-2.
TAN W X. Discussion on ecological environment problems and ecological restoration in Guangdong mining are[J]. Journal of Heilongjiang Vocational Institute of Ecological Engineering, 2008, 21(4): 1-2. (in Chinese)
[25] 滕 应, 黄昌勇, 骆永明, 龙 健, 姚槐应. 铅锌银尾矿区土壤微生物活性及其群落功能多样性研究[J]. 土壤学报, 2004, 41(1): 113-119.
TENG Y, HUANG C Y, LUO Y M, LONG J, YAO H Y. Microbial activities and functional divetsity of community in soils polluted with Pb-Zn-Ag mine tailings[J]. Acta Pedologica Sinica, 2004, 41(1): 113-119. (in Chinese)
[26] 马 静, 卢永强, 张 琦, 李肖肖, 肖 栋, 陈 浮. 黄土高原采煤沉陷对土壤微生物群落的影响[J]. 土壤学报, 2021, 58(5): 1278-1288.
MA J, LU Y Q, ZHANG Q, LI X X, XIAO D, CHEN F. Effects of coal mining subsidence on soil microbial community in the Loess Plateau[J]. Acta Pedologica Sinica, 2021, 58(5): 1278-1288. (in Chinese)
[27] BOLGER A M, LOHSE M, USADEL B. Trimmomatic: a flexible trimmer for Illumina sequence data[J]. Bioinformatics, 2014, 30(15): 2114-2120.
[28] MARTIN M. Cut adapt removes adapter sequences from high-throughput sequencing reads, EMB net[J]. Embnet Journal, 2011, 17(1): 10-12.
[29] MAGOČ T, SALZBERG S L. Flash: fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics, 2011, 27(21): 2957-2963.
[30] EDGAR R C, HAAS B J, CLEMENTE J C, QUINCE C, KNIGHT R. Uchime improves sensitivity and speed of chimera detection[J]. Bioinformatics, 2011, 27(16): 2194-2200.
[31] EDGAR R C. Uparse: highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 2013, 10(10): 996-998.
[32] GRICE E A, KONG H H, CONLAN S,DEMING C B, DAVIS J, YOUNG A C,BOUFFARD G G, BLASKESLEY R W, MURRAY P R,GREEN E D, TURNER M L, SEGRE J A. Topographical and temporal diversity of the human skin micro -biome[J]. Science, 2009, 324(5931): 1190-1192.
[33] 靳东升, 张 强, 张变华, 郜春花, 李建华, 卢晋晶. 种植植物对煤矸石填埋区复垦土壤真菌多样性及养分含量的影响[J]. 华北农学报, 2020, 35 (5): 206-213.
JIN D S, ZHANG Q, ZHANG B H, GAO C H, LI J H, LU J J. Effect of planting plants on fungi diversity and nutrients in reclaimed soil of coal gangue landfill area[J]. Acta Agriculture Boresli-sinica, 2020, 35 (5): 206 -213. (in Chinese)
[34] MENDES R, KRUIJT M, BRUIJN I D, DEKKERS E, VOORT M V D, SCHNEIDER J H M, PICENO Y M, DESANTIS T Z, ANDERSEN G L, BAKKER P A HAM, RAAIJMAKERS J M. Deciphering the rhizosphere microbiome for disease-suppressive bacteria[J]. Science, 2011, 332(6033): 1097-1100.
[35] BEIMFORDE C, FELDBERG K, NYLINDERS S, RIKKINEN J, TUOVILA H, DORFELT H, GUBE M, JACKSON D J, REITNER J, SEYFULLAH L J, SCHMIDT A R. Estimating the phanerozoic history of the ascomycota lineages: combining fossil and molecular data[J]. Molecular Phylogenetics and Evolution, 2014(78): 386-398.
[36] 奎 玲, 王子君, 李国荣, 张广辉, 周 玲. 临沧市古茶园土壤细菌和真菌群落组成与多样性研究[J]. 生态环境学报, 2020, 29(12): 2307-2321.
KUI L, WANG J, LI G R, ZHANG G H, ZHOU L. Composition and diversity of soil bacterial and fungal communities in ancient tea plantations of Lincang City[J]. Ecology and Environmental Sciences, 2020, 29(12): 2307-2321. (in Chinese)
[37] 季 鑫, 金爱武, 朱强根. 竹炭基有机肥对茶园土壤酶活性及微生物群落的影响[J]. 东北农业科学, 2022, 47(2): 64-68. l
JI X, JIN A W, ZHU Q G. Effects of applying bamboo biochar based organic fertilizer on soil enzyme activities and microbial community in tea garden[J]. Journal of Northeast Agricultural Sciences, 2022, 47(2): 64-68. (in Chinese)
[38] 和文祥, 刘恩斌, 朱铭莪. 土壤脲酶活性与底物浓度定量关系研究[J]. 西北农业学报, 2001, 10(1): 62-66.
HE W X, LIU E B, ZHU M E. The study on quantitative relationship between soil urease activityand substrate concentration[J]. Acta Agriculturae Boreali-occidentalis Sinic, 2001, 10(1): 62-66. (in Chinese)
[39] 曹 越, 赵洋毅, 王克勤, 马彩霞, 王卫喆. 滇中坡改梯不同种植方式对土壤酶活性的影响[J]. 西部林业科学, 2020, 49(4): 91-98.
CAO Y, ZHAO Y Y, WANG K Q, MA C X, WANG W Z. Effects of different planting methods on soil enzyme activity in central Yunnan Province[J]. Journal of West China Forestry Science, 2020, 49(4): 91-98. (in Chinese)
[40] 万春红, 陶 楚, 杨小波, 龙文兴, 冯丹丹, 周文嵩, 杨 琦. 森林群落物种组成对凋落物组成的影响[J]. 生态学报, 2015, 35(22): 7435-7443.
WAN C H, TAO C, YANG X B, LONG W X, FENG D D, ZHOU W S, YANG Q. Impact of forest community species composition on litter species composition[J]. Acta Ecologica Sinica, 2015, 35(22): 7435-7443. (in Chinese).
[41] 吴林坤, 林向民, 林文雄. 根系分泌物介导下植物-土壤- 微生物互作关系研究进展与展望[J]. 植物生态学报, 2014, 38(3): 298-310.
WU L K, LIN X M, LIN W X. Advances and perspective in research on plant-soil-microbe interactions mediated by root exudates[J]. Chinese Journal of Plant Ecology, 2014, 38(3): 298-310 (in Chinese).
[42] 吴则焰, 林文雄, 陈志芳, 方长旬, 张志兴, 吴林坤, 周明明, 陈 婷. 中亚热带森林土壤微生物群落多样性随海拔梯度的变化[J]. 植物生态学报, 2013, 37(5): 397-406.
WU Z Y, LIN W X, CHEN Z F, FANG C X, ZHANG Z X, WU L K, ZHOU M M, CHEN T. Variations of soil microbial community diversity along an elevational gradient in mid-subtropical forest[J]. Chinese Journal of Plant Eeology, 2013, 37(5): 397-406. (in Chinese)
[43] 斯贵才, 袁艳丽, 王 建, 夏燕青, 雷天柱, 张更新. 藏东南森林土壤微生物群落结构与土壤酶活性随海拔梯度的变化[J]. 微生物学通报, 2014, 41(10): 2001-2011.
SI G C, YUAN Y L, WANG J, XIA Y Q, LEI T Z, ZHANG G X. Microbial community and soil enzyme activities along an altitudinal gradient in Sejila mountains[J]. Microbiol China, 2014, 41(10): 2001-2011. (in Chinese)
[44] SHENG Y Y, CONG W, YANG L S, LIU Q, ZHANG Y G. Corrigendum: forest soil fungal community elevational distribution pattern and their ecological assembly processes[J/OL]. Frontiers in Microbiology, 2019, DOI:10.3389/ fmicb.2019.02802.
[45] CHAPARRO J M, SHEFLIN A M, MANTER D K, VIVANCO J M. Manipulating the soil microbiome to increase soil health and plant fertility[J]. Biology and Fertility of Soils, 2011(5): 489-499.
[46] 陈秀波, 朱德全, 赵晨晨, 张路路, 陈立新, 段文标. 不同林型红松林土壤真菌群落组成和多样性[J]. 土壤学报, 2019, 56(5): 1221-1234.
CHEN X B, ZHU D Q, ZHAO C C, ZHANG L L, CHEN L X, DUAN W B. Community composition and diversity of fungi in soils under different types offorests[J]. Acta Pedologica Sinica, 2019, 56(5): 1221-1234. (in Chinese)
[47] 郭雄飞. 刨花润楠根系和根际土壤真菌群落多样性分析[J]. 西华师范大学学报(自然科学版), 2020, 41(1): 11-16.
GUO X F. Analysis of fungal community diversity inroots and rhizosphere soil[J]. Journal of China West Normal University (Natural Sciences), 2020, 41(1): 11-16. (in Chinese)
[48] 沈清清, 赵 芳, 胡 彦, 吴风志, 胡国贤. 云南文山市石漠化土壤真菌多样性研究[J]. 文山学院学报, 2020, 33(6): 23-29.
SHEN Q Q, ZHAO F, HU Y, WU F Z, HU G X. Diversity research of soil fungi in rocky desertification area of Wenshan City[J]. Journal of Wenshan University, 2020, 33(6): 23-29. (in Chinese)
[49] LIENHARD P, TERRAT S, PREVOSTÉ-BOURÉ N C, NOWAK V, RÉGNIER T, SAYPHOUMMIE S, PANYASIRI K, TIVET F, MATHIEU O, LEVÊQUE J, MARON P A, RANJARD L. Pyrosequencing evidences the impact of cropping on soil bacterial and fungal diversity in Laos tropical grassland[J]. Agronomy for Sustainable Development, 2014, 34(2): 525-533.
[50] FREY S D, KNORR M, PARRENT J L, SIMPSON R T. Chronic nitrogen enrichment affects the structure and function of the soil microbial community in temperate hardwood and pine forests[J]. Forest Ecology and Management, 2004, 196(1): 159-171.
[51] 吴佳伟, 杨 瑞, 王 勇, 瞿 爽, 刘 志, 侯春兰. 贵州草海流域三种不同植被类型根际土壤真菌结构组成和多样性[J]. 菌物学报, 2020, 39(7): 1250-1262.
WU J W, YANG R, WANG Y, QU S, LIU Z, HOU C L. Community and diversity of rhizosphere soil fungi in three different vegetation types in Caohai Basin, Guizhou Province[J]. Mycosystema, 2020, 39(7): 1250-1262. (in Chinese)
[52] HEIJDEN M G A V, BARDGETT R D, VAN STRAALEN N M. The unseen majority: soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems[J]. Ecology Letters, 2008, 11(3): 296-310.
Effects of Different Vegetation on Soil Fungal Diversity and Enzyme Activity in the Reclamation Area of Coal Mine Wasteland
YOU Ping1,2, XIAO Qunying1,2, XUE Xiaohui1,2, LIU Xian1,2, DAI Zhidong3
1. School of Ecological Engineering, Guizhou University of Engineering Science, Bijie, Guizhou 551700, China; 2. Guizhou Province Key Laboratory of Ecological Protection and Restoration of Typical Plateau Wetlands, Bijie, Guizhou 551700, China; 3.Guizhou Kangteng Energy Group Co., Ltd, Jinsha, Guizhou 551800, China
In order to evaluate the effect of different vegetation on soil ecological restoration in reclaimed areas of coal mine wasteland, the effects ofL, Taxodiaceae Warming andLon soil enzyme activity and fungal population diversity in reclaimed areas were analyzed. The activity of urease, acid phosphatase and invertase was significantly different in different vegetation. Urease activity was the highest in the control and the lowest inLAcid phosphatase activity was the highest in the control, and the lowest in Taxodiaceae Warming (0‒20, 40‒60 cm) andL. (20‒40 cm), and the enzyme activity generally decreased with the deepening of soil layer, showing surface aggregation, but the changes of invertase activity in different vegetation and different soil layers were different. pH of soil in this area increased with the depth of soil layer, the highest was 5.67, all were acidic, and all showed some differences except the control. Under different treatments,were the dominant phylum.andwere the dominant genus in all soil fungi populations.was the dominant genus, only not inandwere the dominant genera inLwas the dominant genus in Taxodiaceae Warmingwas the dominant genus in the control. However,Non-metric multidimensional scaling (NMDS) analysis showed that the community composition of soil fungi in different vegetation was quite different, and the species number and diversity of 0‒20cm soil in, 20‒40 cm soil in Taxodiaceae Warming and 40‒60cm soilin the control were rich, while the species richness and diversity inL.were relatively low. The results of this study could provide some reference for the study of the soil ecological restoration in other coal mine reclamation areas.
coal mine wasteland; high-throughput sequencing; fungus; diversity; community composition; soil enzyme
S154.3
A
10.3969/j.issn.1000-2561.2022.10.024
2021-12-09;
2022-03-07
贵州省教育厅项目(黔教合KY字[2020]066,黔教合KY字[2020]147);贵州省科技厅项目(黔科合平台人才[2020]2002)。
游 萍(1976—),女,硕士,副教授,研究方向:土壤微生物。E-mail:1037889542@qq.com。
