木薯MeSAP13基因的克隆及其抗细菌性枯萎病功能鉴定
2022-11-11张子奇陈银华张银东张肖飞耿梦婷
张子奇,李 可,陈银华,张银东,张肖飞,耿梦婷*
木薯基因的克隆及其抗细菌性枯萎病功能鉴定
张子奇1,李 可1,陈银华1,张银东1,张肖飞2,耿梦婷1*
1. 海南大学热带作物学院,海南海口 570228;2. 国际热带农业中心,哥伦比亚 卡利 AA 6713
胁迫相关蛋白(stress-associated proteins, SAPs)在植物对胁迫应答和胁迫调控中起重要作用。木薯是我国重要的粮食作物和经济作物,细菌性枯萎病(cassava bacterial blight, CBB)已严重危害我国木薯产业的健康发展。为了探讨木薯基因在抗细菌性枯萎病中的作用,本研究克隆了我国主栽木薯品种‘华南8号’(SC8)的基因,分析该基因在细菌性枯萎病病原菌侵染时的表达模式及其编码蛋白的基本特性。利用基于木薯花叶病毒介导的基因沉默(virus induced gene silencing, VIGS)技术抑制了基因在木薯SC8叶片中的表达,通过接种细菌性枯萎病病原菌HN11对的抗病功能进行抗性鉴定。结果发现:在病原菌HN11侵染叶片3 d后基因表达量显著上调,说明木薯基因能够响应病原菌的侵染;在VIGS载体转化木薯叶片40 d后发现,与转化pCsCMV-A载体的对照叶片相比,在转化pCsCMV-MeSAP13叶片中的表达量显著下调了40%~60%,表明通过VIGS技术成功抑制了在木薯叶片中的表达。将病原菌HN11接种至基因沉默叶片和对照植株叶片,发现基因沉默植株接种叶片的水渍状病斑面积显著大于对照植株接种叶片。分析侵染后0、3、6 d病原菌HN11的繁殖情况发现,在侵染后3 d和6 d的基因沉默植株接种叶片中,其病原菌数量显著高于对照植株接种叶片。以上研究结果表明,抑制基因的表达,降低了木薯对细菌性枯萎病的抗性。
木薯;VIGS;基因;细菌性枯萎病
木薯(Crantz)是世界三大薯类作物之一,是全球第六大粮食作物,为热带地区7亿人口提供主粮[1]。木薯在全球淀粉作物产量中排名第五,其淀粉含量高达其总贮藏根干重的90%,因此被称为“地下粮仓”和“淀粉之王”[1-2]。除了作为粮食作物以外,木薯作为工业以及生物能源的原料在我国占据重要地位,具有重要的经济效益。
病害一直是限制木薯产业健康发展的重要制约因素之一[3]。木薯细菌性枯萎病(cassava bacterial blight, CBB)是由菜豆黄单胞菌木薯萎蔫致病变种(pv,)引起的细菌性病害,该病首先发生于巴西,通过携带病原菌的种茎或种子被传播到世界各地[4]。木薯受细菌性枯萎病危害的部位主要在叶片及茎秆[5]。在受到危害后,叶片开始出现水渍状病斑[6],随着时间推移,病斑变为褐色,最终导致叶片枯萎、脱落;受害茎秆的病斑在后期变为黑褐色,其周围附着的叶片逐渐凋零,枝条逐渐萎焉,当周围环境湿度较大时还会出现黄色菌脓[7]。该病曾导致我国海南地区木薯产量损失超过20%[7],这也给许多国家的木薯生产带来毁灭性的打击,并已成为世界上重要的检疫性病害之一[8]。木薯细菌性枯萎病在生产上主要通过苗期检疫、药物防治等措施进行防控。我国主栽的华南系列、桂热系列木薯品种均不抗该病[9]。因此,创制抗细菌性枯萎病木薯新种质,选育抗病新品种,增强我国木薯主栽品种的抗病性是防控细菌性枯萎病危害木薯种植业的根本出路。
本实验室前期研究发现木薯的丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)编码基因的表达受到病原菌HN11侵染的诱导,且该基因能互补拟南芥、突变体阻断的PTI反应,在拟南芥中过表达基因可显著提高转基因拟南芥的抗病性[10],表明参与了木薯对细菌性枯萎病的抗病过程。利用酵母双杂技术,本实验室筛选到与MeMAPK1互作的抗逆相关蛋白MeSAP13,该蛋白具有A20/AN1锌指结构域。研究表明,在烟草中过表达水稻基因使烟草植株的抗病性增强[11];拟南芥基因的过表达植株表现出对非寄主病原菌丁香假单胞菌(pv.)的敏感性增加,表明在基础抗性中起关键作用[12];兰花SAP蛋白Pha13及拟南芥同源蛋白AtSAP5在植物抗病毒免疫中起着重要的调控枢纽作用[13]。本研究推测MeSAP13可能与MeMAPK1协同调控木薯对细菌性枯萎病的抗病过程。目前关于参与木薯抗细菌性枯萎病过程的作用机制尚不清楚。本研究克隆了我国主栽木薯品种‘华南8号’(SC8)的基因,分析了该基因在细菌性枯萎病病原菌侵染时的表达模式;进一步利用VIGS技术沉默基因的表达,接种细菌性枯萎病病原菌,观察木薯的抗病性变化,确定基因与木薯抗性之间的关系。本研究对于阐明木薯细菌性枯萎病的致病机制具有重要意义,为培育木薯抗病新品种奠定理论基础。
1 材料与方法
1.1 材料
本研究材料为木薯栽培品种‘华南8号’(SC8),供试菌株细菌性枯萎病菌(pv.HN11,HN11)由本实验室分离获得,VIGS病毒载体pCsCMV-B和pCsCMV-A由中国热带农业科学院热带生物技术研究所周鹏老师课题组惠赠。
1.2 方法
1.2.1基因的克隆及生物信息学分析 利用RNAprep Pure Plant Kit试剂盒[天根生化科技(北京)有限公司,DP441]提取木薯SC8叶片RNA。利用RevertAid Master Mix试剂盒(赛默飞世尔科技公司,M1632)将RNA反转录为cDNA,以此为模板,利用特异性引物VIGS- MeSAP13-F/R(表1)进行PCR扩增基因,通过1.5%琼脂糖凝胶电泳检测后送至公司测序。

表1 本研究所用引物
根据基因序列推导其蛋白序列,分析其理化性质,氨基酸数、分子量、等电点、不稳定系数、脂肪指数和平均亲水系数由在线网站ExPASy (https://web.expasy.org/protparam/)进行预测。运用NCBI数据库的在线网站CDD (https://www.ncbi.nlm.nih.gov/Structure/bwrpsb / bwrpsb.cgi)进行MeSAP13蛋白的结构域分析。利用在线网站Plant-mPLoc SEfvEf (http://www. csbio.sjtu.edu.cn/bioinf/plant-multi/)对MeSAP13蛋白进行亚细胞定位预测。
1.2.2基因的表达模式分析 利用病原菌HN11侵染木薯SC8叶片,采用RNAprep Pure Plant Kit试剂盒提取侵染0、3、6 h和1、3、6 d后木薯叶片中的RNA,利用RevertAid Master Mix试剂盒将RNA反转录为cDNA。以为内参基因,利用实时荧光定量PCR技术对基因的表达量进行检测,引物(EF1a- F/R,MeSAP13-F/R)见表1。利用2ΔΔCT方法计算目的基因的相对表达量,每组试验进行3次独立的生物学试验,利用-test方法对结果进行显著性分析。
1.2.3VIGS重组载体pCsCMV的构建 以木薯cDNA为模板,利用特异性引物VIGS- MeSAP13-F/R(表1)进行PCR扩增目标基因,扩增产物经琼脂糖凝胶电泳回收后,利用海南壹田生物科技有限公司的Nimble Cloning试剂盒进行NC克隆反应,将反应产物转化DH5a感受态细胞,使用引物CsCMV-F/R(表1)进行PCR菌落筛选阳性克隆,送至公司进行测序验证,重组载体命名为pCsCMV-。
1.2.4 含VIGS载体的农杆菌侵染木薯 将VIGS重组载体pCsCMV-、正对照pCsCMV-B和负对照pCsCMV-A转化农杆菌GV3101(pSoup-p19)感受态细胞,挑取菌落PCR鉴定出的阳性克隆至5 mL LB(50 μg/mL卡那霉素+ 25 μg/mL利福平)液体培养基中,28℃,220 r/min过夜培养。取1 mL过夜培养菌液于50 mL LB(50 μg/mL卡那霉素+25 μg/mL利福平)液体培养基中,28℃,220 r/min培养至600值为1.0。将菌液移至50 mL离心管中,4000 r/min离心5 min,弃上清。加入适量10 mmoL/L MES和10 mmoL/L MgCl2混合液重悬菌体,4000 r/min离心5 min,弃上清,重复2次。加入25 mL植物注射液(10 mmoL/L MES+10 mmoL/L MgCl2+ 200 μmoL/L乙酰丁香酮)重悬菌体,在室温、黑暗条件下静置3 h。选取长势良好、状态一致的木薯SC8,将菌液用1 mL注射器压渗至木薯叶片背面,30 d后开始观察表型变化并拍照记录。
1.2.5基因的沉默效果检测 利用RNAprep Pure Plant Kit试剂盒提取接种40 d后木薯叶片中的RNA,利用RevertAid Master Mix试剂盒将RNA反转录为cDNA。以为内参基因,利用qRT-PCR技术对基因的表达量进行检测。用于qRT-PCR的引物见表1。利用2ΔΔCT方法计算目的基因的相对表达量,每组试验进行3次独立的生物学重复,利用-test方法对结果进行显著性分析。
1.2.6 木薯植株接种细菌性枯萎病及发病情况统计 将保存的木薯细菌性枯萎病病原菌HN11在含有氯霉素的LPGA固体培养基中28℃倒置培养2 d。挑取单克隆菌落于5 mL含有氯霉素LPGA液体培养基中,28℃,220 r/min培养约16 h。吸取200 μL菌液涂布于含有氯霉素的LPGA固体培养基上,28℃培养24 h左右。用10 mmoL/L MgCl2洗下菌体,4000 r/min离心5 min收集菌体,并用10 mmoL/L MgCl2清洗菌体2~3次,调整细菌浓度为1×108CFU/mL(600≈ 0.1)。阴性对照为10 mmoL/L MgCl2,用去除针头的1 mL注射器将菌液接种至叶片背面。在接种后的3 d和6 d观察木薯叶片水渍状病斑扩散情况并拍照记录。
1.2.7 叶片病斑的细菌生长计数 用直径为1 cm的打孔器取下接种HN11后的0、3、6 d木薯叶片,置于已灭菌的研钵中,加入1 mL MgCl2充分研磨,吸取100 µL上层研磨液,加入900 µL无菌水中得到稀释液,以此类推,稀释10倍、100倍、1000倍。取3个连续稀释的浓度梯度的100 μL上清涂布于LPGA固体培养基上,28℃倒置培养24 h后统计菌落数量,根据平板上的菌落数计算叶片中的活菌数。
2 结果与分析
2.1 MeSAP13基因的克隆
提取木薯SC8叶片RNA,经反转录后获得cDNA,以此为模板,利用特异性引物进行PCR扩增基因。扩增产物经琼脂糖凝胶电泳检测,扩增条带长度为522 bp(图1),克隆测序所得基因序列(Manes.14G001000)与Phytozome数据库(https://phytozome- next.jgi.doe. gov/info/ Mesculenta_v8_1)的信息一致。
2.2 MeSAP13基因生物信息学分析
利用NCBI在线网站分析基因开放阅读框,显示基因全长522 bp,由一个外显子编码。利用在线网站ExPASy分析木薯MeSAP13蛋白的生理生化性质,结果显示MeSAP13蛋白理论分子式为C793H1275N235O247S15,理论相对分子质量为18.5 kDa,理论等电点pI值为8.44。该蛋白富含丙氨酸(Ala,9.8%)、赖氨酸(Lys,8.7%)、缬氨酸(Val,8.7%)、半胱氨酸(Cys,6.9%)、甘氨酸(Gly,6.9%)、丝氨酸Ser(Gly,6.9%)、天冬酰胺(Asn,6.4%)、脯氨酸(Pro,6.4%)、谷氨酸(Glu,5.2%)。MeSAP13蛋白亲水指数从-2.744到2.222(负值表示亲水性,正值表示疏水性),亲水性平均指数为-0.349,表明该蛋白水溶性较好。MeSAP13蛋白的理论不稳定系数为26.36,属于稳定蛋白质。利用NCBI站点Conserved Domain Database分析MeSAP13蛋白保守结构域(图2),发现MeSAP13蛋白N端具有典型的A20锌指结构域,C端具有AN1锌指结构域,是典型的锌指蛋白。利用在线网站Plant-mPLoc SEfvEf预测MeSAP13蛋白可能定位于细胞核。
M: DL2000 DNA marker.

图2 MeSAP13蛋白的保守结构与分析
2.3 MeSAP13基因的表达模式分析
为了探究木薯基因是否能够响应病原菌入侵,本研究用木薯细菌性枯萎病病原菌HN11侵染扦插盆栽45 d的木薯SC8。以不含病原菌的10 mmoL/L MgCl2为对照,分别取0、3、6 h和1 d、3 d、6 d木薯叶片,通过qRT-PCR技术检测木薯基因的表达量变化。结果如图3所示,HN11侵染3 d后,基因表达量显著升高10倍,6 d后基因表达量下降,推测基因能够响应HN11侵染。
2.4 VIGS沉默效果的表型分析
阳性对照pCsCMV-B为含有病毒基因与指示基因的重组质粒,阴性对照pCsCMV-A为仅含有病毒基因的质粒。用含有重组质粒的农杆菌去侵染野生型木薯SC8的叶片,利用病毒在植物体内扩增从而达到沉默目的基因的效果,含有指示基因的正对照会使植物合成叶绿素的能力受阻,导致新叶部分出现褪绿白化的现象[14]。如图4所示,侵染大约40 d后,pCsCMV-B成功转化的木薯新叶出现了明显的白化表型,而转化pCsCMV-A或pCsCMV的木薯新叶则无明显变化。以正对照沉默指示基因产生的表型来指示基因的沉默效果,表明本研究所用的沉默体系能够有效沉默木薯基因。
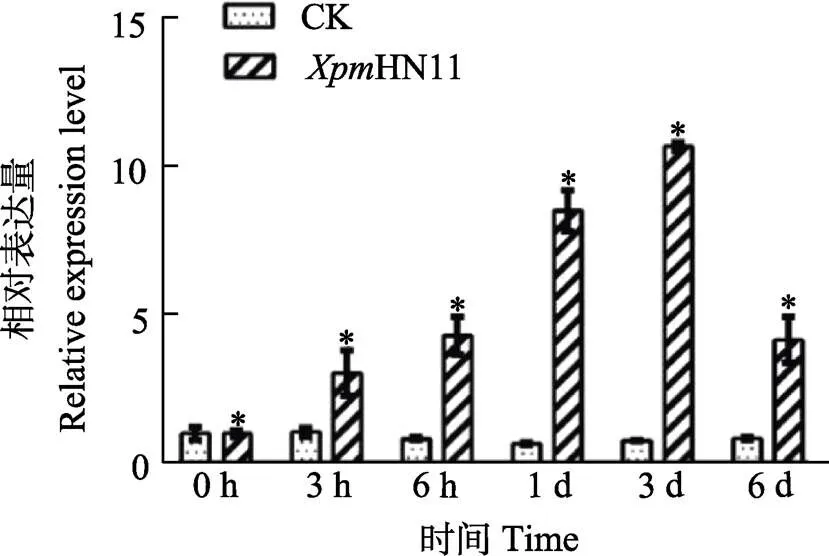
*表示处理间差异显著(P<0.05)。

图4 VIGS接种后木薯表型变化
2.5 MeSAP13基因沉默效果检测
为进一步验证基因是否被有效沉默,利用qRT-PCR技术进行检测。取VIGS沉默40 d后的pCsCMV和阴性对照pCsCMV-A木薯新叶叶片,提取RNA,反转录为cDNA,以此为模板检测基因的表达量。结果发现基因在转pCsCMV-木薯新叶中的表达量显著降低,下降了40%~ 60%,说明基因表达受到了有效的沉默(图5)。

*表示处理间差异显著(P<0.05)。
2.6 MeSAP13基因沉默后对木薯细菌性枯萎病抗病性的影响
为进一步探究基因在木薯抗细菌性枯萎病中的作用,将病原菌HN11接种至沉默木薯叶片,以转化pCsCMV-A木薯植株叶片为阴性对照。当HN11侵染3 d后,叶片背面逐渐开始出现水渍状病斑;侵染6 d后,可以明显地看到病斑面积开始逐渐扩大,且沉默后的pCsCMV植株产生的水渍状病斑大于负对照pCsCMV-A(图6A)。此结果说明沉默基因后植株对的病原菌HN11抗性减弱。
为了能够对发病程度进行量化,利用ImageJ软件计算叶片背面的病斑面积大小,并计算平均值(单位为mm2)。取各植株不同时间点的病斑面积大小绘制成柱状图,并进行显著性分析。结果如图6B所示,沉默3 d和6 d后的pCsCMV植株的病斑面积均显著高于阴性对照pCsCMV-A,分别升高了49%和39%,说明沉默基因后木薯叶片对细菌性枯萎病的抗病性降低了。
为了进一步确定侵染后木薯叶片的发病程度,利用细菌生长计数对不同时间点叶片病斑中病原菌的繁殖情况进行分析。结果表明,侵染0 d时,各转化木薯叶片病斑中细菌数目差异并不显著,但在侵染3 d和6 d后,沉默基因的木薯叶片中含有的细菌数量高于阴性对照(图6C)。证明了沉默基因促进了HN11的增殖,导致木薯抗病性降低。
3 讨论
本课题组前期利用酵母双杂交筛选木薯抗细菌性枯萎病关键蛋白MeMAPK1的互作蛋白MeSAP13。本研究在木薯SC8中克隆到该互作蛋白的编码基因后,通过序列比较发现该蛋白可能是一个SAP蛋白,因此,对基因及编码蛋白的结构及特点进行生物信息学分析。在植物中,胁迫相关蛋白SAPs一般含有N-端A20锌指结构域和C-端AN1锌指结构域[15]。通过A20/AN1锌指结构域的数量和组合形式将SAP蛋白分为4种类型,包括A20、AN1、A20+AN1、AN1+AN1[16]。其中,A20+AN1是植物中最常见的类型,比如水稻OsSAP1~OsSAP9,拟南芥AtSAP1~AtSAP10均含有A20+AN1锌指结构域[17]。本研究通过分析蛋白保守结构域,发现MeSAP13蛋白也含有A20+AN1锌指结构域。此外,基因中不含或含有少量的内含子是此类蛋白的一个重要特点[18],比如水稻基因家族中有11个基因没有内含子,番茄中有7个基因不含内含子。本研究的木薯基因也不含内含子。研究发现,内含子可以延迟调控反应,表达水平对应激反应迅速变化的基因含有明显较低的内含子密度[19]。大部分SAPs定位于细胞核中,比如拟南芥AtSAP5[20]、小麦TaSAP1[21]、柽柳ThSAP6[22]、大麦HvSAP、HvSAP12[23]等均定位于细胞核。本研究中的MeSAP13也定位于细胞核中。综上所述,基因及编码蛋白与其他作物中的有相似的结构特点,因此我们认为该基因是木薯中的一个基因。本研究对木薯SC8接种病原菌HN11,通过实时荧光定量PCR发现,侵染3 d后木薯基因的表达量上调,是对照的10倍。在其他植物中,基因也响应病原菌的侵染,葡萄基因在白粉菌的诱导下,其表达量在感病初期上调5倍[24];香蕉基因在枯萎病菌Foc TR4侵染4 d后其表达量上调7.9倍[25]。表明本研究克隆的基因参与木薯对病原菌HN11侵染的响应过程。

*表示处理间差异显著(P<0.05)。
VIGS(virus-induced gene silencing)技术是通过携带植物基因转录本序列的重组病毒侵染植物,激活宿主的核酸序列特异性降解系统,使得植物内源基因沉默,从而引起表型变异,是鉴定植物基因功能的重要方法[26]。VIGS技术相比于传统基因功能分析方法而言,具有快速、高效、高通量等优点,它避免了许多传统基因功能分析方法的局限性[27]。目前,VIGS技术已在禾本科、十字花科、茄科、豆科等植物中广泛应用[28]。TUO等[14]利用木薯普通花叶病毒建立了木薯VIGS体系,为木薯基因功能鉴定提供了新技术。本研究利用CsCMV介导的VIGS技术对木薯基因进行抗细菌性枯萎病功能验证,发现沉默后的基因表达量降低,削弱了木薯对细菌性枯萎病病原菌HN11的抗性,病菌更易于繁殖,病斑面积增大。此结果表明参与木薯先天免疫途径,抑制基因的表达降低了木薯对细菌性枯萎病的抗性,但基因是否正调控木薯对细菌性枯萎病的抗性有待进一步验证。本研究结果为下一步深入阐明基因在调控木薯抗病机制中的作用提供了基础。
[1] 曹 升, 陈江枫, 黄富宇, 严华兵, 韦朝念, 李富山, 陆柳英, 覃夏燕, 陈会鲜, 李恒锐. 广西木薯产业现状分析及其发展建议[J]. 南方农业学报, 2021, 52(6): 1468-1476.
CAO S, CHEN J F, HUANG F Y, YAN H B, WEI C N, LI F S, LU L Y, QIN X Y, CHEN H X, LI H R. Development status and countermeasures of cassava industry in Guangxi[J]. Journal of Southern Agriculture, 2021, 52(6): 1468-1476. (in Chinese)
[2] JANSSON C, WESTERBERGH A, ZHANG J M, HU X W, SUN C X. Cassava, a potential biofuel crop in (the) People’s Republic of China[J]. Applied Energy, 2009, 86(1): 95-95.
[3] REY C, VANDERSCHUREN H. Cassava mosaic and brown streak diseases: current perspectives and beyond[J]. Annual Review of Virology, 2017, 4(1): 429-452.
[4] ZáRATE-CHAVWS C A, GóMEZ DE LA CRUZ D, VERDIER V, LóPEZ C E, BERNAL A, SZUREK B. Cassava diseases caused bypv.and[J]. Molecular Plant Pathology, 2021, 22: 1520-1537.
[5] 卢 昕, 李超萍, 时 涛, 蔡吉苗, 黄贵修. 国内木薯主产区细菌性枯萎病病原鉴定[J]. 广东农业科学, 2013, 40(21): 84-87.
LU X, LI C P, SHI T, CAI J M, HUANG G X. Pathogen identification of cassava bacterial blight from several main cultivation area in China[J]. Guangdong Agricultural Sciences, 2013, 40(21): 84-87. (in Chinese)
[6] MUTKA A M, BART R S. Image-based phenotyping of plant disease symptoms [J]. Frontiers in Plant Science, 2015, 5: 734.
[7] 李超萍, 时 涛, 刘先宝, 蔡吉苗, 裴月令, 黄贵修. 国内木薯病害普查及细菌性萎蔫病安全性评估[J]. 热带作物学报, 2011, 32(1): 116-121.
LI C P, SHI T, LIU X B, CAI J M, PEI Y L, HUANG G X. General survey on cassava diseases and safety assessment of cassava bacterial blight[J]. Chinese Journal of Tropical Crops, 2011, 32(1): 116-121. (in Chinese)
[8] 廖华兰. 木薯类受体胞质激酶基因的分离鉴定[D]. 海口: 海南大学, 2016.
LAIO H L. Isolation and identification of receptor like cytoplasm genefrom cassava[D]. Haikou: Hainan University, 2016. (in Chinese)
[9] 李伯凌. 木薯抗细菌性枯萎病的生理机制研究[D]. 海口: 海南大学, 2017.
LI B L. Research on the physiological mechanism of cassava resistance to bacterial blight[D]. Haikou: Hainan University, 2017. (in Chinese)
[10] 李 可. 木薯蛋白激酶和基因的分离与功能鉴定[D]. 海口: 海南大学, 2017.
LI K. Isolation and identification of protein kinaseandfrom cassava[D]. Haikou: Hainan University, 2017. (in Chinese)
[11] TYAGI H, JHA S, SHARMA M, GIRI J, TYAGI A K. Rice SAPs are responsive to multiple biotic stresses and overexpression of OsSAP1, an A20/AN1 zinc-finger protein, enhances the basal resistance against pathogen infection in tobacco[J]. Plant Science, 2014, 225: 68-76.
[12] KANG M, LEE S, ABDELMAGEED H, REICHERT A, LEE H K, FOKAR M, MYSORE K S, ALLEN R D.stress associated protein 9 mediates biotic and abiotic stress responsive ABA signaling via the proteasome pathway[J]. Plant Cell and Environment, 2017, 40(5): 702-716.
[13] LI C, CHANG H H, CHANG J C, LU H C, WANG T T, HSU D W, TZEAN Y, CHENG A P, CHIU Y S, YEH H H. Plant A20/AN1 protein serves as the important hub to mediate antiviral immunity[J]. PLoS Pathogens, 2018, 14(9): e1007288.
[14] TUO D C, ZHOU P, PU YAN, CUI H G, LIU Y, WANG H, YANG X K, LIAO W B, SUN D, LI X Y, SHEN W S. A cassava common mosaic virus vector for virus-induced gene silencing in cassava[J]. Plant Methods, 2021, 17(1): 1-12.
[15] GIRI J, DANSANA P K, KOTHAIR K S, SHARMA G, VIJ S, TYAGI A K. SAPs as novel regulators of abiotic stress response in plants[J]. BioEssays, 2013, 35(7): 639-648.
[16] VIJ S, TYAGI A K. Genome-wide analysis of the stress associated protein (SAP) gene family containing A20/AN1 zinc-finger(s) in rice and their phylogenetic relationship with[J]. Molecular Genetics & Genomics, 2006, 276(6): 565-575.
[17] SOLANKE A U, SHARMA M K, TYAGI A K, SHARMA A K. Characterization and phylogenetic analysis of environmental stress-responsivegene family encoding A20/ AN1 zinc finger proteins in tomato[J]. Molecular Genetics & Genomics, 2009, 282(2): 153-164.
[18] JAIN M, KHURANA P, TYAGI A K, KHURANA J P. Genome-wide analysis of intronless genes in rice and[J]. Functional & Integrative Genomics, 2008, 8 (1): 69-78.
[19] JEFFARES D C, PENKETT C J, BäHLER J. Rapidly regulated genes are intron poor[J]. Trends in Genetics, 2008, 24(8): 375-378.
[20] CHOI H, HAN S, SHIN D, LEE S. Polyubiquitin recognition by AtSAP5, an A20-type zinc finger containing protein from[J]. Biochemical & Biophysical Research Communications, 2012, 419(2): 436-440.
[21] 苏晓帅, 张宝华, 刘佳静, 陈耀仙, 田 晓, 肖 凯, 李小娟. 小麦SAPs家族分析及耐盐和低磷胁迫功能研究[J]. 植物遗传资源学报, 2022, 23(3): 857-871
SU X S, ZHANG B H, LIU J J, CHEN Y X, TIAN X, XIAO K, LI X J. Genomic analysis of stress associated proteins in wheat and functional study ofin salt and low-Pi tolerance[J]. Journal of Plant Genetic Resources, 2022, 23(3): 857-871. (in Chinese)
[22] 赵 鑫. 柽柳SAP家族基因鉴定及耐盐功能研究[D]. 哈尔滨: 东北林业大学, 2021.
ZHAO X. Comprehensive analysis of the stress associated protein (SAP) gene family inand the function ofin salt tolerance[D]. Ha’erbin: Northeast Forestry University, 2021. (in Chinese)
[23] 张书发. 大麦基因家族鉴定与功能分析[D]. 杨凌: 西北农林科技大学, 2021.
ZHANG S F. Analysis and functional identification ofgene family in barley[D]. Yangling: Northwest A & F University, 2021. (in Chinese)
[24] 牛 姣, 张玉成, 郭荣荣, 王西平. 中国野生葡萄病原菌诱导响应基因的克隆及表达分析[J]. 果树学报, 2012, 29(4): 563-568.
NIU J, ZHANG Y C, GUO R R, WANG X P. Cloning and expression analysis of a pathogen-responsivegene in Chinese wild[J]. Journal of Fruit Science, 2012, 29(4): 563-568. (in Chinese)
[25] 邢文婷, 徐碧玉, 王 卓, 贾彩红, 刘菊华, 金志强. 香蕉胁迫相关蛋白基因的克隆及其表达分析[J]. 西北植物学报, 2014, 34(2): 225-230.
XING W T, XU B Y, WNAG Z, JIA C H, LIU J H, JIN Z Q. Cloning and expression of stress associated protein gene from banana[J]. Acta Botanica Boreali-Occidentalia Sinica, 2014, 34(2): 225-230. (in Chinese)
[26] 张增艳, 姚乌兰, 辛志勇. 植物基因功能鉴定新工具——病毒诱导基因沉默技术的研究进展[J]. 植物遗传资源学报, 2006, 7(1): 100-105.
ZHANG Z Y, YAO W L, XIN Z Y. Advances on virus-induced gene silencing for gene function characterization in plants[J]. Journal of Plant Genetic Resources, 2006, 7(1): 100-105. (in Chinese)
[27] BURCH-SMITH T M, ANDERSON J C, MARTIN G B, DINESH-KUMAR S P. Applications and advantages of virus-induced gene silencing for gene function studies in plants[J]. Plant Journal, 2010, 39(5): 734-746.
[28] 李 姣, 于宗霞, 冯宝民. 植物中病毒诱导基因沉默技术的研究与应用进展[J]. 分子植物育种, 2019, 17(5): 1537-1542.
LI J, YU Z X, FENG B M. Advances in research and application of virus induced gene silencing in plants[J].Molecular Plant Breeding, 2019, 17(5): 1537-1542. (in Chinese)
Cloning of CassavaGene and Identification of Its Function Against Cassava Bacterial Blight
ZHANG Ziqi1, LI Ke1, CHEN Yinhua1, ZHANG Yindong1, ZHANG Xiaofei2, GENG Mengting1*
1. College of Tropical Crops, Hainan University, Haikou, Hainan 570228, China; 2. International Center for Tropical Agriculture, Cali AA 6713, Colombia
Stress-associated proteins (SAPs) play an important role in plant response to stress and stress regulation. Cassava is an important food crop and economic crop in China, however, cassava bacterial blight (CBB) has seriously harmed the healthy development of cassava industry in China.In order to explore the role of cassavagene in cassava resistance to CBB, this study cloned the3 gene of cassava cultivar SC8, and analyzed the expression pattern of this gene in the infestation of bacterial blight pathogens and the basic characteristics of the coding protein.The expression ofin cassava SC8 leaves was inhibited by cassava mosaic virus-mediated gene silencing (VIGS) technology, and the resistance function ofwas identified by inoculating the bacterial blight pathogenHN11.The results showed that the expression ofwas significantly upregulated 3 d after the pathogenHN11 infected the leaves, indicating thatcould respond to the infection of pathogenic bacteria; after 40 days of transformation of cassava leaves with VIGS vector, it was found that the expression ofin the transformedleaves was significantly reduced by 40%-60% compared with the control leaves of the transformedvector, showing that the expression ofin cassava leaves was successfully inhibited by VIGS technology.The pathogenHN11 was inoculated into the leaves of thesilencing and control plants, and the water-stained lesion area on the inoculation leaves of thegene-silencing plants was found to be significantly larger than that of the control plants. We analyzed the reproduction of the pathogenHN11 at 0 d, 3 d and 6 d after infection, the number of pathogens in the inoculated leaves ofsilencing plants 3 d and 6 d after infection was significantly higher than that of the control plants. The above results show that inhibiting the expression ofreduces the resistance of cassava bacterial blight.
cassava; VIGS;gene; bacterial blight
S435.33
A
10.3969/j.issn.1000-2561.2022.10.003
2022-03-17;
2022-04-07
国家重点研发计划项目(No. 2018YFD1000500);国家木薯产业技术体系项目(No. CARS-11-HNCYH)。
张子奇(1996—),女,硕士研究生,研究方向:作物分子育种。*通信作者(Corresponding author):耿梦婷(GENG Mengting),E-mail:mengtinggeng8908@163.com。
