分光光度法测定离子膜工艺精盐水中的碘
2022-11-10宁骏斌
宁骏斌
(金川集团有限公司,甘肃 金昌 737100)
碘在离子膜上的累积是一个不可逆的过程,会造成离子膜的永久损坏。因此离子膜氯碱工艺十分注重碘含量的监控。精盐水中的碘有很多检测方法[1-2],但都必须要考虑精盐水的高盐性质。相比之下,在天然水质分析中碘的方法[3]则要精巧的多,它的检测过程是依据酸性条件下碘离子和碘酸根反应产生3倍的碘单质这一定量原理设计的:
在分析过程上,将水样酸化后,加入过量饱和溴水,将其中的低价态碘氧化成高价态;然后在至沸条件下用甲酸钠去除多余的溴水,再加热分解甲酸钠;放冷后,调整酸度;最后用碘化钾-淀粉体系显色,分光光度法测定。这一方法的关键在于两步,第一步是用溴水将低价态碘氧化成高价态,多余溴水会干扰碘化钾-淀粉体系显色,因此必须除去;第二步是在加热至沸条件下用甲酸钠来分解溴水;但是多余的甲酸钠会与碘反应,也会干扰碘化钾-淀粉体系显色,所以需要利用甲酸钠遇热分解的特点将其去除[4]。如果将这个方法应用到精盐水中碘的分析,则除了加热会导致精盐水中的氯化钠结晶析出外,还会因为加热带来的体积变化,在显色前必须进一步调整酸度。执行完整个分析过程的时长在100 min以上,这其中还要考虑氯化钠结晶析出和体积变化带来的分析误差问题,这样的方法显然不够简捷。因此在试验的基础上,本文提出,溴水对碘离子的氧化无需加热,如果控制好甲酸钠的用量,采用磷酸体系并保持精盐水pH值在2.5~3.5,则多余的甲酸钠可不用加热去除,因此也就无需再次调整溶液体系酸度用来适应碘化钾-淀粉体系的显色,同时避免了加热导致的精盐水中氯化钠结晶析出。本方法较传统水质分析中碘的分析方法明显简捷,灵敏度与精密度均能满足精盐水中碘的日常快速分析要求。
1 试验部分
1.1 仪器和试剂
721型分光光度计;HP-2型袖珍数显笔式酸度计(便携式pH计);25 mL具塞比色管。
磷酸溶液:1+1(体积比);甲酸钠溶液:20%;KI溶液:1%;淀粉溶液:0.5%;饱和溴水;饱和NaCl基体溶液。
KI标准溶液:称取0.130 8 g基准碘化钾,用无碘蒸馏水溶解后,稀释至1 000 mL,使用时取10 mL稀释至1 000 mL,则该溶液1.00 mL含0.001 mg碘。
无碘蒸馏水:取普通蒸馏水加1 g氢氧化钠重蒸馏。
试剂均为优级纯,试验用水为无碘蒸馏水。
1.2 试验方法
分别取一定体积样品于25 mL具塞比色管。加入磷酸(1+1)溶液0.10 mL,加入0.10 mL饱和溴水,混匀静置5 min;加入20%甲酸钠溶液0.25 mL,混匀静置5 min;加入1%碘化钾溶液0.20 mL和0.5%淀粉溶液0.20mL,定容后充分摇匀显色5 min。用 2 cm比色皿比色,于分光光度计波长575 nm处,测定溶液的吸光度。
2 结果与讨论
2.1 吸收波长
取KI标准溶液4.00 mL,并取饱和NaCl基体溶液15.00 mL,按照试验方法,在530~600 nm波段测定其吸光度,结果见图1。
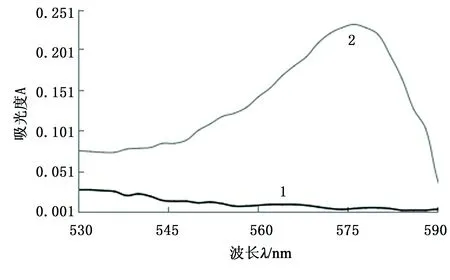
1—加入KI标准溶液4 mL时的体系;2—没有加入KI标准溶液时的试剂空白体系。图1 体系的吸收光谱Fig.1 Absorption spectrum
由图1可见:在570~580 nm段为吸光度达到最大值,因此本文选择在575 nm处为吸光度吸收波长。
2.2 显色酸度
如果运用分光光度法来测定碘的含量,则显色时体系的酸度至关重要[5-6]。取KI标准溶液4.00 mL,并取饱和NaCl基体溶液15.00 mL,按照试验方法显色后,加入不同体积的磷酸(1+1)溶液,以改变溶液最终显色时酸度,结果见图2。

图2 不同酸度下的吸光度Fig.2 Absorbance in the case of different acidity
可见,体系酸度在pH=2.5~3.5时显色稳定,吸光度相对误差在5%左右。淀粉与碘的络合反应在pH=3~5的弱酸性溶液中进行最佳,显然由于饱和盐水的存在,这一范围变窄。本次试验取pH=3左右。这是本方法的关键,酸度会影响接下来甲酸钠溶液加入以后分析结果的稳定性。
2.3 溴水的加入量
溴水的作用是将待测液中各价态的碘氧化为碘酸根,因此,溴水的加入量是过量的,判别标准是加入后溶液呈淡黄色且稳定。通过试验,确定欲氧化15 mL溶液中8 μg的碘离子,加入0.10 mL饱和溴水即可。
2.4 甲酸钠加入量影响
甲酸钠加入量的影响,可从两方面考虑:第一种可能,在去除多余的溴水后,如果多余甲酸钠在酸性溶液中将碘酸根还原为碘单质,则该方法将不会成立。因为这种情况下,不用加入KI,直接加入淀粉就会显色,而在实际试验中并未出现这种现象。据此可推断多余的甲酸钠不会对高价碘产生影响。第二种可能,多余甲酸钠对显色后的碘单质产生影响。取KI标准溶液8.00 mL,并取饱和NaCl基体溶液15.00 mL,按表1试验,首先加入不同磷酸量,通过控制甲酸钠的加入量保证显色酸度pH值在3.0左右,用袖珍数显笔式酸度计测量显色前后的溶液酸度,测定吸光度,结果见表1。

表1 不同甲酸钠加入量对吸光度的影响Table 1 Effect of sodium formate addition amount on absorbance
试验结果显示:1~3组吸光度相对稳定,4~8组吸光度波动较大。pH值在显色以后增大,这表明甲酸钠在加入后没有马上与碘反应,否则pH值会变小。甲酸钠的加入量会影响体系的酸度。
2.5 褪色试验
按照表1所列条件,保持不同的时间后测定8组样品吸光度,做褪色试验,结果见图3。

1~8—分别对应表1中的8组条件。图3 不同的甲酸钠加入量下的褪色曲线Fig.3 Discolourization curves in the case of different sodium formate addition amount
从图3可见:在15 min内, 1~3组吸光度最大下降约3%;30 min后,除第1组外都有明显下降。以上试验表明,甲酸钠最终还是会影响碘-淀粉的显色,但是可以控制甲酸钠加入量,使得加入量较少且在测定周期内不会对显色产生影响。当取磷酸(1+1)溶液0.10 mL,20%甲酸钠溶液0.25 mL的条件下,即能保证多余的溴除去,也能满足酸度要求。
2.6 共存离子的影响
试验条件下,对于饱和NaCl基体溶液空白和碘含量8 μg/25 mL的KI标准溶液,控制相对误差不高于10%时,共存离子为以下允许量时,不会对测定产生干扰: 0.1 mg/L的Ni(Ⅱ),0. 2 mg/L的Ca(Ⅱ)、Mg(Ⅱ)、Cr(Ⅱ),0. 3 mg/L的Fe(Ⅲ),1 mg/L的Al(Ⅲ)、Ba(Ⅱ)、Sr(Ⅱ),2 mg/L的Cu(Ⅱ),5 mg/L的SiO2。共存离子的选择依据是工艺设备的材质和原料中无法通过精制工艺完全去除的物质;各共存离子在试验中加入的最高量,则是依据生产中可能出现的最高可能含量的10倍。
2.7 工作曲线绘制和检出限
取9支25 mL具塞比色管,均加入15.00 mL饱和NaCl基体溶液,再依次加入KI标准溶液0、1.00、2.00、3.00、4.00、5.00、6.00、7.00、8.00 mL。加入磷酸(1+1)溶液0.10 mL,加入0.10 mL饱和溴水,混匀静置5 min;加入20%甲酸钠溶液0.25 mL,混匀静置5 min;加入1%碘化钾溶液0.20 mL和5%淀粉溶液0.20 mL,定容后充分摇匀显色5 min。用2 cm比色皿比色,于分光光度计波长575 nm处,测定溶液的吸光度。根据浓度与吸光度的关系制作标准曲线。标准曲线线性回归方程为:
A=0.058 116 7C+0.004 533,r=0.999 4。
其中:A为吸光度;C为15 mL溶液中含碘的质量,μg;r为相关线性系数。用KI标准溶液0 mL的标准测定11组空白,平均吸光度0.004,标准偏差0.001 49,根据IUPAC建议[7],计算线性方程检出限为:
相当于5 μg/L。
式中:sb为空白的标准偏差;Kb为标准曲线斜率;3为检出限计算系数。
由于标准曲线的最高标准点是取KI标准溶液8.00 mL,则计算可得线性上限:
0.533 (mg/L)≈500 (μg/L)。
式中:8.00为最高标准点取样量, mL;0.001为KI标准溶液质量浓度,mg/mL;0.015为样品量,L。综合以上结果,标准曲线的线性范围为5~500 μg/L。
2.8 精密度试验
量取同一份实际精盐水15.00 mL于25 mL比色管中,按试验方法测定吸光度,查找标准曲线测定样品碘含量。试样1重复11次,测定结果分别为83、78、75、70、73、75、80、89、82、73、82 μg/L,平均值为78 μg/L,相对偏差(RSD)为7.13%。
2.9 加标回收率试验
随机取两份实际精盐水15.00 mL,向其中加入一定量的KI标准溶液,按试验方法测定并计算回收率,结果见表2。

表2 15 mL实际精盐水的加标回收率试验Table 2 Recovery test of 15-mL practical refined brine
2.10 实际样品分析
取500 mL左右精盐水样品,先用便携式pH计测定其pH值,保持pH在6.5~7.5。然后从中分取15.00 mL样品于25 mL比色管中,按试验步骤所述方法操作,根据吸光度在标准曲线上查出样品的浓度。
在应用中,由于原料长期保持稳定等原因,精盐水中的碘含量很稳定。利用待测样品干扰物质较少、方法线性好的特点,用标准加入法求得待测物质中的碘含量,进一步简化分析步骤,提高分析速度。取两份各15.00 mL待测的样品,向其中一份加入一定量的KI标准溶液,其余按试验方法所述步骤操作。按照下式计算待测样品碘含量:
其中:Cx为待测样品碘含量,g/L;Ax为待测样品吸光度;Gb为加入的KI标准溶液中碘的质量,g;Ab+x为标准加入后待测样品吸光度;0.015为取样量,L。
3 结论
碘-淀粉络合显色反应中酸度是关键,并且会受到基体物质的影响,需要根据具体的待测体系而确定。在饱和精盐水体系中,甲酸钠依然会与碘反应,这一点试验已经证明;但是本文中通过磷酸与甲酸钠的配合试验,验证了甲酸钠无需加热除去,并能够与磷酸配合达到最后的显色体系酸度,在测定周期内不会影响测定结果。在实际工作中,简单快捷往往是检测方法的首选,本方法简单易掌握,检出限和精密度均能够达到现场快速测定的需要。
