指纹图谱结合一测多评法测定金银花叶的化学成分
2022-11-09宁二娟张丽先李智宁
宁二娟, 张丽先, 陈 玲, 李智宁, 王 伟, 李 晓
(河南省科学院河南省纳普生物技术有限公司,郑州 450002)
金银花是忍冬科(Caprifoliaceae)忍冬(Lonicera japonicaThunb.)的花蕾或带初开的花,和忍冬藤皆为我国传统中药. 金银花叶为金银花和忍冬藤的副产物,产量远大于金银花. 金银花叶中富含环烯醚萜类、黄酮类、酚酸类等成分[1-3],具有抗氧化、抑菌消炎、清热解毒等药理活性[4-6].
目前,关于金银花叶成分含量测定的研究多集中在酚酸类和黄酮类成分[7-8],对环烯醚萜类成分的研究相对较少. 本研究将指纹图谱和多指标成分测定方法相结合,建立金银花叶的高效液相指纹图谱. 采用一测多评法(Quantitative Analysis of Multi-components by Single Marker,QAMS),选用绿原酸为参照物,并建立其与新绿原酸、断氧化马钱苷酸、断马钱子酸、马钱苷、断氧化马钱子苷、鞣花酸、木犀草苷、异绿原酸B、异绿原酸A、野漆树苷及异绿原酸C的相对校正因子,从一年12个月份中的金银花叶中首次发现断氧化马钱苷酸,并对金银花叶中的断氧化马钱苷酸、断马钱子酸和断氧化马钱子苷含量进行了测定,为金银花叶的质量控制以及采收期提供数据分析及理论依据.
1 仪器与试药
1.1 仪器
Agilent 1260 InfinityⅡ高效液相系统(PDA/UV)、Agilent 1290 型液相色谱-6460 型三重串联四极杆质谱系统(包括DAD)、Shimadzu LC-20AD 高效液相系统(UV).
1.2 对照品
木犀草苷(批号111720-201810,质量分数93.5%)、异绿原酸C(批号111894-202103,质量分数95.2%)、绿原酸(批号110753-202018,质量分数96.1%)、马钱苷(批号111640-201707,质量分数99.2%)、鞣花酸(批号111959-201903,质量分数88.8%),购于中国食品药品检定研究院;断氧化马钱子苷(批号21061505,质量分数98.16%),购于成都格利普生物科技公司;野漆树苷(批号17061305,质量分数≥98%)、异绿原酸B(批号21012902,质量分数98.68%),购于成都普菲德公司;新绿原酸(批号wkq18030107,质量分数≥98%)、异绿原酸A(批号wkq18090301,质量分数≥98%),购于四川维克奇生物科技有限公司;断马钱子酸(批号CFS201802,质量分数≥98%),购于武汉中标科技公司;断氧化马钱苷酸(批号PRF21102243,质量分数≥98%),购于成都普瑞法科技公司.
1.3 试剂
乙酸、甲醇、乙醇均为分析纯;色谱乙腈,购于赛默飞世尔科技公司.
1.4 样本
样本采自河南封丘同一地块的金银花叶(一年中每个月采一次,分别标记),于通风处阴干;经河南省科学院赵天增研究员鉴定确为忍冬科(Caprifoliaceae)忍冬(Lonicera japonicaThunb.)的叶子(表1).

表1 金银花叶样本Tab.1 12 batches of leaves of Lonicera japonica from Fengqiu area
2 方法与结果
2.1 色谱条件
Agilent色谱柱:型号Eclipse XDB-C18(250×4.6 mm,5 μm).
流动相:乙腈(A)-0.1%乙酸水(B). 梯度条件:0~20 min,A5%~17%,B95%~83%;20~26 min,A17%,B83%;26~35 min,A17%~21%,B83%~79%;35~40 min,A21%~25%,B79%~75%.
柱温30 ℃,流速1.0 mL/min,检测波长240 nm,进样体积10 μL.
2.2 混合对照品溶液的制备
称取新绿原酸、绿原酸、断氧化马钱苷酸、断马钱子酸、马钱苷、断氧化马钱子苷、鞣花酸、木犀草苷、异绿原酸B、异绿原酸A、野漆树苷及异绿原酸C对照品于同一量瓶中,加入甲醇溶解并定容至刻度处,摇匀,即得混合对照品储备液. 吸取此储备液适量于另一20 mL量瓶中,加入甲醇稀释至刻度,得混合对照品溶液.
2.3 样品溶液的制备
阴干的金银花叶研为细粉过3号筛. 取粉末状金银花叶0.5 g置三角瓶中,加入50%乙醇溶液50 mL并称重;超声30 min,放至室温,再称重,用50%乙醇溶液补重,摇匀,经0.45 μm滤膜,即得样品溶液.
混合对照品溶液和样品溶液的HPLC图谱见图1.
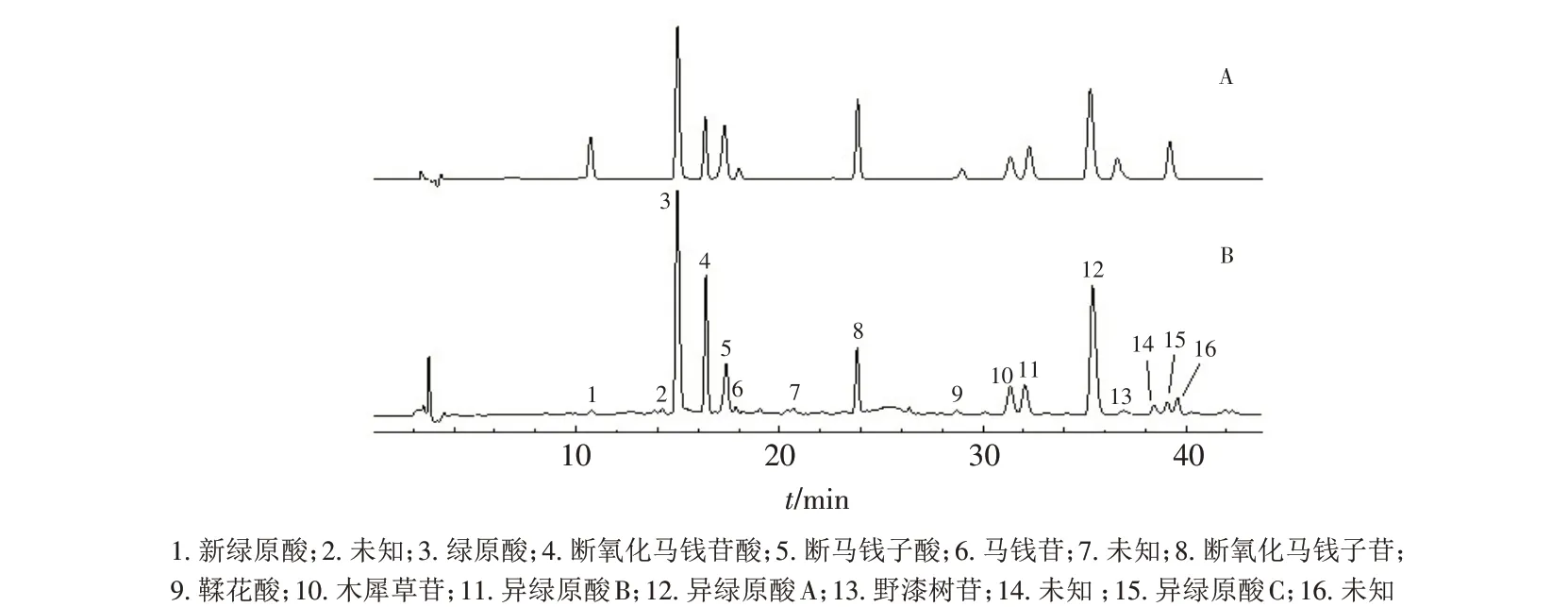
图1 混合对照品和样品的HPLC 色谱图Fig.1 HPLC chromatograms of reference substance solution and sample solution
2.4 方法学考察
2.4.1 线性范围考察
线性系列溶液:吸取混合对照品储备液0.1、0.2、0.5、1 mL,分别置于20、20、10、5 mL量瓶中,加入甲醇至刻度,摇匀,标记为线性①、②、③、⑤溶液;以“2.2”项下的混合对照品溶液为线性④溶液.
吸取以上线性溶液进样测定,以峰面积为纵坐标(Y),进样浓度为横坐标(X),得回归方程和相关系数如表2.
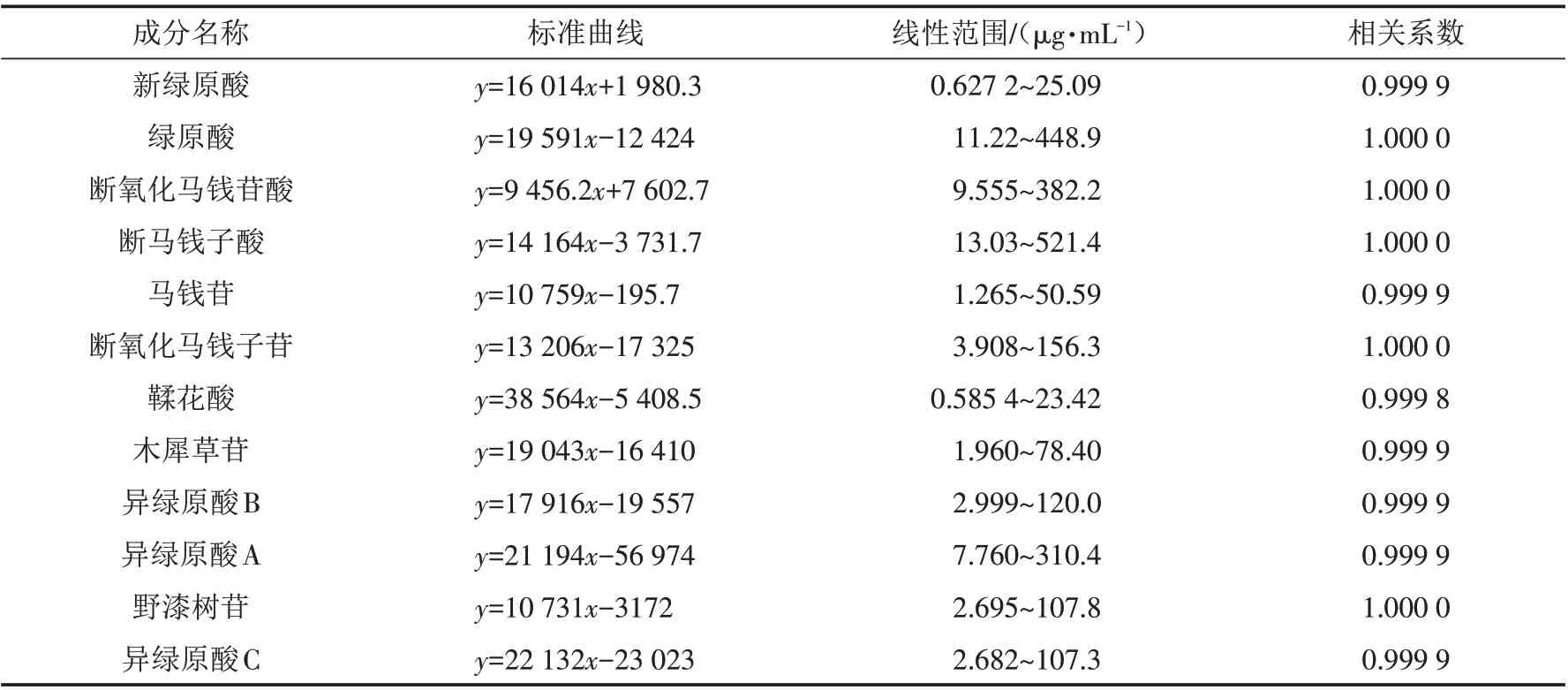
表2 金银花叶中12种成分的线性回归方程Tab.2 Linear regression equations of 12 components in Lonicera japonica leaves
2.4.2 精密度试验
取线性④溶液,连续进样测定6次,结果12种成分对照品的RSD值依次为1.86%、0.74%、0.91%、1.02%、1.25%、1.90%、1.37%、1.77%、1.13%、1.30%、1.46%、1.55%,表明该仪器的精密度良好.
2.4.3 重复性试验
取金银花叶(S4),平行制得6份样品溶液,进样测定,用外标法分别计算各指标成分的含量. 得12种成分的质量分数依次为0.045%、2.056%、1.770%、0.607%、0.033%、0.650%、0.016%、0.328%、0.355%、1.421%、0.236%、0.080%;RSD 值分别为2.63%、0.61%、0.77%、0.89%、1.95%、1.32%、2.54%、1.70%、1.58%、1.02%、1.83%、1.94%.
2.4.4 稳定性试验
取金银花叶(S4)的同一个样品溶液,分别于0、l、2、4、6、8、12 h 时进样测定,计算各指标成分峰面积的RSD 值,结果12 种成分的峰面积RSD 值依次为2.51%、0.95%、1.21%、1.36%、1.81%、1.07%、2.87%、1.71%、1.22%、2.06%、1.69%、1.44%,表明样品溶液在12 h内稳定.
2.4.5 加样回收率试验
称取金银花叶(S4)样品6份,每份0.25 g,置于三角瓶中;分别加入各对照品(新绿原酸0.112 mg、绿原酸5.013 mg、断氧化马钱苷酸4.216 mg、断马钱子酸1.510 mg、马钱苷0.080 mg、断氧化马钱子苷1.615 mg、鞣花酸0.042 mg、木犀草苷0.814 mg、异绿原酸B 0.890 mg、异绿原酸A 3.452 mg 野漆树苷0.603 mg和异绿原酸C 0.198 mg),按“2.3项”(样品溶液的制备)的方法制备溶液并进样测定;计算各加样对照品中12种成分的回收率,得结果依次为98.81%、99.54%、99.41%、98.92%、97.92%、99.18%、98.02%、99.33%、99.07%、99.18%、97.79%、98.96%;RSD 值分别为3.16%、1.11%、1.52%、2.57%、2.24%、1.60%、2.38%、2.52%、2.09%、1.82%、1.54%、1.93%;表明准确度良好.
2.5 指纹图谱的研究
分别称取S1~S12样品,按“2.3项”(样品溶液的制备)的方法制备溶液并进样测定,记录色谱图. 将12批样品的色谱图全谱导入“中药指纹图谱相似度评价系统”[9],采用中位数法生成对照谱图. 选取S4 作为参照图谱(R),并进行色谱峰自动匹配及相似度分析,生成金银花叶指纹图谱的共有模式(图2). 最终确定图谱中有16个共有峰,指认出其中的12个峰,分别为新绿原酸、绿原酸、断氧化马钱苷酸、断马钱子酸、马钱苷、断氧化马钱子苷、鞣花酸、木犀草苷、异绿原酸B、异绿原酸A、野漆树苷及异绿原酸C,12批金银花叶色谱图与对照指纹图谱相似度分别为0.957、0.976、0.981、0.976、0.957、0.973、0.931、0.955、0.995、0.925、0.963、0.949.
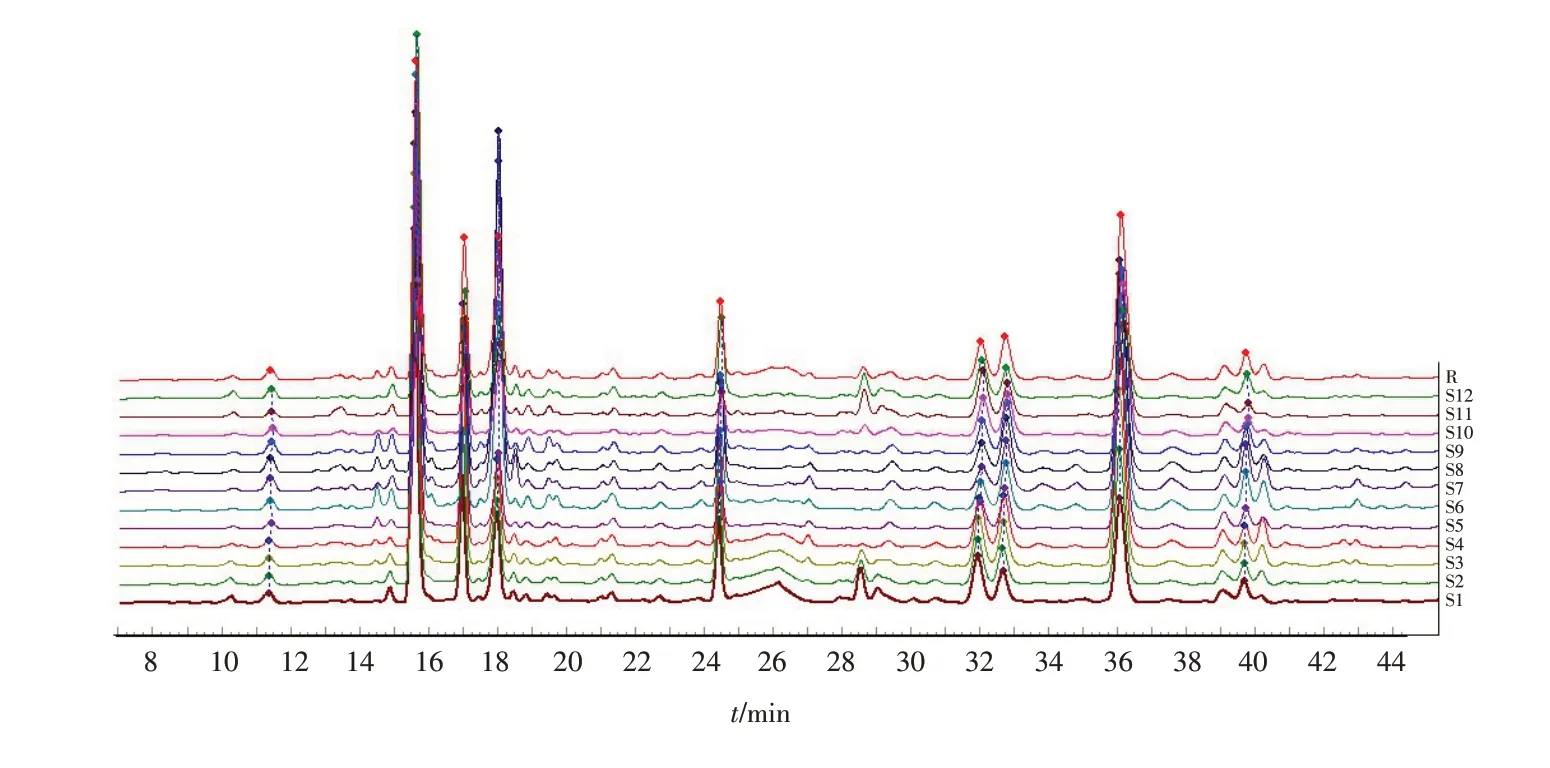
图2 12批金银花叶样品指纹图谱Fig.2 HPLC fingerprints of 12 batches of Lonicera japonica leaves
2.6 QAMS法测定12种成分含量
2.6.1 相对校正因子的计算
据线性溶液中各对照品的含量及对应峰面积,以绿原酸为内标(S),分别计算得新绿原酸、断氧化马钱苷酸、断马钱子酸、马钱苷、断氧化马钱子苷、鞣花酸、木犀草苷、异绿原酸B、异绿原酸A、野漆树苷及异绿原酸C 11种成分的相对校正因子系数. 结果见表3.
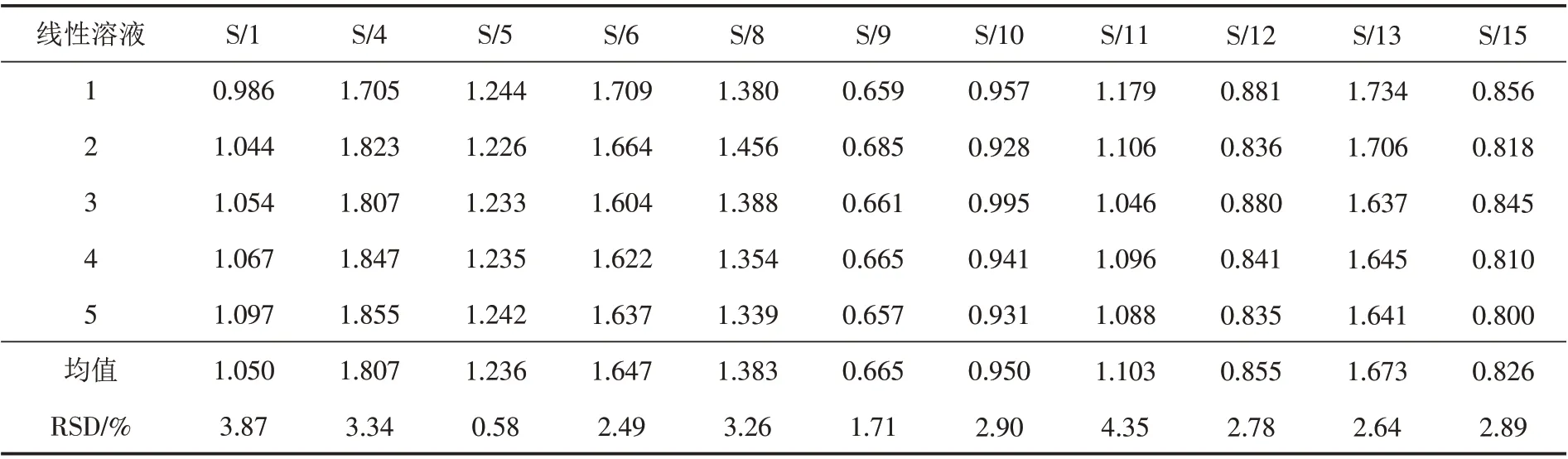
表3 金银花叶中11种成分的相对校正因子系数Tab.3 Relative correction factor coefficients of 11 components in Lonicera japonica leaves
2.6.2 不同仪器时相对校正因子的考察
分别考察3种HPLC系统(Shimadzu LC-20AD、Agilent 1260-UV、Agilent 1260-DAD)的相对校正因子.结果显示,3种HPLC系统中的新绿原酸、断氧化马钱苷酸、断马钱子酸、马钱苷、断氧化马钱子苷、鞣花酸、木犀草苷、异绿原酸B、异绿原酸A、野漆树苷及异绿原酸C与内标物绿原酸的相对校正因子RSD分别为4.25%、3.76%、1.60%、2.95%、3.72%、2.26%、3.07%、4.51%、3.18%、3.04%和2.96%,校正因子重现性良好.
2.6.3 不同色谱柱时相对校正因子的考察
用Agilent 1260 型HPLC 系统,分别考察3 种不同色谱柱(Agilent Eclipse XDB-C18、Agilent ZORBAX SB C18、Phenomenex Luna C18)的相对校正因子. 结果显示,3 种色谱柱的新绿原酸、断氧化马钱苷酸、断马钱子酸、马钱苷、断氧化马钱子苷、鞣花酸、木犀草苷、异绿原酸B、异绿原酸A、野漆树苷及异绿原酸C与内标物绿原酸的相对校正因子RSD分别为4.10%、3.54%、1.43%、2.17%、3.65%、1.85%、3.25%、4.77%、3.06%、2.94%和2.51%,校正因子重现性良好.
2.7 QAMS法和外标法测定结果的比较
采取QAMS 法和外标法(ESM)对12 批金银花叶中的12 种成分含量进行测定(表4). 两种方法结果经t检验无显著性差异(P>0.05).
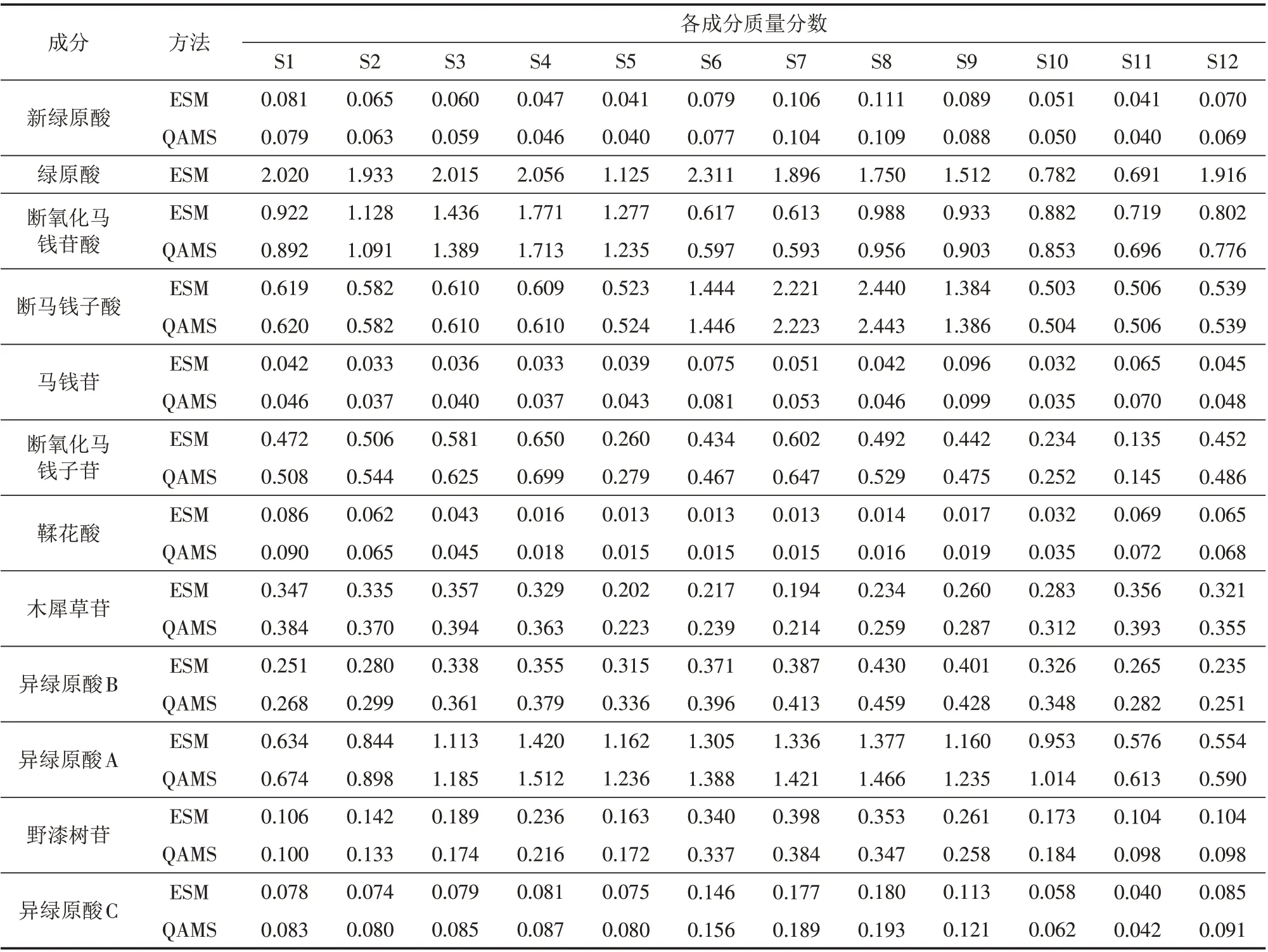
表4 金银花叶中12种成分的含量(n=3,RSD<2%)Tab.4 Contents of 12 components in Lonicera japonica leaves determinated by the methods of QAMS and ESM单位:%
3 讨论
本研究对金银花叶检测的色谱条件进行了选择和优化,在前期金银花叶研究的试验基础上[10],采用乙腈-乙酸溶液为流动相,考察了不同乙酸浓度(0.1%、0.5%、1.0%)下的色谱图. 结果显示,在乙腈-0.1%乙酸水溶液梯度洗脱程序下,流动相满足各色谱峰分离度要求,各峰峰型良好. 采用DAD对样品溶液全波长扫描,发现断氧化马钱苷酸、断马钱子酸、断氧化马钱子苷的最大吸收波长分别为234、244、240 nm;木犀草苷的最大吸收波长为348 nm和252 nm;有机酸类成分的最大吸收波长为327 nm,但是在220~240 nm处仍有较好吸收;为兼顾样品中的所有成分,在同一波长下检测实现多指标成分的准确定量测定,综合考虑了目标色谱峰响应值和分离度,最终选择240 nm 作为检测波长. 色谱柱考察了Diamonsil Plus C18、Agilent Eclipse XDB-C18、Agilent ZORBAX SB-C18,最后选择Agilent Eclipse XDB-C18柱,峰型、分离度均较好.
参考2020年《中华人民共和国药典》金银花项下金银花药材的检测方法[11],样品选择超声提取,考察了水和30%、50%、70%、95%乙醇作为提取溶剂,发现用50%乙醇作为提取溶剂时,各成分提取率高.
本研究建立了HPLC法同时测定金银花叶中新绿原酸、绿原酸、异绿原酸B、异绿原酸A、异绿原酸C、鞣花酸、断氧化马钱苷酸、断马钱子酸、马钱苷、断氧化马钱子苷、木犀草苷及野漆树苷12种成分,以绿原酸为参照物,采用一测多评法对其他11种成分同时测定,确定了其相对校正因子,且不同条件下相对校正因子重现性良好,对同一产地12个月采摘的金银花叶进行测定,发现外标法和QAMS法测定12种成分含量无明显差异. 12批金银花叶的指纹图谱相似度>0.925,得到16个共有峰.
经本试验提取、分析并定量测定的金银花叶12 种成分,经过HPLC-MS 检测第4 个峰的分子质量为390.0;通过参考文献[12]和标准品验证,发现此峰为断氧化马钱苷酸,为首次从金银花叶分离得到. 绿原酸为有机酸类中的主要成分,其在金银花叶中的含量1—4月呈上升趋势,5月有所下降,6月达到一年中最高值. 经分析,绿原酸的含量的这种变化可能与不同时期金银花的生长存在密切联系:封丘金银花在5 月开花,绿原酸从叶向花中转移,从而造成在叶子中含量降低;6月,由于光照时间长,光合作用增强,叶子中又生成大量的绿原酸,故出现这种现象. 断氧化马钱苷酸、断马钱子酸和断氧化马钱子苷属环烯醚萜苷类,已有研究表明,环烯醚萜苷类具有良好的抗病毒活性[13-14],其总量的变化与花中成分的转移关系不大,推断其总量主要受植物生长期的影响.
通过表4也可以看出,4—8月金银花叶中各成分的含量较高,金银花的剪枝多在每年的5—8月采花后,目的是促进形成多茬花,提高产量[15]. 因此,建议采摘金银花叶的时间可以在每年的采花后进行,此时不但其叶片中各种有效成分含量高,还可以提高金银花的产量.
