不同甜叶菊品种叶中绿原酸类成分的比较研究
2020-07-04郭志龙马治华张虹陈任张自萍
郭志龙 马治华 张虹 陈任 张自萍
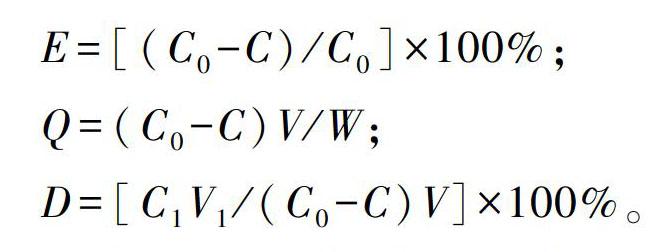
摘 要: 該文以14个扦插培育的甜叶菊品种叶为材料,从8种不同型号的树脂中筛选出一种合适的大孔吸附树脂对甜叶菊叶中绿原酸类成分进行纯化前处理,采用HPLC法对不同甜叶菊品种叶中所含绿原酸类成分进行比较分析。结果表明:(1)在8种不同型号的树脂中,XAD-16对甜叶菊叶中绿原酸类成分吸附-解析性能最佳。(2)经优化,上样液浓度1.20 mg·mL-1、样品溶液pH 3、解析液乙醇体积分数70%时XAD-16树脂对甜叶菊叶中绿原酸类成分具有较好的纯化效果。(3)HPLC检测分析表明,在14个品种中共检测出新绿原酸、绿原酸、隐绿原酸、异绿原酸B、异绿原酸A、异绿原酸C六种绿原酸类成分,其中主要成分均为异绿原酸A、绿原酸、异绿原酸C,而在品种3、5、13、14中没有检测出异绿原酸B。(4)14个品种中6个绿原酸类成分的含量分别为异绿原酸 A 20.55~54.3 mg·g-1、绿原酸17.96~32.93 mg·g-1、异绿原酸C 4.15~19.49 mg·g-1、新原酸0.61~4.61 mg·g-1、隐绿原酸0.52~3.11 mg·g-1、异绿原酸B 0.0~3.17 mg·g-1,6种绿原酸类成分总量为43.9~97.8 mg·g-1。可见,不同品种甜叶菊叶中绿原酸类成分含量有明显差异,富含绿原酸类成分的甜叶菊品种可用于开发获取绿原酸类物质。
关键词: 甜叶菊, 绿原酸类成分, 甜叶菊叶, XAD-16树脂
中图分类号: Q945
文献标识码: A
文章编号: 1000-3142(2020)05-0696-10
Variation of chlorogenic acid components in leaves of various Stevia rebaudiana cultivars
GUO Zhilong, MA Zhihua, ZHANG Hong, CHEN Ren, ZHANG Ziping*
( Key Laboratory of Ministry of Education for Conservation and Utilization of Special Biological Resources in the West, Ningxia University, Yinchuan 750021, China )
Abstract: The leaves of 14 Stevia rebaudiana cultivars cultured by cuttings were used as experimental materials. Firstly, a suitable macroporous adsorption resin was screened from eight different types of resins to purify chlorogenic acid components in Stevia rebaudiana leaves. Then, the chlorogenic acid components contained in the leaves of different S. rebaudiana cultivars were compared and analyzed by HPLC in order to screen the S. rebaudiana with high chlorogenic acid components. The results were as follows: (1) Among the eight tested resins, XAD-16 showed much better adsorption/desorption capacity for chlorogenic acid components. (2) XAD-16 resin had better purification effect on the chlorogenic acid components in the leaves of S. rebaudiana when the concentration of sample solution was 1.20 mg·g-1 with pH 3 and 70% (v/v) ethanol used as desorption solution. (3) HPLC analysis showed that six kinds of chlorogenic acids were detected in the leaves of 14 S. rebaudiana cultivars, including neochlorogenic acid, chlorogenic acid, cryptochlorogenic acid, isochlorogenic acid B, isochlorogenic acid A and isochlorogenic acid C. The main components were isochlorogenic acid A, chlorogenic acid and isochlorogenic acid C, but no isochlorogenic acid B was detected in varieties 3, 5, 13 and 14. (4) The contents of six chlorogenic acids in the leaves of 14 S. rebaudiana cultivars were 20.55-54.3 mg·g-1 ( isochlorogenic acid A ), 17.96-32.93 mg·g-1 ( chlorogenic acid ), 4.15-19.49 mg·g-1 ( isochlorogenic acid C ), 0.61-4.61 mg·g-1 ( neochlorogenic acid ), 0.52-3.11 mg·g-1 ( cryptochlorogenic acid ), 0.0-3.17 mg·g-1 ( isochlorogenic acid B ), respectively, and the total amount of six chlorogenic acids was 43.9-97.8 mg·g-1. The research results suggest that different varieties of S. rebaudiana cultivars contain different contents of chlorogenic acids, and the S. rebau-diana cultivars rich in chlorogenic acids can be used to develop and obtain chlorogenic acids. The resarch can provide a basis for expanding the development and utilization of S. rebaudiana.
Key words: Stevia rebaudiana, chlorogenic acids, leaves of Stevia rebaudiana cultivars, XAD-16 resin
甜叶菊(Stevia rebaudiana)为一种原产于南美亚热带地区的多年生草本植物,我国于20世纪70年代引进栽培,目前在我国南北方地区均有种植(丁海荣等,2016)。其叶片中含有多种低热量、高甜度的甜菊糖苷,被誉为最有发展前途的新糖源,已在食品、饮料等行业得到广泛应用(Samueli et al., 2018)。此外,近年来研究发现甜叶菊提取物具有抗氧化、抗炎、降血糖、降血压等多种功效(Kim et al., 2011;刘乃新等,2016),研究表明这些功效可能更多地与其所含绿原酸等酚酸类物质有关(Molina-Calle et al., 2017)。绿原酸类物质是由咖啡酸与奎尼酸组成的一类缩酚酸类化合物,具有抗菌、抗氧化、抑癌、调控糖脂代谢等多种生物学活性(赵昱等,2006),已被应用于食品、保健品、日用化工等领域,但目前主要从金银花、杜仲叶、咖啡豆等植物中获取绿原酸类物质,原材料来源有限,成本较高(席利莎等,2014)。现有研究表明甜叶菊中除含有高含量的甜菊糖苷外还含有丰富的绿原酸类物质,其整株均含有绿原酸、异绿原酸A和异绿原酸C,以叶片含量最高,叶中绿原酸类成分含量高达52.69 mg·g-1(付晓等,2014);Karakose et al.(2011)采用LC-MS在甜叶菊中发现了24种奎尼酸和莽草酸的羟基肉桂酸衍生物;额尔敦巴雅尔等(2017)采用UPLC-QTOF-MS在甜叶菊水提物中检测出10种酚酸类物质;Hande et al.(2015)在甜叶菊叶中检测出5种绿原酸类成分;李华丽等(2017)测定不同产地甜叶菊中酚酸类成分含量最高可达6.726%。
近年来,大孔吸附树脂在天然产物领域应用十分广泛,如王立志等(2014)采用DM700树脂用于纯化绿咖啡豆中的绿原酸,熊硕等(2013)选用NKA-2树脂对杜仲中绿原酸成分进行了纯化研究,但鲜有树脂纯化处理甜叶菊中綠原酸类成分相关方面的研究报道。在甜叶菊中除含有绿原酸类成分外,还含有碳水化合物、生物碱、植物色素等其他杂质成分(刘乃新等,2016),直接进行分析不仅影响测定结果准确性,而且会对检测系统产生较大污染。因此,本文以紫外分光光度法测定绿原酸类成分总量,以HPLC法测定不同种类绿原酸类成分含量,先筛选合适的大孔吸附树脂对甜叶菊叶中绿原酸类成分纯化前处理,继而对14个不同甜叶菊品种叶中所含绿原酸类成分进行比较分析,以期筛选出有较高含量绿原酸类物质的甜叶菊品种,为扩大甜叶菊的开发利用提供依据。
1 材料与方法
1.1 材料
14个甜叶菊品种是由宁夏优势特色作物现代分子育种重点实验室利用植物培养专用智能温室扦插培育的,包括目前生产上常用的9个品种及张虹等(2017)以秋水仙素诱导处理中山二号种子获得的5个四倍体品种。甜叶菊叶自然阴干后,粉碎过40目筛处理。
1.2 试剂和仪器
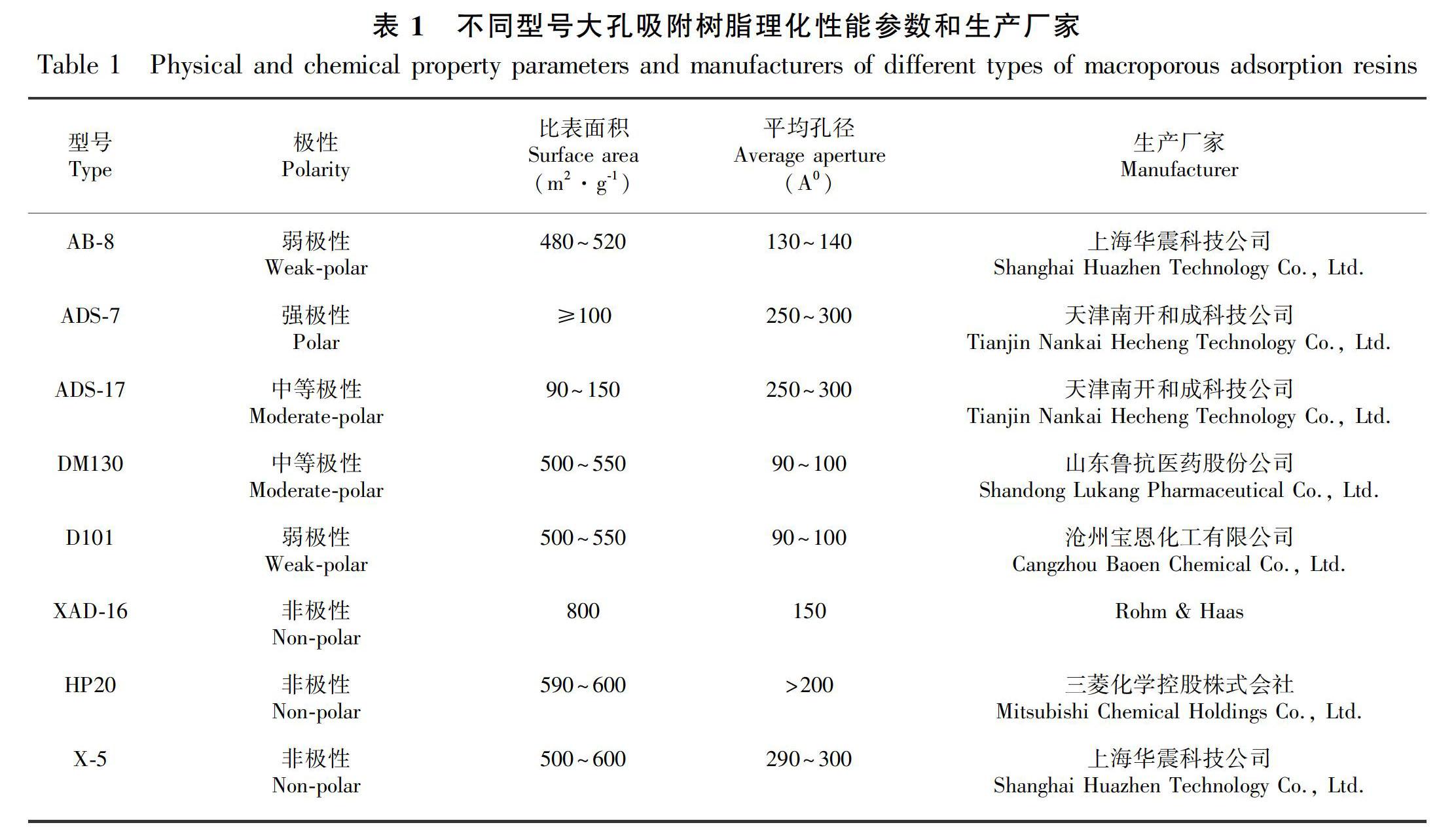
绿原酸(批号MUST-15041814)、隐绿原酸(批号MUST-17022403)、新绿原酸(批号MUST-17011001)、异绿原酸A(批号MUST-17030621)、异绿原酸B(批号MUST-17021602)、异绿原酸C(批号MUST-17021603)标准品均购自成都曼斯特生物科技有限公司;咖啡酸(批号170406)、阿魏酸(批号170106)标准品购自成都植标化纯生物技术有限公司,质量分数均大于98%;色谱纯乙腈,Fisher公司;冰乙酸,天津市永大化学试剂开发中心;水为娃哈哈饮用纯净水;其余试剂均为分析纯。不同型号大孔吸附树脂理化性能参数及生产厂家如表1所示。
U-5100型紫外可见分光光度计, 日本日立公司;CQ-250-DST型超声波清洗机,上海跃进医用光学器械厂;DELTA-320 pH计、AL204型电子天平,梅特勒-托利多仪器有限公司;RE-52A旋转蒸发仪,上海亚荣生化仪器厂;SHA-B双功能水浴恒温振荡器,杰瑞尔电器有限公司;SHB-IV双A循环水式多用真空泵,郑州长城科工贸有限公司;Sorvall ST-8型离心机,美国Thermo公司;Waters 2695高效液相色谱仪、2998检测器,沃特世科技(上海)有限公司。
1.3 样品溶液制备
取甜叶菊叶粉末0.1 g,加60%乙醇水5 mL,60 ℃条件下超声提取25 min,提取3次,离心取上清液,合并上清液过滤,收集滤液于25 mL容量瓶并定容至刻度,备用。
1.4 紫外分光光度法
参考钟方晓(2005)的紫外分光光度法,以绿原酸为标准品,在波长327 nm处测定甜叶菊叶中绿原酸类成分的总量。
1.5 高效液相色谱法
借鉴李华丽等(2017)测定甜叶菊中6个酚酸类成分的HPLC方法并对其优化。
1.5.1 色谱条件 Waters SunFire C18色谱柱(150 mm × 4.6 mm,5 μm),流动相A为乙腈,B为1%乙酸水溶液,梯度洗脱(0~15 min,8% A~17% A,1.0 mL·min-1;15~22.5 min,17% A ~17.5% A,1.0~0.6 mL·min-1;22.5~30 min,17.5% A~18% A,0.6 mL·min-1;30~40 min,18% A~20% A,0.6 mL·min-1;40~42 min,20% A~24% A,0.6~1.0 mL·min-1;42~50 min,24% A~40% A,1.0 mL·min-1;50~65 min,40% A~40.2% A,1.0 mL·min-1),柱温30 ℃,进样量10 μL,波长330 nm。
精密度试验中新绿原酸、绿原酸、隐绿原酸、异绿原酸A、异绿原酸B、异绿原酸C的RSD值在0.53%~0.91%之间,表明该仪器精密度良好;重复性试验中新绿原酸、绿原酸、隐绿原酸、异绿原酸A、异绿原酸B、异绿原酸C的RSD值在0.93%~1.81%之间,表明该方法重复性良好;稳定性试验中新绿原酸、绿原酸、隐绿原酸、异绿原酸A、异绿原酸B、异绿原酸C的RSD值在0.95%~1.74%之间,表明样品溶液在24 h内保持稳定;回收率试验中新绿原酸、绿原酸、隐绿原酸、异绿原酸A、异绿原酸B、异绿原酸C的平均回收率在95.1%~104.8%之间。
2.2 树脂型号的筛选
以紫外分光光度法所测绿原酸类成分的总量为指标,表2结果表明,八种不同极性的树脂中强极性树脂ADS-7对甜叶菊叶中绿原酸类成分吸附率和吸附量最高,但其解析率过低;非极性的XAD-16树脂吸附能力略低于ADS-7树脂,却表现出最佳解吸附能力。因此,选择XAD-16树脂对甜叶菊叶中绿原酸类物质前处理。
2.3 XAD-16吸附与解析性能的优化
2.3.1 样品溶液浓度对XAD-16吸附性能的影响 0.3、0.6、1.2、2.4、3.6 mg·mL-15个不同样品溶液浓度条件下XAD-16对甜叶菊中绿原酸类成分的吸附率分别为89.0%、88.5%、90.1%、85.2%、76.0%。可以看出,上样浓度低于1.2mg·mL-1时对XAD-16树脂的吸附能力几乎没有影响,当上样浓度大于1.2 mg·mL-1时,XAD-16树脂吸附率逐渐下降。因此,样品溶液浓度以1.2 mg·mL-1最佳。
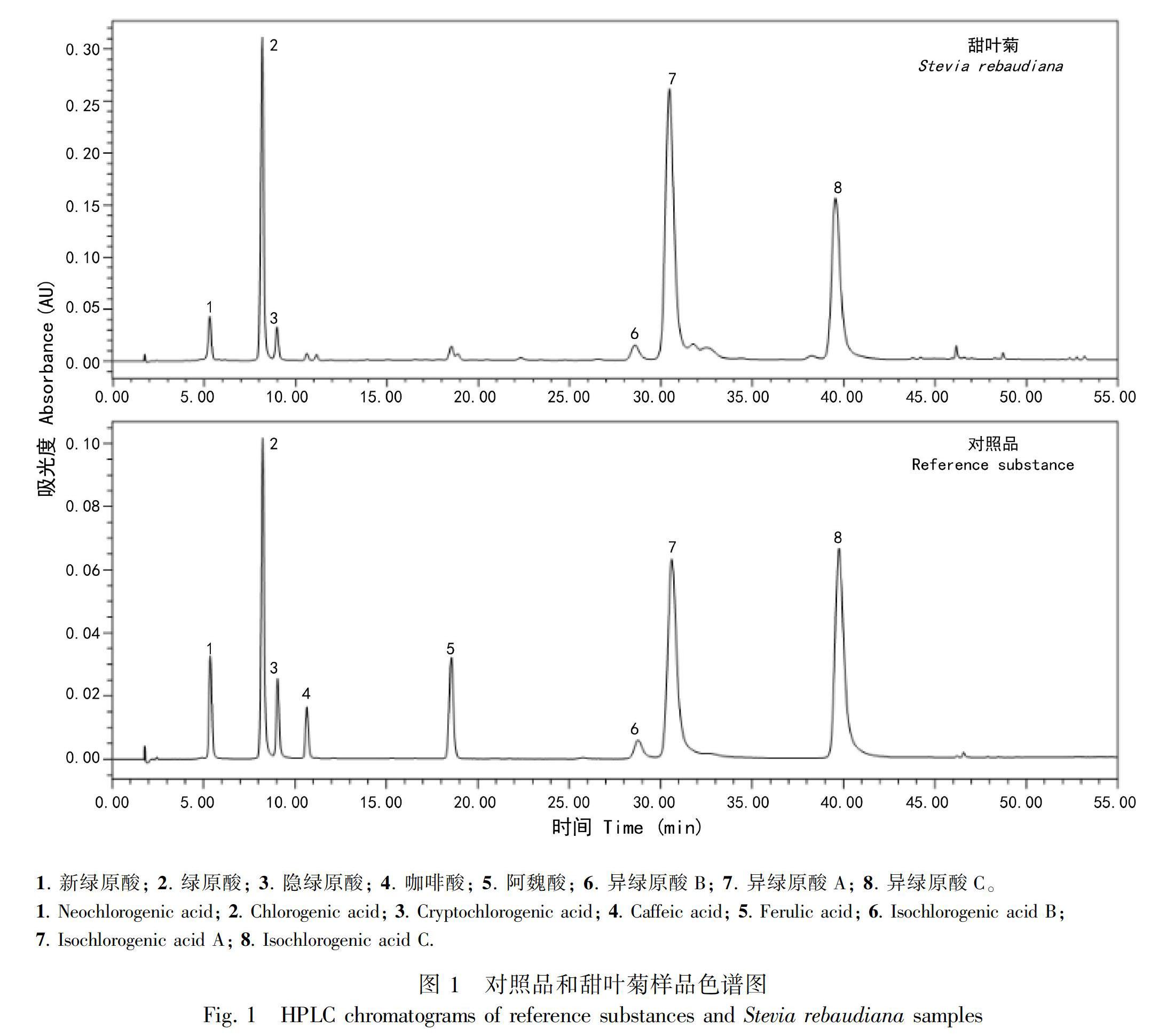
2.3.2 样品溶液pH对XAD-16树脂吸附性能的影响 当我们采用HPLC分析XAD-16吸附前后样品溶液中绿原酸类成分的情况后,发现XAD-16对不同种类绿原酸类成分吸附能力不同。如图2所示,吸附前可检测到样品溶液(pH 5.6)中含有多种绿原酸类成分,吸附后几乎检测不到异绿原酸A、异绿原酸C等成分(对应的色谱峰为6、7、8),只检测到绿原酸、新绿原酸、隐绿原酸成分(对应的色谱峰为1、2、3),表明在pH 5.6时XAD-16对其中的异绿原酸A、异绿原酸C等成分的吸附能力强,而对绿原酸、新绿原酸、隐绿原酸成分的吸附能力较差。绿原酸类化合物是一类含有羟基和邻二酚羟基的有机酚酸,研究表明酸性条件下有利于酚酸类化合物在大孔吸附树脂上的吸附(Zhang et al., 2008)。因此, 我们进一步通过调节样品溶液pH考察甜叶菊叶中绿原酸类成分在XAD-16树脂上的吸附能力。
通过考察样品溶液pH对XAD-16树脂吸附性能的影响(图3),发现不同pH条件下异绿原酸A、异绿原酸C等成分在XAD-16上均有较好的吸附效果,XAD-16对绿原酸、新绿原酸、隐绿原酸的吸附能力随pH值降低逐渐增强,表现在随着pH值的降低,吸附后样品溶液中绿原酸、新绿原酸、隐绿原酸成分含量逐渐降低,其中绿原酸含量降低最为明显(对应的色谱峰为2)。提示经pH 3处理后,总体上增强了XAD-16对甜叶菊叶中绿原酸类成分的吸附能力。因此, 选择pH 3条件下进行甜叶菊叶中绿原酸类成分的吸附。
2.3.3 乙醇体积分数对XAD-16树脂解析性能的影响 10%、 30%、60%、70%、90% 5个不同乙醇浓度条件下XAD-16树脂的解析率分别为12.8%、52.6%、80.7%、92.8%、88.2%。结果表明,不同体积分数的乙醇对绿原酸类物质的解析产生较大影响,随着乙醇体积分数的增加,绿原酸类物质的解析率先上升后下降,70%乙醇时最高达到92.8%。乙醇体积分数较低时,随着解析液极性性质逐渐减弱,有利于目标组分的洗脱,而过高体积分数的乙醇会把杂质成分洗脱下来从而导致解析率下降(Sun et al., 2013)。因此,选择70%体积分数的乙醇作为洗脱液进行解吸附。
2.4 14个甜叶菊品种叶中绿原酸类成分含量测定
以HPLC法测定14个不同品种甜叶菊中绿原酸类物质,结果见表3。从表3可以看出,在成分种类方面,14个甜叶菊品种中都含有新绿原酸、绿原酸、隐绿原酸、异绿原酸A和异绿原酸C,其中主要组成成分均为绿原酸、异绿原酸A、异绿原酸C,而新绿原酸、隐绿原酸、异绿原酸B含量相对较少,在品种3、5、13、14中没有检测出异绿原酸B成分。14个品种中6种绿原酸類物质总量介于4.39%~9.78%之间,含量最高的为品种1,其中异绿原酸A含量在20.55~54.3 mg·g-1之间,含量最高的为品种3;绿原酸含量在17.96~32.93 mg·g-1之间,含量最高的为品种10;异绿原酸C含量在4.15~19.49 mg·g-1之间,含量最高的为品种8;新绿原酸含量在0.61~4.61 mg·g-1之间,含量最高的为品种1;隐绿原酸含量在0.52~3.11 mg·g-1之间,含量最高的为品种1;异绿原酸B含量在0~3.17mg·g-1之间,含量最高的为品种1。
3 讨论
大孔吸附树脂具有工艺简单、成本相对较低以及可重复使用等优点,已被广泛应用于多酚类、黄酮类等天然产物的分离纯化(黄燕秋,2018)。本文首次采用大孔吸附树脂对甜叶菊叶中绿原酸类成分进行纯化处理,在8种不同型号的树脂中XAD-16具有较大的比表面积,对甜叶菊叶中绿原酸类成分总体上表现出较好吸附及解吸附能力。大孔吸附树脂以物理吸附为主,本研究发现XAD-16对不同种类绿原酸类成分吸附能力不同,非极性树脂XAD-16易于吸附极性相对较弱的异绿原酸A、异绿原酸C等组分,而对绿原酸、新绿原酸等极性较强的组分吸附能力较差,通过比较不同pH值对XAD-16树脂吸附性能的影响,发现XAD-16对甜叶菊叶中绿原酸类成分的吸附能力随pH降低逐渐提升,样品溶液pH 3处理后XAD-16对绿原酸、新绿原酸等组分的吸附能力显著提高,总体上增强了XAD-16对甜叶菊叶中绿原酸类成分的吸附能力。此外,确立了XAD-16树脂最佳处理样品溶液浓度为1.2 mg·mL-1,最佳解析液乙醇体积分数为70%。
绿原酸物质是药用植物中非常重要的功效成分(王丽萍等,2011)。本研究发现品种不同会对甜叶菊叶中绿原酸类物质产生较大影响,绿原酸类成分种类及含量均会受到品种差异性的影响。14个品种中多数均含有新绿原酸、绿原酸、隐绿原酸、异绿原酸A、异绿原酸C、异绿原酸B六种酚酸类成分, 而少数品种中只含有新绿原酸、 绿原酸、
隐绿原酸、异绿原酸A、异绿原酸C五种酚酸类成分;14个品种中绿原酸类成分总量最高的品种可达97.8 mg·g-1,最低僅为43.9 mg·g-1,不同种类绿原酸类成分在不同品种中含量高低不同。目前甜叶菊的主要用途是作为糖草使用生产甜菊糖苷甜味剂,有必要对绿原酸类物质含量较高的甜叶菊品种进一步开发研究,丰富绿原酸类物质原材料来源的同时还可促进甜叶菊综合利用。
参考文献:
DING HR, HONG LH, ZHAO BQ, et al., 2016. Main uses of Stevia rebaudianum and current problems in production [J]. Sugar Crop Chin, 38(6): 77-78. [丁海荣, 洪立洲, 赵宝泉, 等, 2016. 甜叶菊主要用途及当前生产中存在的问题 [J]. 中国糖料, 38(6):77-78.]
EERDUN BAYAER, ZHAO PY, JIAO LW, et al., 2017. The study of the differences of compositions between water extract and flocculation supernatant from Stevia rebaudiana [J]. Food Res Dev, 38(18): 143-149. [额尔敦巴雅尔, 赵鹏宇, 焦利卫, 等, 2017. 甜叶菊水提物和絮凝上清液成分差异研究 [J]. 食品研究与开发, 38(18):143-149.]
FU X, YIN ZP, SHANGGUAN XC, et al., 2014. HPLC simultaneous determination of three caffeoylquinic acids in leaves of Stevia rebaudianum Bertoni [J]. Food Sci Technol, 39(8): 276-280. [付晓, 尹忠平, 上官新晨, 等, 2014. HPLC法同时测定甜叶菊中3种绿原酸类化合物 [J]. 食品科技, 39(8):276-280.]
HANDE KS, ANJA M, NIKOLAI K, 2015. Profiling and quantification of phenolics in Stevia rebaudiana leaves [J]. J Agric Food Chem, 63(41): 9188-9198.
HUANG YQ, 2018. The review on macroporous adsorption resin application in the purification studies of traditional chinese medicine [J]. Guangdong Chem Ind, 45(8): 130-132. [黄燕秋, 2018. 孔吸附树脂在中药纯化中的应用进展 [J]. 广东化工, 45(8):130-132.]
KARAKOSE H, JAISWAL R, KUHNERT N, 2011. Characte-rization and quantification of hydroxycinnamate derivatives in Stevia rebaudiana leaves by LC-MSn [J]. J Agric Food Chem, 59(18): 10143-10150.
KIM IS, YANG M, LEE OH, et al., 2011. The antioxidant activity and the bioactive compound content of Stevia rebaudiana water extracts [J]. LWT-Food Sci Technol, 44(5): 1328-1332.
LIU NX, ZHANG WB, WU ZD, et al., 2016. Progress in secondary metabolites and biological functions of Stevia rebaudiana [J]. Sugar Crop Chin, 38(3): 59-60. [刘乃新, 张文彬, 吴则东, 等, 2016. 甜叶菊次生代谢产物及其生物功能研究进展 [J]. 中国糖料, 38(3):59-60.]
LI HL, YUAN J, YU RH, et al., 2017. Determination of six phenolic acids in the leaves of Stevia rebaudiana Bertoni by HPLC [J]. Chin J Pharm Anal, 37(2): 219-223. [李华丽, 袁君, 郁荣华, 等, 2017. HPLC法测定甜叶菊中6个酚酸类成分含量 [J]. 药物分析杂志, 37(2):219-223.]
LIU B, DONG B, YUAN X, et al., 2016. Enrichment and separation of chlorogenic acid from the extract of Eupatorium adenophorum Spreng by macroporous resin [J]. J Chromatogr B Analyt Technol Biomed Life Sci, 1008(1): 58-64.
MOLINA-CALLE M, PRIEGO-CAPOTE F, LUQUE DE CASTRO MD, 2017. Characterization of Stevia leaves by LC-QTOF MS/MS analysis of polar and non-polar extracts [J]. Food Chem, 219(15): 329-338.
SAMUELl P, AYOOB KT, MAGNUSONB A, et al., 2018. Stevia leaf to stevia sweetener: exploring its science, benefits, and future potential [J]. J Nutr, 148(7): 1186-1205.
SUN L, GUO Y, FU C, et al., 2013. Simultaneous separation and purification of total polyphenols, chlorogenic acid and phlorizin from thinned young apples [J]. Food Chem, 136(2): 1022-1029.
WANG LZ, HU XM, FU QS, et al., 2014. Studies on the purification technology of total chlorogenic acid in green coffee beans [J]. Chin Food Add, (7): 123-128. [王立志, 胡晓梅, 付其胜, 等, 2014. 绿咖啡豆中总绿原酸的纯化工艺研究 [J]. 中国食品添加剂, (7):123-128.]
WANG LP, GUO D, WANG G, et al., 2011. Advancement of chlorogenic acid in traditional chinese medicine [J]. Lishizhen Med Mat Med Res, 22(4): 961-963. [王丽萍, 郭栋, 王果, 等, 2011. 中药绿原酸的研究进展 [J]. 时珍国医国药, 22(4):961-963.]
XI LS, MU TH, SUN HN, 2014. Progresses in the research of chlorogenic acids [J]. Acta Agric Nucl Sin, 28(2): 292-301. [席利莎, 木泰华, 孙红男, 2014. 绿原酸类物质的国内外研究进展 [J]. 核农学报, 28(2):292-301.]
XIONG S, CUI L, LIU ZH, et al., 2013. Optimization by orthogonal array design of separation and purification of chlorogenic acid from Eucommia ulmoidues leaves by macroporous adsorption resin [J]. Food Sci, 34(16): 23-26. [熊硕, 崔丽, 刘仲华, 等, 2013. 正交试验优化大孔吸附树脂分离纯化杜仲绿原酸 [J]. 食品科学, 34(16):23-26.]
ZHAO W, ZHAO J, LI XP, et al., 2006. Advances in caffeoylquinic acid research [J]. J Chin Mat Med, 31(11): 869-874. [赵昱, 赵军, 李湘萍, 等, 2006. 咖啡酰奎尼酸类化合物研究进展 [J]. 中国中药杂志, 31(11):869-874.]
ZHANG H, LIU X, HU J, et al., 2017. Induction and identification of polyploidy in Stevia rebaudiana [J]. Mol Plant Breed, 15(3): 1010-1013. [张虹, 刘祥, 虎娟, 等, 2017. 甜叶菊多倍体诱导 [J]. 分子植物育种, 15(3):1010-1013.]
ZHONG FX, 2005. Comparison of method for determination of chlorogenic acid and isochlorogenic acid in honeysuckle by high performance liquid chromatography and ultraviolet spectrophotometry [J]. Lishizhen Med Mat Med Res, 16(3): 212. [钟方晓, 2005. 高效液相及紫外分光光度法测定金银花中绿原酸和异绿原酸含量方法学比较 [J]. 时珍国医国药, 16(3):212.]
ZHANG B, YANG R, ZHAO Y, et al., 2008. Separation of chlorogenic acid from honeysuckle crude extracts by macroporous resins [J]. J Chromatogr, 867(2): 253-258.
(責任编辑 蒋巧媛)
