长春胺对非动脉炎性前部缺血性视神经病变大鼠模型视神经保护作用及其机制
2022-11-06梁超群刘珏君陈长征
付 梅 李 璐 梁超群 苏 钰 刘珏君 陈长征
武汉大学人民医院眼科中心 湖北 武汉 430060
非动脉炎性前部缺血性视神经病变(non‑arte‑ritic anterior ischemic optic neuropathy,NAION)是55 岁以上人群最常见的急性视神经病变,临床表现主要包括突发无痛性视力下降、视盘水肿和特征性视 野 缺 损 ,NAION 的 确 切 发 病 机 制 尚 不 明 确[1,2]。临床常用的治疗手段包括改善微循环、营养神经及激素冲击治疗,但长期疗效不稳定。相关研究表明,内皮型一氧化氮合酶(eNOS)基因多态性与NAION 的发病有关,eNOS 调节一氧化氮(NO)的合成和利用,NAION 患者的血清NO 浓度显著降低[3,4]。这表明,eNOS 信号通路可能参与 NAION的发病过程[5,6]。蛋白激酶 B 磷酸化(p‑AKT)及其磷酸化后的下游产物可以激活eNOS,增加内皮细胞NO 的合成,NO 上调可增加局部血流量,提高细胞摄氧量,改善中枢神经系统血液供应,发挥神经保 护 作 用[7]。 选 择 性 NOS 抑 制 剂 PI3K 可 以 抑 制eNOS 表达上调,阻断这一保护作用[3]。因此,我们推测PI3K/AKT/eNOS 信号通路可能对视网膜神经节细胞(RGCs)起保护作用,是NAION 治疗的潜在靶点。
长春胺是从夹竹桃科蔓长春花属植物中提取的一种生物碱。有研究表明,长春胺可能通过PI3K/AKT/eNOS 信号通路激活eNOS,上调NO,促进RGCs摄氧[8,9],但尚无研究论证长春胺在NAION患者治疗中是否有效。本实验通过制作NAION 大鼠模型研究长春胺对视网膜形态、功能及PI3K/AKT/eNOS通路信号传导的影响,以初步探索长春胺对NAION大鼠(rNAION)的神经保护作用及其可能机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 选择健康、清洁的雄性Sprague‑Dawley(SD)大鼠 90 只,体质量为(220±20)g,所有大鼠饲养于SPF 级屏障系统。动物的饲养与处死遵守美国国立卫生研究院的《实验动物管理及使用指南》。本研究遵循《赫尔辛基宣言》,同时获得武汉大学人民医院动物伦理委员会的批准。正式实验前常规饲养7 d。实验前充分散瞳,裂隙灯显微镜下详细检查双眼前节和眼底,排除眼部异常及病变。
1.1.2 主要试剂与仪器 羧甲基纤维素钠(天津光复精细化工),长春胺(烟台鲁银药业),PI3K 抑制剂LY294002(Cell Signalling Technology 公司),孟加拉玫瑰红(RB)试剂(美国Sigma 公司),Brn‑3a 抗体(sc‑31984,美国 Santa Cruz 公司),NO 检测试剂盒(A012,中国南京建成生物公司),荧光倒置显微镜(日本Olympus 公司),共聚焦激光眼底荧光造影仪(德国海德堡公司),多激光治疗仪(中国科林公司)。
1.2 实验方法
1.2.1 动物分组及模型制备 将90 只大鼠按随机数字表法分为6 组:正常对照组(n=15)、单纯模型组(n=15)、造模羧甲基纤维素钠灌胃组(NaCMC组,n=15)、造模长春胺灌胃组(长春胺组,n=15)、造模PI3K 抑制剂LY294002 玻璃体腔注射合并长春胺灌胃组(IVT LY+长春胺组,n=15)、造模DMSO 玻璃体腔注射合并长春胺灌胃组(IVT DMSO+长春胺组,n=15)。通过光动力诱导制备rNAION 模型[10]。麻醉后,经鼠尾静脉注入 RB 溶液(2.5 mmol/mL,1 mL/kg),注药后立即将大鼠置于激光机前,以盖玻片(涂有加替沙星眼用凝胶)轻触角膜,用YAG 激光对准大鼠视盘进行照射造模(激光参数:能量50 mW,光斑直径500 μm,持续时间为12 s)。正常对照组无干预正常饲养。单纯模型组造模后无后续干预继续正常饲养。NaCMC 组于造模后即给予每日2 次1%羧甲基纤维素钠灌胃,持续28 d。长春胺组于造模后即给予每日2 次长春胺灌胃(3.15 mg/kg,溶于1%NaCMC 中),持续28 d。IVT LY+长春胺组于造模成功后先给予玻璃体腔内注射PI3K 抑制剂LY294002(溶于DMSO)2 μL,随后给予每日2 次相应浓度的长春胺灌胃,灌胃干预持续28 d。IVT DMSO+长春胺组于造模成功后先给予玻璃体腔内注射DMSO 溶液2 μL,随后给予每日2 次相应浓度的长春胺灌胃,灌胃干预持续28 d。所有麻醉均通过腹腔注射10%水合氯醛(1 mg/kg)进行。
1.2.2 玻璃体腔注药 所有IVT 注射均在无菌条件下进行。造模成功后,IVT LY+长春胺组和IVT DMSO+长春胺组大鼠散瞳并麻醉,用微量注射器在显微镜下于大鼠角巩膜缘后1.5 mm 处穿刺巩膜入玻璃体腔,分别给予玻璃体腔内2 μL LY294002 或DMSO 注射。注射后,妥布霉素‑地塞米松眼膏敷眼。
1.2.3 眼底荧光血管造影和眼底照相 分别在rNAION 造模前、造模后第1 天和第28 天进行眼底照相(FP)和眼底荧光血管造影(FA)检查。充分散瞳后麻醉大鼠,在1 s 内将10%荧光素钠注射液(1 mL/kg)注入大鼠腹腔中,使用德国海德堡2 代视网膜血管显像仪摄取大鼠视乳头及其周围30 °范围内网膜彩照及造影早中晚期图片。为了提高荧光信号的信噪比,使用图像分析软件(Heidelberg Eye Explorer,Heidelberg Engineering)从多幅图像中计算出一幅均值图像。
1.2.4 一氧化氮浓度的测定 在造模后的第1 天和第28 天,大鼠尾静脉取血,提取血清,使用NO 检测试剂盒检测血清NO 浓度。
1.2.5 HE 染色和甲苯胺蓝染色 分别在造模后的第1 天和第28 天进行HE 染色及甲苯胺蓝染色。大鼠麻醉后摘除眼球并保留约3 mm 长视神经。刺破角膜缘后置于4%多聚甲醛‑PBS(PF‑PBS)溶液中固定过夜。石蜡包埋,分离眼球及视神经,沿角膜缘去除眼球角膜及晶状体制成眼杯,制成4 μm 厚切片,行视网膜HE 染色。沿视神经冠状面进行切片,厚度1 μm,行甲苯胺蓝染色。光学显微镜下观察并拍照。
1.2.6 RGCs 的免疫荧光染色 在造模后第28 天进行视网膜免疫荧光染色。将眼杯在4%多聚甲醛中固定过夜,PBS 漂洗后沿眼杯边缘钝性分离视网膜及巩膜,将视网膜完整取出,放射状剪开使其平铺于载玻片。室温下,用含有0.2%Triton X‑100 的PBS 和5%BSA 的缓冲液封闭视网膜1 h。一抗Brn‑3a 孵育 12 h(4 ℃),二抗孵育 3 h(室温),防荧光淬灭剂封片。用荧光显微镜观察距离视乳头2 个视乳头直径(papillary diameter,PD)位置视网膜RGC的细胞形态并拍照。在该范围内的每个象限中选择一张照片(×200)应用Image J软件进行RGCs计数。
1.2.7 视网膜实时荧光定量PCR 造模后第28 天检测组织p‑AKT 和eNOS 的相对含量。依照TRIzol 试剂盒说明书从6 组大鼠的视网膜组织中提取 mRNA,使用 Easy‑Script First‑Strand cDNA Syn‑thesis SuperMix 试剂盒逆转录为cDNA,使用PCR仪进行目的基因扩增。引物序列如下:p‑AKT 上游引物 5′‑ACTCATTCCAGACCCACGAC‑3′,下游引物 5′‑ACAGCCCGAAGTCCGTTATC‑3′,扩增片段长度 243 bp;eNOS 上游引物 5′‑CCTGGAGA‑ATGAGCAGAAGG ‑3′,下 游 引 物 5′‑CGGGGA‑CAGGAAATAGTTGA‑3′,扩增片段长度 297 bp。mRNA 的 相 对 表达 量 使用 公 式 2-(targetgeneCt-GAPDHCt)×103计算。将正常对照组目的基因的相对表达量作为1,各标本重复检测3 次后取其平均值。
1.3 统计学分析使用SPSS 19.0(SPSS Inc,Chicago,IL,USA)统计软件进行统计学分析。各组定量数据资料以均数±标准差()表示,多组间比较采用单因素方差分析,当方差不齐时采用近似F检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 眼底彩照及荧光血管造影FP 及FA 结果显示,各组大鼠视盘及视网膜无明显出血及渗出(图1)。与正常对照组(图1A、1E)相比,rNAION 造模成功后第1 天即可见大鼠视盘水肿,边界模糊(图1B、1F)。造模后28 d 时,各组视盘水肿基本消失,荧光血管造影未见明显异常荧光血管影像(图1C、1G),但单纯模型组、NaCMC 组及IVT LY+长春胺组视盘色淡苍白,长春胺组(图1D、1H)及IVT DMSO+长春胺组视盘颜色较正常对照组相比无明显异常。

图1 视网膜荧光血管造影(A~D)及眼底彩照(E~H)
2.2 血清NO 浓度测定造模成功后第1 天和第28 天,单纯模型组的NO 浓度较正常对照组相比明显降低(P<0.05),长春胺组的NO 浓度显著高于正常对照组、单纯模型组及 NaCMC 组(P<0.05),同时高于IVT LY+长春胺组,但长春胺组与IVT DMSO+长春胺组相比,NO 浓度差异无统计学意义(表1)。
表1 造模成功后第1 天和第28 天的NO 浓度()
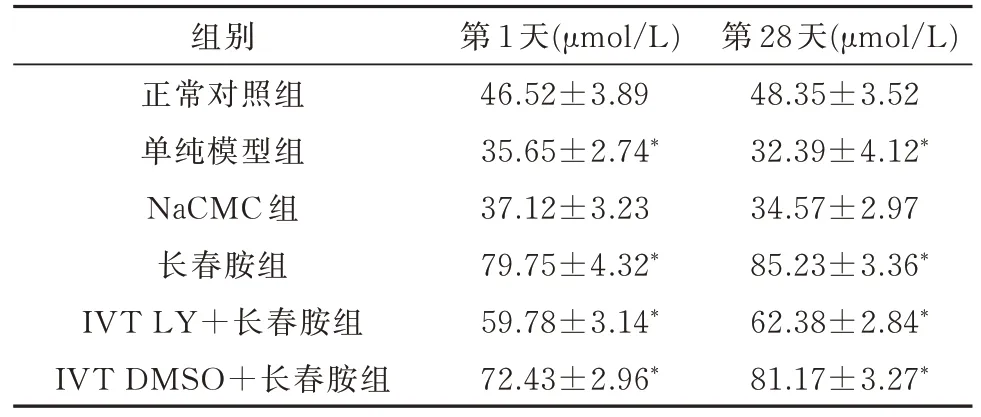
表1 造模成功后第1 天和第28 天的NO 浓度()
与正常对照组相比,*P<0.05
组别正常对照组单纯模型组NaCMC 组长春胺组IVT LY+长春胺组IVT DMSO+长春胺组第 28 天(μmol/L)48.35±3.52 32.39±4.12*34.57±2.97 85.23±3.36*62.38±2.84*81.17±3.27*第 1 天(μmol/L)46.52±3.89 35.65±2.74*37.12±3.23 79.75±4.32*59.78±3.14*72.43±2.96*
2.3 HE 和甲苯胺蓝染色HE 和甲苯胺蓝染色结果显示,正常情况下,大鼠视网膜RGCs 层细胞呈单层紧密排列,细胞呈圆形或椭圆形,边界清晰,视神经纤维束及轴突排列整齐有序(图2E)。rNAION模型造模成功后第1 天,视盘明显水肿(图2C),但视网膜RGCs 层形态尚未见明显改变(图2A)。在造模后第28 天,视盘水肿消退,视网膜RGCs 层变薄,细胞排列疏松紊乱,部分细胞凋亡(图2B),视神经可见空泡样变性(图2D),视神经中央轴突增生,神经纤维束及轴突排列紊乱(图2F)。

图2 大鼠视网膜视神经HE 染色(A~D)及视神经甲苯胺蓝染色(E、F)
2.4 RGCs 免疫荧光染色及计数造模后第28 天由Brn3a 标记RGCs 的视网膜铺片免疫荧光染色(图3)结果显示,与正常对照组相比,单纯模型组的RGCs 数量明显减少[正常对照组:(2 371±357)RGCs/mm2,单纯模型组:(793±167)RGCs/mm2,P<0.05]。与 NaCMC 组相比,长春胺组 RGCs 数量明显增加,差异有统计学意义[NaCMC 组:(829±199)RGCs/mm2,长 春 胺 组 :(1 296±134)RGCs/mm2,P<0.05]。 与 长 春 胺 组 及 IVT DMSO+长春胺组分别相比,IVT LY+长春胺组的RGCs 数量明显减少,差异具有统计学意义[长春胺组 :(1 296±134)RGCs/mm2,IVT DMSO+ 长春胺组:(1 236±220)RGCs/mm2,IVT LY+长春胺组:(935±163)RGCs/mm2,P<0.05]。
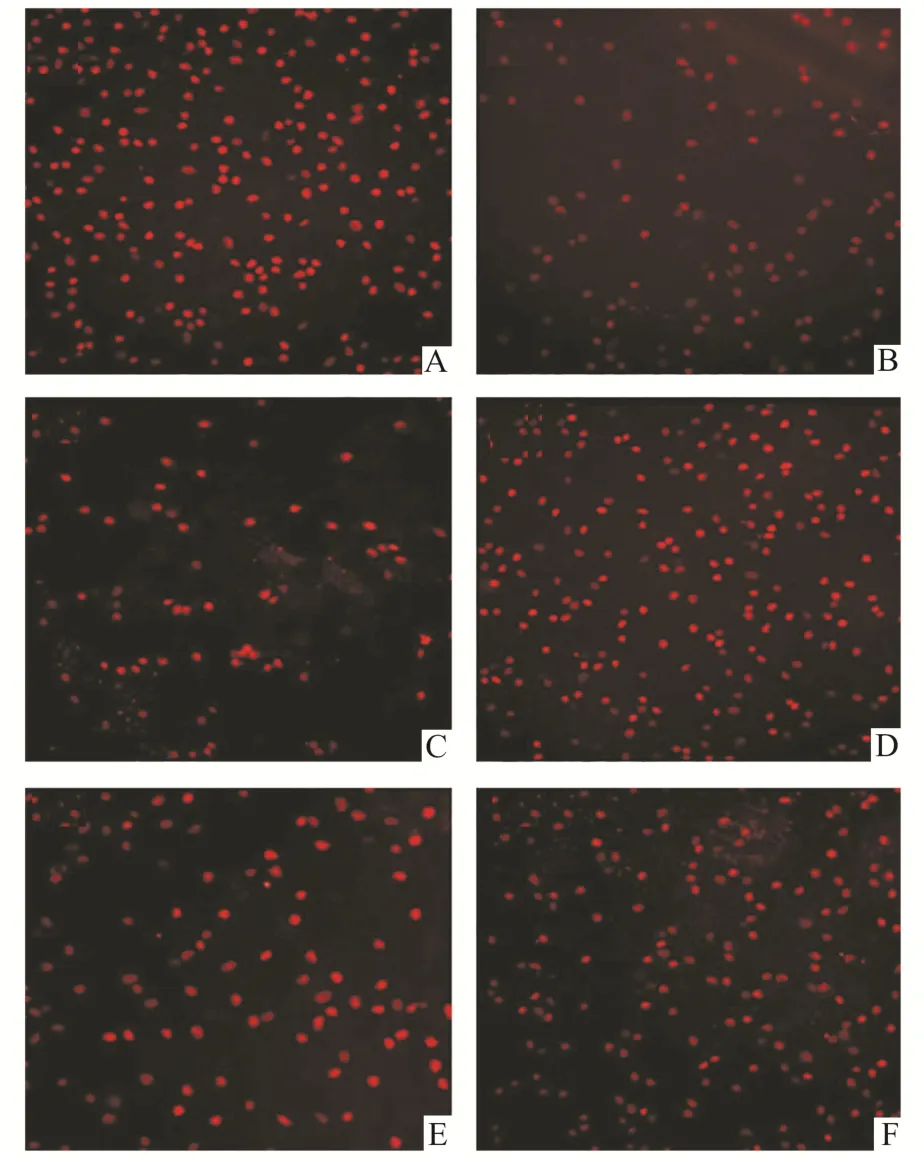
图3 大鼠视网膜RGCs 的免疫荧光染色(×200)
2.5 PCR 结果与正常对照组相比,单纯模型组的 p‑AKT 和 eNOS 含量明显减少(P<0.05)。与单纯模型组相比,长春胺组的p‑AKT 和eNOS 含量明显增加(P<0.05)。IVT LY+长春胺组的p‑AKT和eNOS 含量较长春胺组显著下降(P<0.05)。IVT DMSO+长春胺组和长春胺组的p‑AKT 和eNOS 含量无明显差异(P=0.081)。
3 讨论
NAION 是睫状后短动脉循环障碍导致视乳头供血不足引起的一种缺血性疾病,临床治疗的关键是迅速消除视盘水肿,改善缺血状态,进而延缓视神经损害。目前临床采用大剂量糖皮质激素联合营养神经等药物进行治疗,但长期疗效不佳。NAION 的主要病理改变是视神经轴突变性和RGCs 凋亡。病变急性期视盘筛板前区短暂性缺血引起视盘反应性水肿,直接损伤视神经轴突,在这一阶段给予恰当治疗,可以有效保护RGCs 并减少其凋亡,改善预后。本研究利用rNAION 模型,证明长春胺可能通过PI3K/AKT/eNOS 信号通路,保护RGCs 并减少其凋亡,从而发挥视神经保护作用,为临床NAION 的治疗提供新方向。
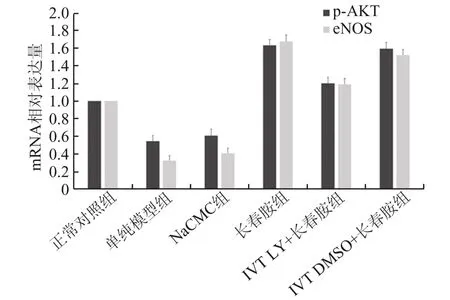
图4 各组大鼠视网膜中p⁃AKT、eNOS mRNA 的相对表达量比较
本研究采用rNAION 动物模型模拟临床NAION 的发病过程。模型制备原理为光化学反应产生的超氧自由基损伤视神经,导致RGCs 丧失[10]。rNAION 单纯模型组标本显示出与NAION 患者相似的病理改变。造模后眼底视盘水肿,边界模糊,血管增粗迂曲,FA 造影呈现高荧光,视网膜RGCs层形态尚未见明显改变。造模后28 d 时,视盘水肿消退、色淡,FA 造影显示正常荧光影像,视网膜RGCs 层变薄,细胞排列疏松紊乱,部分细胞凋亡,视神经可见空泡样变性,视神经中央轴突增生,神经纤维束及轴突排列紊乱。
造模28 d 后眼底彩照结果显示,单纯模型组、NaCMC 组及IVT LY+长春胺组视盘色淡苍白,长春胺组及IVT DMSO+长春胺组视盘颜色较正常对照组相比无明显异常。此外,RGCs 免疫荧光染色及计数显示,长春胺组中RGCs 数量远多于rNAION 单纯模型组、NaCMC 组和IVT LY+长春胺组,这表明长春胺可以有效保护RGCs,减少RGCs 凋 亡,与 Zhang 等[11]、Wang 等[12]的研究 结果相似。Zhang 等[11]研究表明,长春胺可以通过改善神经元可塑性、减少炎症趋化因子和细胞因子的释放来治疗缺血性卒中。Wang 等[12]研究表明,大鼠发生全脑缺血后,应用长春胺可以发挥神经元保护作用,显著提高其康复率。
血清NO 浓度测定结果显示,造模成功后第1天和第28 天,单纯模型组的NO 浓度较正常对照组相比明显降低(P<0.05),长春胺组的NO 浓度显著高于正常对照组、单纯模型组及NaCMC 组(P<0.05),同时高于IVT LY+长春胺组。这表明,rNAION 动物模型的血清NO 浓度显著降低,应用长春胺能增加内皮细胞 NO 的合成,与 Sakai 等[3]、Giannopoulos 等[4]的研究结果一致,其研究结果表明,NAION 患者的血清NO 浓度显著降低。实时定量PCR 检测结果显示,与正常对照组相比,单纯模型组的 p‑AKT、eNOS 含量明显减少(P<0.05)。长春胺组的p‑AKT、eNOS 含量较单纯模型组明显增加(P<0.05),IVT LY+长春胺组的 p‑AKT、eNOS 含量较长春胺组显著下降(P<0.05)。这表明长春胺可能通过PI3K/AKT/eNOS 信号通路增加内皮细胞NO 的合成,NO 上调可以增加局部血流量,促进细胞摄氧,保护RGCs 并减少其凋亡。这与Wu 等[13]、Avraham ‑Lubin 等[5]的 研 究 结 果 一 致 。Wu 等[13]研究表明,长春胺可以通过上调 SOD、激活PI3K/AKT 信号通路,抑制过氧化氢诱导的细胞凋亡并保护 PC12 细胞。Avraham‑Lubin 等[5]研究了高压氧疗法对rNAION 模型的神经保护作用,其结果显示,eNOS 表达上调可能会抑制RGCs 凋亡。
在本研究中,PI3K 抑制剂可以抑制长春胺的神经保护作用,这提示长春胺发挥作用需要PI3K/AKT/eNOS 信号通路的参与。然而,IVT LY+长春胺组与未行任何治疗的rNAION 单纯模型组相比,其p‑AKT 和eNOS 表达水平并不相同。这表明除PI3K/AKT/eNOS 信号通路外,长春胺神经保护作用的发挥可能通过多个信号传导通路介导。
本研究存在一定的局限性。首先,实验样本量较小,实验时间短,因此无法评价长春胺对rNAION模型的远期治疗效果。此外,仅在建模后第28 天检测pAKT、eNOS 表达水平,无法显示其动态变化。后续实验可继续设定不同给药浓度及给药频率,以期得到更好的药物利用率。本研究证实了,长春胺可通过PI3K/AKT/eNOS 信号通路发挥神经保护作用,为临床治疗NAION 患者提供理论依据。
