畜禽养殖粪污中典型致病菌的三重微滴式数字PCR定量检测方法的建立
2022-11-05程深伟张克强梁军锋刘福元郜兴亮杜连柱
程深伟 张克强 梁军锋 刘福元 郜兴亮 杜连柱
(1. 农业农村部环境保护科研监测所,天津 300191;2. 新疆农垦科学院畜牧兽医研究所,新疆石河子 832000)
随着步入“十四五”发展的新阶段,为寻求农业高质量绿色发展,畜禽养殖粪污资源化利用在我国受到了前所未有的关注。种养结合、粪污还田利用是其资源化利用的最主要方式之一,是解决养殖业污染问题的根本出路,也是践行农牧业绿色发展的重要举措[1]。但由于各地养殖业粪污无害化处理技术的参差不齐,畜禽粪污作为多种微生物的主要载体,其内含的致病菌不但会直接影响养殖动物的健康,也会通过各种渠道与人类接触,造成公共卫生安全的危害[2]。因此,快速检测养殖粪污中的食源性致病菌,判断其无害化处理效果,开发建立更为高效、灵敏的检测方法尤为重要。
大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)和肠炎沙门氏菌(Salmonella enteritidis)是3种畜禽养殖粪污中常见的致病微生物。国家标准中对典型致病微生物的检测采用传统培养的方法,通过细菌选择性培养基和生化试验来鉴定、分离和计数样品中的细菌数[3]。但传统检测方法存在着操作繁琐、检测时间长、准确度低等问题。
近年来,实时荧光定量PCR技术(quantitative real-time PCR,qPCR)也被用于养殖粪污中致病菌的检测。其运用PCR反应体系,利用荧光信号的采集对整个PCR系统进行实时监测,最后通过绘制标准曲线对检测样品进行相对定量的分析[4]。此法大大缩减了检测时间,准确度和灵敏度均有明显提升,但也存在着对PCR反应体系要求高、只能进行相对定量值的测定等问题。
微滴式数字PCR(droplet digital PCR,ddPCR)是近年来迅速发展起来的一种定量分析技术。与传统qPCR技术不同,ddPCR不依赖扩增曲线的Ct值(循环阈值)进行定量,不受扩增效率的影响,也不必采用内参基因和标准曲线,具有较好的准确度和重现性,得以实现绝对定量分析[5-6]。与qPCR相比,ddPCR对核酸含量较低的样品检测准确率和灵敏度都明显较高[7-11]。魏咏新等[12]设计了大肠杆菌O157:H7特异性引物、探针,并比较了传统培养计数法、qPCR和ddPCR的定值效果。结果显示,ddPCR检测方法能够有效提高病原菌检出效率。Kelley等[13]使用ddPCR和qPCR对397个样本进行金黄色葡萄球菌的定量检测。结果表明,ddPCR的灵敏度高于qPCR。赵新等[14]建立了沙门氏菌数字PCR检测方法,结果也证实了ddPCR检测方法具有检测快速、检出率高和操作便捷等优点。
ddPCR具有明显的技术优势,其操作简单,样品消耗量少,在反应体系中提高了反应器的数量,可以将稀释后的样品溶液等分到几十到几十万的微滴中,并保证微滴的均一性和表面稳定性,大大提高了ddPCR的灵敏度。且由于其通道和包含在微滴中的样品模板没有直接接触,也减少了反应中交叉污染及模板的损失[15]。ddPCR的技术优势关键在于实现了检测的绝对定量,而对于目前广为使用的多重定量PCR原理上亦属于传统的qPCR技术,因此不具备ddPCR的上述优势。目前相关ddPCR研究方法主要集中在食品中致病微生物的检测,且均为单重检测方法[16-19],针对畜禽养殖废弃物中典型致病微生物的多重ddPCR检测方法鲜见报道。
研究采用数字PCR(dPCR)技术中的主要检测应用方法—ddPCR技术,建立起畜禽养殖粪污中典型致病菌的三重微滴式数字PCR检测方法,实现对金黄色葡萄球菌、大肠埃希氏菌以及肠炎沙门氏菌的绝对定量检测,以期为畜禽养殖粪污无害化处理和安全利用提供技术支撑。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 粪便基因组DNA提取试剂盒(离心柱法)(APEXBIO,中国);细菌基因组DNA提取试剂盒(TIANGEN,中国);PerfeCTa Multiplex qPCR ToughMix,5×(Quantabio,美国);Fluorescein sodium salt(APEXBIO,中国);Sapphire Chip(Stilla Technologies,法国)。
1.1.2 仪器与设备 Naica®全自动微滴芯片数字PCR系 统(Stilla Technologies, 法 国 );Sapphire Chip(Stilla Technologies,法国);微量分光光度计(Titertek-Berthold,德国);生物安全柜(BIOBASE,中国);电子天平(Sartorius,中国);高压灭菌锅(SHENAN,中国);超低温冰箱(海尔,中国);4℃高速离心机器(2-16 PKsigma,德国);迷你水平电泳槽(BG-subMINI cell,中国);紫外凝胶成像(Bio-Rad Gel Doc XR+ Bio-Rad,美国);电泳仪(Power-pac-Bio-Rad,美国)。
1.1.3 实验菌株 共有13株,其中沙门氏菌1株、金黄色葡萄球菌1株、大肠埃希氏菌(O157:H7)1株(详见表1)、非目标菌株10株,既有购买于标准菌株保藏中心的标准菌株,也有本实验室自己从样品中检出的阳性菌株。

表1 3种典型致病菌具体信息Table 1 Specific information on three typical pathogenic bacteria
1.1.4 引物探针 参考文献[16,19-20]中目标菌株核酸的多对引物探针,进行单重荧光PCR扩增比较,筛选最佳引物探针。最佳引物、探针参考文献及序列见表2,引物和探针由上海生物工程技术服务有限公司合成。
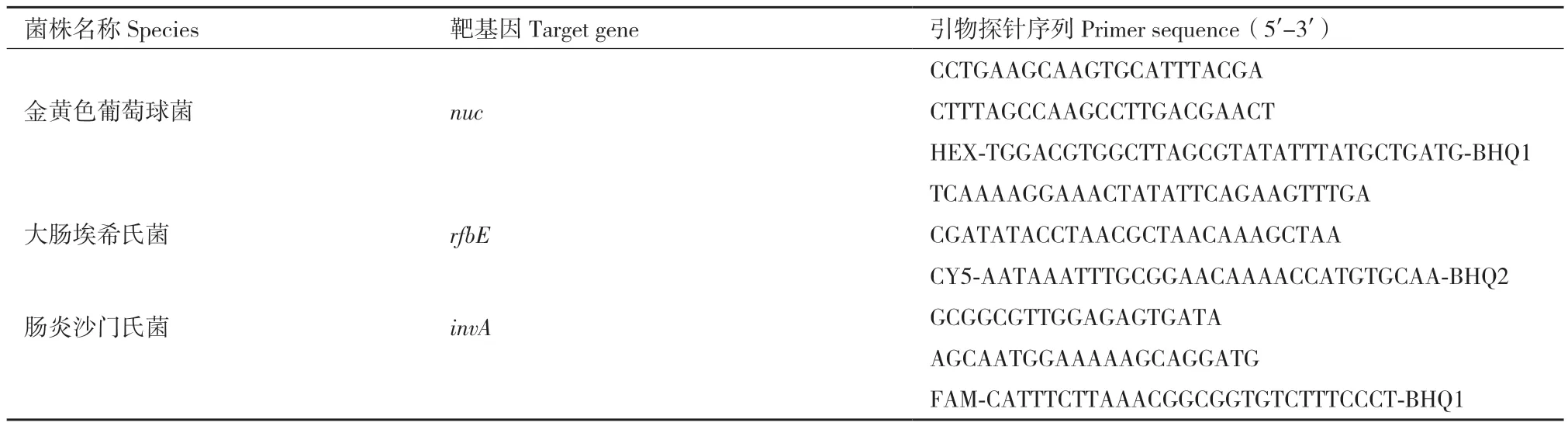
表2 三重数字PCR检测3种致病菌的特异性引物Table 2 Specific primers for detecting three pathogens by triple droplet digital PCR
1.2 方法
1.2.1 致病菌基因组DNA提取 纯菌DNA提取:菌种按1∶50(体积比)比例接种至5 mL NB,37℃培养24 h后,再次按1∶50接种,37℃培养8 h,取1 mL菌悬液做10倍梯度稀释,各取1 mL使用细菌基因组DNA提取试剂盒分别提取基因组DNA,测定DNA浓度,置于-20℃保存备用。
1.2.2 单重ddPCR的扩增 分别以金黄色葡萄球菌、大肠埃希氏菌(O157:H7)、肠炎沙门氏菌的基因组DNA为模板进行单重ddPCR扩增,无菌超纯水为空白对照。本研究所选的3组引物探针的退火温度均为60℃,3种TaqMan探针的荧光基团选用吸光度分段差异较大的FAM、HEX和CY5,以利于建立多重微滴数字PCR反应体系。单重ddPCR反应体系 :PerfeCTa Multiplex qPCR ToughMix,5×5 μL,Fluorescein sodium salt(1 μmol/L)2.5 μL,10 μmol/L引物上下游各 1 μL,探针 0.5 μL,模板 DNA 5 μL,dd H2O补足25 μL。反应程序:95℃预变性5 min;95℃ 15 s,60℃ 30 s,45 个循环。
1.2.3 多重ddPCR的建立与优化 对3种目标菌株的引物、探针和扩增酶的使用量进行筛选和优化,将3组目标菌株的引物与探针组合进行ddPCR扩增,确定彼此间不会互相干扰。再对3组多重ddPCR体系的引物探针添加量进行筛选,经过确认后对25μL体系中扩增酶的使用量进行比较,确认最优多重ddPCR反应体系。
1.2.4 多重ddPCR特异性实验 选取3种目标菌株的混合基因组DNA为阳性对照,10株非目标菌的DNA作为阴性对照,进行三重ddPCR特异性检测,并设立空白对照作为质量控制。
1.2.5 多重ddPCR灵敏度试验 将含有3种目标菌株的基因组DNA进行1∶1∶1混合,进行10倍梯度稀释,稀释至106倍。使用6个梯度稀释样本进行三重微滴数字PCR灵敏度检测,确定其检出限。
1.2.6 畜禽养殖废弃物中3种致病菌的检测 在天津市某养猪场和某养鸡场采集废弃物样本,共16份。称取3 g样本,按照粪便基因组DNA提取试剂盒(离心柱法)提取DNA,测定A260/A280、A260/A230、DNA浓度。随后采用本研究所建立的三重ddPCP检测方法对畜禽养殖废弃物中3种典型致病菌进行定量检测。
2 结果
2.1 单重ddPCR扩增结果
3种典型致病菌的单重ddPCR扩增效果良好,空白对照未出现阳性微滴。3对引物探针的退火温度一致,适合构建多重ddPCR反应体系,见图1-图3。
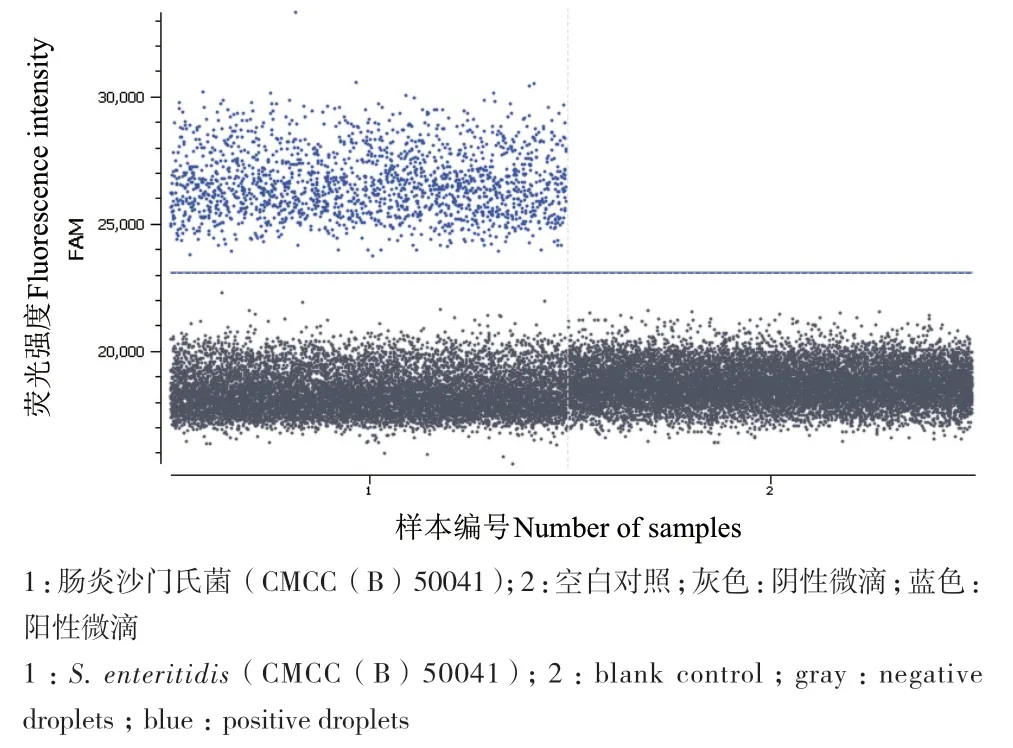
图1 肠炎沙门氏菌单重ddPCR检测一维图Fig. 1 One-dimensional diagram of single ddPCR detection of S. enteritidis
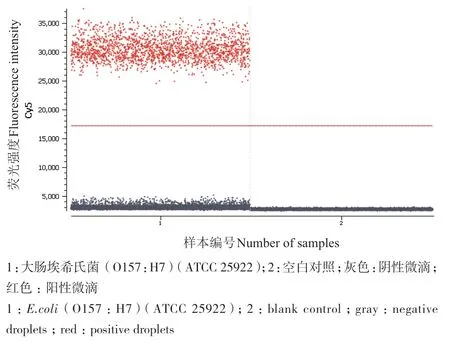
图3 大肠埃希氏菌单重ddPCR检测一维图Fig. 3 One-dimensional diagram of single ddPCR detection of E.coli
2.2 多重dPCR的优化
通过体系优化与实验比较,3组引物探针之间不会产生非特异性扩增,3种发光基团不会互相干扰或者干扰很少,单重ddPCR扩增所得拷贝数与多重ddPCR扩增拷贝数相近,可构建三重ddPCR反应体系。
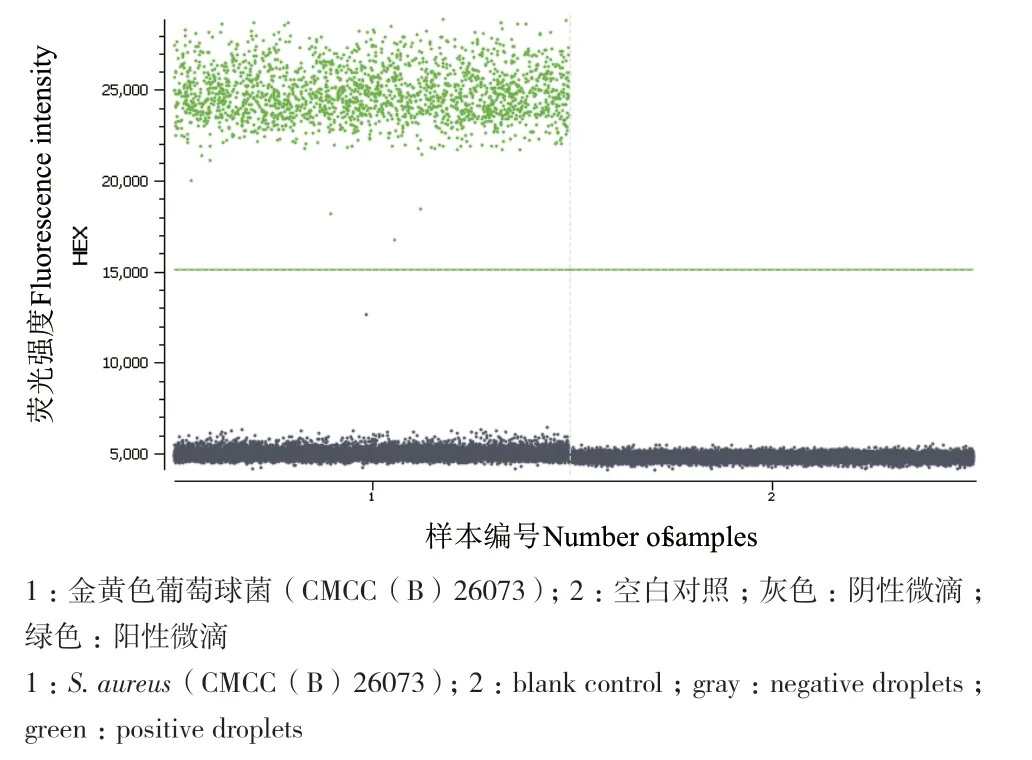
图2 金黄色葡萄球菌单重ddPCR检测一维图Fig. 2 One-dimensional diagram of single ddPCR detection of S. aureus
确定的最佳多重ddPCR反应体系为:PerfeCTa Multiplex qPCR ToughMix,5×5 μL,Fluorescein sodium salt(1 μmol/L)2.5 μL,10 μmol/L 引物上下游各 1 μL,探针 0.5 μL,模板 DNA 5 μL,dd H2O 补足25 μL。反应程序:95℃预变性5 min;95℃ 15 s,60℃ 30 s,45个循环。多重ddPCR检测结果见表3。已建立的大肠杆菌、金黄色葡萄球菌以及沙门氏菌三重微滴式数字PCR的检测方法可用于后续样品的检测。

表3 单重及多重微滴数字PCR检测样本拷贝数结果Table 3 Copy number of samples detected by single and multiple droplet digital PCR
2.3 多重ddPCR的特异性的确定
通过多重ddPCR证实3种目标菌均有相应阳性微滴,同时,设置了阴性菌株和空白作为对照,结果显示均无扩增,说明引物、探针的特异性较好,即非目标菌均无特异性扩增,3组引物探针具有良好的特异性,且不会产生交叉反应,多重dPCR特异性扩增结果见图4。
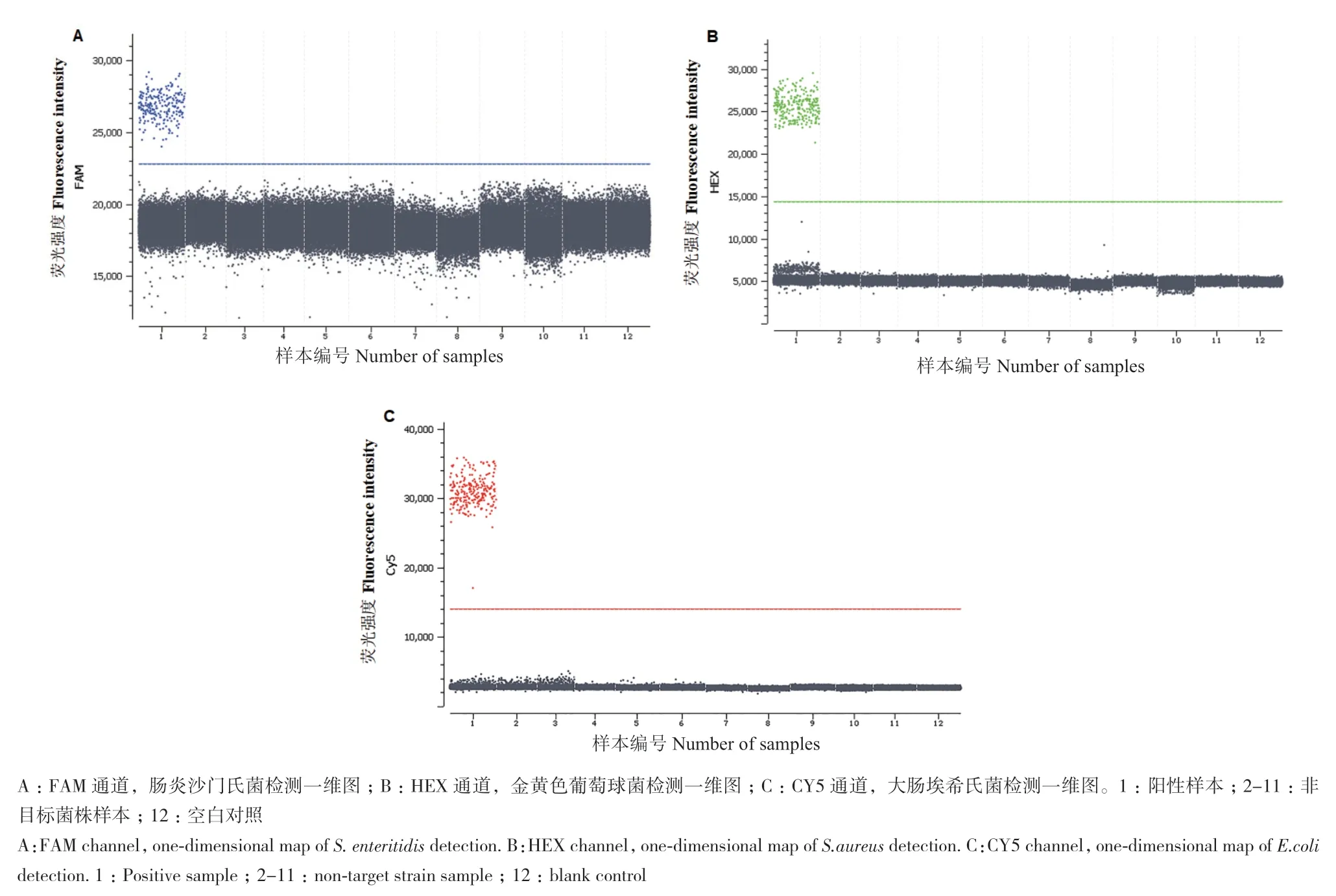
图4 三重ddPCR特异性检测一维图Fig. 4 One-dimensional map of specificity detected by triple ddPCR
2.4 三重ddPCR灵敏度的确定
将3种致病菌的基因组DNA混合后,进行10梯度稀释、6个梯度样本和3次技术重复,以检测反应体系的灵敏度。微滴式数字PCR拷贝数浓度检测结果如表4。由表4可知,三重微滴式数字PCR检测3种致病菌的绝对定量检测低限分别为肠炎沙门氏菌0.68 copies/μL,RSD为41.29%;金黄色葡萄球菌0.79 copies/μL,RSD为39.60%;大肠埃希氏菌1.02 copies/μL,RSD为25.26%。三重微滴数字PCR结果一维图见图5。
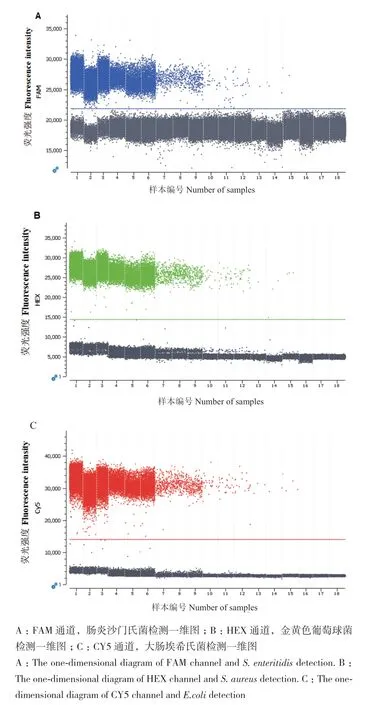
图5 三重ddPCR灵敏度检测一维图Fig. 5 One-dimensional map of sensitivity detected by triple ddPCR
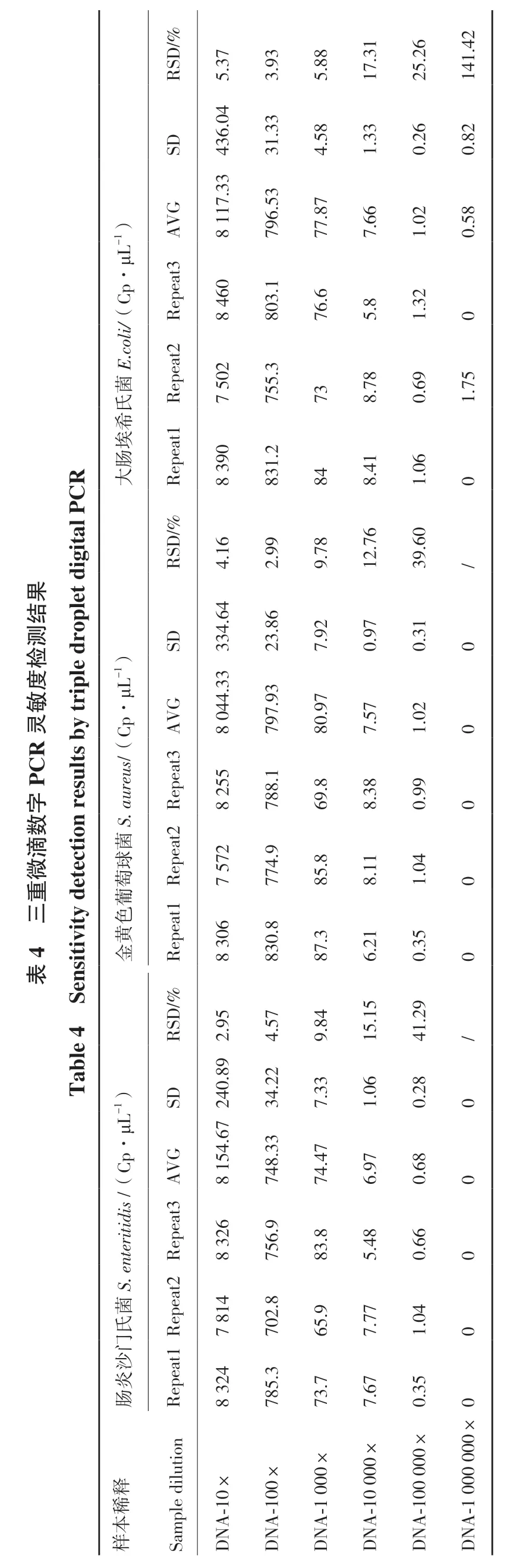
1)·μLCp E.coli/(菌氏希埃CR 肠大igital P果结测roplet d检度敏μL-1)R灵重detection results b y triple d s/(C p·PC字数S. aureu滴 菌微 球萄4 三葡色黄表en sitivity金ble 4 S Ta μL-1)S. enteritidis /(C p·菌氏门沙炎肠释稀本样RSD/%SD G AV Repeat3 Repeat2 Repeat1 RSD/%SD VG Repeat3A epeat2 Repeat1R D/%RS SD VG Repeat3A epeat2 Repeat1R Sample dilution 5.37 6.04 43 3 8 117.3 8 460 02 7 5 90 8 3 4.16 8 044.33334.64 55 8 2 7 572 06 8 3 7240.892.95 8 154.6 8 326 7 814 8 324 A-10×DN 3.93.33 31 796.53 803.1 755.3 831.2 2.99 6.8 23 7.93 79 788.1 774.9 830.8 4.57 2 34.2 8.33 74 756.9 2.8 70 785.3 A-100×DN 5.88 4.58 77.87 76.6 73 84 9.78 7.92.97 80 69.8.8 85 87.3 9.84 7.33 74.47 83.8.9 65 73.7 A-1 000×DN 17.31 1.33 7.66 5.8 8.78 8.41.76 12 0.97 7.57 8.38 8.11 6.21 15.15 1.06 6.97 5.48 7.77 7.67 0×A-1000 DN 6 25.2 0.26 1.02 1.32 0.69 1.06 39.60 0.31 1.02 0.99 1.04 0.35 41.29 0.28 0.68 0.66 1.04 0.35×00 A-100 0 DN 1.42 14 0.82 0.58 0 1.75 0/0 0 0 0 0/0 0 0 0 0 A-1 000 000×DN
以反应体系中 DNA 模板稀释倍数为横坐标,以3个平行检测拷贝数结果为纵坐标绘制线性范围拟合曲线,如图6所示,肠炎沙门氏菌、金黄色葡萄球菌和大肠埃希氏菌的拷贝

图6 三重ddPCR灵敏度检测线性范围拟合曲线Fig. 6 Fitting curve of linear range for triple ddPCR sensitivity detection
数的对数值均与 DNA 模板稀释倍数的负对数值呈现高度的线性相关,相关系数达到0.99以上。说明本实验建立的微滴式数字PCR法具有良好的定量线性相关性,适用于肠炎沙门氏菌、金黄色葡萄球菌和大肠埃希氏菌的拷贝数浓度定量检测。
2.5 畜禽养殖废弃物中三种致病菌的检测结果
使用粪便基因组DNA提取试剂盒(离心柱法)提取16份样本(每份样品3 g)。提取后检测DNA浓度,检测结果见表5,琼脂糖凝胶电泳操作及结果见表6、图7。
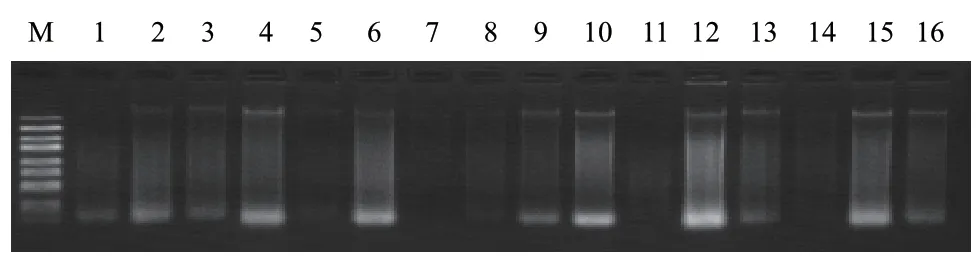
图7 16份样本琼脂糖凝胶电泳结果Fig. 7 Agarose gel electrophoresis results of 16 samples
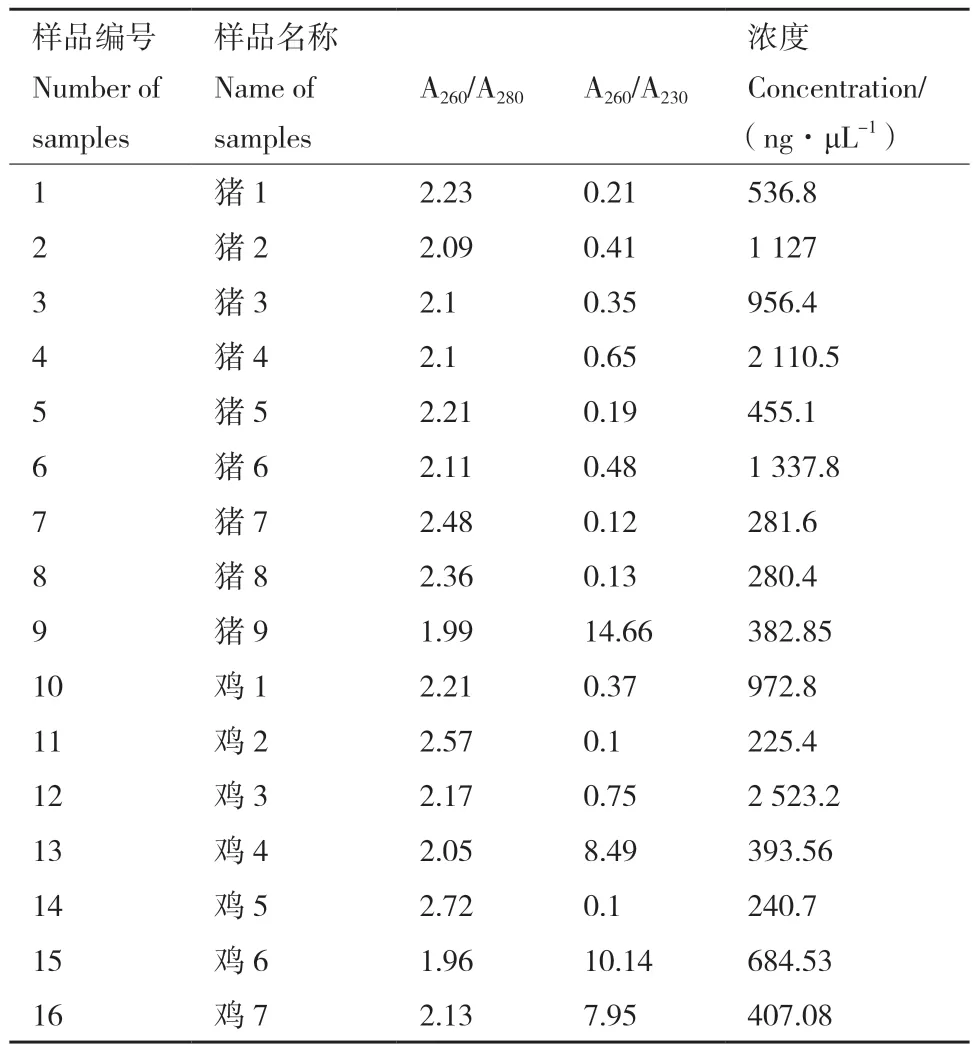
表5 16份样本DNA浓度检测结果Table 5 DNA concentration test results of 16 samples
表6 16份样本DNA浓度琼脂糖凝胶电泳检测表Table 6 Detection of DNA concentration in 16 samples by agarose gel electrophoresis
将上述样本DNA样本进行三重ddPCR检测,确认样本中是否含有相关致病菌。三重ddPCR一维图结果如图8,检测结果如表7。
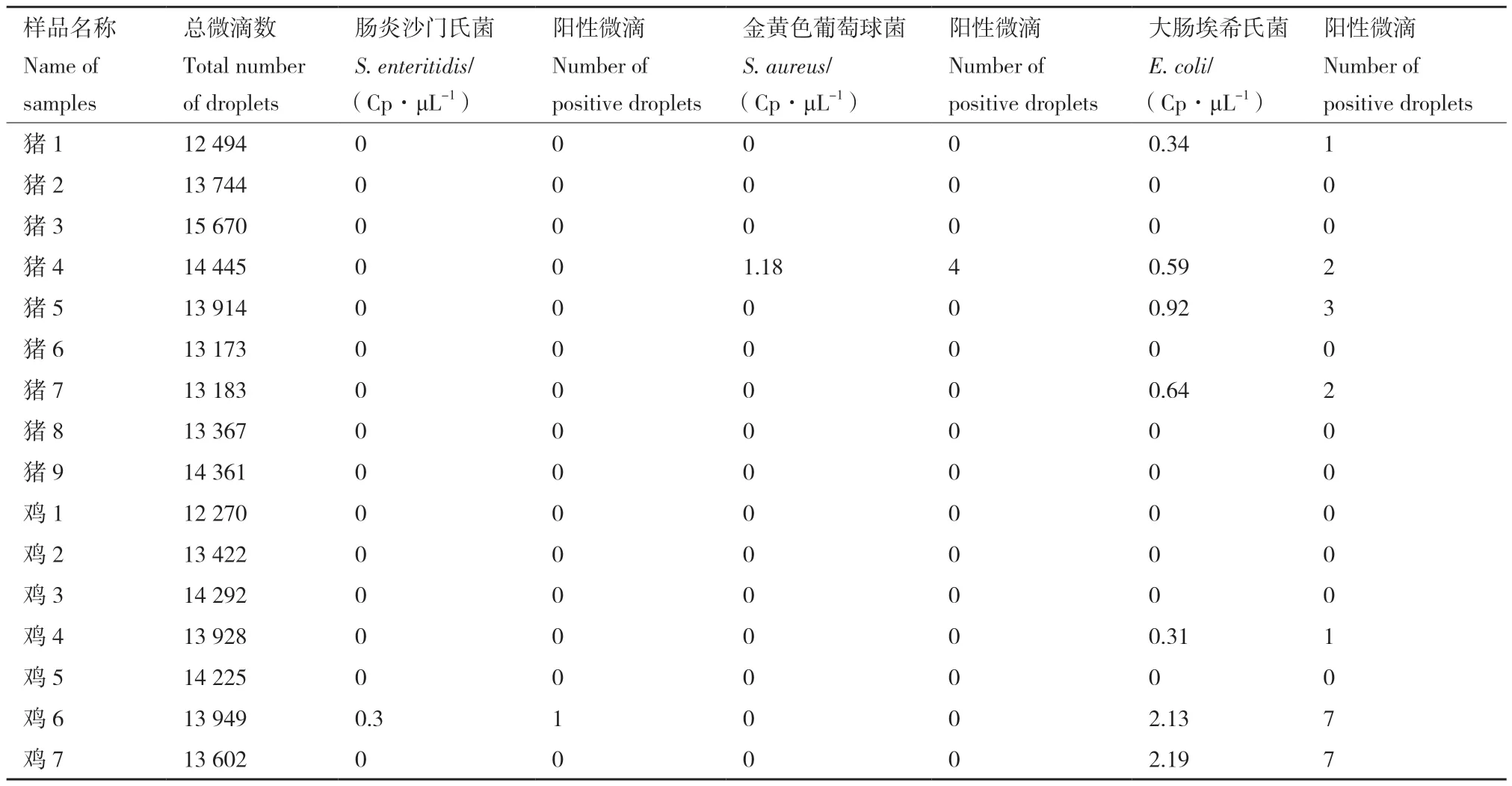
表7 16份样本三重微滴数字PCR拷贝数检测结果Table 7 Copy number detection results for 16 samples by triple droplet digital PCR

图8 三重ddPCR检测14样本一维图Fig. 8 One-dimensional diagram of detecting 14 samples by triple ddPCR
检测结果表明,在16个样本中,仅鸡6检出肠炎沙门氏菌;仅猪4检测到金黄色葡萄球菌;猪1、猪4、猪5、猪7、鸡4、鸡6和鸡7中都检测到大肠埃希氏菌。
3 讨论
在我们现场实地取样调查中发现,各个取样点的样品均有不同程度的畜禽养殖粪污的典型致病菌污染。这也反映了我国目前即使在同一地区的不同区域内,也存在着畜禽养殖无害化处理技术的参差不齐且整体水平有待提升的现状。
国内外对于3种典型致病菌的检测方法进行了大量的研究和对比。国标法使用传统培养的方式检测典型致病菌,通过前增菌、选择性增菌、目的菌株分离、生化试验、革兰氏染色和血清学鉴定等环节对病原菌进行鉴定计数[3]。但此方法的整个流程约耗费一周时间,且实验中多种培养基的配制、复杂的操作流程,使之对待测样品不能及时准确快速地检测出结果。Malorny 等[21]建立了检测肉和蛋中沙门氏菌的qPCR技术,Kawasaki 等[22]建立了检测沙门氏菌、单增李斯特氏菌和大肠埃希氏菌的三重qPCR方法,其自动化程度高,最快检测周期只需6 h,相较于传统培养法极大地提高了对病原菌的检测效率和准确度[23]。ddPCR技术则在此基础上实现了对3种典型致病菌的绝对定量测定,相较三重qPCR法具有更高的灵敏度和准确度的技术优势。
对于多重ddPCR技术,尚存几个亟待解决的问题。ddPCR技术运用需依靠实验室条件下的微滴式数字PCR检测系统,目前检测花费较高且尚未开发出现场实时检测设备,这成为该方法广泛推广的障碍性因素。ddPCR技术基于传统PCR原理,因此假阳性、假阴性的现象不可避免。较好的检测效果应是其线性、非散点式微滴纵向分布于阳性与阴性微滴的交接处,此次试验就有较好的效果呈现,但今后仍需应注意诸多试验方面的控制。例如,实测样品尽可能好地进行样品前处理,提取核酸前对待测菌进行有效的富集,避免其他成分因素的干扰;根据目标生物的不同核酸特性,应及时调整引物、模板、dNTP、Mg2+、缓冲液、DNA聚合酶的浓度,优化反应体系和反应条件,减少非特异性扩增;当多种引物同时存在时,可适当地对引物进行前处理或通过提高退火温度、延长退火时间以及添加5%的二甲基亚砜或甘油等辅助剂来尽可能地减少引物二聚体的形成,保持体系较好的扩增效率和检测特异性;同时,整个实验检测环境应保持较好的负压条件,减少人为操作引起的核酸气溶胶污染。对于典型致病菌更好的三重ddPCR反应体系的配比选择和反应系统的参数设置今后仍需继续优化。
4 结论
本研究建立了畜禽养殖粪污中3种典型致病菌的多重微滴数式数字PCR反应体系,确定了以FAM、HEX和CY5 的TaqMan探针荧光基团,以10 μmol/L引物上下游各1 μL,探针0.5 μL,模板DNA 5 μL,3组引物探针的退火温度均为60℃的25 μL定量反应体系。在该反应体系中,检测肠炎沙门氏菌的绝对定量检测低限为0.68 copies/μL;检测金黄色葡萄球菌的绝对定量检测低限为0.79 copies/μL;检测大肠埃希氏菌的绝对定量检测低限为1.02 copies/μL。
