酶促重组等温扩增实时荧光法快速检测肺炎支原体方法的建立及应用
2022-11-05胡海洋应婉琴何军吕芷贤谢小平邓仲良
胡海洋 应婉琴 何军 吕芷贤 谢小平 邓仲良
(1. 南华大学衡阳医学院公共卫生学院卫生检验与检疫系,衡阳 421001;2. 南华大学衡阳医学院附属南华医院,衡阳 421001 3. 南华大学衡阳医学院附属第一医院,衡阳 421001)
肺炎支原体(Mycoplasma pneumoniae)是引起社区获得性肺炎(community-acquired pneumonia,CAP)的重要病原体[1],主要通过呼吸道飞沫传播,传染性强[2]。肺炎支原体肺炎一般起病缓慢,潜伏期较长,约为1-3周。临床症状主要有发热、流感样症状,如鼻塞、流涕、肌肉酸痛、乏力、咽痛、咳嗽和胸痛等,还可引发呼吸系统并发症和肺外并发症,造成机体多系统损伤,如坏死性肺炎、胸腔积液、支气管哮喘、皮肤损害、神经系统并发症等[3-4]。若不能早期快速诊断,延误治疗,可加重病情,严重患者可发生死亡,因此建立肺炎支原体早期快速诊断的方法,对于肺炎支原体的治疗和控制支原体肺炎的流行具有十分重要的意义。
肺炎支原体的鉴定包括分离培养、抗体检查、分子生物学等方法。分离培养是诊断肺炎支原体感染的“金标准”,但由于支原体培养和形态观察困难,培养时间长,检出率较低,已不能满足临床快速诊断需要[5-6]。抗体检查方法包括ELISA、荧光抗体试验等,检查简单、快速和敏感,但灵敏度较低,在健康人群中出现高背景的干扰性抗体,存在非特异性的交叉反应,可能会导致一定的假阳性结果[7],不能用于支原体早期筛查,适应用于肺炎支原体感染的回顾性调查。分子生物学是检测肺炎支原体核酸最主要检查方法,包括PCR、等温扩增技术等。由于基于PCR的一系列检测方法(常规PCR、实时荧光PCR)检测程序复杂,检测时间较长,需要热循环仪仪器,成本较高,对试验技术条件要求较高,且受仪器、设备和电力以及空间等诸多因素的限制,不利于快速检测以及在基层实验室的推广应用[8-9]。与其他的核酸扩增技术相比,等温扩增技术大大缩短了反应时间、降低了对仪器的依赖[10]。常见的等温扩增技术包括环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)[11]、重组酶聚合酶等温扩增技术(recombinase polymerase amplification,RPA)[12]、依赖核酸序列扩增(nucleic acid sequence based amplification,NASBA)[13]、链替代扩增(strand displacement amplification,SDA)[14]、滚环扩增(rolling circle amplification,RCA)[15]等。目前,等温扩增技术已广泛应用于多种检测病原体的研究,如葡萄卷叶伴随病毒3、鲍曼不动杆菌、沙眼衣原体等[16-18],这些快速检测方法的建立为开发新的诊断技术奠定了基础。
酶促重组等温扩增技术(enzymatic recombinase amplification,ERA)是一种新型等温核酸扩增技术,是RPA技术的改良版本[19]。ERA技术操作简单,耗时短,相比于普通PCR(反应时间1.5 h)[20],LAMP(反应时间 1 h)[21],ERA 技术 15-20 min 即可完成检测。此外,该方法重复性好,操作简单,无需专业背景的操作人员,也不需要大型精密仪器,仅需要便携式荧光仪即可。目前,还尚未发现将该方法运用到肺炎支原体检测的研究。因此,本研究基于ERA技术建立快速检测肺炎支原体的实时荧光检测方法,利用ERA技术对肺炎支原体P1基因进行扩增,在反应体系中引入荧光探针,用荧光仪对发出的荧光进行分析检测。在保证痕量高灵敏度、高特异性检测的情况下,极大的降低对时间及环境的要求,使得利用基因分子检测技术建立快速、低耗的社区肺炎支原体核酸检测技术成为可能。
1 材料与方法
1.1 材料
1.1.1 菌株和临床标本 肺炎支原体标准菌株(ATCC 29342)由南华大学衡阳医学院病毒所提供;34份发热呼吸道候症群临床病例的咽拭子标本由南华大学附属南华医院检验科提供。
1.1.2 仪器和试剂 ERA荧光型核酸扩增试剂盒(苏州先达基因科技有限公司)、QIAamp DNA提取试剂盒(QIAGEN GmbH)、肺炎支原体核酸检测试剂盒(圣湘生物科技股份有限公司)、ABI 7500荧光定量PCR仪(Thermo Fisher Scientific)
1.2 方法
1.2.1 引物、探针的设计与合成 在NCBI的GenBank数据库检索并下载肺炎支原体保守基因P1的基因组(>NC_000912.1:180858-182404),ERA引物和探针设计与常规PCR不同,根据以下参数,使用在线软件Primer BLAST设计引物和探针:引物长度为30-35个核苷酸;Tm值为50-75℃;GC含量为30%-70%;探针长度为46-52个核甘酸,其中至少30个位于THF位点的5'端,另外至少15个位于其3'端;荧光基团与淬灭基团只能标记在胸腺嘧啶(T)上,且荧光基团与淬灭基团间距在2-5个碱基;THF为替换位于荧光基团与淬灭基团之间的某碱基;且探针的3'端需加上阻断基团。引物和探针均尽可能避免引物二聚体。使用BLAST分析引物和探针特异性,确保与其他病原体不会发生错配。详情如表1和图1所示。所有寡核苷酸引物由生工生物工程(上海)股份有限公司合成。

表1 ERA实时荧光法引物和探针序列Table 1 Primer and probe sequences of ERA real-time fluorescence method
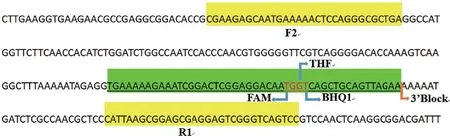
图1 ERA实时荧光法引物和探针序列Fig. 1 Primers and probe sequences for ERA real-time fluorescence method
1.2.2 核酸提取 使用QIAamp DNA提取试剂盒对标准菌株和临床样本进行核酸提取,-80℃保存。
1.2.3 ERA实时荧光法快速检测肺炎支原体方法的建立 向内含重组酶、单链DNA结合蛋白、链置换DNA聚合酶冻干粉的反应管中加入50 μL的反应体系,包括21.2 μL的水,20 μL的溶解剂,10 μmol/L的正向引物和反向引物各2.1 μL,0.6 μL的探针(10 μmol/L),2 μL 的模板和 2 μL 激活剂。其中,2 μL的激活剂加在反应管盖中,通过短暂离心使激活剂进入预混合液中,再次快速离心。迅速将离心后的反应管放入事先调好程序的qPCR仪中,在37℃孵育20 min,每分钟监测一次荧光,实时监测反应动态,同时设置阴性对照。
1.2.4 ERA系统条件优化 针对肺炎支原体P1基因,分别设计两条上游引物和下游引物,分别用F1、F2、R1、R2表示,并交叉配对为4组引物对,将不同的引物对加入反应体系,通过荧光曲线观察优化结果;选定最佳引物后,观察不同的反应温度(25℃、30℃、35℃、40℃)对反应体系的影响。每次反应中肺炎支原体标准菌株模板浓度为105copies/μL,以无酶水作为阴性对照。
1.2.5 敏感性检测 确定一段包含上下游引物在内的肺炎支原体部分序列,将其克隆至pUC57载体上,构建重组质粒。将该质粒进行梯度稀释至终浓度为106、105、104、103、102、101、100copies/μL, 用 建立好的ERA实时荧光法对每个样品进行检测,同时以无酶水作为阴性对照,评价该方法的敏感性。
1.2.6 特异性检测 用建立好的ERA实时荧光法分别对肺炎克雷伯菌(Klebsiella pneumoniae,KPN)、鲍曼不动杆菌(Acinetobacter baumannii,AB)、铜绿假单胞菌(Pseudomonas aeruginosa,PAE)、金黄色葡萄球菌(Staphylococcus aureus,SAU)、流感嗜血杆菌(Haemophilus influenzae,HIB)、鹦鹉热衣原体(Chlamydia psittaci,Cps)和肺炎支原体(MP)进行检测,病原体的模板浓度均为105copies/μL,以无酶水作为阴性对照,评价该方法的特异性。
1.2.7 临床样本验证 收集肺炎支原体感染者和健康人的样本共34例,同时用ERA荧光法和肺炎支原体核酸检测试剂盒(PCR-荧光探针法)检测,同时以无酶水作为阴性对照。以荧光定量PCR法的结果作为标准,评价基于ERA实时荧光法的诊断敏感度、特异度、阳性预测值和阴性预测值。
2 结果
2.1 ERA实时荧光法的建立和条件优化
用本研究建立的ERA实时荧光法同时对肺炎支原体标准株和阴性对照进行检测,结果发现阴性对照的荧光曲线无变化,几乎保持水平状态,而肺炎支原体产生的荧光曲线在10 min左右起峰迅速,反应20 min时几乎达到饱和状态,荧光值远超过阴性对照(NTC)产生的荧光强度,表明该方法具有可行性(图2-A)。随后,分别用4组引物对P1基因进行ERA实时荧光检测,结果显示由F2R1组成的引物对相较于其他引物对(F1R1、F1R2、F2R2)起峰速度快,产生的荧光强度高,与阴性结果之间的差异更为显著,因此将F2R1作为后续研究的引物对用于ERA实时荧光法快速检测肺炎支原体(图2-B)。接下来,又分别对25℃、30℃、35℃、40℃这4个温度进行条件优化,结果显示该方法的温度适用范围广,在25-40℃均可以发生扩增反应,完成对肺炎支原体的检测;当反应温度为25℃时,反应速度最为缓慢,荧光曲线在15 min内几乎无变化,随后荧光值才缓慢上升;其他3个温度(30℃、35℃、40℃)几乎同时起峰,其中30℃时的反应速度较慢,荧光值也略低,35℃和40℃在反应初期荧光曲线就明显上升,40℃温度下的曲线比35℃反应略快些,但由于在该条件下反应18 min后荧光值明显下降,此时35℃下的荧光曲线仍保持稳定状态(图2-C),因此选择35℃作为ERA实时荧光法检测肺炎支原体的最佳反应温度。
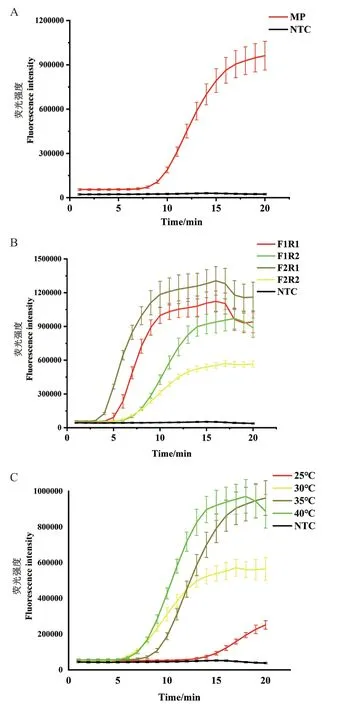
图2 ERA实时荧光法的建立(A)和条件优化(B-C)Fig. 2 Establishment(A)and condition optimization(B-C)of ERA real-time fluorescence method
2.2 敏感性分析
将建立好的ERA实时荧光法对10倍梯度稀释的质粒进行检测分析,结果显示,该方法对肺炎支原体质粒的检出限为103copies/μL(图3)。
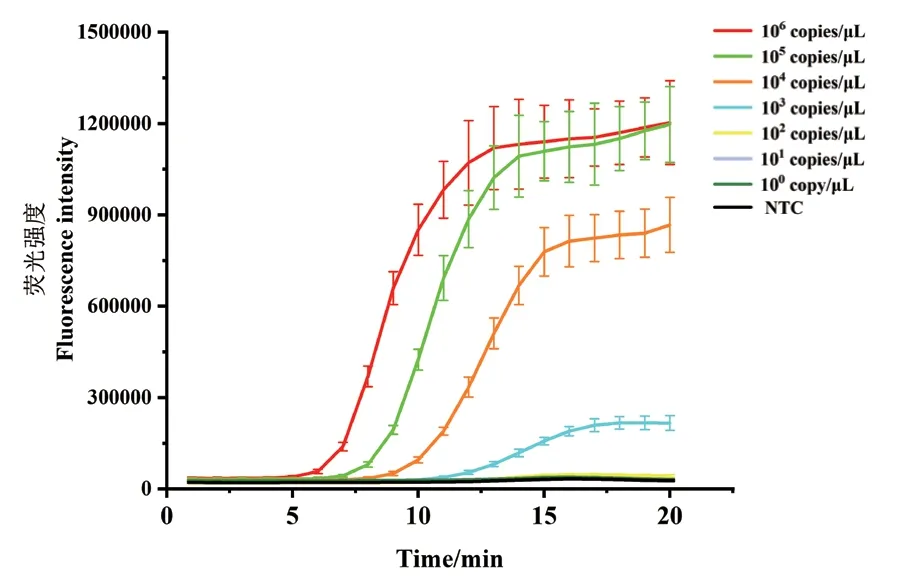
图3 ERA实时荧光法敏感性分析Fig. 3 Sensitivity analysis via ERA real-time fluorescence method
2.3 特异性分析
对肺炎支原体和其他6种呼吸道病原体(KPN、AB、PAE、SAU、HIB和Cps)运用已建立好的ERA实时荧光法进行快速检测,结果如图4显示,只有肺炎支原体产生荧光曲线,完成快速扩增,而其他病原体均无扩增曲线产生,与阴性结果保持一致,表明该方法特异性好,与其他病原体无交叉反应。
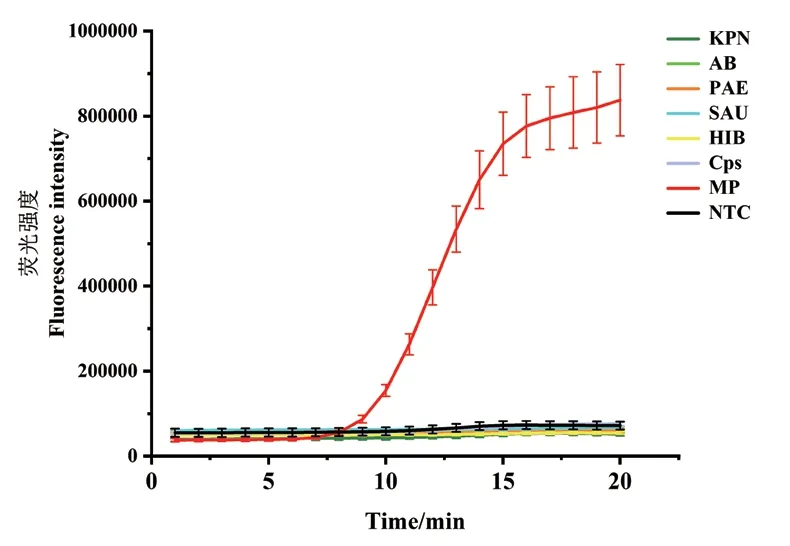
图4 ERA实时荧光法特异性分析Fig. 4 Specificity analysis via ERA real-time fluorescence method
2.4 临床样本验证
为验证ERA实时荧光法与荧光定量PCR法的符合程度,同时用这两种方法对34例临床样本进行检测,以荧光定量PCR法的结果作为标准,ERA实时荧光法的检测结果如图5(图中水平虚线为检出限阈值)所示,8例阴性样本(-1--8)的结果均为阴性,26例阳性样本(1-26)中得到25个阳性结果。经统计(表2),ERA实时荧光法的诊断敏感度为96.15%(25/26)、诊断特异度为100%(8/8)、阳性预测值为100%(25/25)、阴性预测值为88.89%(8/9),说明ERA实时荧光法跟标准荧光定量PCR方法阳性和阴性预测值有很好的一致性。
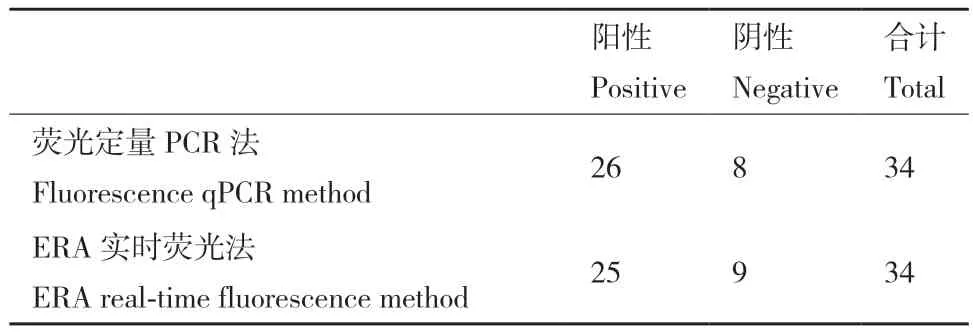
表2 ERA实时荧光法与荧光定量PCR法的比较Table 2 Comparison between ERA real-time fluorescence method and fluorescence qPCR method
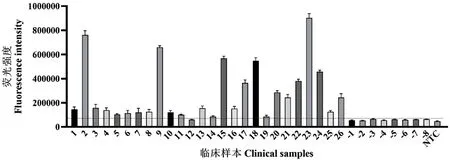
图5 ERA实时荧光法的临床样本验证Fig. 5 Clinical sample validation via ERA real-time fluorescence method
3 讨论
肺炎支原体是是儿童社区获得性呼吸道感染、尤其是非典型肺炎的重要病原体,临床症状以咳嗽、发热、咽喉痛和肌肉疼为主[22],与腺病毒、流感病毒、SRAS等其他呼吸道病毒相似,易漏诊和误诊。分离培养是诊断肺炎支原体感染的“金标准”,但肺炎支原体属于苛养菌,生长条件要求高,培养时间长,已不能满足临床快速诊断需要[23]。抗体的产生需要窗口期,因此抗原抗体反应不能用于支原体早期筛查[24]。PCR技术灵敏度高、特异性好,但对仪器、环境和实验人员要求较高,操作复杂[25]。因此,建立一种肺炎支原体早期快速简单的新诊断方法尤为重要。
肺炎支原体基因组有4组重复序列,其中,肺炎支原体的黏附相关蛋白P1包含了3组,分别是RepMP2/3,RepMP4 和 RepMP5[26],其高度保守性适用于肺炎支原体的核酸诊断。因此,本研究选择肺炎支原体P1基因RepMP4区的部分片段作为靶基因来建立ERA实时荧光法进行快速核酸检测,通过荧光观察来优化反应条件,评价其敏感性和特异性,并对临床样本进行验证。
结果表明本研究建立的ERA实时荧光法检测肺炎支原体可实现快速检测,起峰时间在10 min左右,20 min后反应几乎达到饱和状态,相较于RPA、LAMP、SEA的起峰时间分别是14 min、70 min和22 min[27-29],该方法进一步提高了反应速度,减少了检测时间,可满足现场快速检测的需求;敏感性分析利用肺炎支原体构建的重组质粒进行确定,通过ERA实时荧光法对梯度稀释的质粒进行检测,该方法对肺炎支原体的检出限为103copies/μL,与LAMP检测肺炎支原体的结果一致[30],远高于SEA技术的敏感性[29]。虽然ERA实时荧光法的检出限低于实时荧光PCR法,但较高的阈值可防止由于检测方法过于敏感而产生假阳性结果;对肺炎支原体和其他6种呼吸道病原体进行ERA实时荧光法检测,除肺炎支原体外,其他病原体均为阴性结果,未出现交叉反应,显示了该方法对肺炎支原体的特异性;以荧光定量PCR结果为标准,对34分临床样本进行监测分析,检测出25份阳性结果,9份阴性结果,该方法的诊断敏感度、特异度、阳性预测值、阴性预测值分别为96.15%、100%、100%、88.89%,与RTFQ-PCR的检测效能相当[31]。
尽管ERA实时荧光法可以快速、敏感、特异地检测出肺炎支原体,但该方法的探针设计复杂,价格较贵,且在高温条件下的结果不太稳定,产生“跳跃”现象,有待进一步探究与完善。综上,本研究建立的ERA实时荧光法检测肺炎支原体具有检测周期短、敏感性好、特异性高的特点,还可以在常温下进行扩增,实验设备要求简单,仅需一台荧光仪即可。此外,该方法操作简单,非专业人员也可以完成检测,满足现场检查的需求,使得利用基因分子检测技术建立快速低耗的社区肺炎支原体核酸检测技术成为可能。
4 结论
本研究针对肺炎支原体P1基因设计并建立了ERA实时荧光法,并应用于肺炎支原体的检测,结果发现F2R1引物对的扩增效果最佳,在35℃条件下反应20 min即可达到平台期,反应敏感性为103copies/μL,与其他病原体无交叉反应,临床诊断敏感度、诊断特异度、阳性预测值、阴性预测值分别为96.15%、100%、100%、88.89%,表明该方法具有快速简单,敏感性好,特异性高等特点。
