细菌黏菌素耐药性及其逆转机制研究进展
2022-11-05胡功政崔小蝶翟亚军贺丹丹
胡功政 崔小蝶 翟亚军 贺丹丹
(河南农业大学动物医学院,郑州 450046)
黏菌素(colistin,COL)属于阳离子多肽类抗生素,因肾脏和神经毒性于20世纪70年代几乎被弃用,由于多重耐药(multidrug-resistant,MDR)革兰阴性菌的出现,医学和兽医临床将面临无抗菌药可用的局面,因此COL又被老药新用,作为治疗严重MDR革兰阴性菌感染的最后一道防线。而随着COL使用的增长,细菌COL耐药性世界范围内日益增长,已成为全球关注的焦点。研制具有新作用靶点的新抗菌药异常艰难,而逆转耐药性的联合用药(与新的化合物或老药联用)是与MDR细菌斗争的经济、有效策略。联合用药可利用药物间的协同作用,大幅提高抗菌疗效,克服细菌耐药性,减缓耐药性发展。逆转COL耐药性的化合物筛选、逆转作用(联合用药协同增效)及其机制研究,近年已引起国内外高度重视[1-4],并已取得可喜进展。
细菌COL耐药性,本质上是细菌在COL压力下、为了生存而产生的适应性反应,与COL的作用机制密切相关;而联用药物或佐药的逆转作用往往也针对其作用机制和耐药机制,即作用机制、耐药机制与逆转耐药机制间具有有机的内部联系。
1 COL作用机制
过去一般认为COL对革兰阴性菌的作用机制是膜损害(膜裂解死亡途径),现在的试验已证明其作用机制还包括:囊泡-囊泡触联途径、活性氧(reactive oxygen species,ROS)杀灭途径及呼吸酶抑制途径。
1.1 膜裂解死亡途径
COL可选择性地与革兰阴性菌外膜(outer membrane,OM)LPS(起始靶位)结合,通过膜裂解杀灭细菌[5-7]。首先,COL带正电荷的二氨基丁酸残基中的游离r-氨基质子化,静电吸引类脂A中带负电荷的磷酸头部,竞争性替代Ca2+和Mg2+。随后COL分子插入疏水性N-末端脂肪酸链和D-phe6-L-leu7片段进入外膜,减弱邻近类脂A的组装,引起外膜膨胀并形成不稳定区。最后,COL横跨疏水头部和脂肪酸链的表面,引起自促摄入(self-promoted uptake),使内膜(internal membrane,IM)稀薄并破坏磷脂双层的完整性,从而导致IM裂解和细菌死亡。
1.2 囊泡-囊泡触联途径
COL分子可借助于静电作用和两个疏水区,与阴离子的磷脂囊泡(即OM内叶和IM的外叶)结合,介导环绕周质的囊泡-囊泡触联融合,引起囊泡间(OM和IM小叶间)的磷脂交换,导致磷脂组成的特异性丧失和渗透性平衡破坏,使细菌裂解死亡[5-7]。
1.3 羟基自由基(·OH)诱导的死亡途径(活性氧ROS杀灭途径)
COL穿过外膜和内膜时,使细菌活性氧(ROS)[超氧化物(O2-)、过氧化氢(H2O2)、羟自由基(·OH)]水平升高,首先促进生成O2-,O2-随后由超氧化物歧化酶(SOD)转换成H2O2,H2O2将Fe2+氧化成Fe3+并生成·OH(芬顿反应)。·OH可导致DNA损伤、脂质和蛋白质的氧化损伤,最终导致细菌死亡[5,7]。这一过程不依赖于COL与OM特异性靶位点的结合。
此外,COL刺激大肠杆菌soxS的表达,soxS是sodA(编码含Mn-SOD),fpr(编码NADPH:铁氧蛋白氧化还原酶)和ydbK(编码Fe-S还原酶)等ROS应激相关基因的转录激活剂[5]。
1.4 呼吸酶抑制途径
COL穿过外膜和内膜进入细胞后,可加速TCA(三羧酸)循环和增强呼吸链,通过抑制细菌呼吸链中的NADH氧化酶等关键酶,造成呼吸链混乱并生成超氧化物[5-6]。
2 COL耐药机制研究进展
沙门菌、大肠杆菌等对COL的获得性耐药机制十分复杂,主要有染色体介导的脂多糖(LPS)修饰[由双组分信号转导系统(TCSs)PhoPQ和PmrAB]、质粒介导的可转移COL耐药(mcr基因)及尚未阐明分子机制的主动外排系统等[7-9]。
2.1 染色体介导的LPS修饰(涉及2个TCSs PhoPQ和PmrAB)
2.1.1 PhoPQ介导LPS类脂的AL-Ara4N修饰 TCS PhoPQ由感应子激酶PhoQ和调控子PhoP组成(图1)。PhoP通过感应阳离子抗菌肽等外部信号使自身发生磷酸化而被激活,后者再激活arnBCADTEF(也称pmrH)的表达。pmrH编码4-氨基-4-脱氧-L-阿拉伯糖(Ara4N)转移酶,使阳离子的Ara4N加成到类脂A的磷酸基团,产生L-Ara4N化修饰,导致阳离子COL与外膜阴性LPS的亲和力降低,使细菌耐药[7-9]。MgrB为负性调控蛋白,通过抑制PhoQ而抑制pmrH的表达。mgrB缺失、变异,均可上调PhoPQ和pmrH的表达,导致对COL耐药。
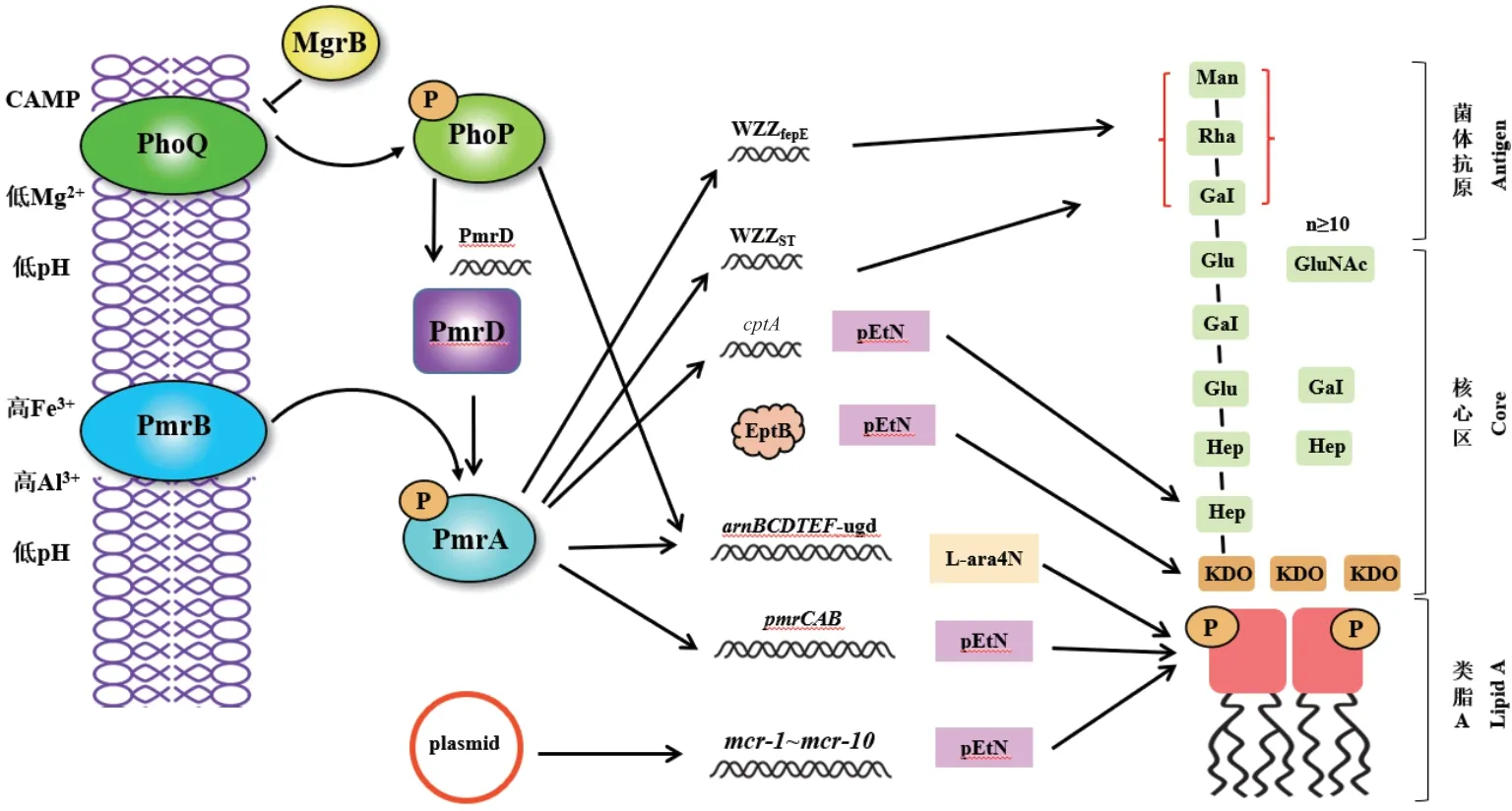
图1 由脂多糖(LPS)修饰介导的沙门菌对黏菌素的一般耐药机制Fig. 1 General mechanism of Salmonella resistance to COL mediated by lipopolysaccharide(LPS)modification
2.1.2 PmrAB介导的类脂A的pEtN修饰 TCS PmrAB由感应子激酶PmrB和调控子PmrA组成(图1)。沙门菌中,PmrD是PhoPQ和PmrAB两个TCSs间的连接蛋白,发挥正调控作用。PmrB感应外部信号(如COL等)被激活,通过磷酸转移使PmrA磷酸化而激活,进而上调pmrC表达,pmrC编码磷酸乙醇胺(pEtN)转移酶,使pEtN加成到类脂A的1-磷酸上,产生pEtN修饰,使细菌耐药[8-9]。PhoPQ也可通过激活PmrD,间接激活PmrAB,进而刺激pmrC的表达。PmrA磷酸化后也可上调pmrH的表达。
PmrA介导的LPS修饰发生于类脂A、核心多糖和 O-抗原链 3 个区域[6,8]。(1)最内的类脂 A区,PmrA除激活pmrC、pmrH外,还可激活L-Ara4N生物合成与类脂A修饰物加合相关基因ugd(编码UDP-葡萄糖-脱氢酶)和pbg(编码L-Ara4N转移酶)的表达;(2)中心的核心多糖区,PmrA可激活eptB和cptA基因,后者的产物可介导LPS核心区磷酸化的庚糖(I)磷酸基团的PEtN修饰;(3)最外的O-抗原链,O抗原长度的增加将导致对COL高度耐药,PmrA可上调沙门菌LPS修饰位点Wzzst和Wzzsep基因的转录,增加LPS中O-抗原量,增加耐药性。
2.2 质粒介导的耐药机制
自质粒介导的mcr-1(编码pEtN转移酶)被发现以来[10],已在全球动物和人的肠杆菌科细菌中相继检出。迄今已报道10种mcr基因(mcr-1-mcr-10)[11]。MCR-1编码一个pEtN转移酶,导致在pEtN加成到LPS的脂质A,增加LPS上的阳离子电荷,从而降低COL与LPS的结合[10]。所有已发表的MCR-1的晶体结构都表明MCR-1的活性位点有至少一个共同的锌离子,证实MCR-1是一种锌离子蛋白[12]。mcr-1可同时位于染色体和质粒上,单拷贝mcr-1可致LPS修饰,而多拷贝染色体mcr-1可促进耐药性的稳定持续[13]。位于质粒上的mcr基因加速了COL耐药性在不同细菌种属之间的传播,因此为解决COL耐药日益严重的问题,中国已禁止将COL作为饲料添加剂用于促生长,许多欧洲国家也减少了COL在畜牧业中的应用[14]。
2.3 未阐明分子机制的主动外排系统
采用正向(激活)或反向(基因缺失或外排泵抑制)研究均证明,外排泵如AcrAB-TolC(大肠杆菌、沙门菌等),KpnEF(肺炎克雷伯菌),以及MexXYOprM(绿脓杆菌)等在COL耐药性中十分重要[8-9]。外排泵抑制剂CCCP能逆转多种细菌对COL的耐药性,无论涉及pmrB、mgrB变异,还是涉及mcr-1阳性,均有逆转效果[15]。我们前期研究发现,沙门菌主动外排系统(AcrAB-TolC)ΔacrB时,并不明显改变对COL的敏感性,但当ΔtolC或ΔacrB与CpxAR系统激活协同作用时,菌株对COL的敏感性显著增强[16-19]。而SoxRS可通过上调AcrAB-TolC介导阴沟和阿氏肠杆菌对COL的异质性耐药[20]。尽管现已证明外排泵在COL耐药性中有重要作用,但其具体分子机制并不清楚。
3 佐药逆转细菌COL耐药性的研究进展
3.1 逆转COL耐药性的药物或化合物
研发新抗菌药耗时长、费用高、风险大,而抗生素佐药(adjuvants)针对细菌的非必须功能,并增强抗生素活性,可提供经济有效的方法逆转细菌耐药性。
目前,应用佐药逆转COL耐药性已成为研究热点,有多种方法用于佐药筛选,如表型检测(MIC测定、棋盘试验等)、分子对接技术、生物信息学方法[4]和万古霉素低温拮抗作用筛选方法[21]等。万古霉素低温拮抗作用是有用的较新的特异性筛选平台,E.coli在应激期间对万古霉素变得敏感,这种表型可由灭活涉及外膜生物合成尤其是LPS核心多糖合成所必需的基因所逆转。由于涉及非必需的外膜生物合成的基因损害,常常使革兰阴性菌对经典的作用于革兰阳性菌的抗生素敏感,故在低温下即15℃对万古霉素拮抗作用的筛选检测,可检出扰乱外膜的非致死分子即逆转COL耐药性的化合物。已有研究利用该筛选方法对1 440种之前批准的药物进行了筛选,筛选鉴定出1种活性化合物喷他脒(pentamidine),能够逆转革兰阴性菌的COL耐药性,突显了这种筛选方法的特异性。
已报道逆转COL耐药性的佐药约60余种,主要包括(1)抗寄生虫药物:如抗原虫药喷他脒、水杨酰苯胺类抗蠕虫药五羟氯柳胺、氯硝柳胺、碘醚柳胺等[21-25];(2)大环内酯类抗革兰阳性菌抗生素克拉霉素、阿奇霉素等[26];(3)其他药物:褪黑素[27]、紫檀芪(抗癌)[28]、叠氮胸苷[29]、阿司匹林等;(4)天然化合物:如白藜芦醇、熊果酸、蛇床子素、丁香酚[30-33];(5)药物衍生物:如苯并咪唑、色胺和苯氨乙酮衍生物和[34-35];(6)新的先导化合物:如广谱佐药SLAP-S25[1]、OmpA抑制剂AOA-2[36];(7)小分子化合物 :二氨基咪唑[37]、dephostatin[38]和带正电荷的二胺吗啡代寡核苷酸肽[39]。
3.2 逆转COL耐药性的分子机制
逆转COL耐药性的机制研究报道不断增加,但仍处于初步探索阶段,大多数仅针对相应药物的某一方面机制进行研究且不深入,复杂的逆转机制阐明仍面临着挑战。目前已报道的逆转COL耐药的机制主要分为以下几个方面:与COL作用机制相关的逆转机制,与COL耐药机制相关的逆转机制、影响外膜蛋白表达的逆转机制以及综合逆转机制。
与COL作用机制相关的逆转机制主要有:(1)损害细菌外膜:通过外漏蛋白质或核酸含量的测定、膜完整性和通透性试验、细菌的溶解检测等试验证明 :如喷他脒[21]、氯羟柳胺[22]、粉防己碱[40]等逆转细菌(肺炎克雷伯菌、铜绿假单胞菌、鲍曼不动杆菌、大肠杆菌)COL耐药性,其机制在于损害细菌外膜而增加了细菌外膜的通透性;(2)增强氧化应激:质子驱动力(PMF)的破坏会减少ATP的生成,增加氧气消耗和氧化应激。当外排泵受到抑制时,通过PMF、细胞内ATP水平、耗氧量及菌体内氧化还原电位测定等证明,氯硝柳胺能使大肠杆菌解偶联氧化磷酸化,破坏菌株的氧化还原稳态,导致氧化应激增加,是逆转COL耐药性的机制之一[41]。
与COL耐药机制相关的逆转机制主要有:(1)抑制mcr-1的表达或抑制MCR-1蛋白,如粉防己碱可抑制 mcr-1 的表达[40];蛇床子素[32]、紫檀芪[28]、苯氨乙酮衍生物(能通过氢键与MCR-1蛋白互作,抑制MCR-1晶体所导致的磷酸乙醇胺(pEtN)转移反应,抑制MCR-1的酶活性)[35]、丁香酚[33]不仅可抑制mcr-1的表达,而且其酚羟基还可与MCR-1蛋白的锌原子结合,与COL联用对大肠杆菌产生协同抗菌作用;带正电荷的二胺吗啡代寡核苷酸肽[39]是以mRNA为靶位、阻止翻译的MCR-1反义分子,能恢复mcr-1阳性大肠杆菌对COL的敏感性。(2)下调TCS pmrAB表达,如小分子二氨基咪唑[37]及亚硝苯胺类化合物dephostatin[38],能显著下调或阻断TCS pmrAB,逆转类脂A修饰,阻断细菌(沙门菌)对COL的耐药性。(3)外排泵机制:基因缺失技术证明,沙门菌标准菌株JS主动外排系统ΔtolC时,能够明显改变对COL的敏感性,菌株对COL的敏感性显著增强[19]。采用表型改变、外排泵活性、分子对接、转录组、基因缺失、荧光探针检测等试验及细菌细胞内的抗生素浓度变化证明,多类逆转药物(如氯羟柳胺[22]、熊果酸[31]、CCCP[15]和粉防己碱[40])均有外排泵抑制作用,能使COL耐药的大肠杆菌或沙门菌恢复敏感性。
影响外膜蛋白表达的逆转机制:AOA-2通过下调OmpA和上调OmpA25的表达量,增强COL对鲍曼不动杆菌的杀菌活性[36]。
综合逆转机制,如SLAP-S25通过膜损害、代谢改变和细胞内抗生素蓄积[1]多种机制恢复细菌对多种抗生素包括COL的敏感性;褪黑素能增加外膜的通透性、促进氧化损伤和抑制外排泵[27],逆转由MCR介导的阴性菌对COL耐药性。粉防己碱通过增强COL的膜损伤能力、破坏了细菌的质子动力、外排泵功能和抑制MCR-1蛋白来逆转由MCR介导的沙门菌对COL的耐药性(图2)[40]。
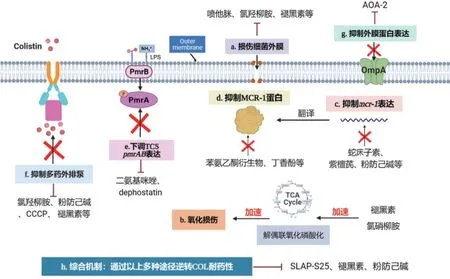
图2 逆转革兰阴性菌黏菌素耐药性的分子机制Fig. 2 Molecular mechanism of reversing COL resistance in gram negative bacteria
4 存在问题与展望
近年文献报道的逆转细菌COL耐药性的佐药已有60余种,但因有效性、安全性、特异性和合理用量等问题尚无一个成功用于临床。这些佐药的化学结构及药理作用各异,其共性逆转机制除膜损害、mcr-1表达降低或MCR-1活性抑制得到清晰的阐明外,对其他方面分子机制的研究尚不系统深入。例如,抑制外排泵、增加氧化损伤被证明是逆转COL耐药性的重要机制,但革兰阴性菌外排泵有多种,除最重要的外排系统AcrAB-TolC外,依赖TolC的RND外排泵还有AcrAD-TolC、AcrEF-TolC、AcrABTolC等多种,每种外排泵又有多个组分,且其表达受marA、soxS、robA、ranA等全局调控基因的调控。佐药抑制何种外排泵、如何抑制外排泵而逆转COL耐药性及其量效关系?又如氧化损伤涉及ROS产生、清除、TCA循环、呼吸链等环节,佐药通过影响何种环节,来逆转细菌对COL的耐药性?其量效关系如何?目前对佐药或联合用药逆转COL耐药性的分子机制远未阐明,该方面的研究总体处于初步阶段,是制约安全高效佐药筛选及联用措施建立的关键瓶颈。
随着组学(转录组、代谢组和蛋白质组)技术的应用,结合差异基因的缺失与回补,将推动佐药的具体靶点(如外排泵、氧化应激和代谢途径)得以揭示,令新的佐药筛选更具针对性;而对逆转作用的量效关系研究,将使得联合用药方案或其复方制剂中佐药用量的确定有科学的理论依据。可以预见,一批新的逆转COL耐药性的高效佐药将陆续筛选发现,逆转耐药性的研究理论将不断的丰富、深化和完善。
