质粒接合转移及其抑制剂的研究进展
2022-11-05刘艺云邓利敏岳慧颖岳超刘健华
刘艺云 邓利敏 岳慧颖 岳超 刘健华
(华南农业大学兽医学院,广州 510642)
抗菌药物在感染性疾病的治疗过程中发挥了重要作用,但也给细菌带来选择性压力。随着抗菌药物的广泛使用,细菌耐药性快速发展且新耐药菌不断出现。据估计,全球每年因耐药菌感染引起的死亡人数超过70万,这对公共卫生安全和人类健康构成严重威胁[1],但新药研发缓慢,临床抗感染治疗可选择的抗菌药物越来越少,因此急需探索新型抗菌策略对抗不断复杂化的耐药细菌感染。
质粒等可移动元件介导的耐药基因(antimicrobial resistance genes,ARGs)水平传播被认为是导致耐药性发展如此迅速的重要原因[2-3]。接合是质粒在不同细菌间水平转移ARGs的主要方式,抑制质粒接合转移将有助于控制耐药基因的传播,因此接合转移抑制剂被认为是耐药性防控的有效策略之一,为解决耐药性问题提供了新思路,近年来受到广泛关注[4-5]。本文将在概述质粒接合转移过程及其机制的基础上,对目前已报道的接合抑制剂展开综述。
1 耐药基因传播方式
细菌耐药性具有可遗传性和可传播性,即ARGs可通过垂直克隆和水平基因转移两种方式进行传播。垂直基因转移(vertical gene transfer,VGT)是指细菌通过增殖分裂将其基因从亲代传递给子代[6]。水平基因传播(horizontal gene transfer,HGT)是指基因借助可移动遗传元件(mobile genetic elements,MGEs)在同一种属细菌甚至不同种属细菌间传播,细菌之间的HGT主要有3种方式:转化、转导和接合[7]。MGEs包括质粒、插入序列、转座子和整合子等,其中质粒可在不同菌种/菌株中进行自我复制,且具有接合转移的功能,这些特性使质粒成为ARGs传播的完美载体[3,8]。
现有研究表明,临床上常见的重要耐药基因,如碳青霉烯酶耐药基因(blaNDM和blaKPC等)、超广 谱 β 内 酰 胺 酶(expanded-spectrum β-lactamase,ESBL)基因、黏菌素耐药基因mcr-1和替加环素耐药基因(tet(X4)和tmexCD1-toprJ1等)常位于质粒上,携带耐药基因的质粒通过接合在不同细菌间转移,导致ARGs在全球广泛传播和扩散[7-8]。此外,质粒的接合转移会诱发细菌基因调控,进而将质粒上的ARGs整合到细菌染色体基因组上,从而有效避免质粒不相容性对ARGs水平转移的抑制作用,加速了多重耐药菌的出现[9-11]。携带ARGs质粒的接合转移是导致细菌耐药性迅速发展和越来越复杂的重要原因。
2 质粒的接合过程和机制
接合又称接合转移,是指质粒或整合接合性元件从供体细菌转移至受体细菌的过程。
2.1 参与质粒接合转移的重要元件
质粒的接合转移过程非常复杂,需要许多基因产物的参与,主要包括转移相关基因(transfer,tra)和转移复制起始点(origin of transfer,oriT)(图1-A)[12]。根据功能的不同,转移相关基因tra可分为两种组分:接合配对形成系统Mpf(mating pair formation,Mpf)和DNA 转移和复制系统Dtr(DNA transfer and replication,Dtr)。根据水平转移的能力和特性,质粒可分为自主转移型质粒(又称接合型质粒conjugative plasmid)、可移动型质粒(mobilizable plasmid)和非接合型质粒(non-conjugative plasmid)。其中,接合型质粒一般能够编码接合转移所需的所有蛋白,实现自身在细菌间接合转移(图1-B);可移动质粒只含有Dtr组分,需借助共栖接合型质粒的Mpf系统所编码的通道进行接合转移(图1-B);非接合型质粒无法进行接合转移,但可通过转化或转导等方式进行传播和扩散[7,12]。
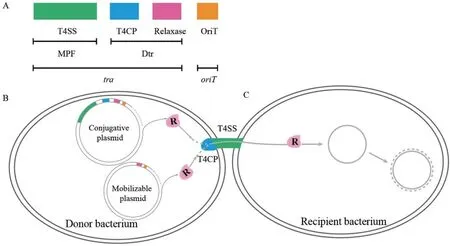
图1 可转移质粒遗传结构示意图(修改自文献[12])Fig. 1 Schematic diagram of the genetic constitution of transmissible plasmids(Modified based on the reference[12])
Mpf系统又称为接合系统,其编码的蛋白组装成复合跨膜蛋白和菌毛,建立细菌间蛋白质和DNA转移的通道(图1-A和图2)。根据蛋白同源性和功能相似性,Mpf系统分为8种类别,其中4种来自变形杆菌门并参与细菌DNA接合转移,包括MPFT(根癌农杆菌pTi质粒virB系统所编码)、MPFF(IncF型质粒编码)、MPFI(IncI型质粒编码)和 MPFG(以流感嗜血杆菌ICEHin1056为原型的整合接合性元件 integrative and conjugative elements, ICE)[13-14]。接合系统常被混淆为Ⅳ型分泌系统(type Ⅳ secretion system, T4SS),但实际上T4SS系统范畴更广,包括3类系统,即效应蛋白转移系统、DNA摄取分泌系统和DNA接合转移系统,因此质粒的DNA接合转移系统(Mpf系统)只是T4SS的一种亚型[15-16]。下文将DNA接合转移系统(Mpf系统)简称为T4SS系统。值得注意的是,虽然不同T4SS系统中的基因/蛋白名称不同,但其所编码的大多数蛋白功能相似、结构高度同源,如IncF型质粒编码的TraBF、TraVF和 TraKF蛋白分别与pTi质粒编码的VirB10、VirB9和VirB7蛋白高度同源[14]。以VirB所编码的T4SS系统为例(图2),该系统是由VirB1-11蛋白组成的跨膜蛋白高分子复合体,根据蛋白位置和功能将其分为3个蛋白结构域:性菌毛(pilus)、通道底部(channel bottom)和跨膜转运通道(transmembrane transport channel)(图2)。其中,菌毛由多个VirB2和小部分VirB5蛋白螺旋组装而成;通道底部由六聚体ATP酶(VirB4和VirB11蛋白)组成,为菌毛的发生和底物运输提供能量;其余VirB蛋白组成跨膜转运通道[17-18]。另外,还有偶联蛋白(type Ⅳcoupling protein, T4CP),如VirD4,结合在T4SS转运通道内膜上,可特异性识别松弛酶和松弛体蛋白等,且为底物运输提供能量[17]。
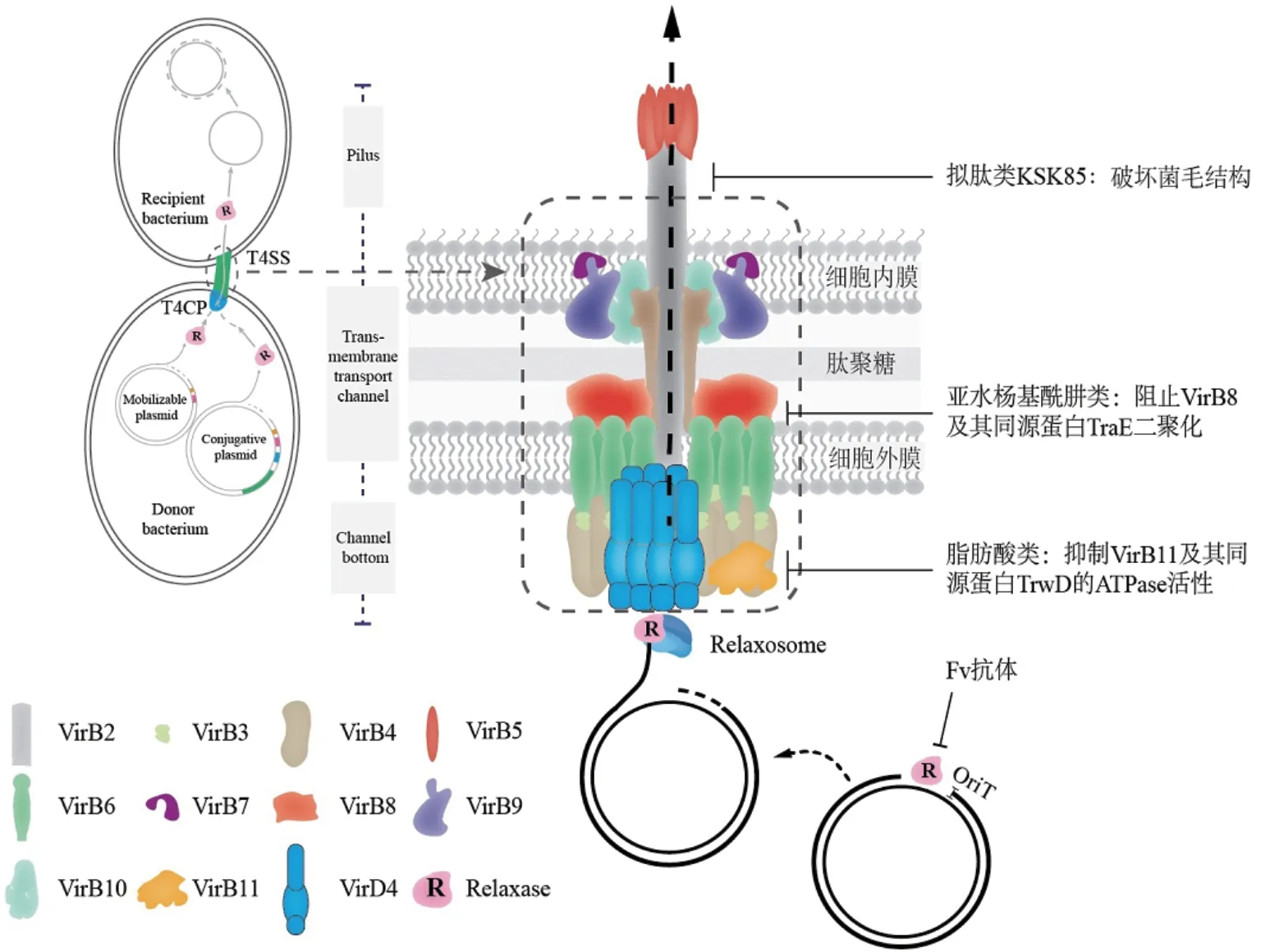
图2 接合转移的结构模型和接合抑制剂的潜在靶点(修改自文献[17])Fig. 2 Structure of conjugation and the potential targets of conjugation inhibitors(Modified based on the reference[17])
Dtr系统是接合型质粒准备转移质粒DNA的功能性组分,该组分系统包括转移起始区(oriT)、松弛酶(relaxase)、松弛体(relaxosome)和多种辅助因子[19]。oriT位点是质粒转移的起始位点,也是质粒转移后DNA末端重新环化的位点。松弛酶是Dtr系统的一个核心组成部分,是一种特殊的DNA内切核酸酶[20]。松弛体由许多种蛋白组成(如IncF质粒所编码的TraY、TraM、TraI蛋白和宿主编码的IHF蛋白),在帮助松弛酶与oriT结合中扮演着重要角色[20-21]。Dtr各组分的功能,将在下文质粒接合转移过程中进行概述,在此不做赘述。
2.2 接合过程及其机制
质粒在细菌间的接合转移主要由松弛酶、偶联蛋白以及接合转移T4SS系统共同调控,是一个多步骤的过程。由于革兰阳性菌和革兰阴性菌细胞结构存在一定差异,质粒在这两种细菌的接合转移过程略有不同,下面以IncF质粒在革兰阴性菌接合转移为例进行介绍。
首先,供体菌的性菌毛游离端与受体细菌接触,细菌之间通过性菌毛和跨膜转运通道形成接合通道。随后菌毛与受体菌接触的信息传递给偶联蛋白,激活松弛酶。被激活的松弛酶在松弛体协助下,特异性识别质粒上oriT序列的nic位点并切开磷酸二酯键,致使质粒变成一条被切割的线状单链DNA(T链)和一条未被切割的环化单链DNA。前者通过转酯反应(松弛酶将T链5'端的脱氧核苷酸键转移至自身的酪氨酸上)与松弛酶共价链接,形成蛋白-DNA复合物(图2);后者在供体菌细胞中通过滚环复制合成第二条DNA链,形成一个完整的质粒。单链质粒DNA与松弛酶形成蛋白-DNA复合物后,偶联蛋白通过特异性识别松弛酶和松弛体以结合或募集蛋白-DNA复合物,随后该复合物被转运至跨膜转运通道上,转运到受体菌中(图1-C和图2)。研究者将T链转移至受体菌的过程比喻为“拍即送模型”[22]:松弛酶充当T链(线状单链DNA)的先导蛋白,通过转运通道从供体菌中被泵到受体菌中,T链搭着松弛酶的“便车”发生了转移。T链到达受体菌后,松弛酶将nic位点识别为终止位点并进行反向切口反应,分解共价蛋白-DNA复合物,T链再环化并通过滚环复制合成第二条DNA链,在受体细菌中形成一个完整的质粒[23-24]。
3 接合抑制剂
接合抑制剂是一类靶向抑制质粒接合转移的物质,可降低质粒及其所携带耐药基因在不同细菌间的传播能力,对耐药性防控具有重要的意义。目前已报道的接合抑制剂主要有天然产物、小分子化合物和纳米材料等,其中天然产物包括脂肪酸类化合物和磷酸化多糖类抗生素。下面按照化合物的化学结构和属性(表1),对各类接合抑制剂分别进行介绍。
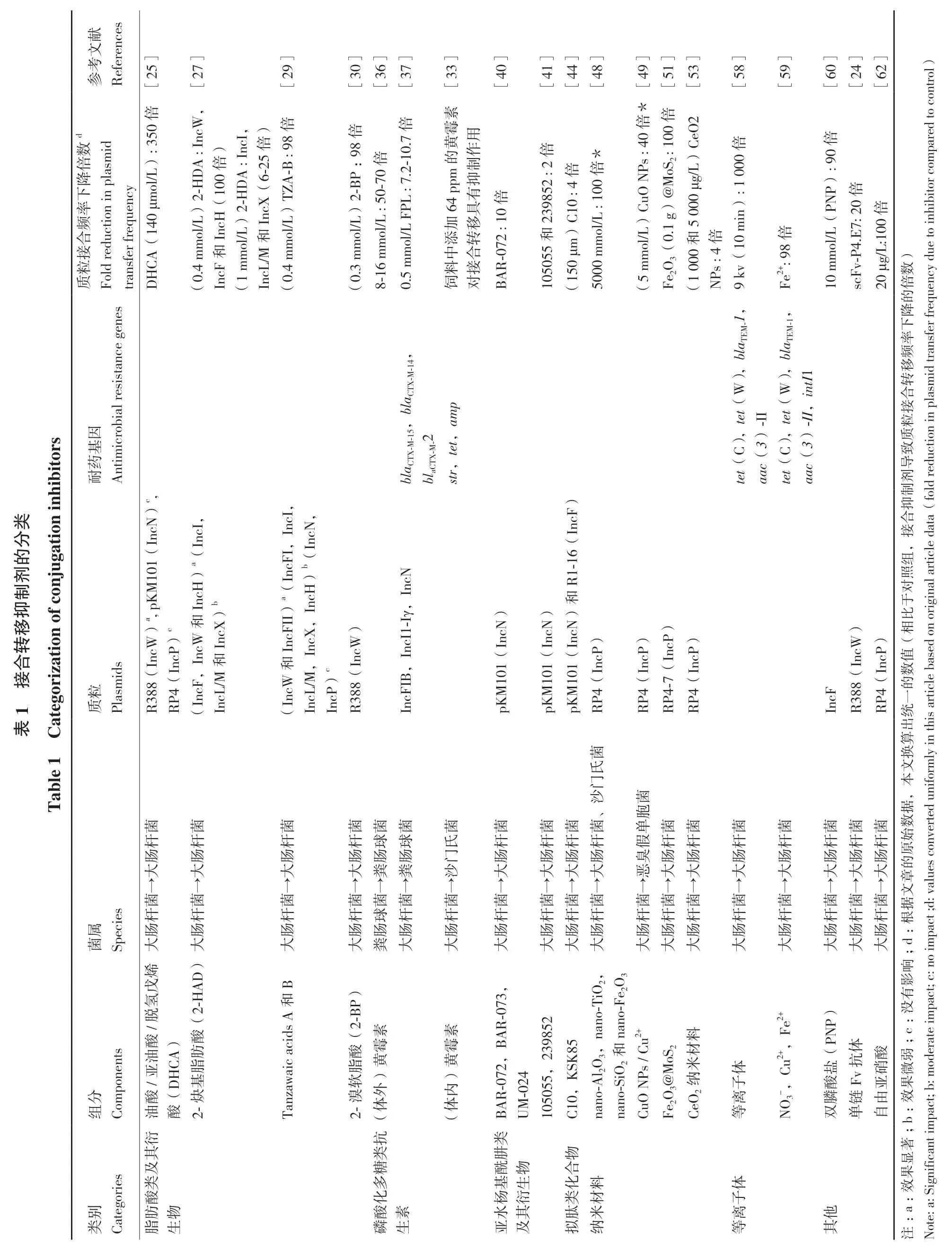
参References献文考[25][27][29][30][36][37][33][40][41][44][48]49][51][53][58][59][60][24][62]倍素*[倍2 d: 7.2-10.7: 350倍倍倍: IncI,)倍霉用A-B : 98数id 00倍eO 倍质Fold reduction in plasm(6-25黄作 倍 *倍)倍pared to control)倍s : 40 μg/L A : IncW,的制 : 2 2-HD倍倍:98 NP降MoS2 : 1 ppm抑TZ): 90 PL 64有下IncH)2-H 52倍率倍(140 μmol/L)DA mol/L)(100 2 : 10)C倍IncX 2-BP mol/L)uO 982300 10 : 4: 100具)C5 0NP ol/L 倍s : 410 m频0.1 g)@倍 (P和和倍合ol/L 55 μg/L ol/L.4 m和transfer frequency加移: 50-70添转mm ol/L接0中合in): 1 000 Fe2+: 9 R-07 ol/L 4.E7: 20 mm 8-16 Fe2O3(00 CA mm mol/L F scFv-P)C 9 kv( )(0 8:100 DH粒和mol/L)料接(0IncFmm/M 0.5 m(1IncL.4 m50μm.3 m50 BA 00 10mm 50饲 对 (1(510(1NP 20数cy due to inhibitor com倍的耐Antimicrobial resistance genes 降M-1,(0频transfer frequen blaTE M-1,blaTE下率转移id),tI1 p合-II X-M-15,blaCT-II, 接X-M-14,am因粒-2基hibitor s 3) 质tet,3) 致药TX blaCT -M C),tet(W blaC),str,tet(c(aatet(c(C),tet(Win aa 导剂reduction in plasm in ) 制fold抑类)c,合分cNIn IncF接的,剂ju gation-1组)a(IncI,移n of con 101(II)a(IncFI,IncI,)b(IncN,6(照制cH IncN R1对抑a, pKM InIncH)b-Iγ,和于IncF和比相on original article data(IncWIncX转))c和,IncX,)IncP))orizatio(R388(IncW),IncI1合M101(IncN)IncP M101(IncN)IncP IncP M101(IncN)IncP粒Plasmids)值1 接IncP和R388(IncW)4(数IncL ateg 4(IncL 4(IncP RP 4-7(IncF的4((IncW/M)c pK 4(IB质pK pK RP RP RP RP IncF R388(IncW)RP 一统表Table 1 C出换ly in this article based(IncF,/M算 文本菌氏菌,门沙据菌、 胞菌菌 菌菌菌 菌 菌 菌菌菌 单菌菌 菌 菌 菌菌菌数杆杆杆球球杆氏 杆 杆杆杆 假杆杆 杆 杆 杆杆杆始verted uniform肠 肠 肠肠肠肠 门 肠 肠肠肠 臭肠肠 肠 肠 肠肠肠原大 大 大粪粪大沙 大 大大大 恶大大 大 大 大大大的→→→→→→ → → →→→ →→→ → → →→→章文属Species 菌菌菌 菌菌菌 菌 菌 菌菌菌 菌菌菌 菌 菌 菌菌菌杆 杆 杆 杆球杆 杆 杆 杆杆杆 杆杆杆 杆 杆 杆杆杆据肠 肠 肠 肠肠肠 肠 肠 肠肠肠 肠肠肠 肠 肠 肠肠肠根act ;d: values con:菌 大 大 大 大粪大 大 大 大大大 大大大 大 大 大大大;d烯 ) 响戊影B AD氢-H R-07 nano-T和e2O3有iO2,脱没aic acids A(2)3,P)/2 e2+素:素油A)酸酸(2-B NP 85nano-F onents 霉霉料BA;c 39肪酸5u2+黄黄l2O3,和亚HC脂材MoS2 u2+,F米(P 体 酸 弱oderate impact; c: no imp酸(D基/软)脂盐)KSK8抗硝R-072,Ps / C微-0分Comp油酸2-炔Tanzaw 105055,2 2-溴nano-A外内24 nano-SiO2 Fe2O3@CeO2 纳 体子酸Fv-,C 亚 果体体BA UM C10,CuO N离NO3膦链由效组等双单自:act; b: m( (衍抗类;b其类肼 物著显别Categories 及 糖 酰物 合类多基生 化料 体 果ignificant imp酸化杨衍 类材 子 效:肪物 酸素 水其 肽米 离 他类 脂生 磷生 亚及 拟纳 等 其 注Note: a: S:a
3.1 脂肪酸类及其衍生物
脂肪酸类化合物接合抑制剂是一类来源于海洋微生物和植物的提取物,最初是基于高通量接合筛选体系(high-throughput conjugation,HTC)得到,并经接合试验证实该类化合物能够抑制质粒的接合转移[25]。Fernandez-Lopez等[25]研究者构建含有荧光标记的重组质粒R388+lux(R388质粒lac启动子下游插入lux报告基因),该质粒在供体菌(含有lacI抑制子)中不发光,只有R388+lux转移到受体菌中(接合转移发生)才发光,从而设计出高通量的HTC。基于HTC,研究人员筛选了植物提取物的化合物库,发现C18不饱和脂肪酸,如油酸(oleic acids)、亚油酸(linoleic acids)和脱氢戊烯酸(dehydrocrepenynic acid,DHCA),对R388质粒接合转移有明显抑制作用,且该类化合物还能降低IncF型 R1质粒和IncP 型RP4质粒的接合转移效率。其中,亚油酸和DHCA对R388质粒的抑制效果最明显,800 μmol/L亚油酸和140 μmol/L的DHCA导致R388质粒的接合频率分别下降了200倍和 350 倍[25]。Li等[26]也发现 3 mmol/L 亚油酸可导致IncX4型mcr-1阳性质粒的接合频率下降100倍。Lopatkin等[11]进一步证实了亚油酸可降低质粒的接合转移能力,发现0.35 μmol/L亚油酸即可抑制质粒接合转移,从而降低质粒在菌群中的入侵和稳定持留。另外,Getino等[27]以抑制活性最强的、具有2-炔基脂肪酸(2-alkynoic fatty acids,2-AFAs)骨架的DHCA为母核结构(图3),经结构优化得到抑制活性更强的化合物,如2-棕榈酸(2-hexadecynoic acid,2-HDA)和 2-硬脂酸(2-octadecynoic acid)。其中,2-HAD是具有一条16个碳原子链长的2-烷基非饱和脂肪酸(图3),对质粒R388在不同菌种,如大肠杆菌、沙门菌、恶臭假单胞菌和根癌农根菌间的接合转移均有抑制作用。除此之外,2-HAD也能够抑制多种质粒在大肠杆菌间的接合转移,如0.4 mmol/L的2-HAD导致IncF、IncW和 IncH质粒的接合频率下降100倍,较高浓度的2-HAD(1 mmol/L)导致IncI、IncL/M和 IncX的接合频率下降6-25倍,但对IncN和IncP质粒无影响。2-HAD在体内也显示出较好的抑制活性,当2-HAD(1.6 μg/mg)添加在鱼饲料或注入小鼠肠道内(100 μg)时,鱼和小鼠肠道内大肠杆菌间的耐药质粒接合转移效率分别降低了10倍和50倍[28]。由于2-HAD对某些细菌和细胞有毒性,其成药性存在问题,研究者从海洋微生物中筛选出细胞毒性较小的tanzawaic acids类化 合 物, 如 tanzawaic acids A 和 B( 图 3)[29]。0.4 mmol/L的tanzawaic acids B可导致IncF、IncW 的接合频率下降100倍,IncFI、IncI、IncL/M、IncX 和IncH的接合频率下降了2-10倍,同样对IncN和IncP 质粒无影响[29]。

图3 脂肪酸类化合物的化学结构Fig. 3 Chemical structure of fatty acid compounds
上述的脂肪酸均属于非饱和脂肪酸,不饱和双键或三键曾被认为是此类化合物发挥抑制活性的必须结构。García-Cazorla等[30]研究发现某些饱和脂肪酸,如2-溴软脂酸(2-bromopalmitic acid)(图3)具有类似的功能,100 μmol/L的2-溴软脂酸导致质粒R388的接合效率降低到对照组的2%左右。尽管上述脂肪酸类化合物结构各异,但均能够抑制VirB11及其同源蛋白(如质粒R388编码的TrwD蛋白)ATPase活性(图2-C)[27,29-30],由此推测脂肪酸可能是通过与相关ATPase互作,从而发挥抑制质粒接合转移的功能。
3.2 磷酸化多糖类抗生素
黄霉素(flavomycin)是一种动物专用的磷酸多糖类抗生素,其化学结构含有1个3-磷酸甘油酸单元、4-5个糖基和1个特殊的异戊烯基脂肪链(图4),可通过干扰细胞壁肽聚糖的合成从而抑制细菌的繁殖,对革兰阳性杆菌具有良好的抑菌效果。由于该类抗生素无法穿透革兰阴性菌的外膜,导致对革兰阴性杆菌没有杀菌效果。相较于黄霉素的抗菌特点,其作为饲料添加剂提高饲料利用率、促进畜禽生长的作用更受关注。但由于药物残留、细菌耐药性和环境污染等原因,自2020年1月起,我国全面禁止使用除中草药外的所有药物作为促生长剂应用于养殖业中[31],这极大限制了黄霉素的应用。值得注意的是,陆续有文章报道黄霉素作为饲料添加剂降低了动物排泄物中耐药菌的数量[32-34],且能够抑制质粒的接合转移[32,35]。

图4 黄霉素的化学结构Fig. 4 Chemical structure of flavomycin
Riedl等[36]研究者通过体外接合试验的方法,研究黄霉素对携带万古霉素耐药基因vanA质粒接合转移的影响,发现黄霉素(8-16 mg/L)可降低万古霉素耐药质粒在粪肠球菌的接合转移频率(降低50-70倍)。随后,Bogaard等[32]发现黄霉素可降低多重耐药大肠杆菌在猪肠道中的数量,但该报道未评估黄霉素对耐药质粒接合转移频率的影响。后来,Poole等[35]发现黄霉素显著降低了质粒在大肠杆菌间的接合转移频率,并发现增加黄霉素的预处理时间可更有效抑制质粒的接合转移。Kudo等[37]研究者也发现黄霉素(2 mg/L)可降低产β内酰胺酶质粒在大肠杆菌间的接合转移频率(1.4-3.0倍),并再次证实该药物(0.5 μg/L)可降低携带vanA基因的质粒在粪肠球菌的接合转移频率(7.2-10.7倍)。最近的研究表明,黄霉素在体内对细菌间质粒接合转移具有较好的抑制作用,当黄霉素64 ppm添加到鸡饲料或250-500 g/t添加到猪饲料时,肉鸡泄殖腔的耐药沙门菌和保育猪粪便中四环素耐药大肠杆菌都显著性降低[33-34]。
显然,上述研究均表明黄霉素具备成为有效接合抑制剂的潜力,为拓展该药在养殖业中的应用提供了新角度。已有的研究尚未系统比较和评估该药物对不同耐药质粒接合转移的抑制效果,其抑制质粒接合转移的作用机制也还有待于进一步研究。
3.3 亚水杨基酰肼类及其衍生物
亚水杨基酰肼类衍生物接合抑制剂是一类蛋白变构抑制剂,是通过细菌双杂交系统高通量筛选得到的T4SS抑制剂[38],该类化合物的母体结构是从假结核耶尔森氏菌中获得[39]。在革兰氏阴性菌中,VirB8蛋白以二聚体的形式参与构建T4SS系统的高分子蛋白复合体,而亚水杨基酰肼类化合物可与VirB8蛋白结合,引起蛋白构象变化且干扰蛋白相互作用,阻止VirB8蛋白二聚化,从而抑制T4SS活性[38]。Paschos等[40]进一步发现该类化合物可结合IncN型质粒 pKM101编码的TraE蛋白(VirB8的同源蛋白),导致质粒pKM101接合转移效率下降。在D8I-2化学结构基础上优化得到的多种化合物(B8I-16、BAR-072、BAR-073 和 UM-024)可显著降低质粒pKM101接合转移,如BAR-072(50 μmol/L)导致质粒pKM101接合转移频率下降了10倍,但是该类化合物对IncP 型RP4质粒接合转移无影响[40]。
在水杨基酰肼类基础上,Casu等[41]经化学结构优化得到了芳基羧酸类化合物(如小分子化合物239852和105055),该类化合物可有效抑制接合转移系统的活性。化合物239852的结构由2-呋喃羧酸和2-氯异烟酸组成,化合物105055具有相似的化学结构(图5),它们都能够有效结合TraE蛋白,抑制TraE蛋白二聚体生成(图2),其与TraE 的平衡解离常数分别为19.6 μmol/L和9.3 μmol/L,对质粒pKM101在大肠杆菌间的接合转移呈现出明显抑制效果。化合物239852和105055(50 μmol/L)联用可导致质粒pKM101的接合效率降低到对照组的45%左右,这两个化合物与上述化合物BAR-072(50 μmol/L)联用对质粒接合转移的抑制效果更明显,导致质粒pKM101的接合效率降低到对照组的5%左右。但化合物239852和化合物105055对IncP型质粒RP4的接合转移仍没有影响[41]。尽管不同质粒所编码的接合系统的组成蛋白具有高度同源性,但结构上仍存在差异,这可能是亚水杨基酰肼类及其衍生物对不同类型质粒接合转移呈现出不同影响效果的原因。

图5 亚水杨基酰肼类化合物的化学结构Fig. 5 Chemical structure of salicylidene acylhydrazide compounds
3.4 拟肽类化合物
拟肽类化合物接合抑制剂是研究者从化合物数据库中筛选得到的T4SS抑制剂,该类化合物具有稠合2-吡啶酮的基本结构骨架(图6)。在T4SS的菌毛装配过程中,分子伴侣-引领蛋白通路(chaperone usher pathway,CUP)调控菌毛蛋白的组装,而稠合2-吡啶酮能够干扰 CUP 活性[42-43]。Shaffer等[44]发现拟肽类化合物,如化合物C10和KSK85,不仅能够抑制幽门螺旋杆菌T4SS所介导效应蛋白的转运,两者也能抑制质粒在大肠杆菌间的接合转移。化合物C10和KSK85(150 μmol/L)都可导致质粒pKM101的接合效率降低到对照组的25%左右,并分别导致IncF型质粒R1-16的接合效率降低到对照组的50%和90%左右[44]。值得注意的是,化合物C10和KSK85仅在2-吡啶酮的萘取代基上相差一个甲氧基(图6),但KSK85能够阻碍T4SS相关菌毛结构的组装(图2),而C10对菌毛的结构没有显著影响。推测KSK85可能通过影响菌毛结构完整性,从而降低质粒的接合转移,而C10可能通过其他方式发挥作用。

图6 拟肽类化合物的化学结构Fig. 6 Chemical structure of peptidomimetic compounds
3.5 纳米材料
纳米材料(nanoparticles,NPs)的基本组成单元是纳米微粒,纳米微粒尺寸(1-100 nm之间)介于原子簇和宏观物体之间,具有表面效应、小尺寸效应、量子尺寸效应和宏观量子隧道效应的基本特性。近年来,随着纳米技术的发展,纳米抗菌材料在抗细菌感染治疗方面也展现出巨大的应用前景,如多种金属及金属氧化物纳米粒子通过破坏细菌蛋白质和DNA、提高活性氧簇(reactive oxygen species,ROS)含量和破坏细胞膜完整性等机制发挥抗菌作用[45-46]。纳米材料也能够影响质粒接合转移的效率,最初研究者发现多种纳米材料(Nano-Al2O3、Nano-TiO2、Nano-SiO2和 Nano-Fe2O3)对质粒RP4、RK2[47]和 pCF10的接合转移有促进作用,使质粒接合频率提高了近100倍,可能与此类纳米材料(5-50 mmol/L)可提高细菌内活性氧的含量和应急反应(SOS)有关[48]。随后,多项研究表明其他纳米材料(CuO NPs、Ag NPs)也可提高细菌内活性氧含量和SOS反应水平,并提高了质粒在细菌间的接合转移[49-50]。
近年来,研究者陆续发现不同金属、不同浓度的纳米材料对质粒接合转移的影响不同。Wang等[51]发现Fe2O3促进RP4(IncP)质粒接合转移,MoS2对质粒接合转移无影响,而Fe2O3@MoS2复合纳米材料(100 mg/L)可显著抑制RP4在大肠杆菌向粪肠球菌、大肠杆菌与大肠杆菌间的质粒接合转移,其抑制效果分别高达10和100倍以上,该抑制活性主要是由于复合纳米材料抑制接合转移相关基因(trfA和trbB)和外膜孔道基因(ompA和ompC)的表达等。Parra等[52]发现 50 mg/L Cu NPs导致IncP质粒从罗尔斯通氏菌转移到恶臭假单胞菌的接合频率降低到对照组的10%。另外,Yu等[53]研究发现高浓度的CeO2NPs(25和 50 mg/L)致使IncP型 RP4质粒在大肠杆菌间的接合频率提高到对照组的118%-123%,而较低浓度(1和 5 mg/L)导致质粒的接合频率降低到对照组的22%-26%。进一步探究CeO2NPs抑制质粒接合转移的机制发现,低浓度CeO2NPs(1 mg/L)可降低细菌内活性氧的积累、降低SOS反应、减少胞外聚合物(extracellular polymeric substances,EPS)。EPS的存在可提高细胞间“接合通道”的稳定性、降低接合转移相关基因(如trbBp、trfAp基因)的表达水平,而高浓度CeO2NPs(50 mg/L)处理后的细菌则呈现出相反的结果[53]。类似的,Liu等[54]再次证明了纳米硫化零价铁可通过上述相似机制,显著降低RP4从大肠杆菌向假单胞菌的转移效率。
虽然目前已报道的金属纳米材料对质粒转移效率的影响有所差异,但根据上述数据可以发现,当纳米材料抑制细菌SOS反应时,质粒的接合转移效率下降。现有的研究表明,质粒以单链DNA形式在细菌间进行接合转移时,激发细菌SOS反应有助于提高细菌基因组稳定性,以确保质粒在细菌间顺利完成转移[55-56]。由此推测纳米材料通过抑制细菌SOS反应,导致质粒接合转移效率下降。另外,Crane等[57]研究者发现锌(如锌离子载体、吡硫锌)通过抑制SOS反应,发挥其抑制质粒接合转移的功能。综上,纳米材料可通过降低细菌SOS反应、降低接合转移相关基因表达和降低细菌间胞外聚合物含量等形式,导致质粒的转移效率降低。
3.6 等离子体
等离子体(plasma)是气体在高压电场间被击穿,致使原子及原子团被电离而产生的正负离子组成的离子化气体状物质。随着等离子体技术的发展,等离子体已被广泛运用于材料、化工医疗等领域。等离子体环境可破坏细菌正常的生理功能,因此被用于医疗器械、食品、牙齿等的消毒与灭菌。最近,Li等[58]发现,大肠杆菌经等离子体(10 min,9 kV)处理后,其质粒的接合频率发生显著下降。研究者还发现在表面等离子氧化条件下,添加NO3-、Cu2+、和Fe2+时,98%质粒的接合转移受到抑制,同时显著消除了细菌的耐药基因(如tet(C)、tet(W)、blaTEM-1和aac(3)-II基因)[59]。与纳米材料抑制质粒接合转移的机制相似,研究者证实了等离子体可降低细菌胞内活性氧含量、ROS反应、细胞间的黏附性(如胞外聚合物含量降低),从而导致质粒接合频率下降[59]。
3.7 其他
除上述几类抑制剂外,还有一些有苗头的化合物,如松弛酶抑制剂。鉴于松弛酶是启动质粒接合转移的关键因子,开发以此为靶点的抑制剂,具有潜在的应有前景。Lujan等[60]发现双膦酸盐能够通过抑制供体菌松弛酶的活性(图2),显著性抑制F质粒接合转移。随后Nash等[61]评估了双膦酸盐对不同质粒接合转移的影响,发现双膦酸盐特异性抑制F质粒的接合转移,而对质粒R100和pCU1影响较小,并发现该化合物是金属螯合物,主要发挥抑制细菌生长的功能。单链Fv抗体是另一种以松弛酶为靶标的接合抑制剂,Garcillán-Barcia等[24]发现单链Fv抗体能够抑制质粒R388松弛酶(TrwC)的活性,当Fv抗体在受体细胞中表达时,可降低质粒在细胞间的接合频率。
另外,还有其他类化合物也展现出具有抑制质粒接合转移的功能,如自由亚硝酸通过改变细菌胞内铁离子浓度、抑制接合转移相关基因表达,导致质粒RP4在大肠杆菌间的接合转移频率显著下降[62]。尽管有研究报道褪黑素可抑制质粒的接合频率[63],特别是导致携带mcr-1基因质粒的接合频率显著性下降,但应注意的是,褪黑素和黏菌素具有协同杀菌效果[64],mcr-1阳性接合子的减少可能主要是由于两个药物同时筛选接合子时产生的协同杀菌作用所致,而非褪黑素抑制mcr-1质粒转移所致。
4 结语与展望
质粒是耐药基因传播的主要载体之一,降低质粒在细菌间的接合转移效率,可有效防控耐药基因/耐药菌的传播和扩散。在松弛酶、偶联蛋白以及接合转移T4SS系统共同调控下,质粒从供体细菌通过接合通道单向转移至受体细菌中,致使质粒携带的耐药基因在不同细菌间传播。接合抑制剂通过降低质粒的接合转移能力,从而减缓耐药基因/耐药菌的扩散,是一种有潜力的新型抗菌策略[4-5,19]。
目前多数接合抑制剂显示出较好的抑制活性,主要是通过破坏T4SS系统所编码转移通道的结构和功能的完整性,导致质粒接合转移能力下降,其中部分抑制剂,如脂肪酸类、亚水杨基酰肼类和拟肽类化合物等,是以某一类接合T4SS系统为靶标筛选出来的化合物,只对特异质粒有抑制活性,存在抑制谱较窄的问题[27,29,40,44]。黄霉素在体外和体内均显示出较好的接合抑制活性,但其抑制机制还有待于进一步研究[32-34]。金属纳米材料是近几年报道较多、活性较强的接合抑制剂,主要是通过干扰细菌生理功能降低耐药质粒的传播,没有质粒特异性,具有良好的应用前景,但由于不同浓度金属原材料对质粒转移的影响不同,不能忽视由其所带来的潜在风险[51-54]。另外,接合转运通道和菌毛为膜蛋白复合体,蛋白分离纯化难度较大,导致靶点不明确,难以明确构效关系,存在难以优化药物结构的缺陷。
尽管存在上述局限,接合抑制剂所具备的优势也不容忽视。抑制剂因不靶向细菌的生存与繁殖,对细菌选择压力小,具有不易诱导耐药性产生的特点。再者,多数抑制剂的靶标是T4SS系统的转运通道和菌毛(位于细菌外膜上)[4,17,44],规避了传统抗菌药物难以穿过细胞膜或被外排泵排出的问题,具备较容易到靶标的优点,展示了良好的应用前景。随着对T4SS系统结构和功能的深入研究,该系统所编码的蛋白组件不断被分离纯化和解析[65-67],靶向T4SS的小分子化合物设计和优化工作将不断提升,未来有望开发更具成药性的小分子接合抑制剂。
