马缨杜鹃Rd3GT1的克隆及对矮牵牛花色形成的影响
2022-11-05孙威张艳王聿晗徐僡徐小蓉鞠志刚
孙威 张艳 王聿晗 徐僡 徐小蓉 鞠志刚
(1. 贵州师范大学生命科学学院 植物生理与发育调控重点实验室, 贵阳 550025;2. 贵州中医药大学药学院,贵阳 550025)
花色素苷是植物中重要的次生代谢产物之一,其除可以赋予植物不同的色彩外,在抵御生物和非生物胁迫、激素转运等方面也发挥着关键作用[1]。花色素苷的生物合成在很多植物中已经研究的很透彻,并且参与其合成的多种酶的功能也成功解析。但是,关于花色素苷的修饰酶,如糖基转移酶、甲基转移酶和酰基转移酶等的研究却相对较少[2]。
类黄酮3-O-糖基转移酶(3GT)作为花色素苷生物合成末端的关键修饰酶,在增加花色素苷的稳定性与多样性方面发挥着重要作用[3]。研究显示,3GT基因最早是从玉米中克隆获得的,随后在很多植物中被成功克隆并进行了功能解析,如金鱼草、龙胆和矮牵牛等[4-5]。关于3GT酶学性质的研究表明,其在催化过程中具有底物选择性与区域特异性。例如,拟南芥与矮牵牛的3GT可以同时以花青素和黄酮醇为底物,但只催化其形成花青素和黄酮醇3-O-糖苷[6-7];而香雪兰的3GT则可以催化花青素不仅形成花青素3-O-糖苷,还形成花青素4’-O-糖苷和花青素7-O-糖苷[8]。有关糖基转移酶的晶体结构与突变分析证明,位于其PSPG结构域中的最后一个氨基酸的种类可以决定糖基转移酶对糖基供体的选择性[9-10]。因此,对不同植物的糖基转移酶进行研究将有助于这一问题的解决。
杜鹃花是我国十大传统名花之一,也是世界著名的观赏花卉,具有较高的观赏和园林应用价值[11]。但有关传统名花杜鹃的花色代谢研究却在很大程度上落后于百合、菊花等观赏植物,这极大地限制了研究者对杜鹃的花色改良及其药用和可食用价值的开发利用。
前期研究发现,花青素3-O-糖苷在马缨杜鹃花朵发育过程中含量一直最高,可达93.68%-96.31%,表明3GT在马缨杜鹃花色形成过程中发挥重要作用。因此,本文利用RT-PCR 技术克隆Rd3GT1基因,并将其转入矮牵牛中,获得转基因植株,随后对转基因植株进行表型鉴定、花色素苷检测及基因表达分析,初步解析了Rd3GT1 参与花色素苷合成的功能,为后续深入探究Rd3GT1的催化机制及其在马缨杜鹃花色形成中的功能奠定基础,也为杜鹃花生物技术育种提供一定的参考和借鉴。
1 材料与方法
1.1 材料
马缨杜鹃花朵取至贵州省百里杜鹃国家森林公园的实验样地,矮牵牛种子购买于内蒙古赤峰市鑫卉园艺有限公司;真核表达载体pBI121、大肠杆菌JM109菌株、农杆菌GV3101菌株均为本实验室保存;克隆载体、限制性内切酶、T4连接酶、DNA Marker等购买于宝生物工程(大连)有限公司;矢车菊素3-O-葡萄糖苷和槲皮素3-O-葡萄糖苷标准品购买于绿源生物有限公司。
1.2 方法
1.2.1 引物设计 以马缨杜鹃花朵转录组测序结果为基础,利用 Primer Premier 5.0 软件完成Rd3GT1基因克隆引物的设计(表1)。

表1 本文所用引物列表Table 1 Primers used in this study
1.2.2 Rd3GT1的克隆 利用RNA提取试剂盒完成马缨杜鹃花朵总RNA的提取,利用逆转录试剂盒合成cDNA,以此作为模板,Rd3GT1-F1与Rd3GT1-R1为引物进行基因扩增。反应程序为 94℃8 min;94℃ 30 s,52℃ 30 s,72℃ 90 s,35 个循环;72℃ 5 min。PCR扩增产物经1% 琼脂糖凝胶电泳检测后,胶回收,随后与克隆载体pMD18-T 连接,转化。挑取克隆进行菌液PCR与酶切验证,将验证为阳性的质粒送生工生物工程股份有限公司测序确认Rd3GT1的核苷酸序列。
1.2.3 生物信息学分析 使用ProtParam软件对Rd3GT1蛋白进行理化性质分析,利用DNAMAN完成多序列比对分析,利用MEGA 7.0完成系统进化分析。
1.2.4 Rd3GT1真核表达载体的构建 以测序正确的稀释后的重组克隆载体pMD18-T-Rd3GT1质粒为模板,Rd3GT-121F与Rd3GT-121R为引物进行扩增,随后利用Xba I与BamH I分别对目的基因与pBI121进行酶切、胶回收、连接和转化。经菌液PCR与酶切验证后,送公司进行测序。
1.2.5 矮牵牛的遗传转化 利用冻融法,将测序正确的真核表达载体pBI121-Rd3GT1转入农杆菌GV3101感受态细胞中,经菌液PCR与酶切验证正确后用于矮牵牛的遗传转化。取正常生长的矮牵牛叶片放入锥形瓶中,自来水冲洗半小时后,于无菌超净台中完成脱毒,随后切成5 mm×5 mm大小,于pBI121-Rd3GT1(GV3101)菌液中浸泡10 min,取出叶片于滤纸上吸去多余的菌液,转入培养基中分别进行共培养、脱菌培养、筛选培养和生根培养,待根长大后转移至土壤中继续培养,直至植株开花(表 2)。
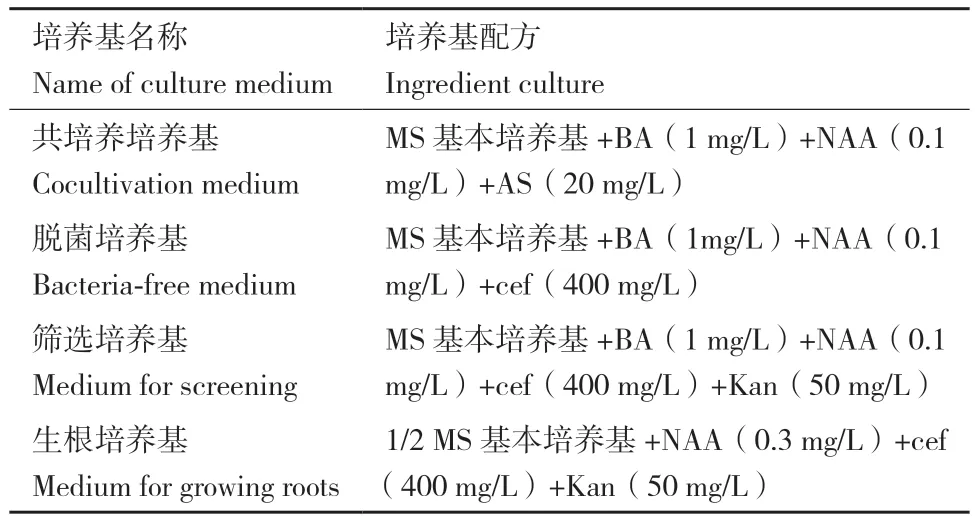
表2 矮牵牛遗传转化培养基成分Table 2 A variety of culture medium in the genetic transformation experiment of P. hybrida
1.2.6 转基因植株的检测 取移栽至土壤中的矮牵牛的成熟叶片组织提取基因组,以Rd3GT1-F1与Rd3GT1-R1为引物,PCR验证Rd3GT1是否成功转入矮牵牛中。待矮牵牛开花后,取颜色表型具有明显变化的花朵,提取RNA,通过RT-PCR进一步验证Rd3GT1是否在矮牵牛中成功表达。将扩增出目的基因的植物标记为转基因植株。
1.2.7 转基因花朵中花色素苷与黄酮醇的检测 取颜色表型明显变化的转基因植株花朵,于研钵中液氮条件下研磨,将0.1 g研磨充分的粉末转至含有1 mL类黄酮提取液(H2O∶MeOH∶HCl= 75∶24∶1,V/V/V)的棕色瓶中,4℃黑暗条件下浸提12-14 h。次日4℃条件下12 000 r/min 离心5 min,取上清经0.22 μm滤膜过滤后用于高效液相(HPLC)分析。HPLC的分析条件如下:流动相A为5%甲酸水溶液,流动相B为甲醇,分析时间为60 min;具体洗脱条件 为 :0-10 min,14%-17% B;10-35 min,17%-23% B;35-60 min,23%-47% B;60-67 min,47%-14% B;67-70 min,14% B。定量分析时,首先将矢车菊素3-O-葡萄糖和槲皮素3-O-葡萄糖苷配置成不同浓度梯度的溶液,利用HPLC绘制标准曲线,然后根据检测样品的峰面积计算出样品中花色素苷与黄酮醇的含量。
1.2.8 转基因植株内源类黄酮合成相关基因的表达分析 分别提取野生型与颜色表型明显变化的转基因花朵,提取RNA,逆转录为cDNA作为基因表达分析的模板,以PhActin2为内参基因,进行Realtime PCR分析(引物序列见表1)。PCR程序如下:95℃ 60 s,95℃ 5 s,60℃ 60 s,40 个循环。程序结束后,分别通过溶解曲线与琼脂糖凝胶电泳检测基因扩增的特异性。每个样本设置3个生物学重复和3个技术重复。利用2-ΔΔCt法进行相对表达量的分析。
2 结果
2.1 Rd3GT1的克隆
以马缨杜鹃花朵cDNA为模板,Rd3GT1-F1与Rd3GT1-R1为引物进行基因扩增,结果如图1所示,克隆获得基因片段大小与目的基因大小一致为1 395 bp。随后,经测序证明,Rd3GT1克隆成功。

图1 Rd3GT1 CDS的克隆Fig. 1 Cloning of Rd3GT1 CDS
2.2 生物信息学分析
2.2.1 蛋白质理化性质分析 利用ProtParam软件对Rd3GT1蛋白进行理化性质分析,结果显示,Rd3GT1的总原子数为7 127 个,蛋白分子式为C2298H3565N603O647S14,蛋白分子质量为50.44 kD,理论等电点为6.09,不稳定系数为43.21,是一种不稳定蛋白。
2.2.2 多序列比对分析 将Rd3GT1的氨基酸序列分别与拟南芥和矮牵牛的糖基转移酶进行多序列比对,结果如图2所示,Rd3GT1具有糖基转移酶所具有的典型结构PSPG box,表明Rd3GT1是糖基转移酶家族成员之一。

图2 多序列比对分析Fig. 2 Multiple sequence alignment analysis
2.2.3 系统进化分析 利用MEGA 7.0采用邻接法对来自不同植物的糖基转移酶进行系统进化分析,结果如图3所示,所有糖基转移酶被分为三类,分别是类黄酮3-O糖基转移酶、类黄酮5-O糖基转移酶和类黄酮7-O糖基转移酶,而Rd3GT1与类黄酮3-O糖基转移酶聚为一类,表明其可以催化类黄酮的C-3位置发生糖基化反应。

图3 系统进化分析Fig. 3 Phylogenetic analysis
2.3 Rd3GT1真核表达载体的构建及农杆菌的转化
对初步构建完成的载体进行酶切验证,结果如图4所示,条带大小与预期大小相符。随后经测序证明,真核表达载体构建成功,将其命名为pBI121-Rd3GT1。
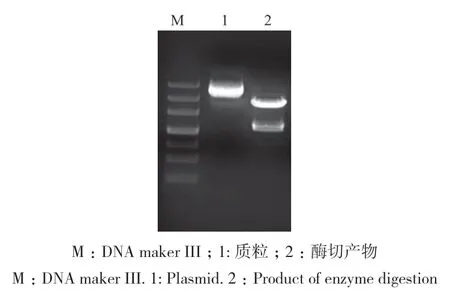
图4 酶切验证Fig. 4 Enzyme digestion verification
利用冻融法将pBI121-Rd3GT1转入农杆菌GV3101感受态细胞中,经抗性筛选后进行菌液PCR检测,结果如果图5所示,条带清晰,大小符合要求,表明pBI121-Rd3GT1已成功转入农杆菌GV3101中。
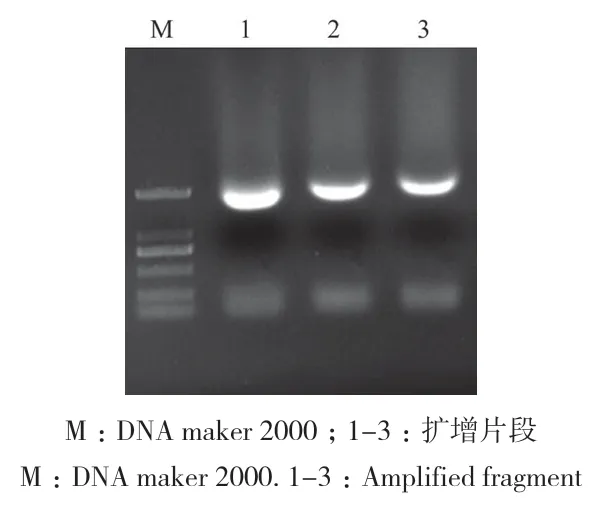
图5 PCR验证Fig. 5 PCR verification
2.4 矮牵牛的遗传转化
将经过农杆菌侵染的矮牵牛叶片置于共培养培养基上暗培养3 d,然后将叶片转移至脱菌培养基中培养7-10 d,随后再将叶片转移至筛选培养基中培养2-3周,而后将叶片转至新的筛选培养基中继续培养进行芽的诱导分化,待不定芽长至2 cm左右时,切下转入生根培养基中进行生根培养,直至植株可以移栽(图6)。

图6 矮牵牛的遗传转化过程Fig. 6 Genetic transformation process of P. hybrid
2.5 转基因植株的检测
经遗传转化后共获得6株转基因植株,其花朵颜色均由白色变为粉色。随后,选择其中2株花朵颜色变化明显的进行RT-PCR分析,结果如图7所示,与野生型相比,在转基因植株的花朵中可以成功检测到Rd3GT1的表达。

图7 转基因植株的表型改变与RT-PCR分析Fig. 7 Phenotypic changes and RT-PCR analysis of transgenic plants
2.6 转基因花朵中花色素苷与黄酮醇的检测分析
取野生型与上述两株转基因矮牵牛花朵,提取其花色素苷与黄酮醇,利用HPLC进行检测。结果如图8所示,与野生型相比,花色素苷的种类由0种增加至3种(A1没有检测到对应的苷元分子),黄酮醇的种类由4种增加至6种。经文献查阅比对后,可以确认所增加的花色素苷与黄酮醇分别为矢车菊素与芍药素衍生物和槲皮素与山奈酚衍生物[12-15]。定量分析显示,与对照相比,转基因矮牵牛花朵中花色素苷与黄酮醇含量均显著增加(图9)。

图8 转基因花朵中花色素苷与黄酮醇成分分析Fig. 8 Analysis of anthocyanin and flavonol components in transgenic flowers

图9 转基因花朵中花色素苷与黄酮醇的定量分析Fig. 9 Quantitative analysis of anthocyanin and flavonol in transgenic flowers
2.7 转基因植株内源类黄酮合成相关基因的表达分析
提取野生型与上述两株转基因矮牵牛花朵的RNA,逆转录为cDNA用于检测转基因花朵中类黄酮合成相关基因的表达。结果如图10所示,在结构基因中查尔酮合酶基因(CHS)、查尔酮异构酶基因(CHI)、类黄酮3-羟化酶基因(F3H)和类黄酮3-O-糖基转移酶基因(3GT)的表达显著上调,转录因子中AN1与MYBx的表达显著上调。

图10 转基因矮牵牛中类黄酮合成相关基因的表达分析Fig. 10 Expression profiles of flavonoid-related biosynthetic genes in flowers of transgenic petunia
3 讨论
在花色素苷的生物合成过程中,3GT不仅仅是一个修饰酶,它在决定花色素苷的水溶性与稳定性方面也发挥着不可或缺的作用[3]。研究显示,参与花色素苷合成的糖基转移酶具有广泛的底物选择性,它们可以同时糖基化花青素与黄酮醇[16]。例如,龙胆、葡萄和苜蓿的3GT它们可以同时将糖基供体转移至矢车菊素、天竺葵素和黄酮醇的3-OH位置,完成糖基化反应[17-19]。同样,过表达Rd3GT1导致转基因矮牵牛花朵中花色素苷与黄酮醇的积累均显著增加,所以推断Rd3GT1在矮牵牛体内既可以糖基化花青素也可以糖基化黄酮醇。
虽然转基因花朵中花色素苷的积累量显著增加,但是却只检测到了矢车菊素类的花色素苷。研究表明,二氢黄酮醇4-还原酶(DFR)作为类黄酮生物合成过程中的调控酶,其对底物的选择性决定了花色素苷的种类[20]。例如,矮牵牛的DFR因其不能以二氢山奈酚为底物,从而导致矮牵牛中不积累天竺葵素类花色素苷。另一方面,黄酮醇合酶(FLS)与DFR均可以二氢黄酮醇为底物,所以当DFR不能催化二氢山奈酚时,二氢山奈酚将在FLS的作用下反应生成更多的山奈酚类黄酮醇[21]。如图8-D-F的结果所示,与对照相比,山奈酚类黄酮醇(F3,F4, F5, F6)的含量确实显著增加,这很可能是因为矮牵牛的DFR不能以二氢山奈酚为底物导致的。同样对拟南芥的研究也获得了相似的结果,即当其FLS发生突变时,拟南芥幼苗中花色素苷的积累显著增加,反之当DFR的功能被抑制后,槲皮素的含量则显著增加[22-23]。所以,上述这些结果表明,DFR与FLS对底物的竞争力直接控制着类黄酮合成过程中的代谢流向。
转基因矮牵牛中类黄酮合成相关基因的表达分析 显 示,CHS、CHI、F3H、3GT、AN1与 MYBx的表达量均显著增加。CHS与CHI是类黄酮合成途径上游最关键的两个酶,它们功能的缺失将直接导致植物合成类黄酮能力的丧失或减弱。例如,在烟草中沉默CHS时,烟草花朵颜色缺失,沉默CHI时烟草花朵颜色变浅[24-25]。所以在Rd3GT1转基因矮牵牛花朵中这两个基因表达量的升高是导致花朵颜色加深的原因之一。F3H与3GT在类黄酮合成过程中同样在决定类黄酮化合物的种类与含量上发挥重要作用。例如,大丽花与马鞭草的F3H突变体花朵因不能积累花色素苷而呈现白色;而在很多植物中花色素苷的积累则与3GT的表达呈正相关[26-28]。所以F3H与3GT的高表达是转基因花朵中黄酮醇与花色素苷高积累的直接原因。但是,作为矮牵牛花色素苷合成的负转录调控因子MYBx,其表达量也升高了。这一结果与草莓和龙胆中转录抑制子的研究相一致,其原因很可能是转录抑制子的高表达要作为制动器来平衡花色苷素苷的积累水平[29-30]。
4 结论
对转基因植株分析发现,转基因植株花朵颜色由白色变为粉色,同时花色素苷与黄酮醇的积累显著增加,并且转基因植株内源类黄酮合成多个相关基因的表达显著升高,表明Rd3GT1通过影响这些基因的表达调控转基因矮牵牛的类黄酮合成(图 11)。
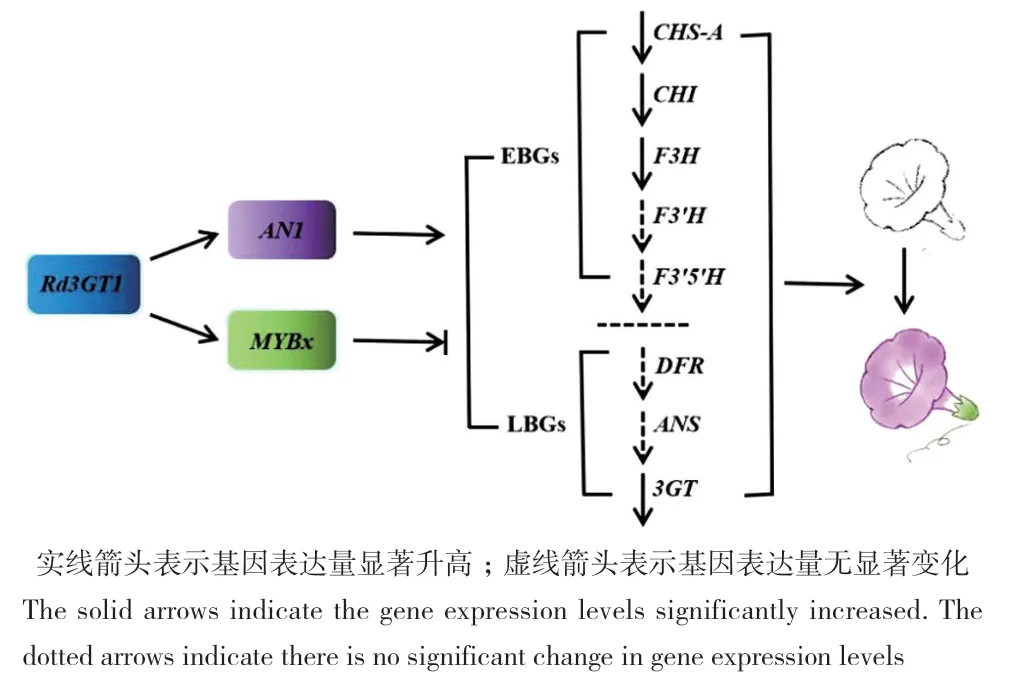
图11 Rd3GT1调节转基因矮牵牛花色的建议模式图Fig. 11 Proposed model for regulation of transgenic petunia flower color by Rd3GT1
