香蕉皮原花色素的酶解辅助提取及稳定性研究
2019-01-09贾宝珠卢胜洪方穗恋鲍金勇陈子键杨公明
贾宝珠 ,卢胜洪,方穗恋,鲍金勇,陈子键 ,杨公明 ,罗 林
(1.广东第二师范学院生物与食品工程学院,广东 广州 510303;2.华南农业大学食品学院/广东省食品质量与安全重点实验室,广东 广州 510642)
贾宝珠,卢胜洪,方穗恋,等. 香蕉皮原花色素的酶解辅助提取及稳定性研究[J].广东农业科学,2018,45(11):95-103.
香蕉是世界“四大水果”之一,在热带和亚热带地区广泛种植[1]。在我国,香蕉年产量可达1 000万t[2]。香蕉因其价格低、味道好、营养价值高深受人们喜爱。近年来,香蕉深加工产业迅速发展,除了鲜食香蕉外,市场上也涌现出了多种香蕉加工制品[3]。作为香蕉深加工的副产物,如若处理不当,对环境十分不利[4]。香蕉皮占香蕉总重的30%~40%,富含多酚[5-6]、纤维素[7]、果胶[8]、有机酸[9]、多糖[10]和蛋白质[11]等多种活性成分,还含有多种无机盐和维生素,Ca、Mg、P、K的含量也相当丰富[12],具有很高的研究和应用价值。原花色素具有很强的抗氧化和清除自由基作用[13-14],被认为是一种天然抗氧化活性成分,目前已被广泛应用于保健品、食品及化妆品等领域[15]。香蕉皮中含有大量的纤维素和果胶[16],复合植物水解酶可以有效分解构成细胞壁及细胞间质的纤维素、半纤维素和果胶,将原花色素从细胞中释放出来,从而提高原花色素的提取得率[17-18]。酶解辅助提取法高效、无毒、反应条件温和,已广泛应用于天然活性成分的提取[19-21]。
本研究采用酶解辅助提取法对香蕉皮中的原花色素进行提取,并对其稳定性进行研究,旨在提供一种优化的香蕉皮原花色素的提取方法和参数,为香蕉皮废弃物的利用提供理论依据,对香蕉加工业的可持续发展具有重要的生态及经济价值。
1 材料与方法
1.1 试验材料
供试青香牙蕉为市售,剥离果肉,备用;复合植物水解酶(酶活力≥1 500 NCU/g),诺维信(中国)生物技术公司;原花青素标准品(UV≥95%),天津市尖峰天然产物研究开发有限公司;乙醇、甲醇、盐酸、香草醛为分析纯,天津市富宇精细化工有限公司;柠檬酸、苹果酸、抗坏血酸、氯化钠、氯化钙、氯化钾、氯化铜、氯化铁、苯甲酸钠、山梨酸钾为分析纯,天津市科密欧化学试剂有限公司。
PL203电子天平,上海梅特勒-托利多仪器有限公司;SHZ-88台式水浴恒温振荡器,江苏太仓市实验设备厂;DGG-9070B电热恒温鼓风干燥箱,上海森信实验仪器有限公司;DXF-04D手提式粉碎机,广州市大祥电子机械设备有限公司;TDL-5-A飞鸽离心机,上海安亭科学仪器厂;RE-32A旋转蒸发器,上海亚荣生化仪器厂;SHZ-D(Ⅲ)循环水式真空泵,巩义市予华仪器有限责任公司;752N紫外-可见分光光度计,上海仪电分析仪器有限公司。
1.2 原花色素的制备、测定及标准曲线制作
1.2.1 原花青素制备 青香蕉皮,50℃烘干至水分含量低于10%,粉碎,过0.425 mm筛,得香蕉皮粉。准确称取1.000 g香蕉皮粉,添加一定量的复合植物水解酶,调节体系pH值为4.4,在一定的温度下酶解一定时间,得原花色素酶解液。在原花色素酶解液中加入乙醇,提取一定时间后,在4 000 r/min条件下离心20 min,取上清液减压干燥,再于50℃恒温烘箱烘干至含水量低于6%,得香蕉皮原花色素提取物。
1.2.2 原花色素提取得率测定 原花色素含量的测定采用香草醛-盐酸法[22],香蕉皮原花色素提取得率的计算公式如下:

式中,m0为提取所用香蕉皮粉的质量(g),m1为粗提品中原花色素的质量(g)。
1.2.3 标准曲线制作 准确称取原花色素标准品0.010 g,用70%甲醇定容到50 mL,得到0.2 mg/mL原花色素标准液。分别移取原花色素标准液0.0、1.0、2.0、3.0、4.0、5.0 mL于50 mL容量瓶中,用70%甲醇定容。分别取1.00 mL上述原花色素-甲醇溶液,加入6.00 mL质量分数4%的香草醛溶液和3.00 mL 36%~38%浓盐酸,摇匀后避光反应30 min。以70%甲醇作空白,在500 nm处测吸光度。标准曲线方程为:y=1.4536x+0.0012,R2=0.9991。
1.3 酶解辅助提取法酶解试验的工艺优化
1.3.1 单因素试验设计 (1)酶添加量体积分数对原花色素提取得率的影响。分别以0、0.2%、0.4%、0.6%、0.8%、1.0%的酶添加量,在50℃条件下酶解60 min,再用65%乙醇以料液比1∶23(W/V,g/mL)、提取温度50℃的条件下提取90 min,测定原花色素的提取得率。(2)酶解温度对原花色素提取得率的影响。以0.6%的酶添加量,分别在35、40、45、50、55、60℃的条件下酶解60 min,再用65%乙醇以料液比1∶23、提取温度50℃的条件下提取90 min,测定原花色素的提取得率。(3)酶解时间对原花色素提取得率的影响。以0.6%的酶添加量,在50℃条件下分别酶解15、30、45、60、75、90 min,再用65%乙醇以料液比1∶23、提取温度50℃的条件下提取90 min,测定原花色素的提取得率。
1.3.2 正交实验设计 在单因素试验的基础上,以原花色素的提取得率为考查指标,选择酶解温度、酶添加量、酶解时间3个因素,每个因素选取3个水平,采用L9(34)正交实验。复合酶辅助提取法酶解试验各因素水平的选取如表1所示。

表1 酶解正交实验的因素及水平
1.4 酶解辅助提取法提取试验的工艺优化
1.4.1 单因素试验设计 (1)提取温度对原花色素提取得率的影响。以0.8%的酶添加量,在50℃条件下酶解45 min,再用65%乙醇以料液比 1∶23,分别在 30、40、50、60、70、80℃提取温度下提取90 min,测定原花色素的提取得率。(2)料液比对原花色素提取得率的影响。以0.8%的酶添加量,在50℃条件下酶解45 min,再用65%乙醇,分别以料液比1∶20、1∶25、1∶30、1∶35、1∶40、1∶45(W/V,g/mL),提取温度 50℃条件下提取90 min,测定原花色素的提取得率。(3)提取时间对原花色素提取得率的影响。以0.8%的酶添加量,在50℃条件下酶解45 min,再用65%乙醇以料液比1∶23,在50℃提取温度下分别提取30、60、90、120、150 min,测定原花色素的提取得率。
1.4.2 正交实验设计 在单因素试验的基础上,以原花色素的提取得率为考查指标,选择提取温度、料液比、提取时间3个因素,每个因素选取3个水平,采用L9(34)正交实验。复合酶辅助提取法各因素水平的选取如表2所示。
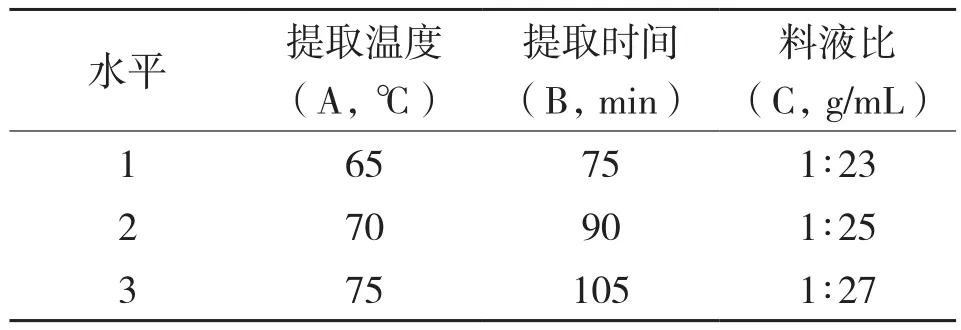
表2 提取正交实验的因素及水平
1.5 香蕉皮原花色素稳定性的研究
1.5.1 温度对香蕉皮原花色素稳定性的影响(1)贮存温度对香蕉皮原花色素稳定性的影响。配制浓度约为1.0 mg/mL的原花色素溶液,分别置于25、4、-18℃下贮藏5 d,每隔1 d测定1次原花色素含量,平行测定3次,观察贮存温度对香蕉皮原花色素稳定性的影响。(2)加热温度对香蕉皮原花色素稳定性的影响。配制浓度约为1.0 mg/mL的原花色素溶液,分别置于50、75、100℃水浴中保温8 h,每隔2 h测定1次原花色素含量,平行测定3次,并按下式计算原花色素的保留率,观察加热温度对香蕉皮原花色素稳定性的影响。

式中,m0为原溶液中原花色素的含量(mg/mL),m1为反应后溶液中原花色素的含量(mg/mL)。
1.5.2 柠檬酸、苹果酸和抗坏血酸对香蕉皮原花色素稳定性的影响 将柠檬酸、苹果酸和抗坏血酸分别添加到约1.0 mg/mL原花色素溶液中,使得溶液中柠檬酸、苹果酸和抗坏血酸的浓 度 分 别 为 0、0.2、0.4、0.6、1.0和 2.0 mg/mL。将混合好的溶液在50℃下保温8 h,每隔2 h测定1次原花色素含量,平行测定3次,并按1.5.1方法计算原花色素的保留率,观察柠檬酸、苹果酸和抗坏血酸对香蕉皮原花色素稳定性的影响。
1.5.3 金属离子对香蕉皮原花色素稳定性的影响 将氯化钠、氯化钙、氯化钾、氯化铜和氯化铁分别添加到约1.0 mg/mL原花色素溶液中,使得溶液中5种金属离子的浓度为0、0.1、0.3、0.5 mol/L。将混合好的溶液在50℃下保温8 h,每隔2 h测定1次原花色素含量,平行测定3次,并按1.5.1方法计算原花色素的保留率,观察5种金属离子对香蕉皮原花色素稳定性的影响。
1.5.4 防腐剂对香蕉皮原花色素稳定性的影响将苯甲酸钠和山梨酸钾分别添加到1.0 mg/mL原花色素溶液中,使得溶液中苯甲酸钠和山梨酸钾的浓度分别0、1.0、2.0和3.0 mg/mL。将混合好的溶液在50℃下保温8 h,每隔2 h测定1次原花色素含量,平行测定3次,并按1.5.1方法计算原花色素的保留率,观察苯甲酸钠和山梨酸钾对香蕉皮原花色素稳定性的影响。
2 结果与分析
2.1 香蕉皮原花色素酶解辅助提取法酶解试验的工艺优化结果
2.1.1 酶添加量对香蕉皮原花色素提取得率的影响 由图1可知,随着酶添加量增加,原花色素的提取得率呈现先增大后平缓的趋势。当酶添加量较少时,酶与底物结合充分,提取得率随着酶添加量增加而提高;随着酶添加量的升高,底物不足,未能对酶达到饱和,此时随着酶添加量增加原花色素提取得率变化不显著。因此,综合考虑选择0.8%为最适添加量。

图1 酶添加量对香蕉皮原花色素提取得率的影响
2.1.2 酶解温度对香蕉皮原花色素提取得率的影响 由图2可知,随着酶解温度的升高,原花色素的提取得率呈现先增大后减小的趋势。50℃时,原花色素的提取得率最高。温度对原花色素的影响是双重性的,随着温度升高,酶解反应速度加快,酶活力越大,然而温度过高会使酶发生变性,酶解速率和酶解效果都会受到影响。因此,选择50℃为最佳酶解温度。

图2 酶解温度对香蕉皮原花色素提取得率的影响
2.1.3 酶解时间对香蕉皮原花色素提取得率的影响 由图3可知,随着酶解时间的延长,原花色素的提取得率呈现先增大后减小的趋势。当酶解时间为45 min时,原花色素的提取得率最高。随着酶解时间的延长,酶解逐渐完全,原花色素逐渐被释放到溶液中,提取得率逐渐增大,但溶液中原花色素的含量不断增多,会对酶促反应造成抑制;且原花色素暴露在细胞外时间过长,易被氧化和破坏。因此,选择45 min为最佳酶解时间。

图3 酶解时间对香蕉皮原花色素提取得率的影响
2.1.4 酶解辅助提取法酶解试验的正交实验结果 复合酶辅助提取法酶解试验的L9(34)正交实验结果见表3,分析极差R可知,影响香蕉皮原花色素酶解效果的因素大小顺序为酶添加量(B)>酶解温度(A)>酶解时间(C)。根据均值大小可知,酶解的最优条件为A2B2C2,该组合未在正交表中出现。在A2B2C2条件下重复试验3次,所得原花色素的提取得率平均为1.655%,高于A2B2C3条件下的提取得率。因此,复合酶辅助提取法的最佳酶解条件为:酶解温度50℃,酶添加量0.8%,酶解时间45 min。

表3 香蕉皮原花色素酶解辅助提取法酶解试验的正交实验结果
2.2 香蕉皮原花色素酶解辅助提取法提取试验的工艺优化结果
2.2.1 提取温度对香蕉皮原花色素提取得率的影响 由图4可知,随着提取温度的升高,原花色素的提取得率呈现先增大后平缓的趋势。当温度达到70℃时,原花色素的提取得率最高。在一定范围内,温度的提高有利于原花色素的提取,但在高温条件下,原花色素的结构遭到破坏,使得提取得率上升平缓甚至有所下降。因此,选择70℃为最佳提取温度。
2.2.2 料液比对香蕉皮原花色素提取得率的影响 由图5可知,随着料液比的增加,原花色素的提取得率呈现先增大后平缓的趋势。当料液比为1∶25时,原花色素的提取得率最高。此时,原花色素几乎全部被提取出来,继续加大溶剂用量对提取效果无显著影响。因此,选择1∶25为最佳料液比。

图4 提取温度对香蕉皮原花色素提取得率的影响

图5 料液比对香蕉皮原花色素提取得率的影响
2.2.3 提取时间对香蕉皮原花色素提取得率的影响 由图6可知,随着提取时间的延长,原花色素的提取得率呈现先增大后减小的趋势。当提取时间为90 min时,原花色素的提取得率最高。原花色素的结构中含有大量羟基,长时间高温加热,会破坏其结构,使得提取得率降低。因此,选择90 min为最佳提取时间。
2.2.4 酶解辅助提取法提取试验的正交实验结果 复合酶辅助提取法提取试验的L9(34)正交实验结果见表4。分析极差R可知,影响原花色素提取效果的因素大小顺序为:料液比(C)>提取时间(B)>提取温度(A)。根据均值大小可知,香蕉皮中原花色素提取的最优条件为A1B1C1,与正交实验结果相符。在A1B1C1条件下试验重复3次,所得原花色素的提取得率平均为1.702%。因此,复合酶辅助提取法的最佳提取条件为:料液比1∶23,提取温度65℃,提取时间75 min。
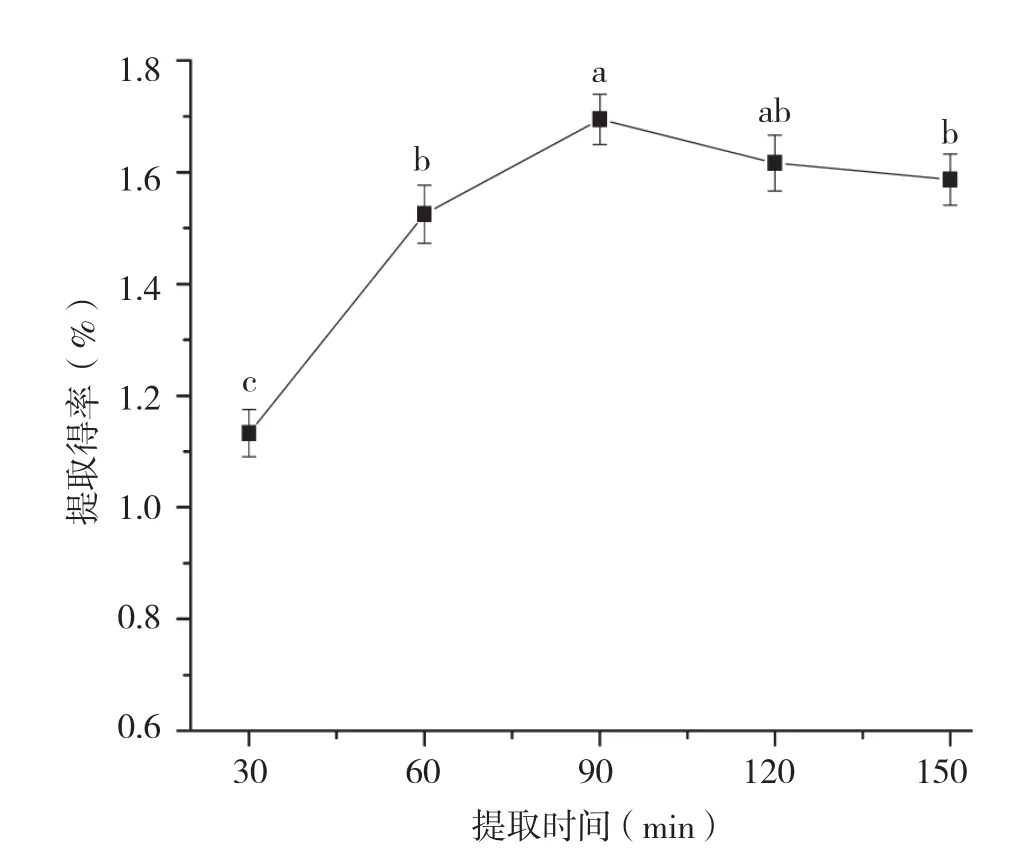
图6 提取时间对香蕉皮原花色素提取得率的影响

表4 香蕉皮原花色素酶解辅助提取法提取试验的正交实验结果
2.3 香蕉皮原花色素稳定性研究结果

图7 温度对香蕉皮原花色素稳定性的影响
2.3.1 温度对香蕉皮原花色素稳定性的影响由图7可知,随着温度的升高和时间的延长,香蕉皮原花色素的稳定性逐渐降低。由图7A可知,当温度较低时,香蕉皮原花色素相对较稳定。在室温(25℃)、冰箱冷藏(4℃)和冻藏(-18℃)条件下贮存5 d,原花色素的保留率分别为88.11%、96.83%和99.24%。图7B显示,随着加热温度的升高,原花色素降解速度逐渐加快。在50、75、100℃条件下加热8 h,原花色素的保留率分别为88.62%、79.74%和56.77%。由此可见,低温贮藏可较好地保护原花色素,而高温加热会破坏其稳定性。
2.3.2 柠檬酸、苹果酸和抗坏血酸浓度对香蕉皮原花色素稳定性的影响 由图8可知,随着柠檬酸、苹果酸和抗坏血酸浓度的增大,对香蕉皮原花色素的保护作用呈先增大后减小的趋势。当溶液中柠檬酸、苹果酸和抗坏血酸的浓度为0.6、0.6、0.4 mg/mL时,原花色素的稳定性最好,8 h后原花色素的保留率分别为94.90%、94.31%和96.34%。
2.3.3 金属离子浓度对香蕉皮原花色素稳定性的影响 从图9可以看出,随着溶液中金属离子浓度的增大,原花色素的稳定性逐渐降低。当溶液中Na+、Ca2+、K+、Cu2+和Fe3+的浓度为0.5 mol/L时,8 h后原花色素的保留率分别为81.78%、79.08%、81.73%、60.90%和40.52%。当溶液中加入Fe3+时,溶液由红棕色变为紫黑色,且伴有少量絮状沉淀产生;当溶液中加入Cu2+时,溶液变为青绿色。由此可见,Na+、Ca2+和K+对原花色素的稳定性影响较小,Cu2+和Fe3+对原花色素的稳定性破坏显著。

图8 柠檬酸、苹果酸和抗坏血酸浓度对香蕉皮原花色素稳定性的影响

图9 金属离子浓度对香蕉皮原花色素稳定性的影响
2.3.4 防腐剂浓度对香蕉皮原花色素稳定性的影响 图10显示,随着防腐剂浓度的增加,原花色素的稳定性逐渐降低。当苯甲酸钠和山梨酸钾的浓度为1.0(mg/mL)时,8 h后原花色素的保留率分别为85.71%和85.34%。可知,当防腐剂浓度较低时,其对原花色素的稳定性影响较小。

图10 防腐剂浓度对香蕉皮原花色素稳定性的影响
3 结论与讨论
本试验结果表明,香蕉皮原花色素酶解辅助提取法酶解试验的最佳工艺条件为:酶添加量0.8%,酶解温度50℃,酶解时间45 min;提取试验的最佳工艺条件为:料液比1∶23(g/mL),提取温度65℃,提取时间75 min。在最佳工艺条件下,原花色素的提取得率为1.702%,与溶剂提取法的0.459%和超声波辅助提取法的0.685%相比[23],酶解辅助提取法的提取得率有了明显提高。且酶解辅助提取法操作简便、条件温和、绿色环保,是目前天然产物提取较为常用的辅助手段。但是,本研究将酶解和提取两个部分单独进行,导致耗时较长,今后可进一步完善工艺流程,提高提取效率。
随着温度的升高和时间的延长,香蕉皮原花色素稳定性逐渐降低。因此,应将原花色素储存在低温环境中,在制备和使用的过程中也应尽量避免温度过高。柠檬酸、苹果酸和抗坏血酸对香蕉皮原花色素具有保护作用。因此,可以在原花色素的保存和使用过程中加入一定量的柠檬酸、苹果酸或抗坏血酸作为保护剂。Na+、Ca2+、K+、Cu2+和 Fe3+等金属离子会对香蕉皮原花色素起破坏作用,其中Cu2+和Fe3+的影响最为显著。因此,在原花色素的制备、保存和使用过程中应尽量避免与Cu2+和Fe3+接触。苯甲酸钠和山梨酸钾会降低香蕉皮原花色素的稳定性,但影响相对较小。因此,在保存和应用过程中可以适量加入苯甲酸钠和山梨酸钾。
