欧洲卫矛叶片花色素苷组分鉴定及稳定性分析
2020-04-10卓启苗丁彦芬
宋 鹏,卓启苗,丁彦芬
(南京林业大学 风景园林学院,江苏 南京 210000)
植物叶色变化主要是受花色素苷的影响。花色素苷是广泛存在于植物中的水溶性天然色素,是植物叶片、果皮及其它器官的主要呈色物质。花色素苷不仅赋予植物丰富多彩的颜色,还可以提高光饱和能力、减轻光损伤的伤害,提高植物抗旱、抗寒及抗氧化等能力,从而提高植物对环境的适应能力[1]。有6种花色素苷广泛存在于果实和蔬菜中,分别是天竺葵色素、矮牵牛色素、矢车菊色素、芍药色素、飞燕草色素和锦葵色素[2]。从这些花色素中衍生出的花色素苷种类繁多,其性质、附着在糖苷配基上的糖的数量、附着的位置以及附着在糖残基上的脂肪酸或芳香酸的性质和数量各不相同[3-4]。花色素苷极不稳定,易降解,稳定性受pH值、贮藏温度、酶、光、氧、花色素苷结构和浓度,以及其他化合物如黄酮类化合物、蛋白质和矿物质等存在的影响[5],因此在研究和开发利用花色素苷时存在诸多困难。
欧洲卫矛(Euonymuseuropaea)为卫矛科(Celastracea)卫矛属(Euonymus)落叶灌木,原产欧洲,因其极具观赏特色的红叶和红果,现在我国华东、华北地区已有引种栽培。但迄今为止,对欧洲卫矛的研究主要集中在繁殖技术方面[6],有关欧洲卫矛叶片花色素苷的组分及稳定性研究尚未见报道。本试验从不同提取溶剂、提取时间对欧洲卫矛花色素苷提取效果进行了比较分析,同时利用高效液相色谱-VWD检测-电喷雾电离质谱连用技术(HPLC-VWD-ESI-MS)分析花色素苷组分,并探讨了不同光源、pH、温度、氧化还原剂及金属离子对花色素苷稳定性的影响,从而为研究欧洲卫矛叶色机理及花色素苷提取、资源利用提供参考和依据。
1 材料与方法
1.1 试验材料
供试材料为欧洲卫矛的品种“矮生卫矛”(Euonymuseuropaea‘Pumilis’)3年生扦插苗,栽植于江苏省句容市天王镇乾景天园苗木有限公司基地(119.1 E, 31.9 N),长势一致,无病虫害,
1.2 试剂与仪器
试剂:甲醇、乙醇、盐酸、甲酸、硫酸镁、硝酸钾、30%过氧化氢、亚硫酸钠、硫酸锌、氯化钠、三氟醋酸(分析纯,南京化学试剂股份有限公司)。氯化钙、硫酸铜、硫酸亚铁、柠檬酸、柠檬酸钠(分析纯,国药集团化学试剂有限公司)。硫酸锰(分析纯,西陇科学股份有限公司)。三氯化铁(分析纯,上海沃凯生物技术有限公司)。
仪器:粉碎机(FW-80,北京市永光明医疗仪器厂);电子天平(UX420H,日本岛津公司);冷冻离心机(4K-15,德国SIGMA公司);pH计(FE20-FiveEasy Plus,梅特勒-托利多国际贸易(上海)有限公司);电热恒温水浴锅(DK-S24,上海森信实验仪器有限公司);紫外可见分光光度计(Lambda 25型,美国Perkin Elmer公司);烘箱(DHG-9070A,上海精宏实验设备有限公司)。高效液相色谱仪(Agilent1260,安捷伦科技有限公司)。
1.3 试验方法
于2018年9月30日、10月20日、11月9日上午10点左右,选取长势一致、无病虫害的植株,在相同高度上从向阳面采集变色初期、变色中期及变色末期具有代表性的叶片。采后立即带回实验室,洗净,烘干,去叶柄及叶脉后粉碎备用。浸提剂选择试验及花色素苷组分鉴定选择“矮生卫矛”变色初期、变色中期及变色末期的叶片,花色素苷提取时间及稳定性测定选择“矮生卫矛”变色末期的叶片。
1.3.1 花色素苷提取与测定
1)浸提剂选择
称取叶片1 g,均分别加入10 mL的1%盐酸甲醇、1%盐酸乙醇、0.1 mol/L盐酸3种不同浸提剂,置于32℃的恒温水浴锅浸提5 h,过滤后即刻用紫外可见分光光度计扫描,波长为440~700 nm,每处理设3次重复,并加以比较分析。
2)提取时间的选择
称取叶片0.1 g,加10 mL 1%盐酸甲醇,置于32℃的恒温水浴锅中分别浸提0、1、2、3、4、5、6、7、8、9、10、11、12、13、14 h,过滤后迅速检测在527 nm处的吸光值,每处理设3次重复,并加以比较分析。
1.3.2 花色素苷组分的鉴定
称取1 g去掉主脉的速冻叶片,磨碎后加入组成为甲醇∶水∶甲酸∶三氟醋酸(70∶27∶2∶1)提取液10 mL,置于4℃冰箱中低温避光浸提24 h,取上清液,然后经微孔滤膜(0.22 μm)过滤,供花色素苷的定性、定量分析用,重复3次。
HPLC参数:色谱柱:安捷伦反向C18色谱柱,250*4.6 mm,5 μm粒径,检测器:VWD检测器,柱温:25℃;流速:1 ml·min-1;进样量:3 μL;检测波长:527 nm。流动相A:0.1%甲酸水溶液;流动相B:乙腈;洗脱梯度:0 min,30% B;8 min,60% B;35 min,95% B;45 min,30% B。
MS条件:ESI离子源,毛细管温度为220℃,毛细管电压4 V,N2流速20 L·min-1,离子扫描范围100~1500 m/z,整个过程采用正负离子交替模式。
1.3.3 花色素苷稳定性的测定
根据刘晓东等[7]的方法,略有改动。称取10 g叶片,加1%盐酸甲醇100 mL,置于32℃的恒温水浴锅浸提10 h,过滤后置于4℃的冰箱中保存备用,花色素苷含量以527 nm下的吸光度表示。
1)不同光源处理对花色素苷稳定性的影响
取3份提取液,置于日光灯(光照培养箱)、自然光(室内避免阳光直射)、黑暗条件下,每隔1 h取样1次,测定不同光照条件和不同光照时间下花色素苷的含量。每处理重复3次,并加以比较分析。
2)不同温度处理对花色素苷稳定性的影响
取6份提取液各70 mL,置于4、25、35、45、55、65℃6个不同温度的恒温水浴锅中避光保温,每隔1 h取一次样,立即用自来水平衡至室温,置于暗处测定在527 nm处的吸光值。每处理重复3次,并加以比较分析。
3)不同pH值缓冲液处理对花色素苷稳定性的影响
取9份1 mL花色素苷提取液,分别用pH值为0、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0的缓冲液,定容至25 mL,混匀后室温避光放置2 h后,在440~700 nm波长范围内进行扫描。每处理重复3次,并加以比较分析。pH值0,1,2缓冲液分别为1.0,0.1,0.01 mol/L的盐酸,pH值3~8溶液用柠檬酸-柠檬酸钠缓冲液配制。
4)氧化剂、还原剂对花色素苷稳定性的影响
以H2O2为氧化剂,以Na2SO3为还原剂,分别配制浓度为0.5%、1%、2%、3%、4%、5% H2O2溶液及0.025、0.05、0.1、0.2 mol/L Na2SO3溶液,加入1 mL花色素苷提取液,摇匀后室温放置于暗处,2 h后置于暗处测定在527 nm处的吸光值。每处理重复3次,并加以比较分析。
5)金属离子对花色素苷稳定性的影响
分别配制浓度为0.025、0.05、0.1、0.2 mol/L的Cu2+、Zn2+、Mg2+、Na+、Ca2+、Fe3+、Fe2+、Mn2+、K+溶液10 mL,加入1 mL花色素苷提取液,摇匀后室温放置于暗处,2 h后置于暗处测定在527 nm处的吸光值。每处理重复3次,并加以比较分析。
1.4 数据分析
采用Excel 2010进行统计分析与作图,采用SPSS 24.0对测定数据进行方差分析和多重比较。
2 结果与分析
2.1 不同提取溶剂对欧洲卫矛叶片花色素苷提取效果的影响
从图1A和图1B可以看出,在变色初期及变色中期,采用1%盐酸甲醇和1%盐酸乙醇所提取的花色素苷的吸收光谱,在654 /655 nm均有明显的吸收峰,1%盐酸甲醇所提取的花色素苷的吸收光谱在530 nm处另有一吸收峰,这与前人研究表明的花色素苷的特征吸收峰结果一致,而0.1 mol/L盐酸所提取的花色素苷的吸收光谱无明显吸收峰。在变色末期(图1C),1%盐酸甲醇、1%盐酸乙醇所提取的花色素苷的吸收光谱均在654/655 nm有吸收峰,另有一个吸收峰在527/537 nm处,且1%盐酸甲醇所提取的花色素苷在527 nm的吸光度远大于1%盐酸乙醇所提取的花色素苷在537 nm的吸光度,0.1 mol/L盐酸所提取的花色素苷的吸收光谱为单一吸收峰,在512 nm处吸光度小于前两者。因此,1%盐酸甲醇可作为欧洲卫矛叶片花色素苷的提取溶剂。
2.2 不同提取时间对欧洲卫矛叶片花色素苷提取效果的影响
如图2所示,随着提取时间的延长,在1%盐酸甲醇提取溶剂中的花色素苷溶液吸光值有所增加。浸提时间1 h内,吸光值急剧增加。在随后浸提时间2-10 h内,花色素苷溶液吸光值逐渐增加,到10 h后达到最大值,并在之后保持相对稳定。因此,提取时间在10 h左右的时间范围内可获得较稳的产率。
2.3 欧洲卫矛叶片花色素苷的种类和组成
HPLC图谱(图3、4、5)显示,欧洲卫矛叶片在变色初期、变色中期及变色末期共检测到6种不同结构的花色素苷物质。依据质谱分析图谱(图6),对照已有文献分析花色素苷种类,鉴定结果见表1。
峰A的保留时间t=2.8 min,其分子离子m/z 551获得1个碎片离子m/z 303,碎片离子m/z 303是失去一分子葡萄糖[M-162]+和一分子丙二酸[M-86]+得到,碎片离子m/z 303是飞燕草苷元的特征质荷比,故推测峰A为飞燕草-3-丙二酸酰葡萄糖苷[8]。
峰B、F的保留时间分别为t=3.2 min、t=3.5 min,其分子离子m/z 449获得1个碎皮离子m/z 287,碎片离子m/z 287是失去一分子葡萄糖[M-162]+得到,m/z 287是矢车菊苷元的特征质荷比,故推定峰B、F为矢车菊素-3-葡萄糖苷[9]。
峰C、H的保留时间t=6.4 min,其分子离子m/z 595获得2个碎片离子,碎片离子m/z 449是失去一分子香豆酸[M-146]+得到,碎片离子m/z 287是失去一分子芸香糖[M-308]+得到,碎片离子m/z 287是矢车菊苷元的特征质荷比,故推测峰C、H为矢车菊素-3-香豆酰芸香糖苷[10]。
峰D的保留时间t=2.3 min,其分子离子m/z505获得1个碎片离子m/z 301,碎片离子m/z 301是失去一分子葡萄糖[M-162]+和一分子乙酸[M-42]+得到,碎片离子m/z 301是芍药苷元的特征质荷比,故推测峰D为芍药素-3-乙酰葡萄糖苷[10]。
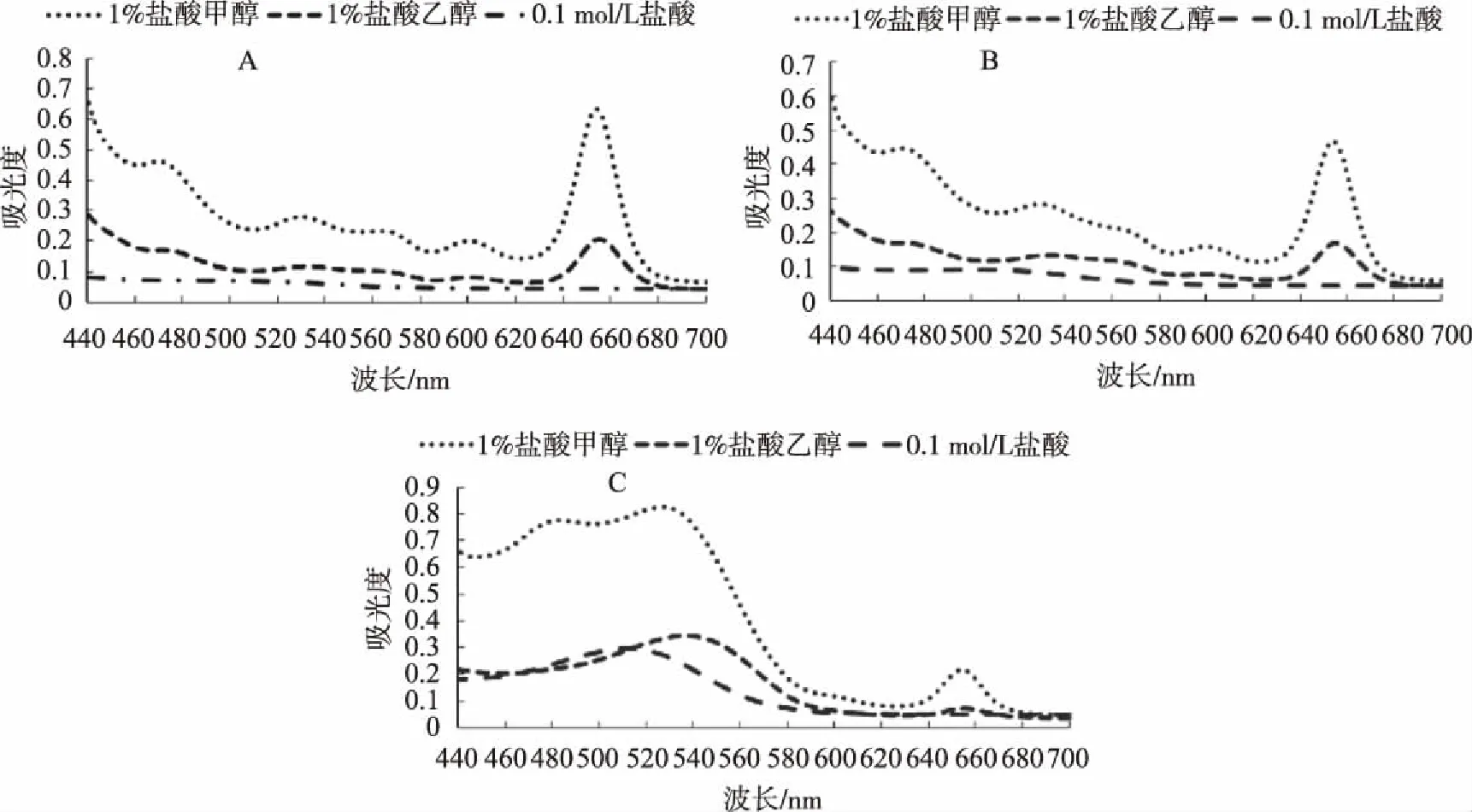
图1 不同溶剂提取的叶片变色初期、中期和末期中花色素苷吸收光谱Fig.1 The absorption spectrum of the anthocyanin obtained from leaves in initial, middle and end of leaf color change with different extraction solvents
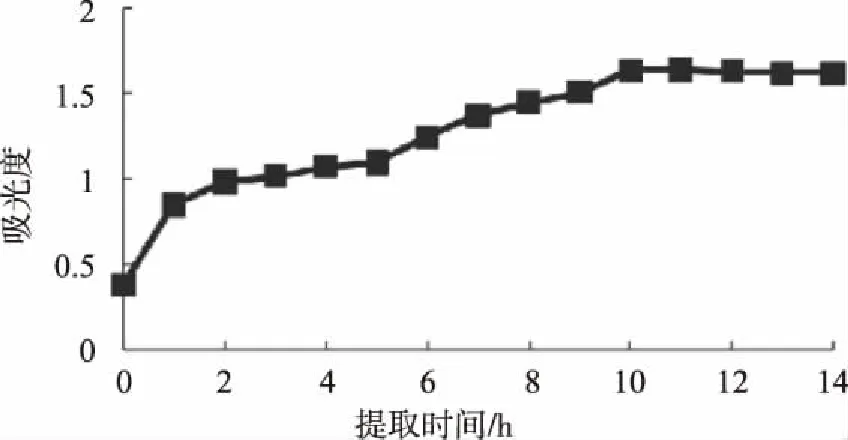
图2 不同提取时间下花色素苷含量变化Fig.2 Content changes of anthocyanin at different extraction time

表1 欧洲卫矛叶片花色素苷组分的种类和组成
峰E的保留时间t=2.7 min,其分子离子m/z 465获得1个碎片离子m/z 303,碎片离子m/z 303是失去一分子葡萄糖苷[M-162]+得到,碎片离子m/z 303是飞燕草苷元的特征质荷比,故推测峰E为飞燕草素-3-葡萄糖苷[11]。
峰G的保留时间t=2.8 min,其分子离子m/z 433获得1个碎片离子m/z 271,碎片离子m/z 271是失去一分子葡萄糖[M-162]+得到,碎片离子m/z 271是天竺葵苷元的特征质荷比,故推测峰G为天竺葵素-3-葡萄糖苷[11]。
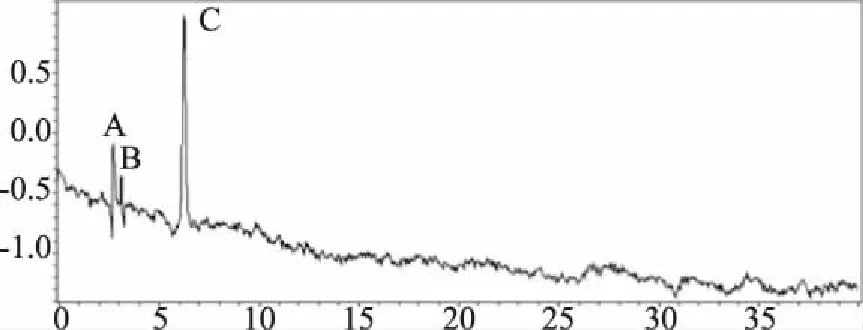
图3 欧洲卫矛叶片变色初期花色素苷的HPLC图谱Fig.3 HPLC chromatograms of anthocyanin in the early-stage of discoloration of E.europaea leaves

图4 欧洲卫矛叶片变色中期花色素苷的HPLC图谱Fig.4 HPLC chromatograms of anthocyanin in the mid-stage of discoloration of E.europaea leaves
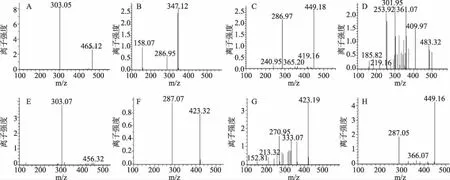
图6 各峰值碎片离子质谱图Fig. 6 MS/MS spectra of each peak
2.4 不同理化因子对欧洲卫矛叶片花色素苷稳定性的影响
2.4.1光照条件对欧洲卫矛叶片花色素苷稳定性
的影响
由图7A可以看出,在自然光和避光条件下,花色素苷溶液吸光值8h后分别增加了5%和3%。在日光灯下吸光值增幅较自然光、避光明显,作用3h时含量较为稳定,与自然光、避光条件下变化一致,作用3~8 h内吸光值上升速率增大,8 h后增加了28%。可见在自然光、避光条件下花色素苷较稳定。通过方差分析可知,花色素苷在自然光、避光条件下的吸光值与在日光灯下的吸光值差异显著,自然光与避光条件下花色素苷差异性不大。由此表明,欧洲卫矛叶片的花色素苷光稳定性较好,仅日光灯条件下的变化较大。
2.4.2 不同温度对欧洲卫矛叶片花色素苷稳定性
的影响
欧洲卫矛叶片花色素苷提取液经不同温度处理后,其花色素苷溶液吸光值见图7B,吸光值在不同温度处理下呈上升趋势。由方差分析可知,不同温度对欧洲卫矛花色素苷有较大的影响,花色素苷溶液吸光值在不同温度处理下的差异显著。4、25、35、45、55、65℃各处理8 h后的增幅分别为9.74%、49.36%、258.83%、805.91%、948.26%、955.01%。低温下,花色素苷的颜色保存时间较长[12],随着温度的升高,花色素苷溶液的颜色由亮红变为深红。花色素苷在25~35℃时较为稳定,可作为提取时温度条件。
2.4.3 不同pH值对欧洲卫矛叶片花色素苷稳定性的影响
由图7C可知,不同pH 值对欧洲卫矛叶片花色素苷影响很大。在pH为0、1.0、2.0时,欧洲卫矛叶片花色素苷有明显的吸收峰,最大吸收波长分别为495、494、495 nm,其对应的吸光值为0.488、0.574、0.567。在pH为3.0~8.0时,花色素苷无明显的吸收峰。随着pH值增大,花色素苷溶液颜色由红色变为橙色至棕褐色[13,14],欧洲卫矛叶片花色素苷在酸性条件下稳定性相对较好。
2.4.4 氧化剂H2O2、还原剂对欧洲卫矛叶片花色素苷稳定性的影响
由表2可知,随着氧化剂浓度的升高,花色素苷的吸光值无明显变化;随着花色素苷溶液中还原剂浓度的增加,吸光值有所上升,还原剂浓度为0.2 mol/L时花色素苷溶液吸光值比0.025 mol/L时增加了112%。低浓度如0.5%、1%的H2O2及0.025 mol/L的Na2SO3对花色素苷溶液无太大影响,但是随着氧化剂、还原剂浓度的升高,花色素苷溶液的颜色变浅。可见氧化剂、还原剂对欧洲卫矛叶片花色素苷的影响较大,花色素苷对氧化剂、还原剂的耐受性差。
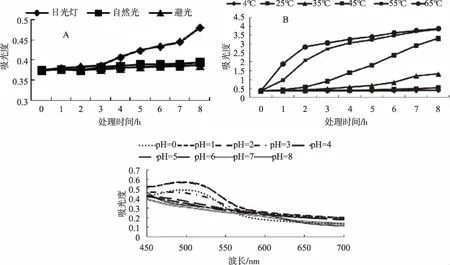
图7 不同光源、温度和pH下叶片花色素苷稳定性的差异Fig.7 Differences in stability of anthocyanin at different light sources, temperatures and pH value
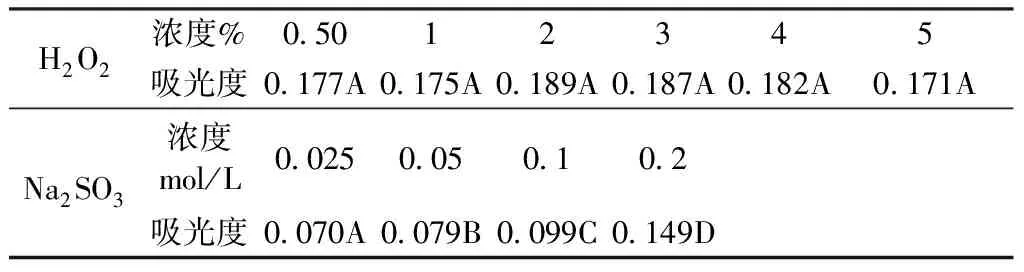
表2 氧化剂H2O2和还原剂Na2SO3对叶片花色素苷稳定性的影响
注:同行不同大写字母表示不同浓度下差异显著(P<0.05)
Note: Different capital letters on the sameline indicate significant differences at different concentrations(P<0.05)
2.4.5 金属离子对欧洲卫矛叶片花色素苷稳定性
的影响
由表3可知,9种金属离子对欧洲卫矛花色素苷的稳定性均有不同程度的影响。Fe3+、Fe2+对花色素苷溶液颜色影响较大,溶液由红色变为茶褐色、浅褐色,吸光度值分别增加了46.96%、32.82%;Na+、K+所在的花色素苷溶液吸光值分别增加了34.46%、32.82%,但溶液颜色变化不大,可见Na+和K+有一定的护色作用;加入Cu2+、Zn2+、Mg2+的花色素苷溶液的吸光度值无太大变化,但Cu2+所在的花色素苷溶液在离子浓度大于0.05 mol/L后呈现绿色,Zn2+、Mg2+所在的花色素苷溶液颜色无太大变化,可知Cu2+对花色素苷影响较大,Zn2+、 Mg2+对花色素苷无太大影响。此外,金属离子浓度由0.025 mol/L变为0.05 mol/L时,花色素苷溶液吸光度值增加较大,花色素苷溶液颜色或无明显变化或略微增色,此后吸光度值或趋于平稳或呈下降趋势,可见小于0.05 mol/L浓度的金属离子适合花色素苷的保存。
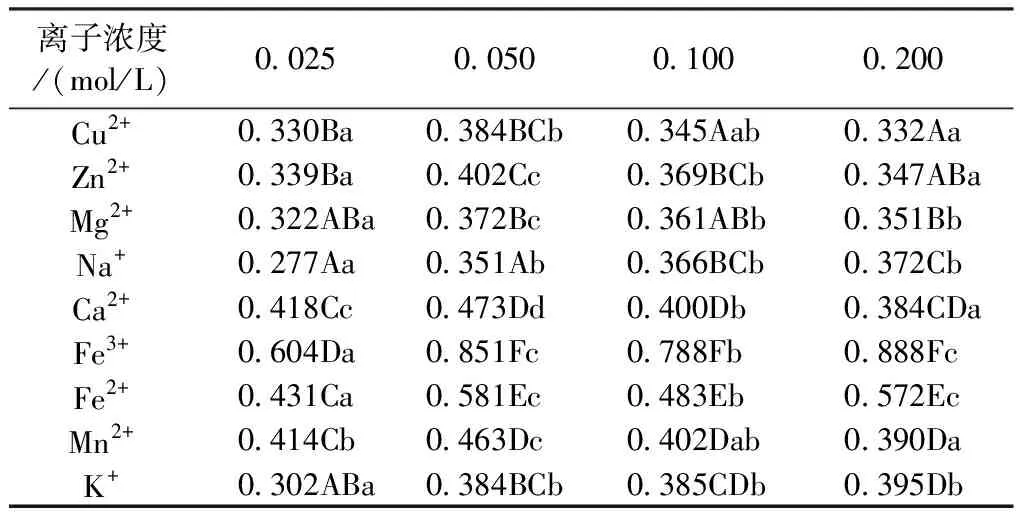
表3 不同浓度金属离子对叶片花色素苷稳定性的影响
注:同列不同大写字母表示不同离子间差异显著(P<0.05);同行不同小写字母表示不同浓度下差异显著(P<0.05)
Note: Different capital letters in the vertical row indicate significant differences between different ions(P<0.05);Different lowercase letters on the same line indicate significant differences at different concentrations(P<0.05)
3 结论与讨论
3.1 植物花色素苷的提取
欧洲卫矛叶片花色素苷的最佳提取液选用1%盐酸甲醇,最佳提取时间9~10 h。这与紫叶风箱果叶片花色素苷的最佳提取溶剂相同[7],而橡胶树叶片花色素苷的最佳提取溶剂为1%盐酸乙醇[15]。紫叶风箱果、橡胶树等植物叶片花色素苷最佳提取时间分别为3~4 h和6 h,相较之下,本试验结果得出的最佳提取时间略长,原因可能是本试验设计中物液比较大,花色素苷需要更多时间才能析出。
3.2 植物花色素苷的种类
花瓣、果实中花色素苷组分一般比叶片中丰富,更具观赏价值和食用价值,因而花瓣、果皮中花色素苷的组分鉴定技术已广泛应用,对今后叶片花色素苷组分的研究有一定参考价值。例如,12个风信子品种花瓣中的花色素苷以天竺葵素为主[16];二月兰粉色花瓣中检测到的5种花色素苷和蓝紫色花瓣中检测到的6种花色素苷以矢车菊素为主[17];粉色郁金香以矢车菊素为主,红色郁金香以天竺葵素为主,花色素苷组分及含量的差异造成两者花色不同[18]。这3种植物花瓣均不含类胡萝卜素。火龙果花色素苷为飞燕草素和矢车菊素的花色素苷衍生物;云南红梨成熟期果皮中花色素苷组分主要是矢车菊素-3-半乳糖苷[19]。由HPLC图谱可知,矢车菊素在叶片变色初期、中期、末期的峰值逐渐增大,且峰值远高于其它物质,说明呈色的主要花色素苷组分含量在变色过程中逐步增加,从而推测矢车菊素是欧洲卫矛秋色叶中主要的花色素苷组分物质,这与茶[20]、挪威槭[21]、大戟科[22]等植物花色素苷组分鉴定结果一致。在转色期间,花色素苷种类变化不大,花色素苷总含量、各组分含量增加明显。本文只是对花色素苷进行了定性分析,在今后的研究中,可以采用标准品半定量法对欧洲卫矛叶片花色素苷进行定量分析。此外,本文仅是通过与已有文献比对来推测欧洲卫矛叶片花色素苷种类,对于花色素苷元与糖苷连接的具体方式还无法确定,今后可以通过进一步的分离纯化来进行深入探究。
3.3 植物花色素苷的稳定性
欧洲卫矛叶片的花色素苷在黑暗及自然光下稳定性好,高于日光灯条件下。相关研究结果表明,红叶臭椿叶片花色素苷溶液在短时间的可见光照射下的吸光值与散射光下差异不大[13];橡胶树叶片花色素苷在自然光和避光条件下稳定性好,降解缓慢,在日光灯下降解较明显,这与本文研究结果相似。而小果野蕉[23]、巴西野牡丹[24]、黑胡萝卜[25]等植物花色素苷对光、热稳定性较差,认为自然光和高温均可影响花色素苷的稳定性,促使花色素苷降解加快,含量降低。在本研究中,欧洲卫矛花色素苷溶液在自然光及日光灯条件下,其吸光度增加,这与Askar的研究结果相一致[26],可能是由于聚合体的形成,特别是在高浓度花色素苷溶液里。此外,在较高浓度溶液中,由于光穿透的阻碍,在离光源或反应区足够远的花色素苷降解速度会降低,因此稀溶液比浓溶液的降解速度快,这也有待于进一步研究。
热处理被认为可以将花色素苷或其共轭糖分解成醛类、苯甲酸衍生物或同质花色素等小分子,随着时间增加和温度升高,可导致共着色花色素苷复合物的增色和红移。Timberlake认为花色素苷结构间的平衡是吸热的(从左到右):醌类黄酮阳离子甲醇假碱查耳酮[27]。在高温下,平衡转移到查尔酮,这意味着颜色的损失,而查尔酮向黄酮的回归是缓慢的。热力学测量也表明,花色素苷半缩醛形成查尔酮类化合物是吸热的,因而在低温下花色素苷溶液的变色物少,稳定性好[28]。本研究结果发现为低温条件下(不高于35℃)能较好地保持花色素苷的稳定性,但是随着温度的升高,花色素苷溶液吸光值随之增加,颜色由鲜红向深红转变。卫矛[29]花色素苷在50℃时达到最大值,50℃后开始下降,而本试验中欧洲卫矛在65℃时花色素苷溶液吸光值仍在增加。推测认为吡喃环的水解导致查耳酮的产生,查耳酮可以在含有花色素苷的植物体内形成棕色[30]。
花色素苷的离子性质使其分子结构会随pH值的变化而发生改变,产生不同的颜色。欧洲卫矛叶片花色素苷在强酸性条件下能保持高稳定性,而随着pH值的增加,花色素苷吸收峰消失,推测是由于花色素苷结构被破坏。这与相关研究结果一致,火龙果果皮花色素苷在pH值不高于4时较稳定[12];荔枝花色素苷的降解为一级反应,随着pH值增大,其花色素苷降解加快,低pH值溶液对荔枝果实有防褐保鲜效果[31]。研究认为低pH值下花色素苷利于呈红色效应,随着pH值增加,花色素苷的结构随之改变:红色的黄酮阳离子—无色的甲醇假碱—褐色产物[32]。花色素苷溶液颜色的变化说明其在碱性条件下的降解程度高于酸性条件,推测是由于更多的羟基自由基的形成从而提高了降解能力,而在酸性条件下氢氧根离子浓度很低,不足以形成足够的羟基自由基来加强降解能力[26]。当黄酮离子接触碱性pH时呈红色,无论光照与否,火龙果果皮花色素苷在4C、pH为4时均能很好的保持。欧洲卫矛花色素苷在pH为4时,花色素苷特征吸收峰已消失,可能是因为本文是在常温下探究不同pH值对花色素苷稳定性的影响,今后可综合探究pH值与温度共同对花色素苷稳定性的影响。
低浓度氧化还原剂对欧洲卫矛叶片花色素苷影响不大。因为花色素苷本身是一种抗氧化物质,具有较强的自由基清除能力。随着氧化剂、还原剂浓度的增加,花色素苷溶液吸光值无太大变化,但颜色逐渐变淡。说明花色素苷对氧化还原剂的耐受力差,H2O2可氧化花色素苷,随着氧化剂浓度增加,花色素苷逐渐被氧化分解,颜色由鲜红色转变为浅褐色。荔枝果皮在强还原剂(AsA)处理下稳定性较差[33],但Na2S2O7处理下的保存率高于对照,说明低强度的还原剂可在一定程度上保持花色素苷的稳定性,且花色素苷溶液加酸后可恢复红色。
大多数金属离子对花色素苷有很好的护色效果,这与前人研究结果一致,认为金属可以稳定一些浆果的颜色。通过适当的金属络合可以使花色素苷提取液具有理想的色泽和稳定性[34-35]。但本文研究发现,Fe3+、Fe2+、Cu2+对花色素苷呈色影响较大,因此在储存时应避免与铁器、铜器接触。据报道[36],花色素螯合金属离子可以稳定醌基,保护花色素苷分子免受亲核攻击,因此金属离子络合可以减少热处理过程中花色素苷的降解。本文是在常温下探究金属离子对花色素苷溶液的影响,今后可研究欧洲卫矛叶片花色素苷溶液在不同金属离子与不同温度条件下的稳定性。
综上所述,欧洲卫矛叶片花色素苷的提取液以1%盐酸甲醇最佳,适宜提取时间为9~10 h;共鉴定出6种花色素苷组分;光稳定性较好,仅日光灯条件下变化较大;强酸性条件下能保持高稳定性;在不高于35℃时稳定性好,高温利于花色素苷显色;对氧化剂、还原剂的耐受性差,随着氧化还原剂浓度上升,提取液颜色逐渐变浅;大多数金属离子对花色素苷有较好的护色效果,Fe3+、Fe2+、Cu2+对花色素苷呈色影响较大。今后可进一步对欧洲卫矛叶片花色素苷在不同理化因子条件下结构的变化及花色素苷组分的结构进行进一步探究。
