早期剥除卵丘细胞对冻融单囊胚移植妊娠结局及新生儿结局的影响
2022-10-19张卉王常燕王玉红常文亮卢静景丽柴亮听
张卉,王常燕,王玉红,常文亮,卢静,景丽,柴亮听
(1.邯郸市中心医院生殖医学科,邯郸 056000;2.邯郸市第一医院检验科,邯郸 056000)
自1978年以来,辅助生殖技术(ART)取得了极大进步,但常规体外受精(IVF)后完全受精失败的可能性仍不可避免[1-2]。在受精16~18 h后采用补救卵胞浆内单精子注射(R-ICSI),虽然能获得较好的受精率和卵裂率,但因卵母细胞老化,随后的胚胎发育和妊娠结局并不理想[1]。近年来,缩短精卵共培养时间,结合早期R-ICSI被认为是避免常规IVF周期中完全受精失败的有效策略[3]。
卵丘细胞在卵母细胞生长、成熟、受精和胚胎发育过程中起着至关重要的作用[4]。然而,为了识别未受精卵母细胞并进行早期R-ICSI,需要在精卵共培养4~6 h(短时受精)后剥除卵丘细胞,以确定卵母细胞中是否出现第二极体[5]。有研究表明,短时受精可以显著改善受精率、囊胚质量和胚胎种植能力[6],也有研究认为早期剥除卵丘细胞对受精、多精受精、胚胎发育没有显著影响[7]。但大多数研究均认为,在精卵共培养4~6 h剥除卵丘细胞,可以早期发现低受精或完全受精失败。目前,对于早期剥除卵丘细胞仍没有共识,且很少有研究探讨早期卵丘细胞剥除对胚胎移植后活产和新生儿结局的影响。本文旨在研究IVF周期中4 h和16~18 h剥除卵丘细胞组的正常受精率、多原核受精率、胚胎和囊胚发育潜力差异,同时探讨两者冻融单囊胚移植后的妊娠结局和新生儿结局。
资料与方法
一、研究对象及分组
回顾性分析2018年1月至2020年12月于邯郸市中心医院生殖医学科接受常规IVF治疗的单囊胚解冻移植患者的临床资料。
纳入标准:(1)女方年龄≤40岁;(2)取卵周期获得≥4个卵母细胞;(3)移植胚胎为常规IVF周期冻融单囊胚;(4)解冻后存活且培养2 h扩张程度达1/2以上的囊胚。
排除标准:(1)ICSI或R-ICSI周期的冻融囊胚移植;(2)患有先天或继发子宫异常、宫腔粘连的患者;(3)转化日子宫内膜厚度<8 mm的患者;(4)单囊胚移植后单卵双胎分娩的患者。
本研究共纳入241个周期,根据卵丘细胞剥除时间,将患者分为两组:4 h组(n=116)和16~18 h组(n=125),4 h组在精卵共培养4 h后剥除卵丘细胞并进行卵母细胞第二极体观察,16~18 h组在精卵共培养16~18 h后剥除卵丘细胞直接进行原核观察。4 h组患者至少有一个不受精的高危因素:女方有影响卵母细胞质量的因素(如子宫内膜异位症或多囊卵巢综合征)、不孕年限≥3年、不明原因不孕。
二、研究方法
1.促排卵方案和卵母细胞获取:所有患者均接受控制性卵巢刺激(COS),COS方案包括促性腺激素释放激素激动剂(GnRH-a)长方案、促性腺激素释放激素拮抗剂(GnRH-ant)方案或微刺激方案。当≥3个卵泡直径达到18 mm时,肌肉注射5 000~10 000 U的HCG(珠海丽珠),以触发卵母细胞成熟。HCG注射35~37 h后经阴道B超引导下穿刺取卵。将采集的卵丘-卵母细胞复合(COCs)置于G-IVF plus受精培养液(Vitrolife,瑞典)中,在5% O2、6% CO2的37℃培养箱(Cook,美国)中等待受精。
2.精子制备和受精:在禁欲2~7 d后,取卵当日男方手淫取精,精液在室温条件下液化至少30 min。根据《世界卫生组织人类精液检查与处理实验室手册》(第五版)标准,对精液质量进行评估,采用常规不连续密度梯度离心法和上游法处理精液,处理后的精子保存在室温下备用。注射HCG 38~40 h后按照10~20万条精子/ml受精体系将精子加入COCs所在的G-IVF plus受精液中进行授精。
3.卵丘细胞剥除:4 h组将精卵共培养4 h,用140 μm剥卵管(Cook,美国)反复抽吸卵母细胞,直到移除大部分卵丘细胞,将受精卵转移到G-1 plus 卵裂培养液(Vitrolife,瑞典)微滴中观察极体情况。若卵母细胞存在两个极体判断为受精,低于30%的受精率属于低受精,当所有卵母细胞均未出现第二极体时,判定受精完全失败。低受精或完全受精失败的患者在授精6 h后进行早期R-ICSI。16~18 h组将COCs与精子共培养16~18 h后剥除卵丘细胞,直接观察原核情况。
4.受精、胚胎发育评估及移植:在卵母细胞授精约16~18 h后,观察两组卵母细胞是否存在原核(PN),以确定受精情况。当观察到2PN时,判断为正常受精;观察到0PN、1PN或多PN(>2PN)时,判断为异常受精。多PN受精卵直接丢弃,2PN、1PN或0PN卵裂的受精卵于受精后的1~3 d在G-1 plus卵裂培养液中培养,4~6 d在G-2 plus囊胚培养液(vitrolife,瑞典)中培养,第3 天可利用胚胎定义为细胞数≥6个、细胞碎片比例≤25%的2PN 胚胎。除外第3天移植及冷冻的胚胎,将剩余2PN 胚胎及所有1PN和0PN 卵裂期胚胎进行囊胚培养。根据Gardner评分系统对囊胚进行评分,可利用囊胚进行玻璃化冷冻或解冻。
5.内膜准备:如前所述[8],患者采用人工周期或自然周期准备子宫内膜。人工周期方案:月经第3天起口服戊酸雌二醇(补佳乐,拜耳,德国)4~10 mg/d,当B超监测内膜厚度≥8 mm时,肌肉注射黄体酮(浙江仙琚)40~60 mg/d使内膜转化为分泌期,转化第6天行冻融单囊胚移植。自然周期方案:于月经周期的第8~10天开始B超监测卵泡及内膜,当优势卵泡直径>14 mm时,同时监测血黄体生成素(LH)水平,确定排卵时间,排卵前肌肉注射HCG(珠海丽珠)5 000~10 000 U,卵泡破裂后第5天行冻融单囊胚移植。移植后继续给予黄体支持。随访所有移植患者的妊娠结局,直到分娩或流产。
6.临床结局判断:胚胎移植后14 d血清β-HCG≥3 U/L定义为HCG阳性,移植后28 d行B超检查见妊娠囊及原始心管搏动定义为临床妊娠。孕28周之前的胚胎丢失或妊娠终止定义为流产。早产(PTB)定义为妊娠前37周的分娩。低出生体重(LBW)为新生儿出生体重<2 500 g。
7.观察指标:两组患者的基本资料,包括女方年龄、体质量指数(BMI)、不孕年限、基础FSH、不孕类型、不孕原因以及促性腺激素(Gn)总量、促排卵天数、平均获卵数、子宫内膜厚度、内膜准备方案、移植囊胚期;受精及胚胎发育情况,包括2PN率、多PN率、囊胚形成率、可利用胚胎率;妊娠结局,包括HCG阳性率、临床妊娠率、流产率及活产率;新生儿结局,包括新生儿胎龄、早产儿比例、新生儿体重、低体重儿比例、新生儿性别比例和畸形儿比例。
2PN率=2PN卵母细胞数/IVF加精卵母细胞数×100%;多PN率=>2PN卵母细胞数/IVF加精卵母细胞数×100%;囊胚形成率=形成囊胚数/进行囊胚培养胚胎数×100%,可利用胚胎率=(移植胚胎数+冷冻胚胎数)/总卵裂数×100%;HCG阳性率=HCG阳性周期数/移植周期数×100%;临床妊娠率=临床妊娠周期数/移植周期数×100%;流产率=流产周期数/临床妊娠周期数×100%;活产率=活产周期数/移植周期数×100%;胎龄=囊胚移植后的天数+19。
三、统计学方法
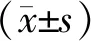
结 果
一、两组患者的基本资料
本研究共分析了241个冻融单囊胚移植周期,根据受精过程中卵丘细胞剥除时间,将患者分为4 h组(n=116)和16~18 h组(n=125)。分析两组患者的基本资料,结果显示:4 h组不孕年限和原发不孕比例均显著高于16~18 h组(P<0.01),两组之间的不孕原因也有显著差异(P<0.05);两组患者在女方年龄、BMI和基础FSH水平方面无显著性差异(P>0.05)(表1)。

表1 两组患者一般情况比较[M(P25,P75),(-±s),n(%)]
二、两组患者的促排卵及受精情况
统计结果显示,与16~18 h组相比,4 h组Gn总量和可利用胚胎率显著增加(P<0.05);而在促排卵天数、平均获卵数、2PN率、多PN率、囊胚形成率、子宫内膜厚度、内膜准备方案和移植囊胚期方面,两组间均无显著差异(P>0.05)(表2)。
三、两组患者的临床结局比较
两组患者的HCG阳性率、临床妊娠率、流产率及活产率比较均无显著差异(P>0.05)(表3)。
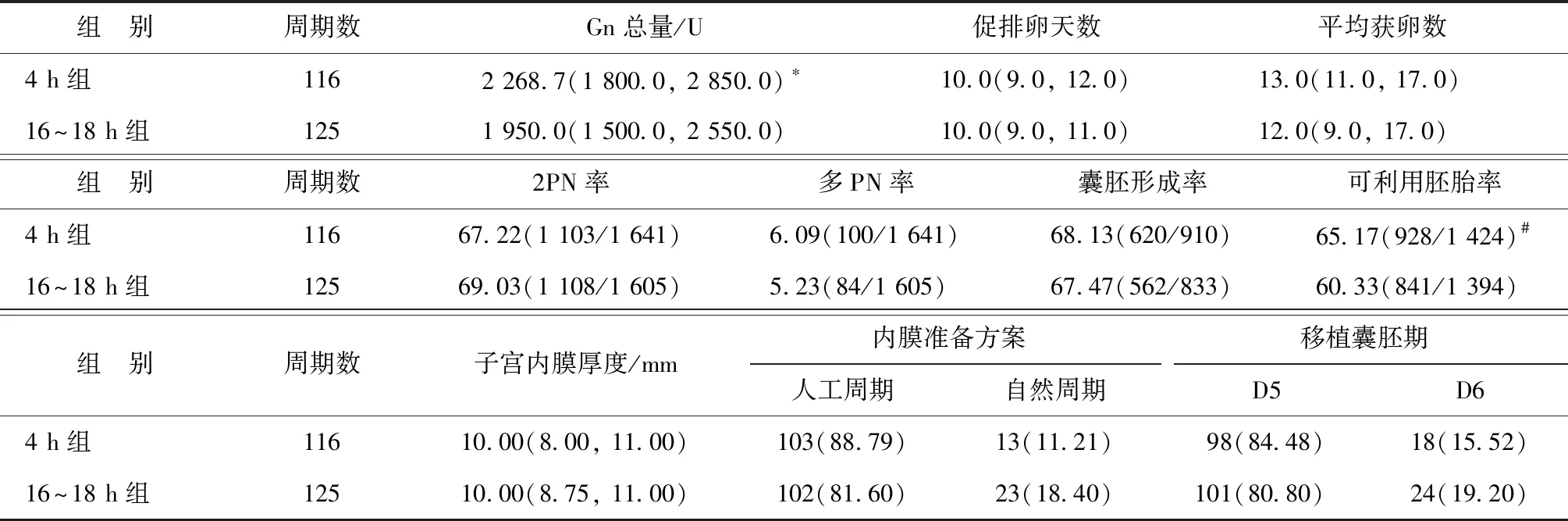
表2 两组患者的促排卵及受精情况比较[M(P25,P75),%,n(%)]
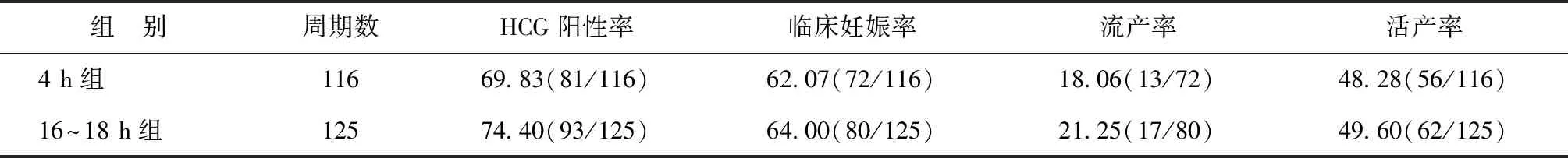
表3 两组患者的妊娠结局比较(%)
四、两组患者新生儿结局比较
两组间的新生儿胎龄、新生儿体重、早产儿比例、低体重儿比例以及性别比均无显著差异(P>0.05),两组均无畸形儿出生(表4)。

表4 两组间新生儿结局比较[M(P25,P75),(-±s),%]
五、早期剥除卵丘细胞对妊娠结局和新生儿结局的影响
通过多因素线性回归及多因素Logistic回归分析探讨早期剥除卵丘细胞与妊娠结局及新生儿结局之间的独立关联。在调整了女性年龄、BMI、不孕年限、基础FSH、不孕类型、不孕原因、Gn总量、移植囊胚期、子宫内膜厚度、内膜准备方案后,两组患者间的临床妊娠结局比较均无显著性差异(P>0.05)(表5);新生儿结局分析中,两组间的新生儿胎龄、新生儿体重、早产儿比例、低体重儿比例比较也均无显著性差异(P>0.05),但4 h组新生儿男性比例显著高于16~18 h组(P=0.04)(表6)。
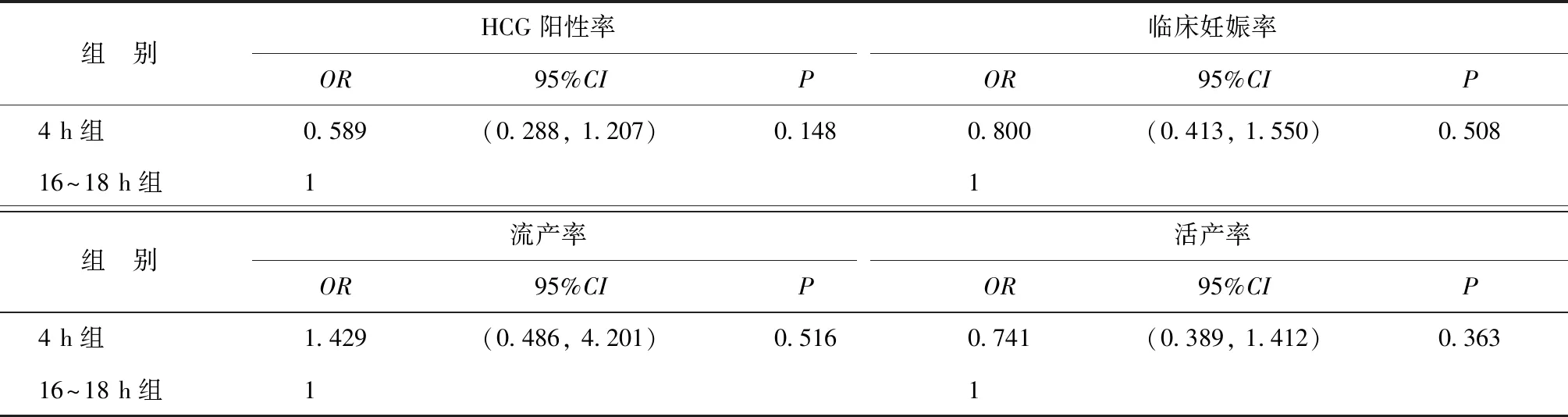
表5 早期剥除卵丘细胞对妊娠结局影响的多因素Logistic回归分析
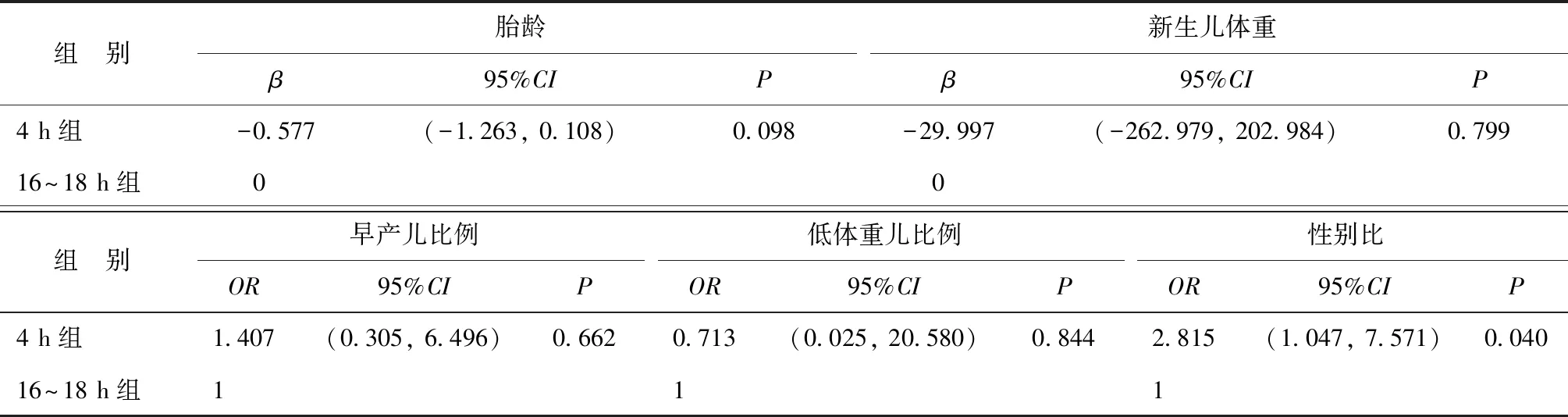
表6 早期剥除卵丘细胞对新生儿结局影响的多因素线性/Logistic回归分析
讨 论
卵丘细胞在卵母细胞发育和自然受精过程中必不可少,但在ICSI周期中胚胎在没有卵丘细胞的情况下能够正常发育,这一事实表明,早期剥除卵丘细胞可能不会影响胚胎发育。此外,Chen等[9]发现,卵母细胞与精子共培养2~4 h后受精,约90%卵母细胞在授精6 h出现第二极体。Jin等[10]发现,在精卵共培养4 h时观察到第二极体的卵母细胞中93.3%于授精14~18 h后观察到受精迹象,其中84.8%表现为正常受精;如果在早期卵丘细胞剥除过程中未观察到第二极体排出,可进行早期R-ICSI,与晚期R-ICSI相比,早期R-ICSI可获得更高的受精率和更具有发育潜力的胚胎。
既往研究表明,原发不孕和较长的不孕时间是完全受精失败的高危因素[11],不明原因不孕患者完全受精失败的发生率也较高[12]。本研究将这些原因导致不孕的患者纳入4 h组,必要时进行早期R-ICSI。因此,4 h组与16~18 h组在原发不孕率、不孕持续时间、不育原因等方面存在显著差异。与16~18 h组相比,4 h组Gn总量显著增加,这可能是由于4 h组患者卵巢功能反应欠佳所致。
早期剥除卵丘细胞对多精受精的影响仍存在争议。受精早期较晚期剥除卵丘细胞更困难,同时,在受精早期,卵母细胞由于纺锤体和微管的活跃而更加脆弱,重复性的抽吸可能会对卵母细胞结构的完整性造成不利影响,从而损伤其多精受精的保护机制[13]。已有研究显示,早期剥除卵丘细胞后多PN率显著增加[14]。然而,也有研究报道,短时受精并没有增加多PN率[13]。有学者观察到早期剥除卵丘细胞后正常受精率显著降低[15-16]。我们的研究显示,4 h组的多PN率增高,而2PN率降低,尽管两组之间的差异均无统计学意义,但仍有一定的变化趋势,这一结果与之前的报道[7]一致。卵丘细胞为卵母细胞提供了一系列在卵母细胞成熟、受精和发育中发挥重要作用的物质[17]。但我们的结果显示,4 h组的可利用胚胎率显著高于16~18 h组,这可能是由于随着共培养时间的延长,卵丘细胞和精子产生的有毒代谢物会对胚胎发育产生不利影响[18]。然而,也有报道认为早期剥除卵丘细胞并不影响胚胎的活力、质量以及临床结局[19-20]。产生这些矛盾结果的原因可能是研究设计和患者的异质性。卵丘细胞对卵母细胞的受精结局有利有弊,其确切性质有待进一步研究证实。
关于受精过程中早期剥除卵丘细胞对临床结局和新生儿结局的影响,一项前瞻性随机对照研究显示,与20 h组相比,4 h剥除卵丘细胞对新鲜胚胎移植周期的HCG阳性率和临床妊娠率无不良影响[21]。另一项回顾性研究也表明,在年龄小于40岁的患者中,与常规卵丘细胞剥除相比,早期卵丘细胞剥除对临床妊娠、流产和活产率没有不利影响[22]。本研究中,4 h组与16~18 h组的冻融单囊胚移植结局比较,在HCG阳性率、临床妊娠率、流产率和活产率方面差异均无统计学意义(P>0.05)。上述数据表明,在新鲜胚胎移植和冻融单囊胚移植周期中,受精过程中早期卵丘细胞剥除可能对妊娠结局没有不利影响。
目前,关于早期卵丘细胞剥除对新生儿预后的研究还很有限。已有研究发现,4 h和20 h剥除卵丘细胞组的新鲜胚胎移植后单胎和双胎的新生儿在出生体重、早产率、新生儿性别比例等方面相似[22]。尚未有文献对早期剥除卵丘细胞后的冻融胚胎结局进行研究,本文针对冻融单囊胚移植,分析了胚胎移植后的单胎妊娠和新生儿结局。研究结果显示,排除混杂因素干扰后,两组间新生儿胎龄、早产儿比例、新生儿体重及低体重儿比例比较均无显著差异(P>0.05),两组均无重大畸形儿出生,但4 h组中男性新生儿比例显著高于16~18 h组(P=0.04),提示早期剥除卵丘细胞可能会增加冻融单囊胚移植后男性新生儿的出生比例。
本研究的主要优势在于探究了早期卵丘细胞剥除后冻融周期囊胚移植的临床妊娠和新生儿结局。由于双胎妊娠与不良妊娠和新生儿结局的风险增加相关,因此本研究只纳入了单囊胚移植及单胎新生儿出生的病例,排除了多胎妊娠产生的不利影响;此外,本研究进行了回归分析,尽量减少与妊娠和新生儿结局可能相关的混杂因素。但本研究也存在一定的局限性:首先,作为一个回顾性分析,数据收集来自病历记录,不能排除所有可能影响研究结局的自变量因素;其次,研究数据来自单中心,纳入的周期数较少,出生的新生儿数量也相对较少。因此,后期需要进行多中心前瞻性研究,以消除混杂因素的影响。
综上所述,在冻融单囊胚移植周期中,受精过程中早期剥除卵丘细胞对妊娠结局和除新生儿性别比以外的新生儿结局没有显著影响。对于有不受精高危因素的患者,可以选择早期卵丘细胞剥除联合早期R-ICSI。但尚需对早期剥除卵丘细胞后新生儿性别及新生儿长期随访进行关注,进一步验证早期卵丘细胞剥除的安全性。
