基于网络药理学和分子对接研究人参-黄精药对治疗癌因性疲乏的作用机制
2022-10-17姜家康牛泽基姜庆辉周云波邹香妮迟文成
姜家康,牛泽基,姜庆辉,周云波,邹香妮,迟文成
(1. 黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040;2. 黑龙江中医药大学,黑龙江 哈尔滨 150040)
癌因性疲劳(cancer-related fatigue、CRF)定义为在临床上与癌症或癌症治疗相关的令患者痛苦、持续、主观的身体上或者情绪上的认知疲劳或疲惫感,与近期活动不成比例,休息或睡眠后不能得到缓解,是临床上癌症患者最常见的不良反应之一[1-2]。在临床上,任何癌症在其发生发展及治疗过程中均可发生CRF,40%的癌症患者在诊断时、90%接受放疗和80%接受化疗的患者均经历过[3-4]。Bower[5]认为CRF的发病机制与下丘脑-垂体-肾上腺轴失调(HPA轴)、细胞免疫、肿瘤治疗前、治疗中和治疗后的炎症等有关,并受遗传风险、心理和生物行为风险因素的影响。临床上的非药物治疗如体育锻炼及功能康复补充和替代疗法医从性差,持续时间较长,而药物治疗常引起失眠、心悸、焦虑等一系列不良反应[6-7]。因此,临床上需要较为安全有效的CRF治疗药物。人参作为黑龙江省的道地药材,首载于《神农本草经》:“补五脏、安精神、定魂魄、止惊悸……”现代药理研究证明人参在抗疲劳方面具有调节中枢神经系统、刺激HPA轴、抗氧化和抗炎等作用[8]。陆宏隆[9]在对人参及人参类药物治疗CRF的研究结果表明人参能有效减轻患者的疲乏程度,改善患者功能状态且无不良反应。徐大玉[10]通过实验证实人参中的人参皂苷Rg3通过激活AMPK改善CRF。黄精首见于《名医别录》;记载其具有“补中益气……安五藏”之功用。黄精中的黄精总多糖、薯蓣皂苷元等在抗炎、抗氧化、抗肿瘤、提高免疫力方面疗效确切[11]。黄精在临床上也应用于治疗CRF[12]。目前对于CRF的相关研究多倾向于临床疗效分析,在人参-黄精药对协同作用于CRF的机制不甚明确,尚无系统性研究发表。网络药理学最早由Andrew L Hopkins 在Nature Biotechnology 杂志中提出并系统描述,通过网络中的多靶点及药物间其协同作用,广泛应用于从系统层次和整体角度挖掘药物对多种疾病的作用或机制[13]。中药具有悠久历史,可以利用网络药理学基于大数据精确分析中药的药效基础,为筛选中药有效成分和靶点提供了一种从系统角度和分子水平的新研究方法。分子对接采用计算机软件进一步探究关键化合物和核心靶点之间的结合方式,同时评估两者的结合潜力。本研究采用网络药理学和分子对接技术研究人参-黄精治疗CRF的潜在靶点和协同机制,为临床应用提供理论参考和依据。
1 资料与方法
1.1人参-黄精的活性成分以及靶点预测 在中药系统药理学数据库(Traditional Chinese Medicine Database and Analysis Platform,TCMSP,https://tcmsp-e.com/),根据吸收、分布、代谢和排泄(ADME)和药物相似性(drug likeness,DL)、口服生物利用度(oral bioavailability,OB),筛选OB≥30%、DL≥0.18的药物活性成分。整理筛选出来的活性成分的“Mol ID”,在TCMSP数据库中“Related Targets”库中检索相对应的“Mol ID”靶点信息,从而得到人参-黄精的全部潜在靶点基因。然后将其导入UniProt数据库(https://www.uniprot.org/),设置筛选条件为“Human”,限定结果为“Reviewed(已验证)”,将所有蛋白质靶点名称转换为基因名。
1.2CRF相关疾病靶点检索 分别在GeneCards(https://www.genecards.org/)和人类孟德尔遗传在线数据库(Online Mendelian Inheritance in Man Database OMIM)(https://www.omim.org/),以“cancer related fatigue、cancer-related fatigue”为关键词进行搜索,收集CRF所有相关的基因靶点信息,去重,得到疾病靶点信息。
1.3药物-疾病共同靶点 将药物靶点和疾病靶点分别导入Venny2.1.0在线网络平台(https://bioinfogp.cnb.csic.es/),绘制Venn图,获得药物-疾病的交集靶点基因。
1.4构建核心靶点PPI网络 运用STRING在线数据库(https://www.string-db.org/cgi/)对筛选出的核心靶点进行蛋白质-蛋白质相互作用网络(Protein-Protein Interaction,PPI)分析,将蛋白种类设置为“homo sapiens”,最低相互作用阈值设为“highest confidence”(0.7),并删除游离的靶点。下载TSV格式文件,导入Cytoscape3.7.2软件,运用网络拓扑学原理绘制PPI网络,然后根据Degree值筛选关键靶点。
1.5靶点的生物富集分析和通路注释解释 将筛选得到的交集靶点基因输入DAVID 6.8(https://david.ncifcrf.gov/)在线网站,进行基因本体(GO)功能富集分析与京都基因和基因组百科全书(KEGG)通路注释分析。设定物种选为“Homo.sapiens”提交,以“P-Value< 0.01”为筛选条件。使用微生信在线平台(http://www.bioinformatics.com.cn/)将GO富集分析中细胞组分(cellular component,CC)、分子功能(molecular function,MF)、生物过程(biological process,BP)排名前10名的分析结果制作水平条形图,将KEGG通路注释分析中与癌症相关的通路绘制气泡图进行展示。运用Hiplot生物医学可视化平台(https://hiplot.com.cn/)展示多靶点基因共同作用于同一通路的调控机制,制作KEGG弦图。
1.6构建中药-有效成分-靶点-KEGG通路网络 将KEGG通路注释分析中与癌症相关的通路和与之相关的基因靶点、活性成分以及药物用Excel整理,制作“Note Work”和“Type”文件,分别导入Cytoscape3.7.2软件。即得到人参-黄精治疗CRF的中药-有效成分-靶点-KEGG通路网络图。
1.7关键活性成分与靶点的分子对接验证 分子对接是一种预测蛋白质和配体结合能力和连接类型的计算工具。它可以计算和预测活性蛋白位点配体的构象和方向。将PPI网络中Degree值较高的5个关键靶点和中药-有效成分-靶点-KEGG通路网络中Degree值排名靠前的6个有效成分进行分子对接实验。对接具体步骤为:从TCMSP数据库中下载配体(有效成分)的mol2格式文件,从RCSB PDB数据库(https://www.rcsb.org/)中获得受体(关键靶点)的3D分子结构的pdb文件。将受体和配体通过Autodock Tools软件进行去水、加氢键、计算电荷等处理后统一转化为pdbqt格式,然后设置适当的盒子大小,使用Vina依次对接,获得结合自由能,并验证其亲和力。自由能越小,亲和力越高,对接结果越好。将结果输出为.dlg文件并上传到PyMOL软件以建立3D模型。结合能可作为对接评分以评估有效成分与关键靶点的蛋白质-配体结合潜力。
2 结 果
2.1人参-黄精的活性成分以及靶点预测 以“人参”“黄精”为关键词,通过TCMSP数据库中检索共得到34个活性成分符合标准,其中人参有22个、黄精有12个。然后再于“Related Targets”中检索并删除无潜在靶点基因的药物成分,最后得到人参-黄精可纳入研究的活性成分分别为17个和8个,并得到一个共同交集成分“MOL000358”(见表1)。得到每个活性成分对应的所有基因靶点,导出数据,经过UniProt校正、去重、筛选并剔除未识别靶蛋白及非人源基因,最终得到人参-黄精有效成分对应的118个药物靶点。然后使用Cytoscape软件构建“成分-靶点”网络(见图1),靶点的大小随Degree值变化。图中Degree值较高的靶点包括PTGS2(Degree=17)、PTGS1(Degree=15)、ADRB2(Degree=11)等;Degree值较高的成分包括山柰酚(MOL000422,Degree=50)、黄芩素(MOL002714,Degree=29)、β-谷甾醇(MOL000358,Degree=27)、豆甾醇(MOL000449,Degree=23)、原阿片碱(MOL000787,Degree=20)等。
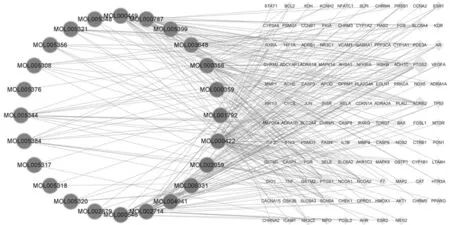
圆形节点代表药物活性成分MOLID,其中紫色来源于人参;红色来源于黄精黄色菱形节点表示药物起作用的靶基因,节点大小反映其活性

表1 人参-黄精主要活性成分及基本信息
2.2CRF相关疾病靶点检索与获取疾病-药物共同靶点 通过OMIM、GeneCards数据库检索“cancer related fatigue”,由于GeneCards数据库中基因较多,以“Relevance score”大于中位数(>5.600)的基因作为目标靶点,得到2 228个靶基因,结合OMIM中获得1140个靶基因,去除重复值后得到最终得到3 694个疾病靶基因。将药物靶基因和疾病靶基因导入Venny2.1.0平台,绘制Venn图(见图2),获得93个CRF与药物的交集基因。

图2 疾病-药物Venn图
2.3构建核心靶点PPI网络 将筛选出的93个交集靶点导入STRING数据库进行PPI关系分析,去除孤立靶点,将TSV文件导入Cytoscape3.7.2软件进一步计算所有纳入节点的度值(Degree)、中间中心性(Betweenness Centrality,BC)、紧密中心性(Closeness Centrality,CC),计算上述所有值的中位数。PPI网络共包含76个节点和410条边(见图3)。网络图中的节点代表蛋白质,度值表示连接到同一节点的线数,用于评估网络中每个节点的重要性。每条边代表蛋白质之间的相互作用关系,线越多,关联程度越大。拓扑学结果分析表示,Degree值中位数为8,BC中位数为0.003 496 27,CC中位数为0.447765185,将低于上述参数的靶点剔除。最后满足上述靶点的共27个,然后以Degree值排序,选取排名前5个,包括6个核心靶点AKT1、JUN、TNF、TP53、CASP3、IL-1β,可能提示这6个靶点在人参-黄精治疗CRF中发挥的作用最强,是分子调控网络的中的关键靶点(见表2)。
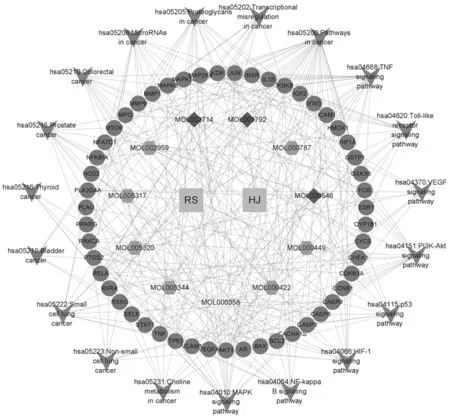
菱形节点代表26≥Degree值≤37的靶点;三角形节点代表17≥Degree值≤25的靶点;V形节点代表9≥Degree值≤16的靶点;圆形节点代表1≥Degree值≤8的靶点

表2 人参-黄精药对治疗癌因性疲劳关键靶点及其基本信息
2.4靶点的生物富集分析和通路注释解释 将上述的93个关键靶点导入DAVID数据库进行GO富集分析与KEGG通路注释分析,共得到234个GO富集分析及87条信号通路。其中生物过程(BP)168个,细胞组成(CC)21个,分子功能(MF)45个。GO富集分析显示(见图4),关键靶点主要通过细胞(核、质、膜)、胞浆、线粒体、内质网等细胞组分参与对RNA 聚合酶Ⅱ启动子对转录的正调控、信号转导、对药物的反应、脂多糖、凋亡过程反应等生物学过程,并发挥蛋白质结合、酶结合、特定DNA结合等分子功能,进而发挥治疗CRF的作用。KEGG通路注释分析表明(见图5),19条通路与人参-黄精治疗CRF有关。气泡图中气泡大小与富集的集团数目相关,颜色随“P-Value”大小变化,颜色越红,P值越大。KEGG弦图显示,核心靶点AKT1、JUN、TP53等主要调控癌症途径通路(hsa05200);MAPK8、TNF、IL-1β等主要调控TNF信号通路(hsa04668);AKT1、CASP3、MAPK14等主要调控肿瘤蛋白多糖通路(hsa05205);AKT1、RELA、TP53等主要调控PI3K-Akt信号通路(hsa04151),NF-κB信号通路(hsa04064)是炎症通路的焦点。在纳入的靶点基因中AKT1、TP53、RELA参与调控的信号通路最多,分别为13、10、10,可能与其他靶点产生较强的相互作用。

图4 癌因性疲劳与人参-黄精药对共同靶点GO功能富集分析结果
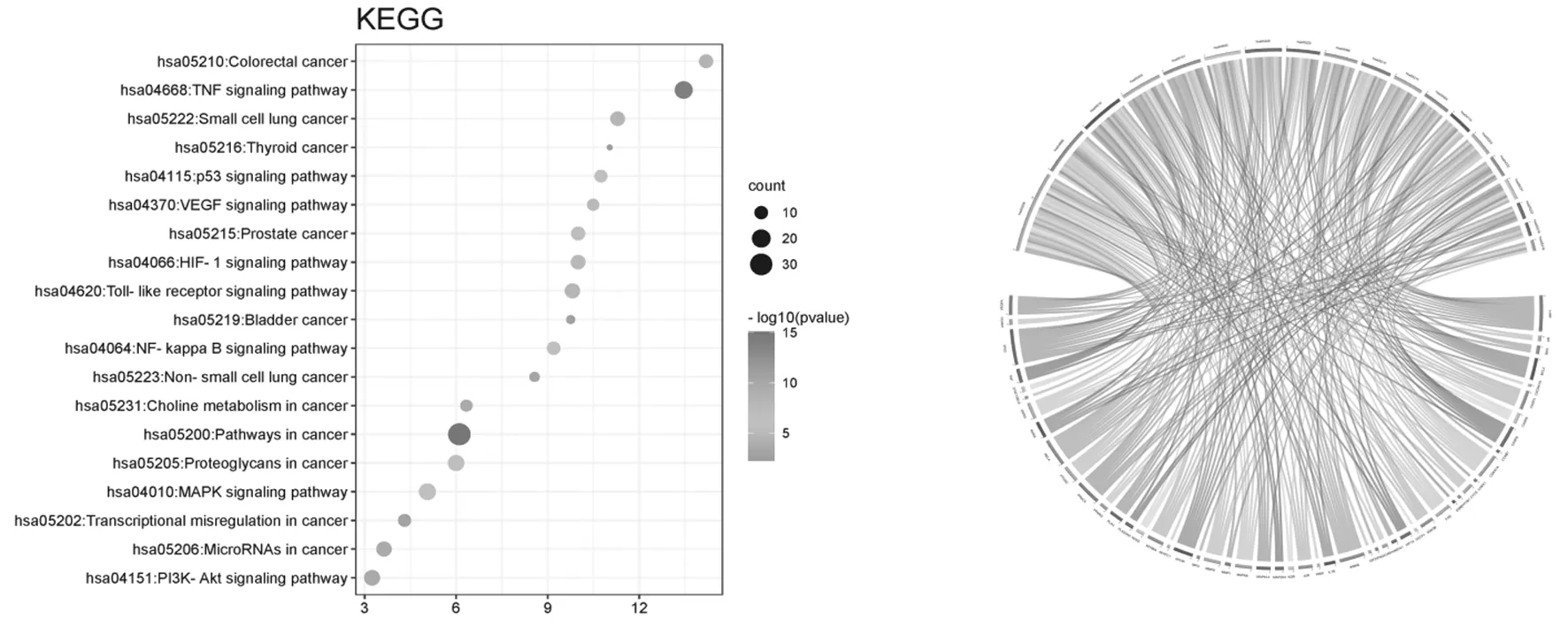
弦图上半圆表示信号通路、下半圆表示靶点,连线表示靶点与通路之间的联系
2.5构建中药-有效成分-靶点-KEGG通路网络 为了阐明人参-黄精作用于CRF的潜在机制,通过Cytoscape构建中药-有效成分-靶点-KEGG通路组成的复杂网络。该网络显示了药物、成分、关键靶点与信号通路之间的关系,包含83个节点和300条边,显示了这19条信号通路的详细信息。通过该网络分析,网络中连接节点的边越多,提示对应节点的重要程度越高(见图6)。

浅蓝色代表药物;绿色代表人参的活性成分;深蓝色代表黄精的活性成分;黄色代表二者共有的活性成分;红色代表靶点;紫色代表通路
2.6关键活性成分与靶标的分子对接验证 基于Degree值排名,选择有效成分山柰酚、黄芩素、β-谷甾醇、豆甾醇、原阿片碱与关键靶点AKT1、JUN、TNF、TP53、CASP3、IL-1β进行对接。基于文献报道,通常结合能<-5.0 kcal/mol提示分子之间具有较强的结合活性[14]。分子对接结果显示:5种有效成分与上述靶点对接的结果结合能均<-5.0 kcal/mol,说明他们之间的结合能力均较好,其中IL-1β与原阿片碱的结合能最好。并通过计算对接自由能合计得分,IL-1β总分最低(-40 kcal/mol),说明与有效成分结合效果最好。见表3及图7。

图7 关键靶点IL-1β、TP53、TNF与核心成分结合最佳构象

表3 人参-黄精药对有效成分与关键靶点结合自由能 kcal/mol
3 讨 论
中医古籍没有明确的关于CRF的记载,根据其临床表现可归于“虚劳”范畴。CRF不单独起病,多因肿瘤或治疗损伤人体正气,则脾胃亦伤,病久损其肾气,则脾肾两虚,气血不荣,最终脏腑气血阴阳俱虚[15]。“虚劳”最早见于《金匮要略》,病机以虚为本,或本虚标实,或虚中夹实,故临床治疗应以补虚为基本原则,注重调整脏腑功能,补益气血[16]。人参与黄精皆味甘,甘则能补、能缓、能和,归脾、肺、肾经,均有健脾益肾,补气润肺补虚之用,则可认为人参-黄精有潜在治疗CRF的作用。
本研究运用网络药理学从人参-黄精药对中筛选得到24个活性成分,93个重要靶点,通过“药物-活性成分-靶点”网络得到山柰酚、黄芩素、β-谷甾醇、豆甾醇和原阿片碱等是“人参-黄精”治疗CRF的主要活性成分。β-谷甾醇是人参和黄精共有的活性成分,通过内质网-线粒体轴增强活性氧的产生和钙内流,使线粒体膜电位的丧失和促凋亡信号产生,改变肿瘤细胞的信号通路,抑制肿瘤细胞聚集、生长和转移[17],同时随浓度变化促进细胞凋亡[18],也可以通过调节TP53基因加速肿瘤细胞凋亡[19]。山柰酚、豆甾醇和原阿片碱是来自人参的活性成分。山柰酚作为一种典型的抗疲劳成分,具有很强的抗氧化活性和清除自由基的作用[20-21],并在肿瘤细胞凋亡、血管生成、转移和炎症方面具有广泛的靶向作用[22]。豆甾醇通过抑制TNF-α、VEGFR-2和p-Akt、PCL和FAK的表达,有效地抑制肿瘤内皮细胞生长[23],通过阻断Akt-mTOR信号通路诱导胃癌细胞凋亡和自噬[24]。原阿片碱通过线粒体途径以半胱天冬酶依赖式抑制肿瘤细胞的活力并诱导其凋亡,并能抑制PI3K-Akt通路和Caspase-3的激活[25]。黄芩素是来自黄精的活性成分,通过清除体内自由基,保护细胞膜系统的完整性,防止脂质氧化加剧,从而缓解疲劳[26],并能诱导肿瘤细胞凋亡和自噬,使细胞周期停滞,从而抑制肿瘤细胞的增殖和侵袭[27]。在这5个活性成分中,属于人参的活性成分有4个,从网络药理学角度推测人参-黄精药对在CRF的治疗中,人参起主要作用,黄精可增加人参的疗效。
PPI网络分析提示药物靶点与CRF靶点间具有复杂的相互作用关系。将调控网络中靶点以Degree值排序得到AKT1、JUN、TNF、TP53、CASP3、IL-1β等重要靶点,初步分析重要靶点主要对细胞凋亡、转移、炎症等的调节有关。AKT1是一种原癌基因,参与细胞生长、增殖和血管生成等生物过程,并可以作为靶向治疗PI3K-Akt通路的抑制剂[28];TP53和JUN是重要的抑癌基因,是癌症基因靶向治疗的新方向[29-30]。TP53可诱导细胞周期停滞和细胞凋亡,并且突变型TP53可作为预测患者预后的分子标记物[31]。沈炀等[32]研究发现在膀胱癌中的JUN表达显著低于正常组织,但膀胱癌患者的预后中,JUN低表达的却远优于高表达。CASP3 具有诱导细胞凋亡的作用,其诱导细胞凋亡的作用与体内CASP3的水平有关。Lin等[33]研究发现五味子甲素A可以降低慢性疲劳小鼠大脑中海马神经元裂解的CASP3的表达水平,通过抑制海马神经元的凋亡来改善小鼠疲劳。TNF-α、IL-1β作为一种炎性细胞因子,当受到应激反应后过度释放,会影响HPA轴并使其功能减退[34]。Yang等[35]研究发现慢性疲劳综合征与TNF-α的上升和IL-1β的下降密切相关。Himbert等[36]的研究发现在大肠癌患者中炎症的生物标志物(TNF-α、IL-6、IL-1β)与疲劳评分成正相关。Zhu等[37]发现参芪注射液可能通过抑制荷瘤小鼠外周免疫细胞产生的促炎细胞因子,从而改善CRF。这与研究报道提出的炎症在CRF的发生机制中起着重要作用的观点所吻合[38]。化疗会触发肿瘤或免疫细胞产生和分泌炎性细胞因子,从而诱导产生CRF[39]。化疗后疲劳感可持续10年以上,同时促炎细胞因子水平居高不下,影响中枢神经系统功能和其他行为症状[5,40]。外周组织中TNF-α水平升高是影响大多数癌症患者或接受癌症治疗患者疲劳严重程度的重要预测因素[41]。总结发现炎症因子是影响CRF的关键因素。
进一步分析GO生物信号通路发现,生物过程主要与RNA聚合酶Ⅱ启动子对转录的正调控、信号转导、凋亡过程等有关;分子功能可能涉及蛋白质结合、酶结合、特定DNA结合等;细胞(核、质、膜)、线粒体、内质网等细胞组分等在治疗过程中的变化值得关注。KEGG通路分析发现人参-黄芪治疗CRF中与癌症相关的通路有19条,主要包括癌症途径、TNF、MAPK、蛋白多糖、PI3k-Akt、HIF-1、NF-κB、P53等信号通路,其中癌症途径富集数值最高。TNF信号通路中的TNFR1主要参与细胞调节过程,TNF-α水平在氧化应激产生时显著升高,诱导参与氧化应激和炎症反应过程的IL-1β、IL-6细胞因子的产生[42]。MAPK通路被生长因子、不同类型的压力或炎性细胞因子提供的刺激激活,可导致细胞增殖、分化、发育、炎症或凋亡,也可以在肿瘤耐药中起到作用[43]。PI3K-Akt信号通路参与多种癌症的治疗,广泛存在于细胞中,可以调控细胞的生长、增殖、凋亡、代谢、肿瘤侵袭和转移[44]。人参皂苷Rb1可能通过激活PI3K-Akt通路,减轻炎症和氧化应激反应来改善患者的疲劳状态[45-46]。NF-κB是介导免疫炎症反应的核心物质,通过调节兴奋性和抑制性的神经递质,调节突触信息传递,调节突触可塑性和调节中枢神经系统功能基因参与中枢性疲劳的发生和发展[47],也可以通过circRNAs参与疲劳的发生和发展[48]。以上通路研究表明人参-黄精可通过药物-成分-靶点-通路网络,通过抑制细胞生长、促进凋亡以及炎症反应发挥治疗CRF的作用。
分析对接结果显示活性成分与核心靶点结合能均<-5.0 kcal/mol,结合位点存在稳定的氢键,其中最稳定的是原阿片碱与IL-1β(-8.5 kcal/mol),原阿片碱能和IL-1β的LYS-26、ARG-13残基形成氢键作用,说明人参-黄精的活性成分与核心靶点能够稳定结合,起到治疗CRF的作用。
综上所述,人参-黄精药对CRF的治疗中可能涉及不同靶点和通路,并在癌细胞的凋亡、转移以及炎症因子等发挥治疗作用,延缓CRF的进展,体现了中医药治疗的多成分、多靶点、多通路协同的特点。
利益冲突:所有作者均声明不存在利益冲突。
