基于转录组测序技术探究电针促进新西兰兔骨缺损愈合的作用机制
2022-09-29周立群王兴建田向东耿少辉蒋海旭赵吉平
李 霞,周立群,徐 林,王兴建,田向东,王 立,4,耿少辉,蒋海旭,许 恒,赵吉平
(1. 北京中医药大学东直门医院,北京 100700;2. 北京中医药大学武当医学研究院,北京 100029;3. 北京中医药大学第三附属医院,北京 100029;4. 安元全律(北京)医学研究院,北京 100055;5. 北京中医药大学生命科学学院,北京 102446)
骨折是指骨的连续性与完整性中断,无论是保守治疗还是手术治疗,促进骨折愈合均是骨折治疗的核心内容[1]。电针辅助治疗骨折的临床研究早在60年代就已开展[2],随后大量的临床研究证明电针能够促进骨折愈合,并从形态学、血液流变学、微量元素及骨折局部分子生物学的角度对电针促进骨折愈合的机制展开了探讨[3-5],但其具体的作用机制尚未完全揭示。现代研究显示,肾脏众多信号通路在骨折愈合过程中激活,表明肾脏与骨折的发生和愈合密切相关[6-7]。基于此,本实验基于转录组测序技术研究了电针治疗能否通过激活肾脏相关信号通路来促进骨折愈合,以期从新的角度揭示电针促进骨折愈合的分子机制。
1 实验材料与方法
1.1实验动物 雄性新西兰兔42只,清洁级,体重2.5~3 kg,购自北京隆安实验动物养殖中心,合格证号:110323210100040242。动物室内温度20~25 ℃,相对湿度40%~50%。实验兔由专一实验人员进行饲喂,每天定量饮食饮水。本实验通过北京中医药大学学术委员会实验动物伦理委员会审查(BUCM-4-2021022701-1092)。
1.2主要实验仪器及试剂 PVC兔子固定盒(河南智科弘润环保科技有限公司),韩氏穴位神经刺激仪(HANS-200A,南京济生科技有限公司),无菌针灸针(苏州医疗用品厂有限公司),咬骨钳(沧州市佳谊五金工具制造有限公司),外科手术剪(邦标医疗科技(广州)有限公司),手术镊(邦标医疗科技(广州)有限公司);注射用头孢西丁钠(齐鲁制药有限公司),安尔碘皮肤消毒液(上海利康消毒高科技有限公司),氯化钠注射液(石家庄四药有限公司),兔生长繁殖饲料(北京科奥协力饲料有限公司),多聚甲醛(北京索莱宝科技有限公司)。
1.3实验方法 将实验兔随机分为正常组6只、骨缺损组18只、电针组18只。骨缺损组和电针组建立骨缺损模型:按30 mg/kg 体重耳缘静脉注射3 %戊巴比妥钠溶液麻醉兔,手术区域脱毛后,将兔仰卧位固定在台上,碘伏消毒3遍,铺无菌洞巾,暴露出右前肢中段桡骨背侧,做2 cm纵向切口,依次切开皮肤、皮下,充分显露桡骨中段,于旋前圆肌止点下手术刀切开骨膜,剥离1 cm,用咬骨钳造成宽约3 mm深入髓腔骨质缺损区,注意避开重要血管和神经。生理盐水冲洗,逐层缝合皮下组织、皮肤,纱布包扎,胶带固定。术后肌肉注射头孢西丁钠(1 g头孢西丁钠加100 mL生理盐水)1次,4 mL/只。电针组于术后当天开始进行电针干预:参照《实验针灸学》[8]与《动物针灸学》[9]定位合谷穴(前肢背侧,第2掌骨桡侧中点处)、曲池穴(前肢背侧,肱骨外上髁内侧凹陷处),毫针向骨缺损部位斜刺进针0.5~1.0 cm,然后接韩氏穴位神经刺激仪,采用疏密波,设定频率2/100 Hz、电流2.1 mA,以局部皮肤肌肉微颤为度,留针30 min,1次/d,持续干预4周。
1.4观察指标及方法
1.4.1骨愈合情况 分别在实验1,2,4周末对骨缺损组与电针组兔前肢进行X射线平扫,由北京中医药大学第三附属医院的2位影像科医生双盲法阅片,并采用Lane-Sandhu X射线评分标准对骨形成、骨连接、骨塑形3个方面(11项)进行评分,取平均值。①骨形成:0分,无骨形成;1分,骨形成占缺损25%;2分,骨形成占缺损50%;3分,骨形成占缺损75%;4分,骨形成满缺损。②骨连接:0分,骨折线清楚;2分,骨折线部分存在;4分,骨折线消失。③骨塑形:0分,未见骨塑形;2分,骨髓腔形成;4分,皮质骨塑形。
1.4.2肾脏组织转录组测序(RNA-seq)及功能富集分析 于实验2周末,从3组中各随机选取3只兔,耳缘静脉注射3 %戊巴比妥钠溶液麻醉后,开腹取双侧肾脏,切小块放入冻存管,保存在-80 ℃冰箱,样本送至上海美吉生物医药科技有限公司进行基因测序。① RNA-seq方法:从组织样本中提取总RNA,用Nanodrop2000检测提取的RNA的浓度和纯度。琼脂糖凝胶电泳检测RNA的完整性,使用Agilent 2100测定RNA完整性数值(RIN)。单文库构建需要总RNA ≥ 1 μg,浓度≥ 35 ng/μL,OD260/280 ≥ 1.8,OD260/230 ≥ 1.0。根据制造商提供的方案,使用Ion total RNA-Seq Kit v2(Life Technologies,美国)制备每个RNA样品的测序文库。根据标准测序方案,使用Illumina NovaSeq 6000对cDNA文库进行测序。②差异基因表达分析:采用Fast-QC软件评估数据质量,包括碱基质量值的分布、GC含量、PCR重复的比例、K-mer的频率,使用Mapsplicing作为RNA-seq读取映射分析工具来识别外显子-外显子剪接,最后应用 DESeq2过滤差异表达的基因。统计分析后,按照差异倍数≥2或≤0.5和P<0.05的标准筛选差异表达基因(DEGs)。③功能富集分析:根据基因注释和功能数据库,用基因本体(Gene Ontology,GO)富集分析DEGs的生物学功能。使用基因百科全书KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库对DEGs进行通路分析,识别DEGs的显著通路。采用Fisher精确概率检验和2检验对GO术语进行分类,选择P<0.05的GO和通路类别进一步分析。

2 结 果
2.1X射线骨形成、骨连接、骨塑形评分比较 实验1,2,4周末,电针组骨形成评分、骨连接评分、骨塑形评分均较同期骨缺损组高,但仅2周末时骨塑形评分与骨缺损组比较差异有统计学意义(P<0.05)。见表1。

表1 骨缺损组和电针组兔X射线骨形成、骨连接、骨塑形评分比较分)
2.2肾脏中RNA-seq基因表达情况 与正常组相比,骨缺损组共鉴定出454个DEGs,其中上调基因255个,下调基因199个,见图1。与骨缺损组相比,电针组共鉴定出444个DEGs,其中上调基因179个,下调基因265个,见图2。正常组与骨缺损组间有98个DEGs显著差异表达,骨缺损组与电针组间这98个DEGs也显著差异表达,Venn图显示见图3。骨缺损组与电针组间的50个DEGs聚类热图见图4。电针组和正常组钙感应受体 (Calcium Sensing Receptor,CASR) 基因相对表达量均明显低于骨缺损组(P均<0.05),见图5。

绿点表示与正常组相比,骨缺损组上调的基因(255个);红点表示与正常组相比,骨缺损组下调的基因(199个)

绿点表示与骨缺损组相比,电针组下调的基因(265个);红点表示与M组相比,EL组上调的基因(179个)
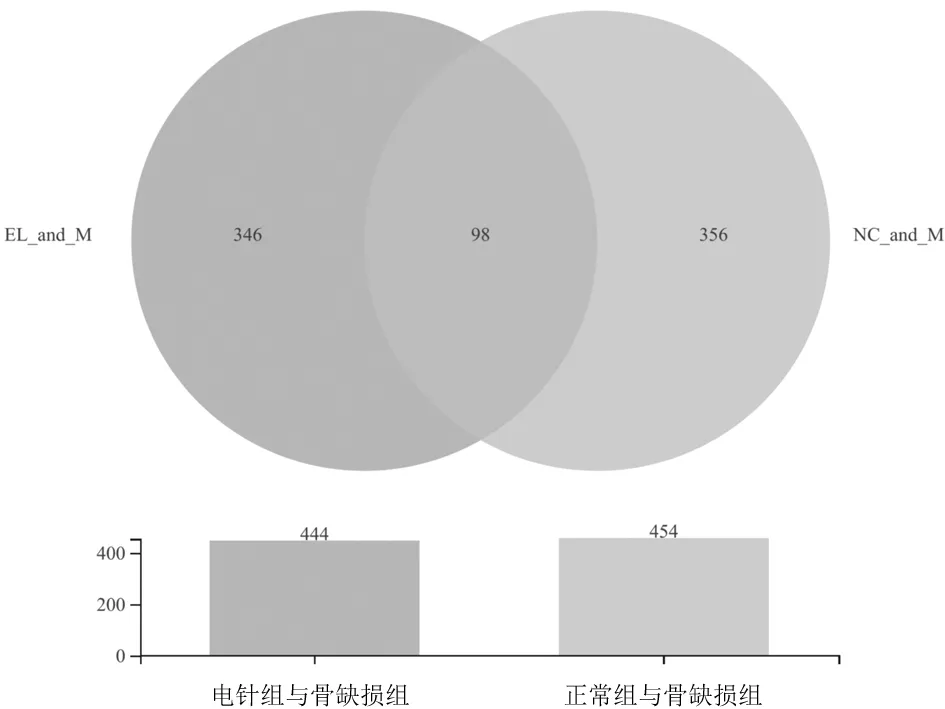
图3 不同组间兔肾脏中差异基因的Venn图

图4 骨缺损组与电针组间兔肾脏中50个差异表达基因的聚类热图
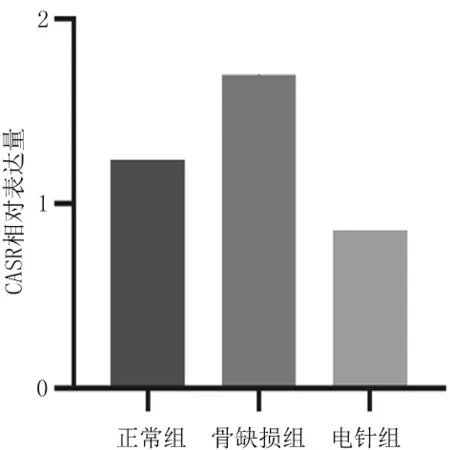
图5 不同组间兔肾脏中钙感应受体(CASR)基因相对表达量
2.3肾脏中DEGs的GO分析
2.3.1正常组和骨缺损组间肾脏中的DEGs 生物过程主要富集在代谢与刺激反应的过程,如蛋白水解的负调控(negative regulation of proteolysis)、极低密度脂蛋白颗粒重塑的调控(regulation of very-low-density lipoprotein particle remodeling)和对外部刺激的反应(response to external stimulus)等;细胞组分主要富集在细胞外空间(extracellular space)、细胞外基质(extracellular matrix)和酶原颗粒膜(zymogen granule membrane)等;分子功能(molecular function)主要富集在钙激活钾通道活性(calcium-activated potassium channel activity)、肝素结合(heparin binding)和钙激活的阳离子通道活性(calcium activated cation channel activity)等生物功能中。见图6。
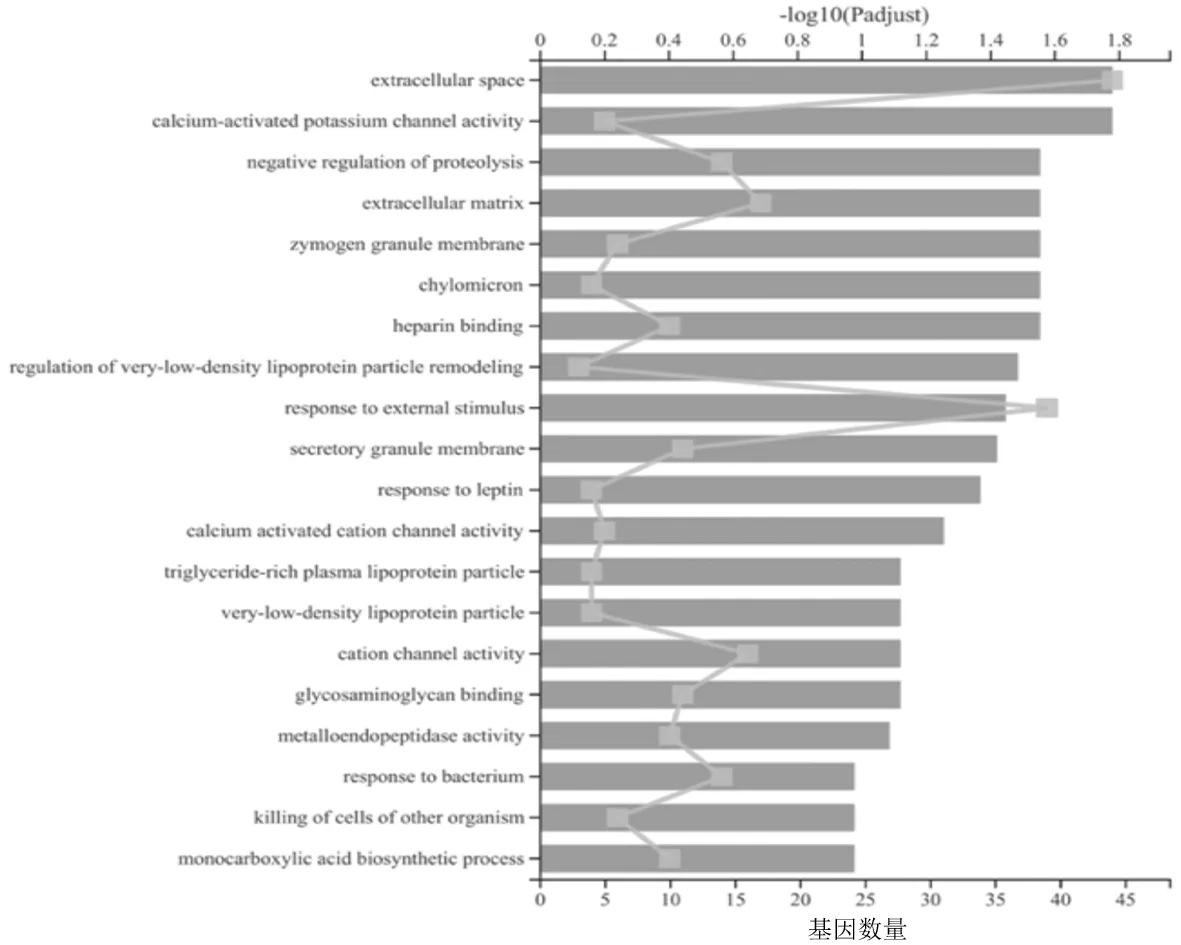
横条表示GO富集条目的显著性水平(上横坐标);方块表示GO富集条目中的基因数量
2.3.2电针组和骨缺损组间肾脏中的DEGs DEGs主要参与的生物过程和分子功能为磷酸盐代谢过程的调节(regulation of phosphate metabolic process)、磷代谢过程的调节(regulation of phosphorus metabolic process)、参与骨成熟的骨矿化调节(regulation of bone mineralization involved in bone maturation)、细胞钙离子稳态(cellular calcium ion homeostasis)、钙离子稳态(calcium ion homeostasis)、钙离子结合(calcium ion binding)、细胞溶质钙离子浓度的调节(regulation of cytosolic calcium ion concentration)。见图7。

横条表示GO富集条目的显著性水平(上横坐标);方块表示GO富集条目中的基因数量
2.4肾脏中DEGs的KEGG通路分析 正常组和骨缺损组间的DEGs富集在过氧化物酶体增殖物激活受体信号通路(PPAR signaling pathway)、甘氨酸(Glycine)、丝氨酸(serine)和苏氨酸代谢(threonine metabolism)、抗原加工和呈递(antigen processing and presentation)、补体和凝血级联(complement and coagulation cascades)、细胞色素P450对异生素的代谢(metabolism of xenobiotics by cytochrome P450)等通路中,见图8。电针组和骨缺损组间的DEGs富集在PPAR信号通路(PPAR signaling pathway)、胆固醇代谢(cholesterol metabolism)、p53信号通路(p53 signaling pathway)、补体和凝血级联(complement and coagulation cascades)、乳腺癌(breast cancer)、JAK-STAT信号通路(JAK-STAT signaling pathway)等,见图9。

气泡形状越大表示KEGG通路中富集的基因数量越多,气泡颜色越红表示通路富集程度越显著

气泡形状越大表示KEGG通路中富集的基因数量越多,气泡颜色越红表示通路富集程度越显著
3 讨 论
电针促进骨折愈合的疗法已得到临床证实,本研究根据临床经验,在新西兰兔桡骨中段建立骨缺损模型,选择合谷与曲池穴进行电刺激,基于转录组测序技术检测肾脏中相关基因表达情况,探讨电针促进新西兰兔骨缺损愈合的作用机制。选穴中合谷为阳明大肠经腧穴、原穴,可调气活血,振奋整体功能[8]。曲池为手阳明大肠经腧穴、合穴,按“合治内腑”之理,具有通调脏腑、调气和血消肿之功。曲池走而不守,合合谷生而能散,共奏调气活血、消肿镇痛之功。针刺时参考文献[9]设定特定频率和电流强度,以刺激增强穴位效应。结果显示,电针组2周末时骨塑形评分明显高于骨缺损组,证实电针可促进新西兰兔桡骨骨缺损的愈合。
中医学认为骨折的愈合过程与五脏生理功能密切相关,其中肾主骨生髓,髓充于骨,骨骼得养,肾气盛则髓骨坚硬凝而轻利[10]。中医学概念中的肾是一个以解剖肾为中心,与膀胱、骨、髓、脑、头发、耳、前后二阴等密切相关的功能系统,本实验中选取了解剖上的肾脏研究肾主骨的功能。
肾脏是一个钙敏感器官,能够感知尿和血清钙水平的变化。CASR是一种G蛋白偶联受体,可调节甲状旁腺激素释放和尿钙排泄,在钙离子稳态和细胞钙离子稳态通路中发挥调控钙离子稳态的作用,是肾脏中调控和维持钙稳态的重要基因[11-12]。CASR在肾细胞的表面高度表达[13],其通过感受血清钙的变化而调节钙的重吸收,在肾脏钙处理中起着重要作用[14]。CASR不仅可通过肾脏髓襻升支粗段介导的细胞外钙转运调控直接参与细胞外钙水平的调控,还可以通过紧密连接蛋白的密蛋白家族(CLDN)的几个成员(CLDN14、CLDN16和CLDN19)直接调节Ca2+和Mg2+渗透性[15-17]。相关实验研究证明,小鼠肾小管中CASR特异性表达的缺失会导致尿中钙含量减少,且CASR的主要作用是以非甲状旁腺素的方式抑制钙的重吸收,其部分通过CLDN14的下调和SLC12A1的激活来发挥对钙重吸收的抑制作用[18]。
本研究肾脏组织转录组测序结果显示,正常组与骨缺损组共有454个DEGs,骨缺损组与电针组共有444个DEGs,骨缺损组与电针组间有98个DEGs显著差异表达;电针组和正常组CASR基因相对表达量均明显低于骨缺损组;GO富集分析发现电针组和骨缺损组间的DEGs主要参与的生物过程和分子功能为细胞钙离子稳态、钙离子稳态、钙离子结合和细胞溶质钙离子浓度的调节。提示电针促进骨折愈合的机制可能与调控肾脏CASR基因的表达和钙离子稳态通路密切相关。
综上所述,电针可能通过下调肾脏中CASR基因的表达,调控钙离子稳态通路,促进肾脏中钙离子的重吸收,进而促进骨折的愈合。
利益冲突:所有作者均声明不存在利益冲突。
