人类胎盘enEVTs通过NCAM1募集白细胞并抑制Th1细胞分化*
2022-10-13马烨灵张巧英郑长武冉娜方丹娜
马烨灵, 张巧英, 郑长武, 冉娜, 方丹娜
人类胎盘enEVTs通过NCAM1募集白细胞并抑制Th1细胞分化*
马烨灵△, 张巧英, 郑长武, 冉娜, 方丹娜
(绍兴文理学院医学院,浙江 绍兴 312000)
探讨血管内绒毛外滋养层细胞(endovascular extravillous trophoblasts, enEVTs)调控妊娠免疫耐受的机制。通过磁珠分选技术获得人工流产早孕蜕膜中的原代enEVTs和间质绒毛外滋养层细胞(interstitial extravillous trophoblasts, iEVTs),再将enEVTs和iEVTs培养上清分别处理Naïve CD4+T细胞,并将enEVTs培养上清处理组定义为实验组,iEVTs培养上清处理组定义为对照组。通过流式细胞术比较实验组和对照组诱导CD4+IFNγ+1型辅助性T细胞(type 1 T helper cells, Th1细胞)分化比例;通过免疫荧光实验比较enEVTs和iEVTs中神经细胞黏附分子1(neural cell adhesion molecule 1, NCAM1)的表达情况;通过enEVTs和iEVTs分别与白细胞共培养,比较enEVTs对白细胞的黏附作用;进一步对37例人类胎盘进行绒毛间隙的苏木精-伊红(hematoxylin-eosin, HE)染色,进行白细胞募集的统计和检测。流式细胞术结果显示,在细胞体外共培养实验中enEVTs相比于iEVTs显著抑制CD4+IFNγ+Th1细胞的分化(<0.05);免疫荧光结果表明,enEVTs相比于iEVTs特异高表达NCAM1;原代细胞共培养结果证明,enEVTs可黏附母血中的白细胞;HE染色结果显示,enEVTs可富集母血白细胞。(1)enEVTs特异表达NCAM1并募集母血的白细胞于enEVTs周围;(2)enEVTs抑制Th1细胞的分化,进而促进妊娠过程中的免疫耐受。
血管内绒毛外滋养层细胞;神经细胞黏附分子1;Th1细胞;白细胞
在人类妊娠过程中,由于胎儿对营养物质的需求增加,子宫螺旋动脉发生改建,使螺旋动脉管径扩大,以确保母体对胎儿氧气和养料的供给,进而维持正常妊娠[1-3]。在螺旋动脉改建过程中,胎儿来源的胎盘血管内绒毛外滋养层细胞(endovascular extravillous trophoblasts, enEVTs)取代母体螺旋动脉血管内皮细胞,并与母血白细胞直接接触[4]。本研究团队前期细胞体外实验结果显示,enEVTs可能参与母胎界面妊娠免疫耐受的调控[5]。
正常妊娠依赖于母体和胎儿免疫耐受的维持[6]。正常妊娠过程中,由螺旋动脉和绒毛间隙组成的胎盘-母体血流路径也同样经历免疫耐受调控[5]。母体-胎盘血流路径中,母血从子宫动脉流入改建完全的螺旋动脉,再流经胎盘绒毛间隙进行母胎之间充分的物质交换,以确保母体对胎儿氧气养料的供给以维持正常妊娠[1-2]。该路径中,胎儿来源的enEVTs与母血中的白细胞直接接触,且未受到免疫排斥[5]。因此,本研究的目的是通过细胞体外培养实验研究enEVTs调控妊娠免疫耐受的机制。
在妊娠过程中,母胎-胎盘血流路径中的白细胞包含T细胞。CD4+T细胞多为辅助性T细胞(T helper cells, Th细胞),其中Th1细胞主要指CD4+IFNγ+的细胞,可以分泌IL-2和IFN-γ等因子并加剧免疫反应[7]。在正常妊娠过程中,Th1细胞呈现低比例的状态以维持妊娠免疫耐受,若比例出现异常上升,可能导致妊娠疾病[8-10]。在母体-胎盘血流路径中,与enEVTs直接接触的母血快速流过,受血流速度影响,enEVTs与母血白细胞之间缺少相互作用的机会,基于此我们提出假设:enEVTs在细胞体外培养实验中可以表达黏附分子并黏附白细胞,以实现对Th1细胞分化的调控。
enEVTs研究存在瓶颈:细胞数量极少,且在人和小鼠、大鼠等动物中差异巨大,无法利用动物模型对enEVTs进行深入研究。根据细胞特性,enEVTs取代螺旋动脉的血管内皮细胞,在生理环境中位于螺旋动脉壁中[5],间质绒毛外滋养层细胞(interstitial extravillous trophoblasts, iEVTs)位于蜕膜内,iEVTs和enEVTs都表达免疫耐受分子HLA-G[11]。神经细胞黏附分子1(neural cell adhesion molecule 1, NCAM1)是一种膜糖蛋白,并通过细胞之间的识别和黏附参与多种生理过程,且在恒河猴中检测enEVTs可能特异表达NCAM1[12]。妊娠期免疫失衡将导致妊娠疾病[5]。基于此,我们进一步细化假设:enEVTs在细胞体外培养实验中可以表达NCAM1并黏附白细胞,以实现对Th1细胞分化的调控,维持妊娠过程中的免疫耐受。
材料和方法
1 材料
实验标本涉及的人早孕蜕膜组织取自2019年3月~2020年6月的10例人工流产的妇女;人胎盘组织取自2019年3月~2021年3月分娩的7例28周剖宫产孕妇、8例32周剖宫产孕妇、9例36周剖宫产孕妇、13例40周剖宫产孕妇,以上孕妇排除肾病、心血管疾病、妊娠期高血压、妊娠期糖尿病、宫内死胎、自然流产、胎儿染色体或先天异常及辅助生殖下怀孕等情况。这些胎盘组织来源于在未足月的情况下进行剖宫产手术的孕妇,多为社会因素要求放弃,如家庭因素,或有多次既往剖宫产史而担心子宫破裂风险等,继而在孕期提早剖宫产。母体外周血取自2019年3月~2020年6月10例非孕女性外周血。标本与本人及家属签署知情同意且通过单位伦理审核。蜕膜组织、胎盘组织和血样放置冰盒内,并于1 h内进行后续实验。
2 主要试剂
用于免疫荧光染色的NCAM1和HLA-G抗体购于Abcam;用于流式细胞术的NCAM1、HLA-G、CD4和IFNγ抗体购于eBioscience和BioLegend;PBS和牛血清白蛋白购于Solarbio;用于免疫荧光的Ⅱ抗购于ZSGB-BIO;用于苏木精-伊红(hematoxylin-eosin, HE)染色的苏木精和伊红染料购自Baso;用于组织固定和包埋的多聚甲醛(paraformaldehyde, PFA)购自Sigma;冰冻切片包埋剂(optimal cutting temperature compound, OCT)购自Sakura Finetek;用于细胞培养的培养液和胎牛血清购自Invitrogen。
3 主要方法
3.1原代细胞的分离enEVTs、iEVTs、Naïve CD4+T细胞和白细胞按照本研究工作人员前期发表的工作中详述的方法,在人工流产的早孕蜕膜中进行分离[5]。简言之,enEVTs和iEVTs通过磁珠分选和差异贴壁的方法分离;白细胞通过裂解红细胞的方法分离;Naïve CD4+T细胞通过磁珠分选的方法分离。
3.2原代细胞的培养与处理获取来自10例人工流产的早孕蜕膜的enEVTs和iEVTs,用含10%胎牛血清的RPMI-1640培养液培养。由于enEVTs和iEVTs数量极少,从每例人工流产早孕蜕膜中分离的细胞不足以获取足够的细胞培养上清,故将来自10例患者的原代细胞先进行24 h培养,再各自混合成enEVTs培养上清混合液和iEVTs培养上清混合液。50% enEVTs培养上清是指enEVTs培养上清与含10%胎牛血清的RPMI-1640培养液按照1∶1比例混合,50% iEVTs培养上清是指iEVTs培养上清与含10%胎牛血清的RPMI-1640培养液按照1∶1比例混合。50% enEVTs培养上清处理Naïve CD4+T细胞为实验组,50% iEVTs培养上清处理Naïve CD4+T细胞为对照组,实验共重复3次。为进一步证明enEVTs对白细胞发挥黏附作用,我们将iEVTs、enEVTs原代细胞分别与白细胞按照2∶1的比例进行共培养,24 h后对共培养体系进行清洗,去除悬浮细胞,并在清洗前和清洗后进行拍照记录。
3.3组织直冻、包埋、冰冻切片制备和HE染色胎盘取回后用剪刀分别在子面和母面剪取1 cm3体积的组织,并按照是否包含enEVTs分为两个切面:不包含enEVTs的胎盘子面(靠近胎儿面)和包含enEVTs的胎盘母面(靠近母体面)。放在预冷的包埋盒中,用OCT包埋剂浸没组织后迅速放置在液氮上凝固,将组织块放于-80 ℃冰箱待用。白细胞在母血中呈现为有细胞核的细胞[13-14],故能通过苏木精染色与无核的红细胞等进行区分,将预冷的冰冻组织放入调节好温度的冰冻切片机内,调节切片机的切片厚度设定为10 μm进行切片,将切片黏附在载玻片上,切片结束后放置于-80 ℃冰箱保存待后续行HE染色实验。冰冻切片从-80 ℃冰箱取出后于55 ℃热台中将水汽烘干,在4% PFA试剂中室温固定10 min。用自来水将PFA洗净后,用苏木精染核3 min,并用梯度乙醇脱水。事先准备好新的95%乙醇,将组织切片取出,滴加伊红醇溶液5~10 s后于100%乙醇中继续脱水,用50%甘油封片。
3.4免疫荧光染色组织块在取材固定后需要经过10%蔗糖、20%蔗糖、50%蔗糖+50% OCT梯度后,再用OCT包埋剂包埋,在低温下等包埋剂凝固,将组织块放于-80 ℃冰箱待用。调节切片机的切片厚度设定为10 μm,进行切片。将冰冻切片放在热台上10 min烘干,再放置于4%多聚甲醛中固定10 min。用PBS配制的0.1% Triton X-100室温处理15 min。并在冰冻切片上滴加3%牛血清白蛋白溶液,室温封闭1 h。用2%牛血清白蛋白溶液配制Ⅰ抗(NCAM1和HLA-G),4 ℃孵育过夜。按照Ⅰ抗属性和荧光颜色的需求滴加荧光Ⅱ抗,室温孵育1 h。DAPI细胞核染料复染,并封片,用指甲油涂抹盖玻片边缘,晾干后共聚焦显微镜拍照。
3.5Th1细胞分化的流式分析将需要检测的细胞计数后按照300×离心,并获得细胞沉淀。按照每1×106个细胞加入100 μL PBS重悬的比例重悬细胞沉淀。按照抗体说明书比例加入CD4和IFNγ的流式抗体,4 ℃冰箱避光孵育30 min。用适量的PBS缓冲液清洗细胞,将抗体洗净,并在4 ℃离心机下按照不同细胞的转速要求离心,并得到细胞沉淀。用200~500 μL缓冲液重悬细胞沉淀,在上机前通过细胞筛,将细胞转移到流式管。用流式细胞仪进行CD4+IFNγ+细胞的比例分析。
3.6被黏附的白细胞的流式细胞术分析将0.25%胰酶稀释35倍,在共培养体系中对黏附的白细胞在镜下室温轻柔消化约2 min,将黏附的白细胞从共培养体系中消化下来,将细胞计数后按照300×离心,并获得细胞沉淀。按照每1×106个细胞加入100 μL PBS重悬的比例重悬细胞沉淀。按照抗体说明书比例加入CD45的流式抗体,4 ℃冰箱避光孵育30 min。用适量的PBS缓冲液清洗细胞,将抗体洗净,并在4 ℃离心机下按照不同细胞的转速要求离心,并得到细胞沉淀。用200~500 μL缓冲液重悬细胞沉淀,在上机前通过细胞筛,将细胞转移到流式管。用流式细胞仪进行CD45+细胞的比例分析。
3.7胎盘绒毛间隙中母血白细胞数量分析胎盘绒毛结构疏松且易破坏,在胎盘娩出体外后,无法直接获得绒毛间隙中的母血,故通过冰冻切片结合HE染色的方法对胎盘绒毛间隙中的母血白细胞进行分析。其中靠近母体面的胎盘组织包含enEVTs,即为母组织,靠近胎儿面的胎盘组织不包含enEVTs,为子面组织。将胎盘分为母面和子面后,分别进行HE染色,并对HE染色结果进行统计和分析。白细胞数量通过使用ImageJ软件根据细胞核的分布进行计数。血窦总面积用Photoshop软件划定血窦区域后通过Image-Pro Plus软件进行像素点数量的计算。再按照比例尺进行像素和面积的换算,计算出单位像素点的面积为0.000 025 mm2,将该系数乘以血窦总像素点数量即可计算出血窦总面积。单位面积白细胞的数量即为白细胞数量/血窦总面积的比值。
4 统计学处理
本研究中使用到数量统计的实验结果均重复3次及以上。作图软件为GraphPad Prism,计量结果用均数±标准差(mean±SD)表示。组间统计学比较采用独立检验或至少三次独立重复实验的单因素方差分析检验进行多重比较分析。以<0.05为差异有统计学意义。
结果
1 enEVTs、iEVTs和Naïve CD4+ T原代细胞分离纯度的鉴定
对人工流产早孕蜕膜中分离的enEVTs、iEVTs和Naïve CD4+T细胞进行纯度分析,流式细胞术结果表明,HLA-G+Jagged1+enEVTs的纯度高达90%(图1A),HLA-G+Jagged1-iEVTs的纯度高达90%(图1B),CD4+CD45RA+Naïve CD4+T细胞的纯度高达95%(图1C)。因此,分离获得的enEVTs、iEVTs和Naïve CD4+T原代细胞纯度高,可用于后续研究。
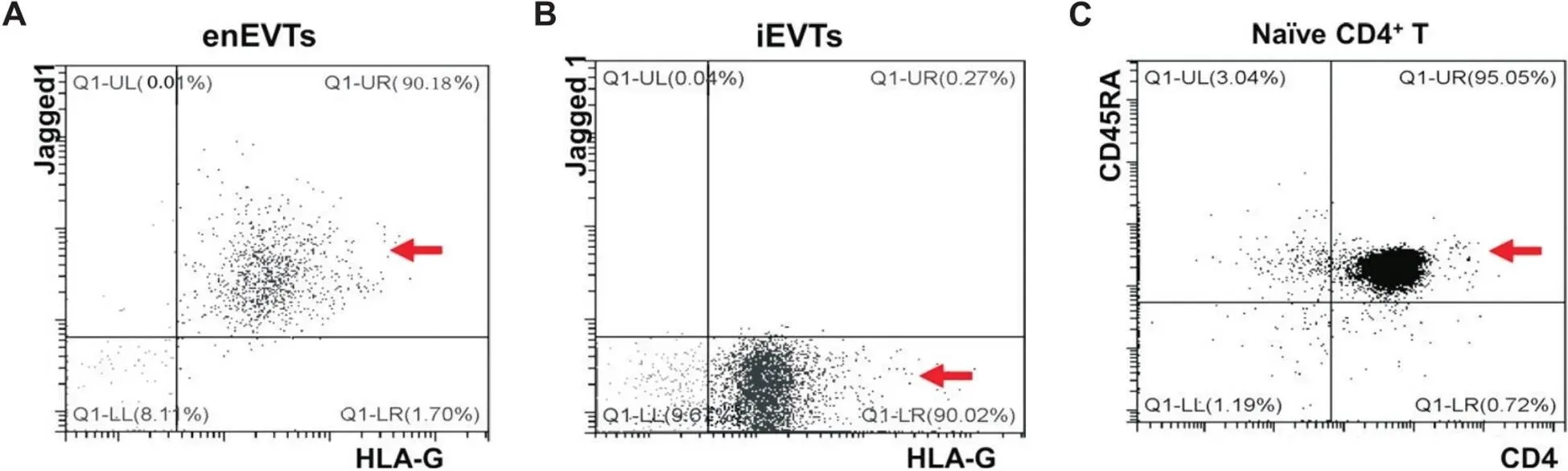
Figure 1. Flow cytometry analysis of the primary cells. A: flow cytometry analysis of HLA-G+ Jagged1+ enEVTs; B: flow cytometry analysis of HLA-G+ Jagged1- iEVTs; C: flow cytometry analysis of CD4+ CD45RA+ naïve CD4+ T cells.
2 enEVTs抑制CD4+ IFNγ+ Th1细胞分化
对Th1细胞的分化程度进行分析,流式细胞术结果表明,iEVTs促进CD4+IFNγ+Th1细胞分化的比例高达12%左右,而enEVTs促进CD4+IFNγ+Th1细胞分化的比例仅约为3%左右(图2A~C),分化Th1细胞的3次实验结果的数据分析(表1)表明enEVTs相比于iEVTs显著抑制CD4+IFNγ+Th1细胞的分化(<0.05),实验结果的柱状统计图如图2D所示。
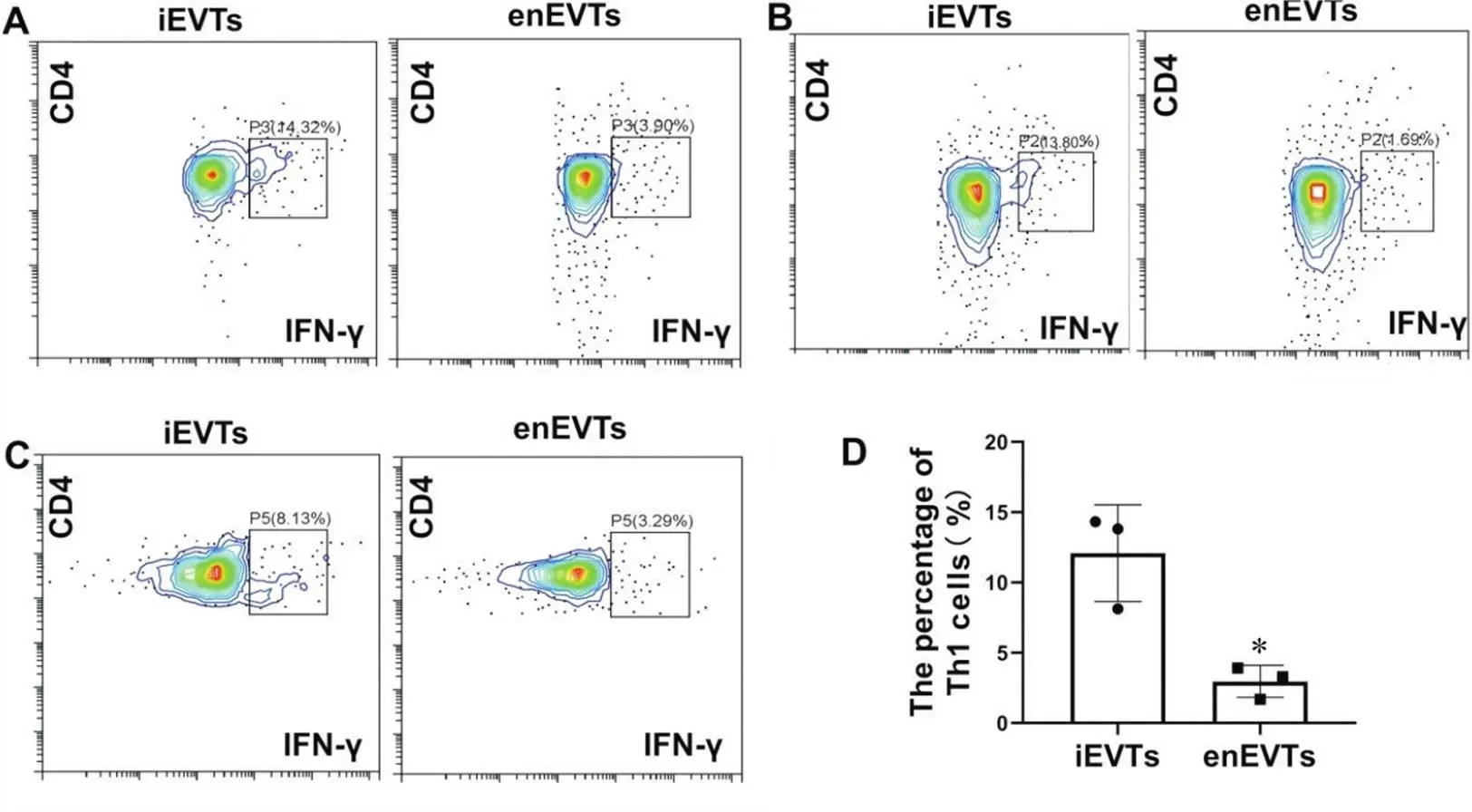
Figure 2. Flow cytometry analysis of iEVTs- and enEVTs-induced CD4+ IFNγ+ Th1 cells. A: the flow cytometry analysis of the first experiment; B: the flow cytometry analysis of the second experiment; C: the flow cytometry analysis of the third experiment; D: the statistical results of the three experiments. Mean±SD. n=3. *P<0.05 vs iEVTs.
3 enEVTs表达NCAM1蛋白并黏附白细胞
对黏附分子NCAM1的表达情况进行检测,免疫荧光染色结果表明,在人早孕蜕膜中,enEVTs为HLA-G+且位于螺旋动脉壁中的细胞,且可以表达NCAM1蛋白(红色箭头所示);而iEVTs细胞为HLA-G+且位于蜕膜基质中的细胞,且不表达NCAM1(黄色箭头所示),见图3。对enEVTs黏附白细胞的情况进行检测,细胞共培养实验结果表明,enEVTs相比于iEVTs可大量黏附细胞,且经过流式分析鉴定确定黏附的细胞为CD45+的白细胞,见图4。
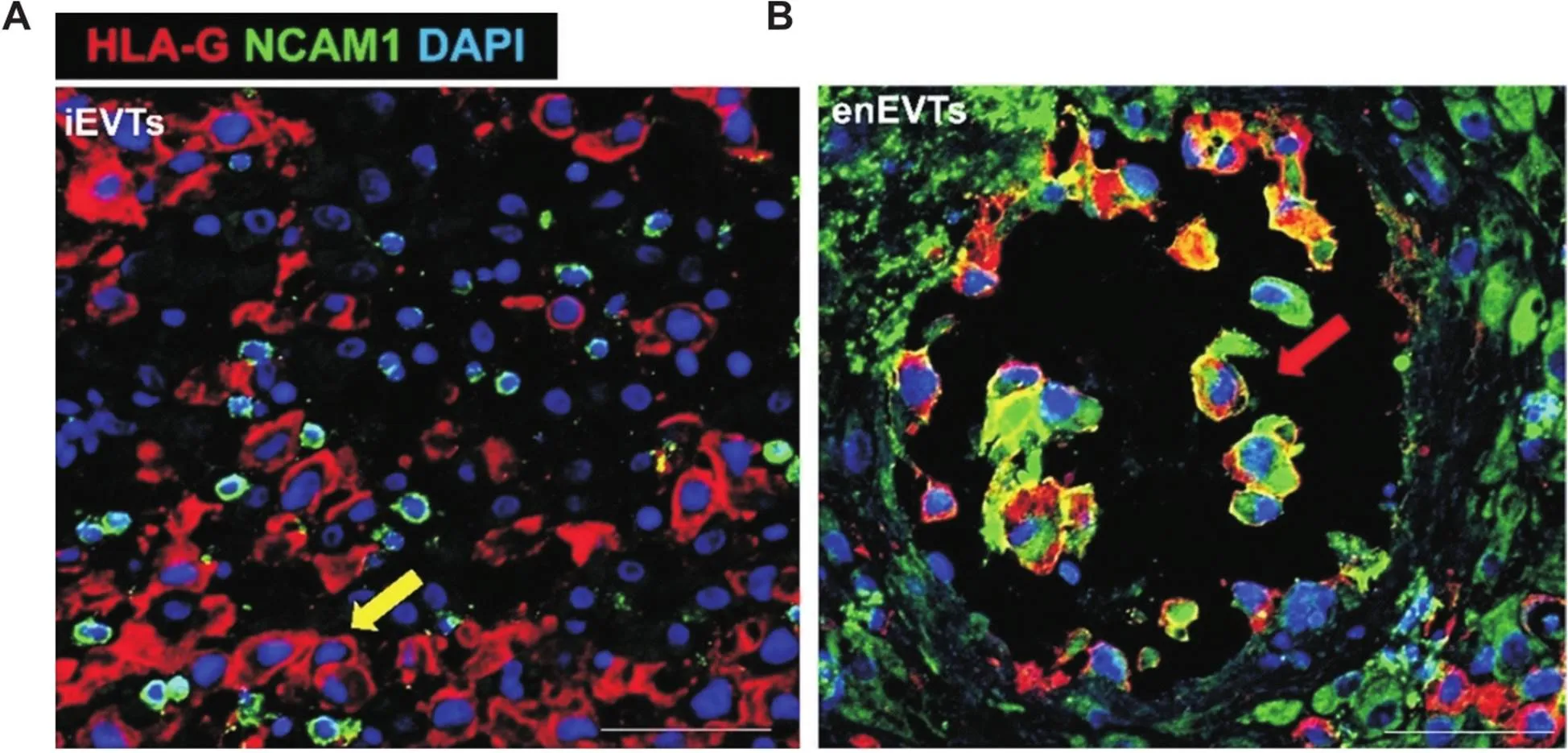
Figure 3. Immunofluorescence staining of HLA-G (red) and NCAM1 (green) in human early pregnant decidua (scale bar=100 μm). A: immunofluorescence staining of HLA-G (red signal) and NCAM1 (green signal) in iEVTs (yellow arrow indicates iEVTs only expressing HLA-G (red signal) without expression of NCAM1 (green signal); B: immunofluorescence staining of HLA-G (red signal) and NCAM1 (green signal) in enEVTs (red arrow indicates enEVTs with both expression of HLA-G and NCAM1.
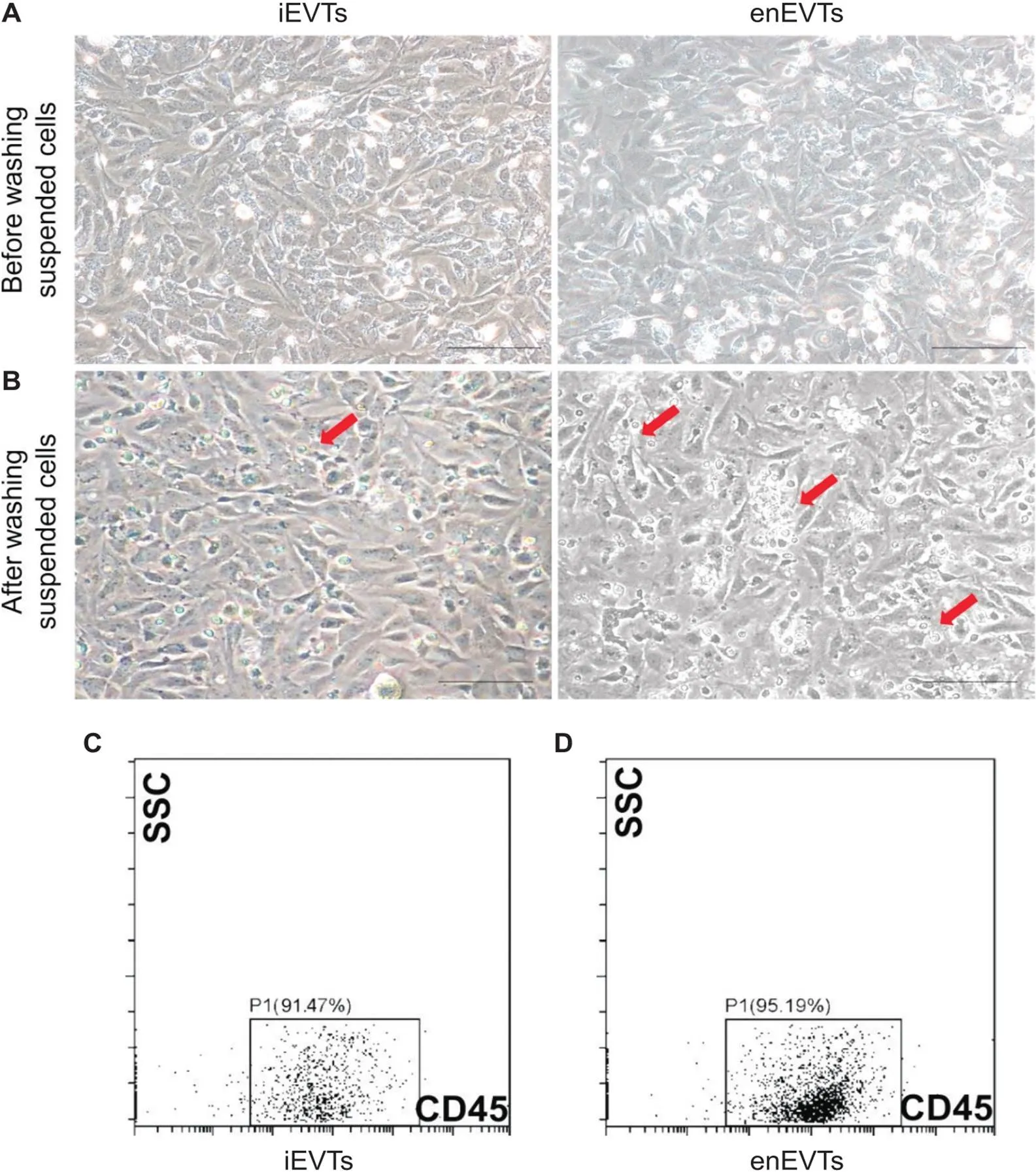
Figure 4. The co-culture experiment of iEVTs or enEVTs with leukocytes. A: the microscopic images of iEVTs or enEVTs before washing the suspended cells (red arrows indicate the adherent leukocytes; scale bar=100 μm); B: the microscopic images of iEVTs or enEVTs after washing the suspended cells (red arrows indicate the adherent leukocytes; scale bar=100 μm); C and D: the CD45 flow cytometry result of the adherent cells with iEVTs and enEVTs, respectively.
4 白细胞选择性地在enEVTs周围募集
28周、32周、36周和40周胎盘绒毛间隙的HE染色结果如图5所示。从HE染色结果中分析各孕龄胎盘绒毛间隙中单位面积白细胞的数量,统计结果表明,绒毛间隙中白细胞的数量伴随孕龄增加呈现上升趋势,甚至呈现显著差异(<0.05);而在同孕龄的胎盘绒毛间隙中,母面白细胞数量(含enEVTs)显著高于子面(无enEVTs),差异有统计学意义(<0.05),见图6。28周胎盘绒毛间隙白细胞的具体数值见表2;32周胎盘绒毛间隙白细胞的具体数值见表3;36周胎盘绒毛间隙白细胞的具体数值见表4;40周胎盘绒毛间隙白细胞的具体数值见表5。以上结果证明,白细胞选择性地在enEVTs周围募集。
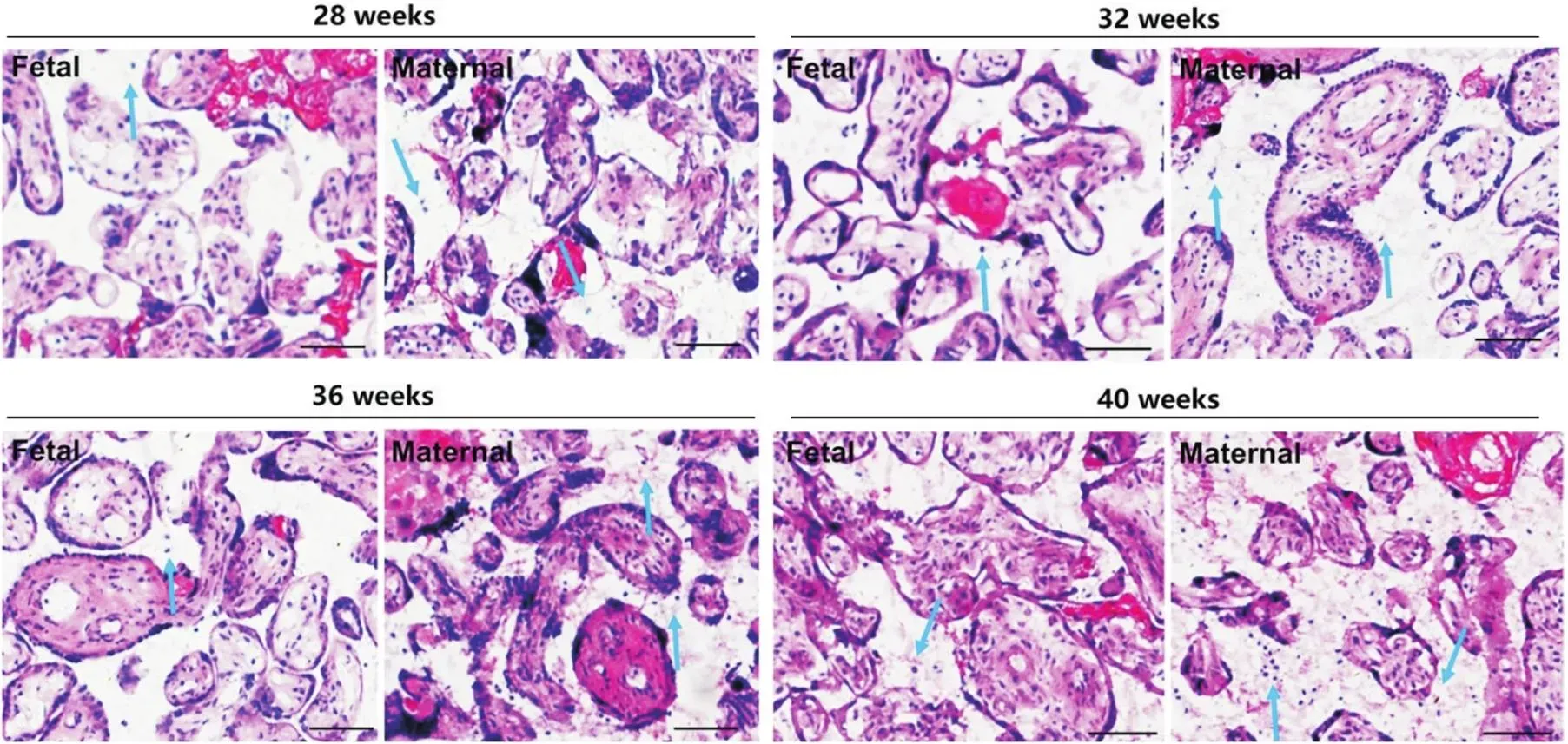
Figure 5. The typical results of leukocytes in placental intervillous space by HE staining. The leukocytes in placental intervillous space at 28, 32, 36 and 40 weeks were shown. Blue arrows indicate the leukocytes. Scale bar=100 μm.
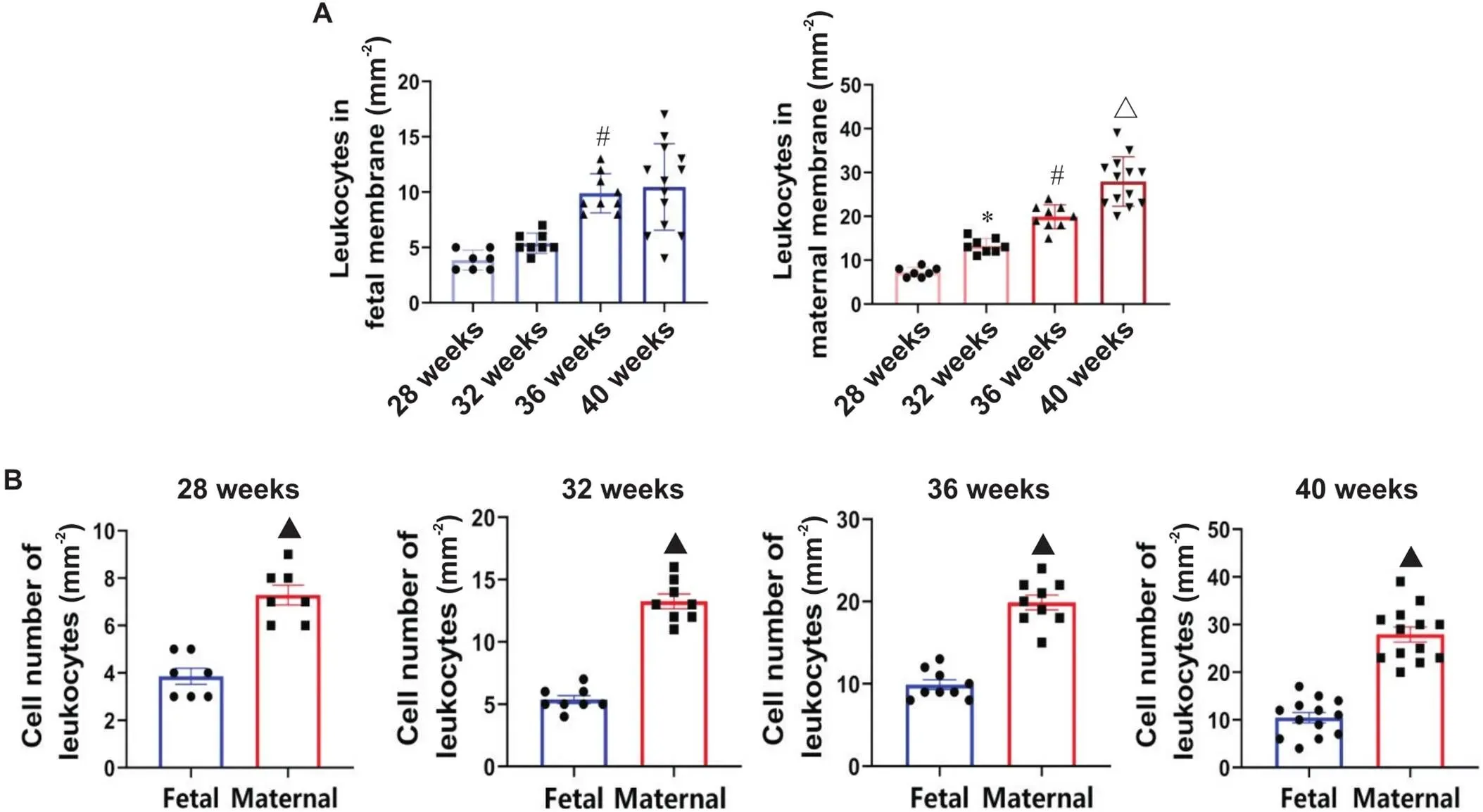
Figure 6. Statistical results of leukocytes in intervillous space of human placenta. A: the statistical results of leukocytes in intervillous space of basal and chorionic plates in human placenta; B: the statistical results of leukocytes in intervillous space during 28 to 40 weeks of human placenta. The statistical results are performed based on the results from at least seven independently repeated experiments. Mean±SD. 28 weeks: n=7; 32 weeks: n=8; 36 weeks: n=9; 40 weeks: n=13. *P<0.05 vs 28 weeks; #P<0.05 vs 32 weeks; △P<0.05 vs 36 weeks; ▲P<0.05 vs fetal.
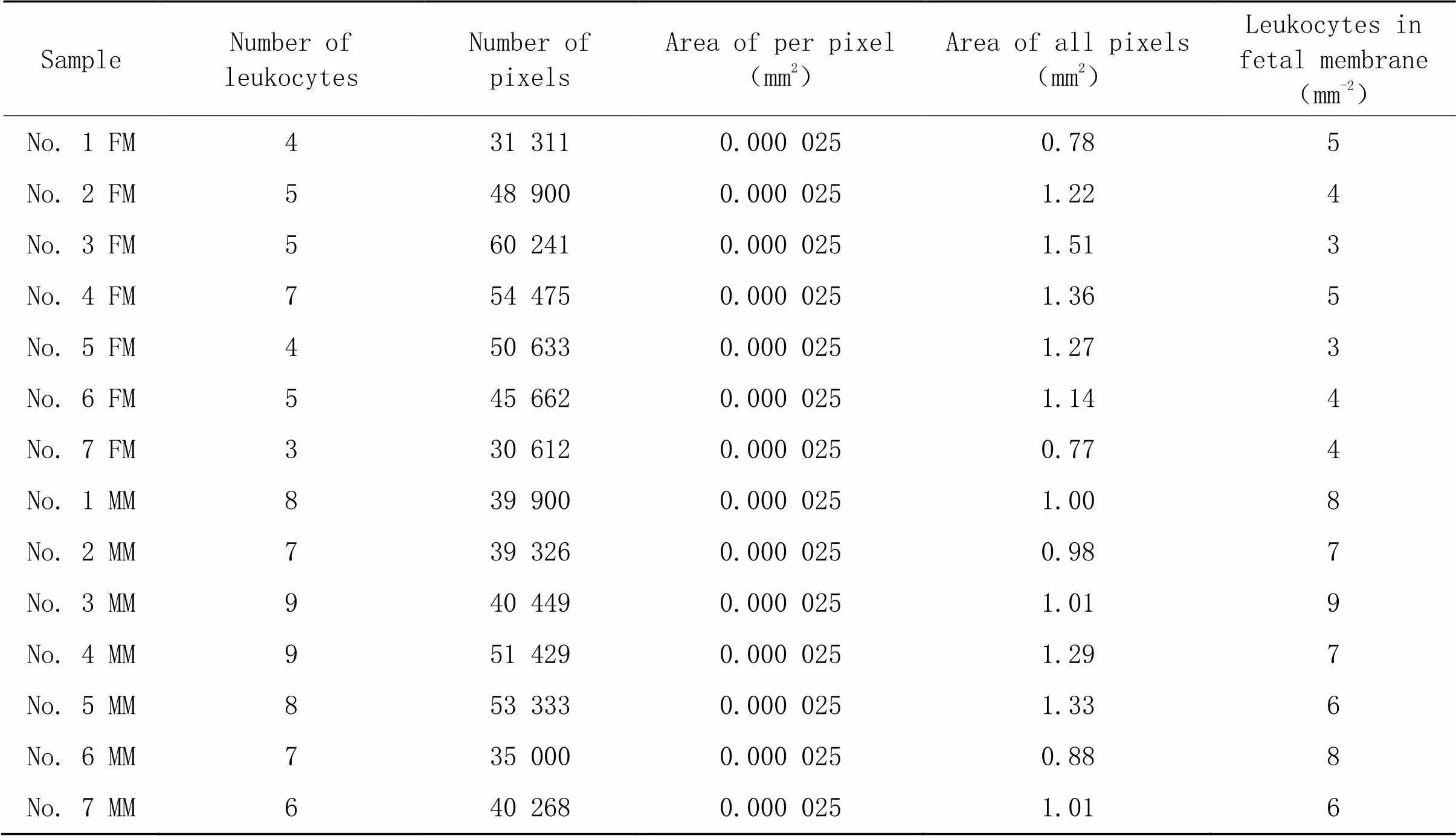
表2 28周胎盘绒毛间隙的白细胞
FM: fetal membrane; MM: maternal membrane.
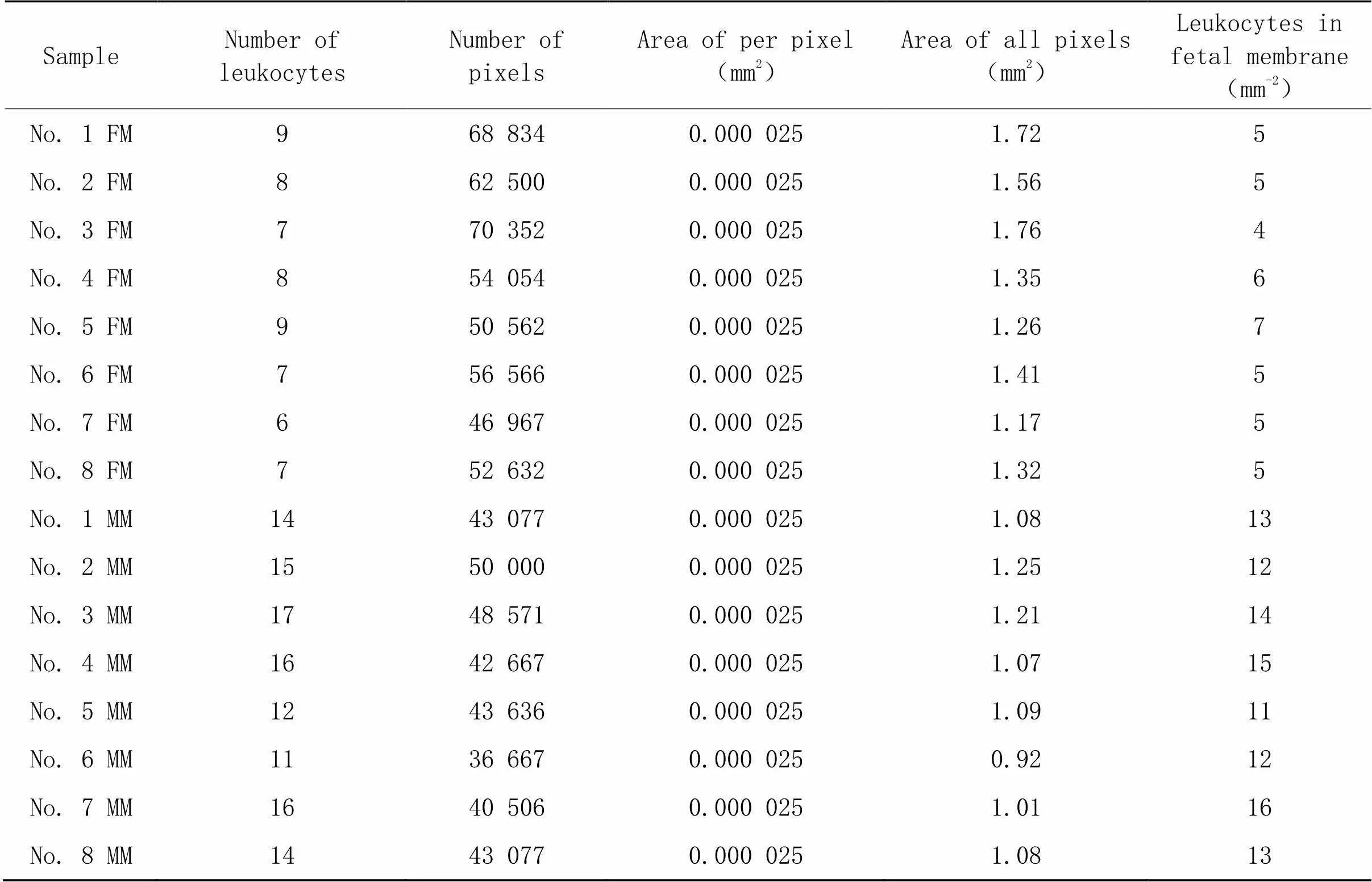
表3 32周胎盘绒毛间隙的白细胞
FM: fetal membrane; MM: maternal membrane.
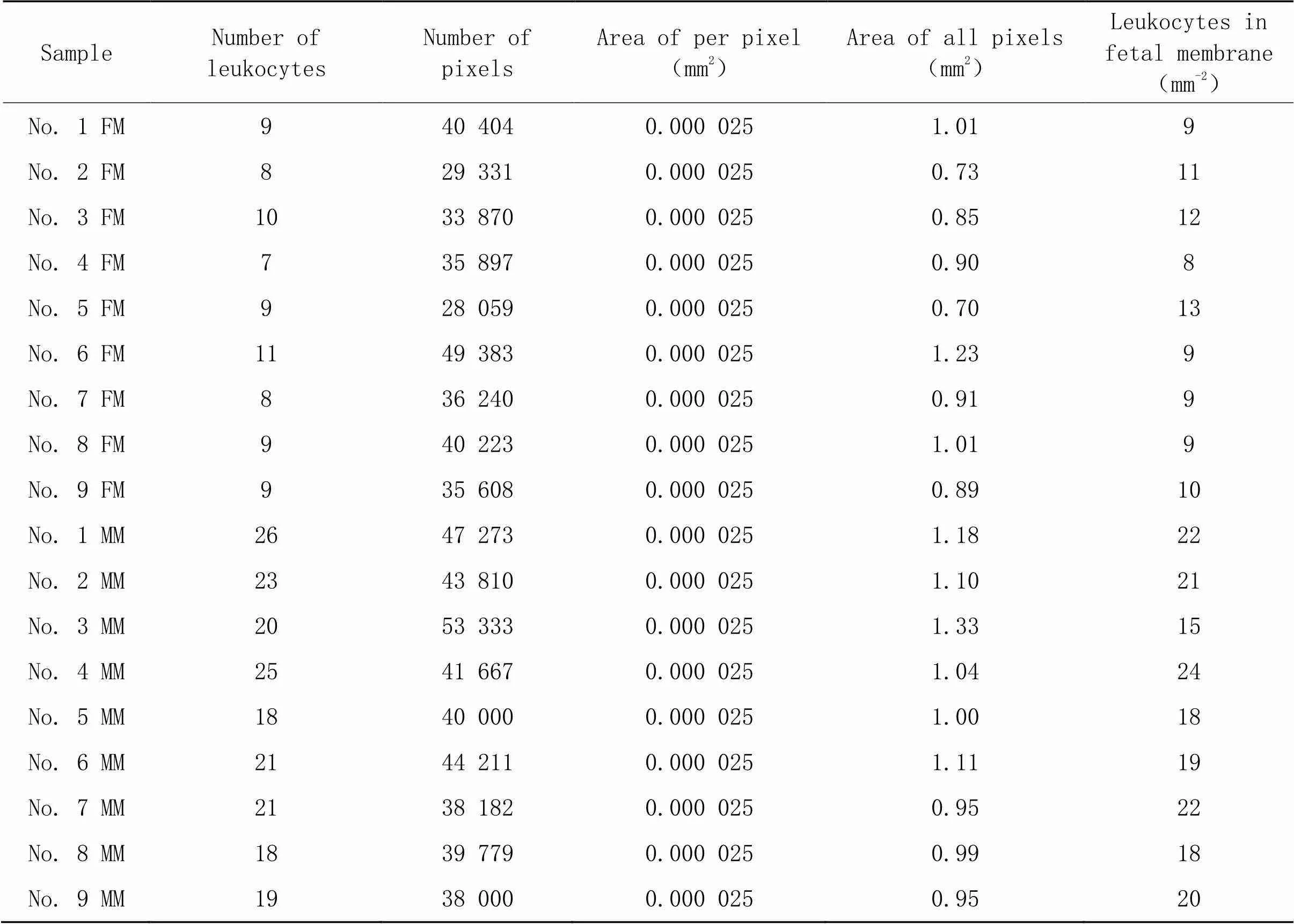
表4 36周胎盘绒毛间隙的白细胞
FM: fetal membrane; MM: maternal membrane.
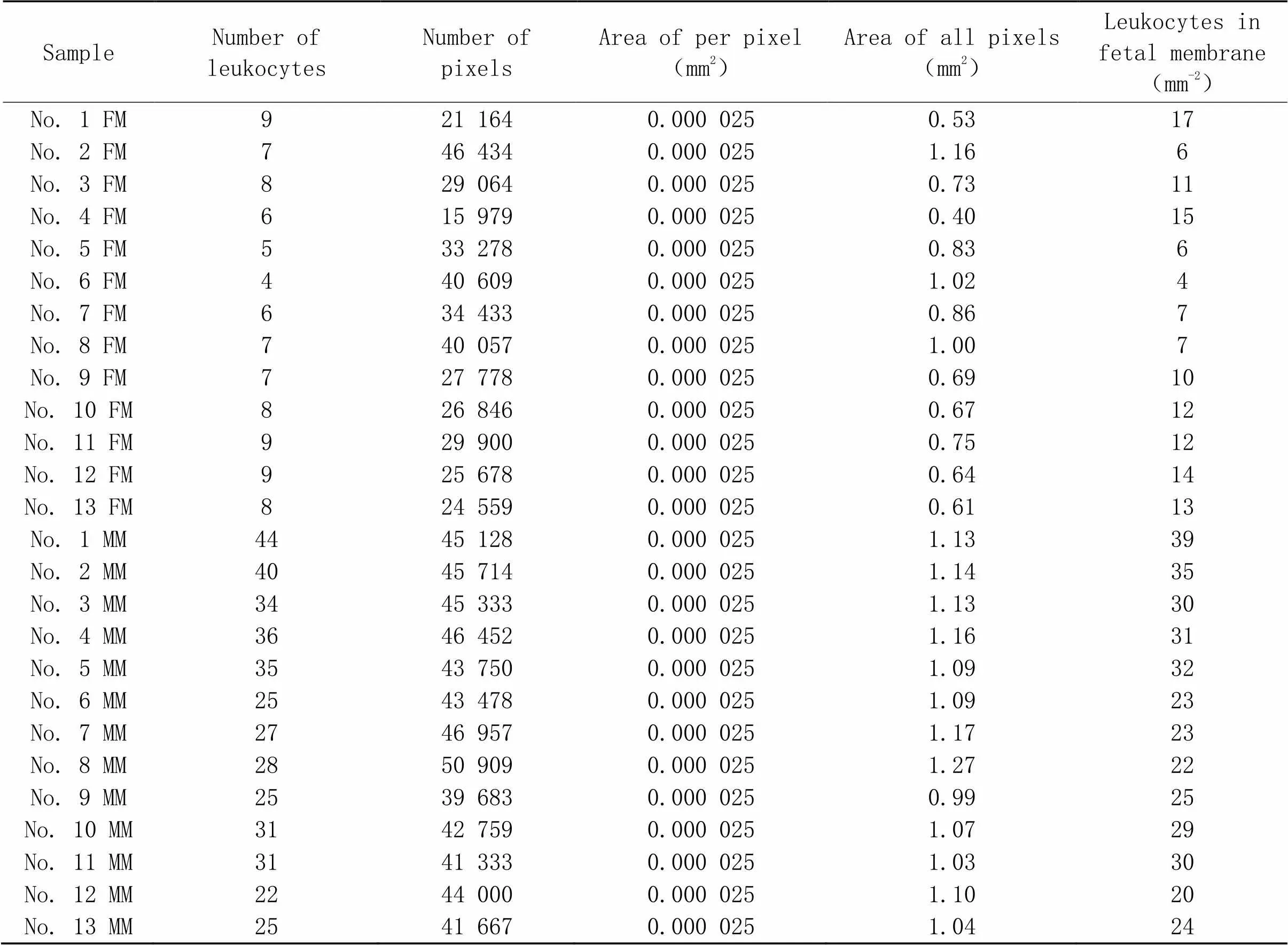
表5 40周胎盘绒毛间隙的白细胞
FM: fetal membrane; MM: maternal membrane.
讨论
enEVTs是取代螺旋动脉血管内皮细胞的一群特殊的滋养层细胞,它可参与妊娠免疫耐受的调控[5]。我们推测enEVTs可能通过黏附白细胞以实现对Th1细胞分化的调控,进而发挥其免疫耐受的功能,而本研究的体外培养实验也证明了此点。在细胞体外培养实验中,enEVTs细胞上清促进Th1细胞分化,这与已报道的enEVTs具有免疫调控功能的研究相一致[5]。此外,免疫荧光实验证明enEVTs表达粘着分子NCAM1,该结果也与已报道的enEVTs表达模式一致[12]。细胞体外共培养实验结果进一步表明,enEVTs原代细胞可以黏附白细胞。以上结果提示enEVTs可通过粘着分子NCAM1黏附白细胞实现对Th1细胞分化的调控,见图7。本研究将enEVT原代细胞和细胞上清都应用于体外共培养体系,相较于以往enEVTs研究[5]在共培养体系的设计上有所改进。
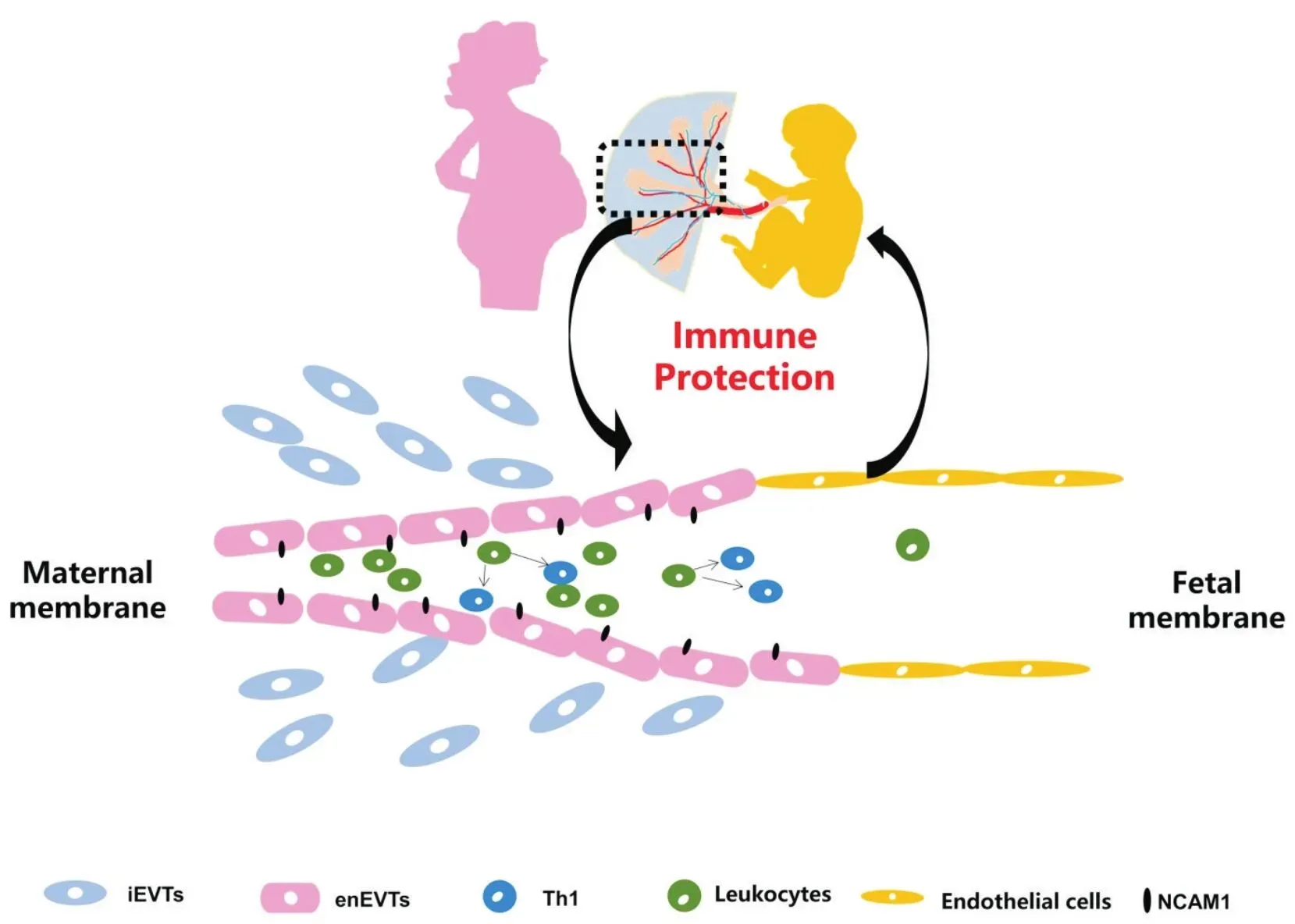
Figure 7. A schematic figure to illustrate the mechanism of endovascular extravillous trophoblasts (enEVTs) participating in immune tolerance during normal pregnancy. iEVTs: interstitial extravillous trophoblasts; Th1: type 1 T helper cells; NCAM1: neural cell adhesion molecule 1.
本研究旨在通过细胞体外培养实验研究enEVTs调控妊娠免疫耐受的机制。胎儿来源的enEVTs与母血中的白细胞直接接触,且参与妊娠免疫耐受的调控,但具体的调控机制尚不明确[5]。NCAM1是一种神经细胞黏附分子,早期文献表明enEVTs特异表达NCAM1[12],但未阐明其功能及意义,本研究在进一步确定enEVTs特异表达NCAM1的基础上,利用细胞体外共培养实验证明enEVTs具有黏附白细胞的功能。
Th1细胞为辅助性T细胞,可分泌大量趋化因子并发挥免疫激活的功能[7]。在正常妊娠过程中,Th1细胞的比例降低以维持孕期免疫耐受,而孕期Th1细胞比例的异常升高会引发妊娠相关疾病[8-10]。目前尚未有研究将Th1细胞的分化情况与enEVTs的细胞功能联系到一起,而本研究利用细胞体外共培养实验证明enEVTs可以抑制Th1细胞的分化。
妊娠免疫耐受依赖于胎盘中母体和胎儿细胞之间复杂的相互作用,胎盘绒毛间隙的免疫微环境复杂且细胞分布不明确[15-17],本研究检测并统计了胎盘绒毛间隙中的母体白细胞分布,并证明胎盘绒毛间隙中靠近胎儿侧的母体白细胞数量减少,以维护孕期母胎免疫耐受。此外,胎盘的免疫炎性因素是分娩发动的主要诱因[18-20],因此本实验所呈现的胎盘绒毛间隙母体白细胞的动态变化,可成为分娩发动的潜在诱因。
子痫前期等妊娠疾病的发生伴随螺旋动脉改建不足[21-24]和全身性炎症反应[25-27],胎盘功能障碍乃至免疫失衡被认为是子痫前期发病的重要原因[28-32]。正常妊娠胎盘中,enEVTs是螺旋动脉改建及妊娠免疫调控的重要基础。
综上所述,本研究通过细胞体外共培养实验证明:enEVTs作为可以取代螺旋动脉血管内皮的特殊滋养层细胞,可以表达粘着分子NCAM1,进而黏附白细胞,抑制Th1细胞的分化,以促进妊娠过程中的免疫耐受调控。本研究为子痫前期等妊娠疾病发病机制的探索提供了实验依据。
[1] Craven CM, Morgan T, Ward K. Decidual spiral artery remodelling begins before cellular interaction with cytotrophoblasts[J]. Placenta, 1998, 19(4):241-252.
[2] Burrows TD, King A, Loke YW. Trophoblast migration during human placental implantation[J]. Hum Reprod Update, 1996, 2(4):307-321.
[3] Ji L, Brkic J, Liu M, et al. Placental trophoblast cell di-fferentiation: physiological regulation and pathological relevance to preeclampsia[J]. Mol Aspects Med, 2013, 34(5):981-1023.
[4] Pijnenborg R, Vercruysse L, Hanssens A. The uterine spiral arteries in human pregnancy: facts and controversies[J]. Placenta, 2006, 27(9):939-958.
[5] Ma Y, Yang Q, Fan M, et al.Placental endovascular extravillous trophoblasts (enEVTs) educate maternal T-cell differentiation along the maternal-placental circulation[J]. Cell Prolif, 2020, 53(5):802-813.
[6] Trowsdale J, Betz AG. Mother' s little helpers: mechanisms of maternal-fetal tolerance[J]. Nat Immunol, 2006, 7(3):241-246.
[7] Constant S, Bottomly K. Induction of Th1 and Th2 CD4+T cell responses: the alternative approaches[J]. Annu Rev Immunol, 1997, 15(10):297-322.
[8] RaghupathyR. Pregnancy: success and failure within the Th1/Th2/Th3 paradigm[J]. Semin Immunol, 2001, 13(316):219-227.
[9] Ramyar A, Majid A, Shahla D, et al. Cyclosporine A improves pregnancy outcomes in women with recurrent pregnancy loss and elevated Th1/Th2 ratio[J]. J Cell Physiol, 2019, 234(19):39-47.
[10] Saito S, Nakashima A, Shima T, et al. Th1/Th2/Th17 and regulatory T-cell paradigm in pregnancy[J]. Am J Reprod Immunol, 2010, 63(6):601-610.
[11] Zhou Y, Fisher SJ, Janatpour M, et al.Human cytotrophoblasts adopt a vascular phenotype as they differen tiate. A strategy for successful endovascular invasion?[J]. J Clin Invest, 1997, 99(9):39-51.
[12] Rutishauser U. Developmental biology of a neural cell adhesion molecule[J]. Nature, 1984, 310(5978):549-554.
[13] Spanjers JM, Stadler B. Cell membrane coated particles[J]. Adv Biosyst, 2020, 4(11):174-185
[14] Dausset J, Colombani J, Colombani M. Anti-leucocyte cytoplasm, anti-leucocyte nuclei and anti-platelets in disseminated lupus erythematosis[J]. Nature, 1961, 191:1209-1210.
[15] Loke YW, King A, Burrows T, et al. Evaluation of trophoblast HLA-G antigen with a specific monoclonal antibody[J]. Tissue Antigens, 1997, 50(2):135-146.
[16] Trowsdale J, Moffett A. NK receptor interactions with MHC class I molecules in pregnancy[J]. Semin Immunol, 2008, 20(6):317-320.
[17] Hackmon R, Pinnaduwage L, Zhang J, et al.Definitive class I human leukocyte antigen expression in gestational placentation: HLA-F, HLA-E, HLA-C, and HLA-G in extravillous trophoblast invasion on placentation, pregnancy, and parturition[J]. Am J Reprod Immunol, 2017, 77(6):11-16.
[18] Phillippe M. Cell-free fetal DNA, telomeres, and the spontaneous onset of parturition[J]. Reprod Sci, 2015, 22(10):1186-1201.
[19] Menon R, Richardson LS, Lappas M. Fetal membrane architecture, aging and inflammation in pregnancy and parturition[J]. Placenta, 2019, 79:40-45.
[20] Gan XW, Wang WS, Lu JW, et al. De novo synthesis of SAA1 in the placenta participates in parturition[J]. Front Immunol, 2020, 11(3):10-38.
[21] Albrecht ED, Pepe GJ. Regulation of uterine spiral artery remodeling: a review[J]. Reprod Sci, 2020, 27(10):1932-1942.
[22] Hu X, Zhang L. Uteroplacental circulation in normal pregnancy and preeclampsia: functional adaptation and mala-daptation[J]. Int J Mol Sci, 2021, 22(16):8622.
[23] Pankiewicz K, Fijalkowska A, Issat T, et al. Insight into the key points of preeclampsia pathophysiology: uterine artery remodeling and the role of microRNAs[J]. Int J Mol Sci, 2021, 22(6):3132.
[24] Windsperger K, Dekan S, Pils S, et al. Extravillous trophoblast invasion of venous as well as lymphatic vessels is altered in idiopathic, recurrent, spontaneous abortions[J]. Hum Reprod, 2017, 32(6):1208-1217.
[25] Tenorio MB, Ferreira RC, Moura FA, et al. Cross-talk between oxidative stress and inflammation in preeclampsia[J]. Oxid Med Cell Longev, 2019, 2019:8238727.
[26] Rambaldi MP, Weiner E, Mecacci F, et al. Immunomo-dulation and preeclampsia[J]. Best Pract Res Clin Obstet Gynaecol, 2019, 60:87-96.
[27] Li X, Zhou B, Han X, et al. Effect of nicotine on placental inflammation and apoptosis in preeclampsia-like model[J]. Life Sci, 2020, 261:118314.
[28] Kim CJ, Romero R, Chaemsaithong P, et al. Chronic inflammation of the placenta: definition, classification, pathogenesis, and clinical significance[J]. Am J Obstet Gynecol, 2015, 213(4 Suppl):S53-S69.
[29] Cheng SB, Nakashima A, Huber WJ, et al.Pyroptosis is a critical inflammatory pathway in the placenta from early onset preeclampsia and in human trophoblasts exposed to hypoxia and endoplasmic reticulum stressors[J]. Cell Death Dis, 2019, 10(12):927-930.
[30] Aggarwal R, Jain AK, Mittal P, et al. Association of pro- and anti-inflammatory cytokines in preeclampsia[J]. J Clin Lab Anal, 2019, 33(4):228-234.
[31] 王江玲, 陈思思, 唐杰, 等. 子痫前期患者胎盘组织中visfatin蛋白与mRNA表达及意义[J]. 中国病理生理杂志, 2015, 31(2):337-342.
Wang JL, Chen SS, Tang J, et al. Protein and mRNA expression of visfatin in placenta of patients with preeclampsia[J]. Chin J Pathophysiol, 2015, 31(2):337-342.
[32] 毛东伟, 杨东霞, 段志宇, 等. 先兆子痫胎盘的基因表达谱研究[J]. 中国病理生理杂志, 2009, 25(9):1806-1809.
Mao D, Yang D, Duan Z, et al. Microarray analysis of gene expression profiles in preeclamptic placenta[J].Chin J Pathophysiol, 2009, 25(9):1806-1809.
Human placental enEVTs recruit leukocytes through NCAM1 and inhibit Th1 cell differentiation
MA Ye-ling△, ZHANG Qiao-ying, ZHENG Chang-wu, RAN Na, FANG Dan-na
(,,312000,)
Study the mechanism of endovascular extravillous trophoblasts (enEVTs) in regulating immune tolerance during pregnancy.Interstitial extravillous trophoblasts (iEVTs), enEVTs and naïve CD4+T were obtained from the decidua of early pregnancy by magnetic bead sorting. The naïve CD4+T cells were treated with enEVTs or iEVTs supernatant. The enEVTs supernatant-treated group was defined as the experimental group, and the iEVTs supernatant-treated group was defined as the control group. The proportion of differentiated CD4+IFNγ+type 1 T helper cells (Th1 cells) was analyzed by flow cytometry analysis. The expression of neural cell adhesion molecule 1 (NCAM1) in iEVTs and enEVTs was analyzed. The adhesion of enEVTs to leukocytes was studied by co-culture experiment. Furthermore, in order to detect the recruitment of leukocytes, hematoxylin-eosin (HE) staining of the intervillous space was performed in 37 human placentas.Flow cytometry analysis revealed that enEVTs significantly inhibited the differentiation of CD4+IFNγ+Th1 cells compared with iEVTs. Immunofluorescence results showed that NCAM1 was highly expressed in enEVTs. Primary cell co-culture results showed that enEVTs could adhere to maternal leukocytes. The results of HE staining further revealed that maternal leukocytes were recruited by enEVTs.Human placental enEVTs recruit leukocytes through NCAM1. The enEVTs inhibit the differentiation of Th1 cells and promote immune tolerance during pregnancy.
Endovascular extravillous trophoblasts; Neural cell adhesion molecule 1; Th1 cells; Leukocytes
1000-4718(2022)09-1634-11
2022-02-16
2022-06-29
13157573855; E-mail: mayelingsxu@163.com
R329.21; R363.2+1
A
10.3969/j.issn.1000-4718.2022.09.013
[基金项目]绍兴文理学院科研启动基金(No. 20210022)
(责任编辑:卢萍,李淑媛)
