胎盘MSCs治疗绝经后骨质疏松骨折Wnt/β-catenin、OPG/RANKL关键因子的变化*
2022-10-11麦彩园
麦彩园 王 斌
1 广东省妇幼保健院产科,广东省广州市 510010; 2 佛山市三水区人民医院创伤骨科
间充质干细胞(Mesenchymal Stem Cells,MSCs)为一类多能干细胞,在成骨和代谢中有明显的促进作用[1]。胎盘是一种容易获得MSCs的来源,PMSCs已经证实与骨MSCs具有几乎相同的功能[2]。LRP5、β-catenin、Runx2、OPG、RANKL是Wnt/β-catenin、OPG/RANKL通路的关键因子。LRP5、β-catenin、Runx2是Wnt/β-catenin通路关键的成骨因子[3]。OPG、RANKL是OPG/RANKL通路关键的破骨因子[4]。本文取人胎盘,培养PBMC,传代,注射于绝经后骨质疏松大鼠骨折端。RT-qPCR检测LRP5、β-catenin、Runx2、OPG、RANKL因子在大鼠骨髓腔的表达。
1 材料与方法
1.1 仪器与实试剂 培养基、胶原酶Ⅰ型、DNase Ⅰ、PercoⅡ液:Sigma公司,美国。FCS、TrypLE、胰酶:Bio-Rad公司,英国。qPCR试剂盒、引物:Takara公司,中国。流式细胞仪、培养箱、PCR检测系统:Bio-Rad公司,美国。
1.2 研究对象 研究方案遵照赫尔辛斯基宣言有关规定,经佛山市三水区人民医院的临床试验及动物伦理委员会审查通过,病人知情并同意。本研究选择2021年1—12月在三水区人民医院招募的足月生产妇女,取得胎盘10例。Sprague-Dawley(SD)大鼠购自广州赛业生物有限公司。
1.3 PMSCs获取 取足月生产胎盘,排出脐带血,抛弃脐带和外膜。将胎盘组织(包括羊膜、绒毛膜和胎盘)解剖成约5g大小的碎片(总共300g)。将该组织置于烧杯中并用500ml HBSS/100g组织洗涤。然后将胎盘片以约10g/管平均分配。将低糖培养基与100U/ml胶原酶Ⅰ型和5μg/ml DNase I添加到每个试管中,总体积为50ml。将试管在振荡器上孵育(220r/min,37℃,2h),然后以540g脉冲离心以去除大颗粒物质,并使细胞悬浮液通过70μm过滤器。剩余的组织用HBSS洗涤,得到的细胞悬液也通过70μm过滤器过滤。将合并的过滤细胞离心(540g,5min,20℃)并重新悬浮在30ml HBSS中,并在12ml 1.073g/ml PercollTM下铺垫。将样品离心(540g,20℃,20min),取出界面并用HBSS洗涤2次(第一次在540g,20℃,10min,第二次在300g,20℃,5min)。然后将单核细胞以(2~4)×105个细胞/cm2接种在组织培养瓶中进行离体扩增。
1.4 细胞培养 将骨髓或胎盘细胞接种到25或75cm2组织培养瓶中。标准组织培养基含有20%(v/v)的FCS和50μg/ml庆大霉素的基础培养基。非热灭活FCS用于所有后续实验。培养物在加湿的5%CO2培养箱中培养,培养基每周更换2次。在扩增培养物中通过塑料黏附分离细胞,3d后将非黏附细胞从培养物中洗掉。
细胞培养物在90%~95%浓度时进行传代。烧瓶用HBSS洗涤并与TrypLETMSelect在37℃下孵育5~10min。去除解离的细胞,然后离心(540g,5min,4℃)沉淀。弃去上清液并将细胞重悬于组织培养基中。在第1代,每个实验将MSCs接种到三个重复的烧瓶中。从第2代开始,将细胞从一个烧瓶中接种到另一个烧瓶中。
1.5 鉴定胎盘间充质干细胞 取第3代培养的干细胞,以0.25%浓度的胰酶消化3min后制成单细胞悬液,加入CD90、CD44、CD34、CD45抗体表达单克隆抗体,冰上反应20min,PBS洗2次后离心5min(4℃,1 000r/min),弃上清,加入2ml PBS将其吹打混匀,以流式细胞仪检测细胞表面标志物。
1.6 构建去卵巢骨质疏松模型
1.6.1 模型建立:从广州赛业生物有限公司购买雌性Sprague-Dawley(SD)大鼠[重(280±20)g]。将所有大鼠单独饲养在透明塑料笼中,在受控的光照下(12h光照/黑暗周期),温度(25±2)℃和湿度(50±10)%。老鼠可以自由获取食物和水。
1.6.2 分组标准:适应1周后,将大鼠随机分为三组:对照组、骨质疏松组、干细胞组。骨质疏松组、干细胞组大鼠腹腔注射7%水合氯醛5ml/kg,麻醉成功后,先固定老鼠。然后以第12根肋骨的后部为中心将毛剃光。消毒后,切开3cm长的纵向切口,仔细剥离皮肤和筋膜,然后暴露卵巢。接下来,结扎卵巢下方的输卵管,并切除两个卵巢。最后,冲洗切口后,缝合并包裹皮肤。对照组不摘除卵巢,仅行假手术,切开皮肤再予以缝合。
1.6.3 模型处理:进行常规术后护理和饮食。术后8周,所有大鼠行摆锯开放式小腿截骨制作骨折并取骨髓3ml,然后予以克氏针固定。用注射器吸取PMSCs并注射于绝经后骨质疏松大鼠骨折端及髓腔。骨髓行RT-qPCR检测LRP5、β-catenin、Runx2、OPG、RANKL的水平。
1.6.4 后续处理:继续常规护理和饮食。1个月后处死全部大鼠并开放骨折部位观察并取骨髓3ml,RT-qPCR检测LRP5、β-catenin、Runx2、OPG、RANKL的水平。
1.7 定量逆转录聚合酶链反应(RT-qPCR) 用Trizol试剂分离来自大鼠股骨的总RNA。RNA的在260/280nm处进行吸收测量,证实达到PCR的要求。用cDNA合成试剂盒合成cDNA。使用ABI 7500序列检测系统进行qRT-PCR。相对表达水平用2-ΔΔCt方法计算,GAPDH作内参对照。引物由Takara公司设计的,引物序列5’to 3’:LRP5-F:CCTGGCGCTGTGACGGCTTCC,LRP5-R:CAATGGC GCTGCTGTGGGCTGGTA;Runx2-F:GAACCCACGGCCCTCCCTGAACTC,Runx2-R:AGCGGCGTGGTGGAATGGATGGAT;β-catenin-F:TGGTGGGCTGCAGAAAATGGTT,β-catenin-R:ACGATGGCCGGCTTGTTGC;OPG-F:TCCTGGCACCTACCTAAAACAGCA,OPG-R:CTACACTTCTGCATTCACTTTGG;RANKL-F:CCATCGGGTTCCATAAAGTAGT,RANKL-R:AAAGCCCCAAAGTACGTCGCATCT;β-actin-F:CACCCGCGAGTACAACCTTC,β-actin-R:CCCATACCCACCATCACACC。所有测定均重复3次。
1.8 实验内容及观察指标 取人胎盘,培养PMSCs。流式细胞仪检测第3代PMSCs。建立大鼠骨折模型,随机分为三组:对照组(假手术未去卵巢)、骨质疏松组(去卵巢骨质疏松)、干细胞组(去卵巢骨质疏松+干细胞治疗:用注射器吸取PMSCs并注射于绝经后骨质疏松大鼠骨折端及髓腔)。于大鼠小腿取骨髓,行克氏针内固定,检测LRP5、β-catenin、Runx2、OPG、RANKL因子在大鼠骨髓腔的表达。1个月后处死动物,骨折处骨髓再次检测以上因子的表达。比较骨折时与1个月后各因子的变化,以及比较各组间的水平。

2 结果
2.1 流式细胞仪检测 流式细胞仪显示,第3代PMSCs高表达CD44、CD90,而CD34、CD45呈阴性表达。结果表明实验培养的细胞具备干细胞的表面标志物,可证实为胎盘间充质干细胞。见图1。

图1 流式细胞仪检测第3代PMSCs
2.2 因子LRP5、β-catenin、Runx2、OPG、RANKL在骨折端骨髓的变化
2.2.1 骨折时骨质疏松组与干细胞组相比LRP5、β-catenin、Runx2、OPG差异不大,但与对照组相比明显降低(P<0.05);骨质疏松组与干细胞组相比RANKL差异不大,但与对照组相比明显升高(P<0.05)。见图2。
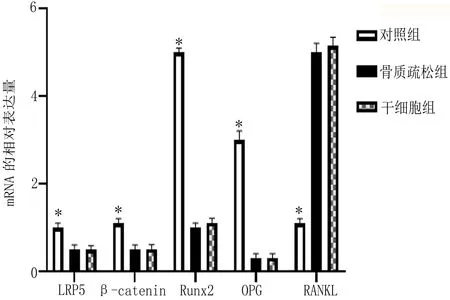
图2 骨折时各因子的表达
2.2.2 术后1个月与骨折时相比,对照组各指标变化不大,而骨质疏松组、干细胞组LRP5、β-catenin、Runx2、OPG明显增加,RANKL明显下降,差异明显(P<0.05)。见图3。术后1个月与对照组、骨质疏松组相比,干细胞组LRP5、β-catenin、Runx2、OPG明显上升,且RANKL明显下降,差异明显(P<0.05)。见图3。

图3 术后1个月各因子的表达
3 讨论
骨髓是人类MSCs的传统来源,骨髓间充质干细胞具有增殖特性,它能促进缺损修复,而且可通过基因修饰的方式表达治疗因子,迁移并发挥治疗作用[5]。MSCs在细胞治疗方面比许多其他细胞类型具有优势,因为它们具有免疫特权,即使在大型动物中,通常也可以跨越主要组织相容性复合体(MHC)屏障进行移植,而无须免疫抑制[6]。人类MSCs是由多种组织和器官产生的,包括胎盘、脐带血、羊膜、羊水、脂肪、肺和肝脏[7]。大多数骨髓等组织来源的Msc,比较难以获取,相比之下,胎盘组织很容易获得。胎盘来源间充质干细胞具有更强的成骨能力[8-9]。
体外诱导培养的PMSCs用软骨诱导培养基培养后,可以分化为软骨细胞,诱导软骨细胞膝关节腔内注射后软骨细胞均有修复,效果优于玻璃酸钠腔内注射治疗[10]。PMSCs可能通过调控炎症因子水平,进而减轻类风湿关节炎大鼠的关节软骨破坏[11]。
在Wnt/β-catenin通路中,LRP5存在于细胞膜表面,Wnt与LRP5/6结合形成复合体,抑制β-catenin的磷酸化。未磷酸化的β-catenin积累进入到细胞核和转录因子结合激活下游靶基因Runx2,LRP5、β-catenin、Runx2是互相促进的引起成骨的基因[12]。
OPG/RANKL通路包括:RANKL-核因子κβ活化受体配体、RANK-NF-κβ活化受体、OPG-RANKL的假性受体骨保护素。OPG与RANKL有着高亲和力,能竞争RANKL和RANK间的互相作用,抑制破骨细胞[13]。RANKL是目前发现的体内仅有的促进OC分化、阻止OC凋亡的因子[14]。
骨折时骨质疏松组与干细胞组相比LRP5、β-catenin、Runx2、OPG差异不大,但与对照组相比明显降低;骨质疏松组与干细胞组相比RANKL差异不大,但与对照组相比明显升高。说明LRP5、β-catenin、Runx2、OPG为成骨因子,RANKL为破骨因子,与前结论一致。术后1个月与骨折时相比,对照组各指标变化不大,而骨质疏松组、干细胞组LRP5、β-catenin、Runx2、OPG明显增加,RANKL明显下降。说明在骨折生长过程中,成骨因子的增强,破骨因子的减弱。术后1个月与对照组、骨质疏松组相比,干细胞组LRP5、β-catenin、Runx2、OPG明显上升,RANKL明显下降。说明PMSCs明显地促进了成骨,同时减少了破骨。
总之,Wnt/β-catenin、OPG/RANKL通路中成骨因子LRP5、β-catenin、Runx2、OPG在骨质疏松中下降,破骨因子RANKL在骨质疏松中上升。PMSCs可引起LRP5、β-catenin、Runx2、OPG在骨质疏松中上升,RANKL在骨质疏松中下降。PMSCs通过调控Wnt/β-catenin、OPG/RANKL通路的关键因子促进骨质疏松性骨折成骨,促进生长。我们可以进一步研究PMSCs预防骨质疏松和治疗骨质疏松性骨折。
