保水功能菌枯草芽胞杆菌LX-1固态发酵的工艺优化
2022-10-10王海燕罗立津郑军荣乐占线林汪洋陈志彪
王海燕,罗立津 ,郑军荣,乐占线,林汪洋,陈志彪,3*
(1.福建师范大学 地理科学学院,福建 福州 350007;2.福建省微生物研究所,福建 福州 350007;3.福建师范大学 湿润亚热带生态地理过程教育部重点实验室,福建 福州 350007)
我国南方红壤分布广泛,区内的水土流失面积仍有16万km2左右,不合理的土地生产及开发利用将导致一系列生态退化问题[1-3]。如何从改善土壤结构、增强土壤肥力和蓄水能力的角度出发以恢复土壤的整体生态功能是水土流失治理应着重研究的方向。人工施肥是改善土壤结构与功能的重要措施,但传统复合肥肥效较低、有效期短。土壤保水剂作为新兴的聚合物材料,凭借特殊的物理结构和化学组成在土壤侵蚀控制中的作用的研究愈加深入,在保水保肥、农田抗旱保水、农作物增产等方面应用前景广阔[4-6]。目前,国际上常用的保水剂为淀粉接枝丙烯酸盐共聚交联物和丙烯酸胺-丙稀酸盐共聚交联物两大类。但这些保水剂存在降解速度慢、失效快和污染土壤等问题[7-9]。近年来,生物保水剂的开发已成为研究热点,并证明其在改良土壤结构[10]、提高土壤蓄水能力[11-12]方面具有明显的作用。γ-聚谷氨酸(γ-PGA)超吸水性树脂具有良好保水特性的关键因素,是新型的环保高分子材料,曾健等[13]研究发现超吸收性γ-PGA树脂具有高保水特性,对土壤中聚集体结构的形成具有显著地促进作用。但当前超吸收性γ-PGA树脂的制备成本高且可能发生各种副反应[14-16]限制其在工农业生产中的应用。张新民等的研究发现相对分子量小的γ-PGA可被应用于农业浸种、增肥等方面[17-19]。Yang等[20]利用γ-PGA作为土壤清洗剂有效去除了土壤中部分重金属,在不破坏土壤结构情况下改良土壤重金属分布。王传海等[21]研究发现γ-PGA的最大自然吸水倍数可以达到千倍以上,对于土壤的吸水倍数也可以达到几十倍。Yin等[22-24]发现γ-PGA在土壤保水、抗旱等方面也取得了较好效果,由此在农业保肥和育苗方面的应用愈发广泛[24-27]。前期实验研究表明,在有机肥料中添加具备合成γ-PGA能力的枯草芽胞杆菌(Bacillussubtilis)可产生丰富的γ-PGA,从而利用其吸水特性赋予有机肥料的保水功效。基于以上研究结果,通过研究优化具有土壤保水特性的产γ-PGA菌株枯草芽胞杆菌的固态发酵工艺,为利用农产品加工下脚料发酵生产含γ-PGA等黏性物质的保水肥料提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株来源 枯草芽胞杆菌(Bacillussubtilis)LX-1,为福建省微生物研究所环境微生物研究室选育鉴定保藏菌种。
1.1.2 培养基 ①牛肉膏蛋白胨培养基[28];②LB培养基[28];③固态发酵培养基:豆粕1 000 mL,无机盐溶液300 mL,该溶液中含K2HPO4·3H2O 2.0 g/L,MgSO4·7H2O 0.50 g/L,pH 8.0。
1.1.3 主要仪器与设备 粉碎机(CLF-10C,中国浙江省温岭市创力药材器械厂);电子天平(CP114,奥豪斯仪器(上海)有限公司);恒温培养振荡器(ZWYR-G2402,上海智诚分析仪器制造有限公司);pH酸度计(S210-K,Sevencompact);旋转蒸发仪(PRM-20ID,上海普渡生化科技有限公司);电热恒温鼓风干燥箱(DHG-9246A,上海精宏实验设备有限公司);电热恒温水浴锅(HH-4,金坛市杰瑞尔电器有限公司);移液枪(Research Plu,德国Eppendorf);超纯水机(WP-UP-Y2-100,沃特谱);冰柜(SC-316,Haier);多功能酶标仪(M5,美谷分子仪器(上海)有限公司);生化培养箱(MI-80A ,施都凯仪器设备有限公司);高压蒸汽灭菌锅(TOMY-SX-700,施都凯仪器设备有限公司);超声波清洗机(KQ5200DE,昆山市超声仪器有限公司);乌氏粘度计(AGE)。
1.2 方法
1.2.1 发酵料FDA测定 荧光素双醋酸酯(FDA)可被不同的酶消解产生荧光素,利用分光光度计和荧光光度计定量测定(其在最大吸收波长下的吸光值(abs)或荧光强度与具有代谢活性的菌体数目成正比[29])是对多种环境样本中微生物酶活性进行迅速、灵敏、简便测定方法。取适量培养基发酵产物上清液置于96微孔板中,根据土壤微生物FDA酶活的测定方法[30]处理,同时取系列标准溶液于96微孔板中,用酶标仪于490 nm波长测各个微孔中溶液的吸光度[31-32]。以一系列荧光素浓度与其所测得的吸光度值绘制标准曲线。将样品的吸光度根据荧光素标准曲线换算为荧光素浓度,根据FDA酶活的计算公式计算各样品的FDA酶活。
1.2.2 发酵料黏度测定 在适宜温度及pH值条件下,发酵料黏性与γ-PGA等黏性物质的产量表现出显著相关关系[33-34]。参考中国药典采用乌氏黏度计测定法[35],取培养的发酵料提取液装入离心杯4 000 r/min离心10 min,去除杂质后于25 ℃条件下测定黏度两次,取其平均值作为测试溶液的流出时间,重复两次,无需重新加载样品。以相同的方式操作同一组发酵液,重复测量两次,两个测量值应相同,取平均值作为溶剂流出时间并计算增比黏度值[36-37]。同时称取定量的γ-PGA纯品配置成10 g/L溶液,稀释成不同倍数的γ-PGA溶液[36]后,用乌氏黏度计在25 ℃下测定各稀释液的流出时间T及超纯水流出时间T0,绘制γ-PGA水溶液增比黏度、流出时间与γ-PGA浓度的线性拟合关系图(图1)。

图1 不同γ-PGA溶液的增比黏度与γ-PGA浓度的关系Fig.1 Relationship between the increasing viscosity of γ-PGA solution and γ-PGA concentration
1.2.3 单因素实验 按以下设置的豆粕、麦麸、K2HPO4·3H2O、MgSO4·7H2O、NaCl系列添加量调整培养基成分,进行单因素实验:①固体料配比:豆粕与麦麸混合比例(体积)分别为0∶10、2∶8、4∶6、6∶4、8∶2、10∶0;②无机盐溶液添加量(体积分数):25%、30%、35%、40%、45%;③无机盐溶液中K2HPO4·3H2O质量浓度:0、2.0、4.0、6.0、8.0 g/L;④无机盐溶液中NaCl质量浓度:0、2.5、5.0、7.5、10.0 g/L。按设定的浓度配制无机盐溶液后,调节pH为8.0,按设定添加量加入到豆粕与麦麸混合发酵料中,混匀,装入三角瓶中,灭菌后,按5%(体积分数)接种量接种枯草芽胞杆菌LX-1种子液,37 ℃生化培养箱中培养36 h后,以发酵料的黏度和FDA酶活为指标,确定培养基的较佳配比。
1.2.4 均匀设计实验 在单因素实验基础上,进行均匀设计试验(表1)。选取X2(K2HPO4)、X3(NaCl)、X4(MgSO4)(X1为空白列)为试验因素,以发酵黏液的FDA酶活为指标,采取拟水平均匀设计实验U7*(74)进行试验(表2)。依据均匀设计设定的试验条件配制7组无机盐溶液,调整pH为8.0,分别取40 mL无机盐溶液加入到100 mL(约50 g)豆粕和麦麸的混合物料中,每瓶加0.5 g CaCO3,混匀,灭菌,接种5%(体积分数)枯草芽胞杆菌种子液,37 ℃培养36 h后,测定各组发酵料FDA酶活,检测结果使用Design Expert 7.0软件进行数据分析,确定培养基的较佳配比,并对所得最优条件进行确证实验。

表1 试验因素水平Table 1 Test factor level

表2 拟水平均匀设计U7*(74)试验条件Table 2 Quasi-horizontal uniform design U7*(74) test conditions
1.2.5 确证实验 通过对比单因素最佳组合、拟合方程预测最佳条件以及均匀设计试验最佳条件的三种不同配比的发酵料的FDA酶活和增比黏度进行比较(表3)。
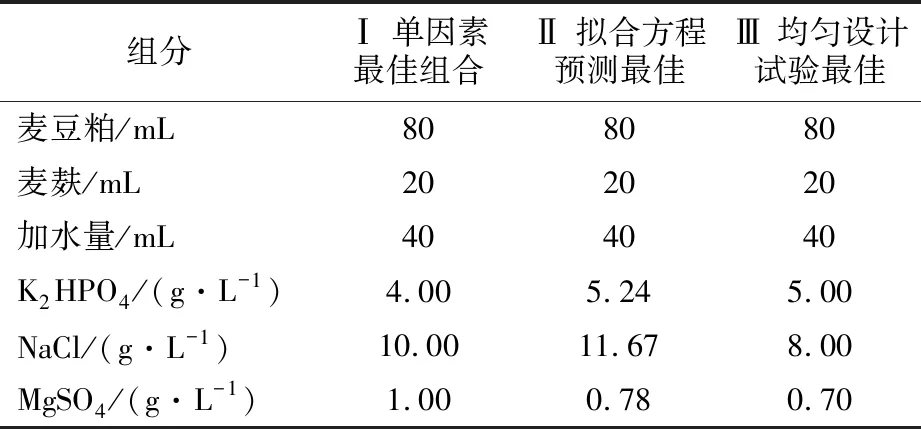
表3 确证实验三种不同培养基配比设置Table 3 Three different media ratio settings of confirmatory experiment
1.2.6 数据分析 上述各项指标取其平均值±标准差为结果。差异性显著分析采用SPSS 18.0软件中Duncan 法进行计算,不同小写字母表示组内显著性差异,显著水平P<0.05;不同大写字母表示组内极显著性差异,显著水平P<0.01。
2 结果与分析
2.1 固体培养基配比对发酵料黏度及FDA酶活的影响
根据图2和图3不同配比的豆粕与麦麸培养基,对比发酵培养测得的FDA酶活与黏度可知,当V豆粕∶V麦麸为10∶0时,增比黏度达到最大值,其原因可能是豆粕自身特性所致,可能由于其通气性不好,导致发酵黏液氨味较重,故不宜采用。在V豆粕∶V麦麸为(9∶1)~(5∶5)区间时,此时的增比黏度不断增加,并在5∶5时达到最大值,随后逐步降低;结合测得的FDA酶活,在6∶4配比之后测得的酶活开始降低,综合两者得出,当豆粕麦麸的固体配比为豆粕60%、麦麸40%(体积分数)时,UFDA酶活最佳,黏度较高。
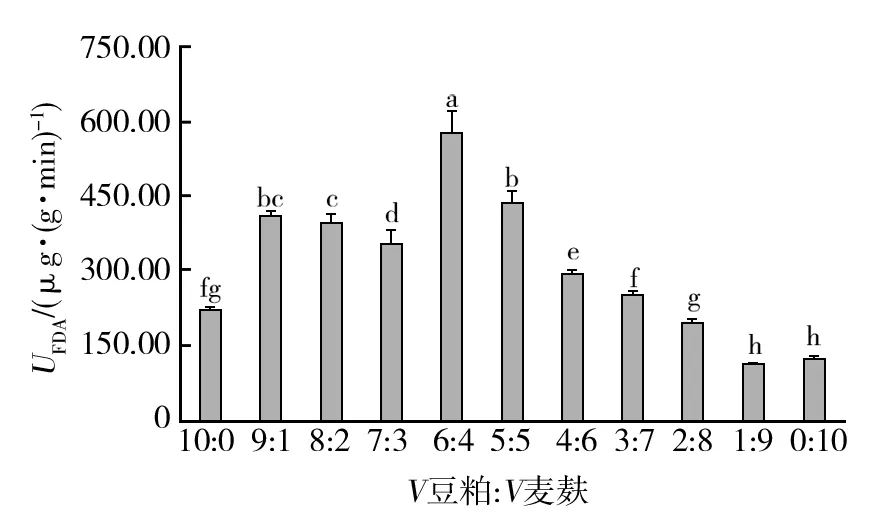
图2 不同豆粕麦麸配比发酵料FDA活性的差异Fig.2 Differences in FDA activity of different soybean meal and wheat bran fermentation proportions不同小写字母表示组内显著性差异,显著水平P<0.05,图3~10同Different lowercase letters indicate the significant difference within the group,the significant level P<0.05,the same as figure 3-10
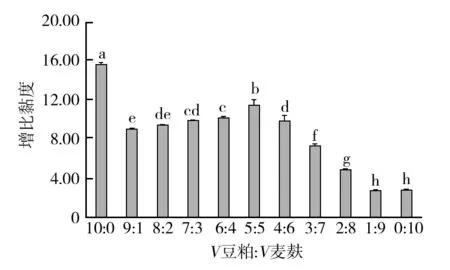
图3 不同豆粕麦麸配比发酵料黏度的差异Fig.3 Differences in viscosity of fermented materials with different soybean meal and wheat bran
2.2 不同加水量对发酵料黏度及FDA酶活的影响
根据图4、图5不同实验配液量培养基的FDA酶活和增比黏度分析显示,当加水量为30%~45%,经发酵培养测得的FDA酶活和黏度不断增加,且加水量40%时,达到最佳值,随后酶活降低,黏度下降。由此可知,固态发酵的最佳加水量为40%。

图4 不同加水量发酵料FDA酶活的差异Fig.4 Differences in FDA activity of fermentation materials with different water addition

图5 不同加水量发酵料黏度的差异Fig.5 Differences in viscosity of fermented materials with different water addition
2.3 不同K2HPO4 浓度对发酵料黏度及FDA酶活的影响
根据不同K2HPO4浓度下的FDA的活性和增比黏度分析(图6、7),对比在添加不同质量浓度K2HPO4的培养基经发酵培养测得数据可知,无机盐溶液的K2HPO4最佳质量浓度为4 g/L。

图6 不同K2HPO4质量浓度发酵料FDA酶活的差异Fig.6 Difference of FDA activity of fermented material with different K2HPO4 concentration

图7 不同K2HPO4质量浓度发酵料黏度的差异Fig.7 Differences in viscosity of fermented materials with different K2HPO4 concentrations
2.4 不同NaCl质量浓度对发酵料黏度及FDA酶活的影响
NaCl不同质量浓度下的FDA酶活和增比黏度分析显示(图8、9),在培养基添加5~10 g/L的NaCl时,FDA酶活和黏度值均表现出不断增加的特性,并且在10 g/L时表现出最大值,而后开始下降,由此可知,无机盐溶液的NaCl最佳质量浓度为10 g/L。
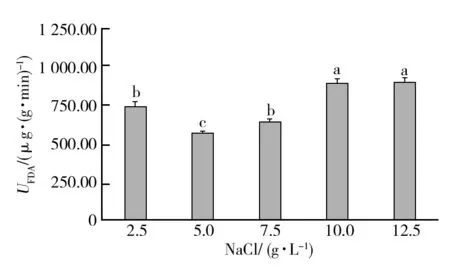
图8 不同NaCl质量浓度发酵料FDA酶活的差异Fig.8 Differences in FDA activity of fermented mmaterials with different NaCl concentrations

图9 不同NaCl质量浓度发酵料黏度的差异Fig.9 Differences in viscosity of fermented materials with different NaCl concentrations
2.5 均匀设计试验结果
均匀设计是基于整个测试范围内测试点,从一致性角度提出的测试设计方法。在条件范围广泛且需要进行多级测试的情况下,均匀设计可以大大减少测试次数,选择一些具有代表性的测试点反映系统的突出特征[38]。
本研究设计3因素,若每个因素取5个水平,采用正交设计实验,须采用L25(56) 表,作25次试验,而采用均匀设计表U5(54),只需要作5次试验,借助Design Expert7.0软件可进行回归分析,再根据回归方程对发酵料FDA酶活进行预测,由此可确定最优参数。
为了获得效果更佳的产γ-PGA的固态发酵工艺参数,需要研究各影响因素及其水平组合对γ-PGA活性及黏度的影响。因此在单因素实验的基础上进行U7(74)均匀设计试验,其中第1列作为空白列,X2(K2HPO4)、X3(NaCl)、X4(MgSO4)分别列于2、3、4列。
从表4的均匀设计试验结果可以发现,试验2(X2=5 g/L、X3=8 g/L和X4=0.7 g/L)发酵料的FDA酶活最高,达到1 038 μg/(g·min)。
通过Design Expert 7.0软件分析,经多元二次线性方程逐步回归,得回归方程:
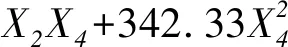
经表5方差分析得知,F=36.48(P<0.000 1),回归关系极显著,表明X2(K2HPO4)、X3(NaCl)、X4(MgSO4)与FDA酶活呈极显著的回归关系。由回归方程可知,X2、X4的系数为正,表明试验指标随因素A、C的增加而增加。通过上述回归方程求UFDA的最大值,得到当X2(K2HPO4)为5.24 g/L,X3(NaCl)为11.67 g/L,X4(MgSO4)为0.78 g/L时,Ymax=1 413.46,这一结果明显优于表4中的7个试验结果。

表4 均匀设计试验结果Table 4 Uniform Design Test Result
2.6 确证实验结果
通过回归模型计算得出UFDA的最佳条件,对比单因素最佳组合以及对均匀设计试验最佳条件进行比较。通过确证实验表明,配比Ⅰ(单因素最佳配比)和配比Ⅲ(均匀设计试验最佳配比)的FDA酶活分别为883和950 μg/(g·min),而根据拟合方程预测最佳条件(配比Ⅱ)测得的FDA酶活高于单因素最佳及均匀设计最佳条件,其UFDA可达到1 014 μg/(g·min),配比Ⅱ与配比Ⅰ之间的UFDA差异达到0.05显著性水平(图10)。测定发酵产物的增比黏度结果表明,配比Ⅱ的增比黏度为7.11,高于配比Ⅰ的6.47和配比Ⅲ的6.93,其中配比Ⅱ与配比Ⅰ的差异达到了0.01极显著水平,配比Ⅱ与配比Ⅲ的差异达到了0.05显著水平(图11)。由此证明,此模型的拟合方程具有一定的参考性。

图10 不同培养基组合之间FDA酶活的差异比较Fig.10 Comparison of differences in FDA activity between different media combinations

图11 不同培养基组合之间发酵料黏度的差异比较Fig.11 Comparison of differences in the viscosity of fermented materials between different media combinations不同小写字母表示组内显著性差异P<0.05;不同大写字母表示组内极显著性差异,显著水平P<0.01Different lowercase letters indicate significant differences within the group P<0.05;different capital letters indicated extremely significant differences within the group P<0.01
通过本研究得出产γ-PGA的芽胞杆菌LX-1固态发酵培养基的最佳配方为V豆粕∶V麦麸∶V无机盐溶液=6∶4∶4,其中无机盐溶液的最佳配方为K2HPO4·3H2O 5.24 g/L、MgSO4·7H2O 0.78 g/L、NaCl 11.67 g/L。
3 讨 论
γ-PGA因其分子主链上大量的亲水性羧基和肽键,故具有良好的可降解性及生物友好等方面的突出优势。不同相对分子质量的γ-PGA表现出不同的生物特性[39],这些良好特性将使生物菌肥在土壤改良和恢复等环保领域上的运用更加广泛。为优化γ-PGA的发酵培养条件,许多学者对γ-PGA固态发酵培养基进行了优化实验。胡荣章等[40]筛选了一株枯草芽胞杆菌菌株并对碳源、氮源、谷氨酸钠浓度、初始pH、接种量、通气量等发酵条件进行了优化。李艳华等[27]利用响应面法优化得到柠檬酸、谷氨酸、磷酸氢二钾和硫酸镁四个显著影响因子。基于前人的研究成果,本研究利用微生物发酵技术选取一株具有保水、保肥作用的枯草芽胞杆菌生产菌株,通过优化其培养基条件,寻找高效的γ-PGA固态发酵工艺。采用黏度测定法能够快速、高效测定γ-PGA等黏性物质的含量。实验虽然没有直接测量γ-PGA的含量,但在发酵培养过程中伴随产生的其他胞外多糖等黏性物质,对于土壤团聚体形成[41]、环境吸附[42]和生物絮凝[43]等具有促进作用,能够与γ-PGA协同发挥保水作用,由此为利用农产品加工下脚料发酵生产含γ-PGA等黏性物质的保水肥料提供参考。
豆粕作为大豆榨油的残渣仍含有丰富的有机质、蛋白质等营养成分,可为微生物生长提供碳源、氮源,但豆粕遇到水溶液会产生不同程度的黏结[44],降低培养基透气性,进而抑制菌体生长。麦麸作为载体辅助成分,能够增加固态培养基的孔隙度,进而改善透气性。朱丽娟[45]在大豆粉培养基质的基础上分别选用玉米芯碎、木屑、花生壳碎和麦麸作为辅助添加,发现在对比实验中麦麸是较好的培养基发酵载体。本研究在综合前人研究结论的基础上选用豆粕、麦麸为培养基质,通过设置系列配比实验以找寻最佳豆粕、麦麸配比,筛选更高效的产γ-PGA固态发酵工艺。固态发酵基于其培养基水分较少且选用农副产品为发酵底物,因此发酵产物浓度更高,生产成本低,能获得较高的经济效益。
适宜水量能够使微生物保持最佳生物活性。水量过多会影响培养基透气性,降低培养基中的溶氧量,而溶氧量是影响γ-PGA产量的重要因素;水量过少又会抑制微生物新陈代谢,降低酶活。本研究发现加水量40%左右时,发酵培养基的FDA酶活和增比黏度达到最佳,而加水量过多或过少均不同程度抑制菌体生长及γ-PGA的产量。桑莉等[46]发现装液量过低时,菌体生长较好,但γ-PGA的产量低,而装液量过高也不利于菌体生长。胡荣章等[40]也发现溶解氧含量并非越高越好,过高可能改变某些代谢途径而引起产量下降。具体影响其代谢途径的机制还有待进一步研究。
无机盐也是微生物发酵的所需物质,一方面调节培养基渗透压、pH值,同时可以组成或调节某些生物生理活性物质。王勇等[47]的实验结果表明磷酸盐会影响产酸效果,尤其是对谷氨酸生产菌OD值的净增有显著影响。李大力等[48]和Wei等[49]研究发现,在一定浓度范围NaCl浓度增加会对γ-PGA产率有促进作用,一旦浓度过高则可能影响γ-PGA分子量大小。本研究通过设置单因素实验,探究不同配比浓度的无机盐添加量对γ-PGA产量的影响并以及最佳实验结果,其结果与张文[50]、吉美萍等[51]的研究结果相似。
基于前期最佳液体发酵培养基的研究基础,本研究通过单因素实验及均匀设计实验,以发酵提取液的黏度及FDA酶活为评价指标,对产γ-PGA的枯草芽胞杆菌的固体发酵培养基进行优化,经过系列实验后得出最佳培养基配方为V豆粕∶V麦麸∶V无机盐溶液=6∶4∶4,其中无机盐溶液的最佳配方:K2HPO4·3H2O 5.24 g/L、MgSO4·7H2O 0.78 g/L、NaCl 11.67 g/L。通过优化保水材料功能菌产γ-PGA枯草芽胞杆菌LX-1的固态发酵工艺,从而为利用农产品加工下脚料发酵生产含γ-PGA保水肥料提供技术基础。
