柴达木沙漠链霉菌S10T阿糖腺苷的大孔树脂分离工艺优化与结构鉴定
2022-10-10吴玉洁刘光琇
吴玉洁,姜 侃,张 威,于 雪,4,汶 瑛,4,刘光琇,陈 拓
(1.中国科学院西北生态环境资源研究院 冰冻圈科学国家重点实验室,甘肃 兰州 730000;2.甘肃省极端环境微生物资源与工程重点实验室,甘肃 兰州 730000;3.中国科学院西北生态环境资源研究院 沙漠与沙漠化重点实验室,甘肃 兰州 730000;4.中国科学院大学,北京 100049;5.甘肃农业大学 农学院,甘肃 兰州 730000)
天然产物(Natural products)作为如今非常重要的化合物家族,由于其普遍具有生物活性而被广泛研究[1],尤其是一些具有抗菌、抗肿瘤和抗病毒活性的化合物已经广泛应用于人类医药和农业生产过程。其中有超过8万种活性天然产物是由链霉菌产生的[2-4]。由链霉菌产生的抗生素主要有非核糖体肽(NRPs)、聚酮类(PKS)、NRPS-PKS杂合化合物、氨基糖苷类(aminoglycoside)、氨基香豆素(aminocoumarin)、酰基内酯(acyl-lactone)、醌类化合物(quinone)、磷酸糖脂(phosphglydolipied)和核苷类化合物(nucleoside)。其中核苷类抗生素(nucleoside antibiotics)是由核苷或核酸衍生而来的一类抗生素,目前所发现的核苷类抗生素几乎全部来源于微生物[5]。它们在结构上具有相似性——核苷基团,而其他基团结构则非常多样,这就使得核苷类抗生素能够参与多种细胞基础代谢过程。因此核苷类抗生素具有非常广泛的生物学活性。根据其生物学活性可分为抗细菌活性、抗真菌活性和抗病毒活性三大类[6]。由于核苷类抗生素广谱的生物学活性、复杂多变的生物合成途径及调控机制,使得核苷类抗生素的研究受到了广泛关注,所以对于核苷类抗生素及其生物合成的研究是非常重要的。本研究所采用的柴达木沙漠链霉菌(Streptomycesqaidamensis)S10T是一株分离自柴达木盆地的链霉菌新种。甘肃省极端环境微生物资源与工程重点实验室在前期研究中发现菌株S10T的发酵液粗提物对于抗甲氧西林的金黄色葡萄球菌(MRSA)具有抑菌活性[7],并且对革兰阳性、革兰阴性菌和真菌具有广谱的抗菌活性,因此开展菌株S10T产生的活性天然产物具有非常重要的研究价值。本研究利用大孔吸附树脂从菌株S10T中提取活性天然产物,筛选了具有良好吸附及解吸性能的大孔吸附树脂,对粗提物进行了初步分离,并鉴定了分离得到的化合物结构。大孔吸附树脂由于其网状结构和较大的比表面积使得其兼具吸附性和分子排阻效应,通过选择不同极性和不同孔径的树脂即可达到分离纯化的目的,具有更强的分离特异性[8]。且大孔吸附树脂具有吸附速度快,不受无机盐和强离子等影响,因此广泛应用于天然产物的分离[9]。通过对菌株S10T中活性天然产物分离方法的探究,为进一步开发该菌株产生的多种具有新颖结构或活性的化合物,为利用大孔吸附树脂从链霉菌中发掘活性天然产物提供参考。
1 材料与方法
1.1 材料
1.1.1 试验菌株 抑菌测定指示菌:金黄色葡萄球菌(Staphylococcusaureus)、表皮葡萄球菌(Staphylococcusepidermidis)、蜡样芽胞杆菌(Bacilluscereus)、苏云金芽胞杆菌(Bacillusthuringiensis)、大肠埃希菌(Escherichiacoli)、乳酸乳球菌(Lactococcuslactis)、藤黄微球菌(Micrococcusluteus)、铜绿假单胞菌(Pseudomonasaeruginosa)、恶臭假单胞菌(Pseudomonasputida),以上供试菌由甘肃省极端环境微生物资源与工程重点实验室提供;实验菌株柴达木沙漠链霉菌(Streptomycesqaidamensis) S10T,由甘肃省极端环境微生物资源与工程重点实验室分离得到。
1.1.2 培养基 ①LB培养基;②MS培养基:黄豆粉 20 g,加入自来水800 mL,煮沸2 h后过滤得滤液,加入甘露醇 20 g,琼脂 20 g,加自来水至1 000 mL;③ISP-2培养基;④高氏一号培养基。
1.1.3 主要试剂与仪器设备 无水乙醇、甲醇等有机溶剂均为国产分析纯;色谱级甲醇和乙腈均购自迈瑞达科技有限公司;氘代试剂购自美国剑桥同位素实验室(CIL);大孔吸附树脂XAD-7HP、XAD-16、AB-8和HP-20,反向硅胶填料购自北京慧德易科技有限责任公司;卡那霉素、TTC(氯化三苯四氮唑)购自索莱宝生物科技有限公司;葡聚糖凝胶LH-20购自美国GE Healthcare。旋转蒸发仪(RV10,德国艾卡仪器设备有限公司);Heal Force台式高速冷冻离心机(23R,力康生物医疗科技控股有限公司);高效液相色谱仪(EClassical 3100,大连依利特分析仪器有限公司);超高分辨率质谱仪(TSQ Alitis,赛默飞世尔科技有限公司);400 MHz核磁共振波谱仪(AVANCE NEO,布鲁克科技有限公司)。
1.2 方法
1.2.1 静态吸附试验 ①活性物质浓缩:菌株S10T使用高氏一号培养基经过7 d发酵后所得的菌液离心除去菌丝体后所得上清即为发酵液,发酵液使用等体积乙酸乙酯萃取后重新溶解,浓缩至活性物质浓度为10 mg/mL,该浓缩发酵液供后续实验使用。②树脂筛选实验:在4个500 mL三角瓶中分别加入10 g预处理好的XAD-7HP、XAD-16、AB-8和HP-20树脂[10],加入100 mL浓缩发酵液,静态吸附0.5 h后,取出吸附后剩余浓缩发酵液进行抗菌物质浓度测定。③不同pH值对吸附能力的影响:分别称取5 g处理好的AB-8湿树脂5份于5个500 mL三角瓶中,量取100 mL浓缩发酵液,分别将pH调为1、3、6、9、12,吸附2 h后,取吸附后剩余浓缩发酵液进行活性物质含量的测定,并计算吸附效率。④AB-8树脂静态饱和吸附量测定:分别称取2 g处理好的AB-8湿树脂于500 mL三角瓶中,再加入100 mL浓缩发酵液,分别吸附0.5、1、2、4、6、8、12、24 h,取出吸附后剩余浓缩发酵液测定其残余活性物质含量。⑤洗脱液浓度选择:分别称取5 g处理好的AB-8湿树脂于12个500 mL三角瓶中,加入100 mL发酵液,吸附2 h后,滤纸过滤除去吸附后的剩余浓缩发酵液,分别测定其中抗菌活性物质含量。过滤后湿树脂分别用0、10%、20%、30%、40%、50%、60%、70%、80%、90%和100%(体积分数)的甲醇洗脱,分别测定洗脱液中活性物质含量。
1.2.2 活性天然产物分离及鉴定 ①天然产物分离:使用200目正向硅胶分离洗脱液,再分别使用石油醚与乙酸乙酯、氯仿与甲醇不同比例梯度洗脱,合并相同组分。打孔法[11]对分离得到的组分进行抑菌活性检测,对于有抑菌活性的组分再以不同比例的甲醇与水为洗脱液反相硅胶进行分离。最后将进一步分离得到的活性物质组分经葡聚糖凝胶LH-20分离,分别使用100%、70%、30%的甲醇和纯水作为洗脱剂,梯度洗脱,TLC分析后将相同的组分合并。②结构鉴定:将分离提纯的化合物用氘代DMSO溶解后,核磁共振仪测定其1H和13C同位素峰。甲醇溶解的化合物使用高分辨质谱测定其质核比及相对分子质量。③色谱条件:色谱柱为ODS-18(4.6 mm×150 mm,5 μm);流动相为V乙腈∶V1‰TFA水溶液=75∶25,等梯度洗脱;检测波长为254 nm;流速0.8 mL/min;柱温35 ℃;进样量20 μL。
1.2.3 抑菌活性检测方法 发酵液及化合物抑菌活性的检测使用氯化三苯四氮唑(TTC)显色法[12]。精确称取TTC 1 g,用100 mL蒸馏水溶解,配制成1%(质量分数)溶液,0.22 μm的无菌滤器过滤除菌后避光保存备用。检测抑菌活性时再将1% TTC溶液使用培养基稀释100倍加入96孔板中,同时加入样品和供试菌液(TTC、样品和供试菌液的量可根据不同菌株进行调整,但总量保持在200 μL)。TTC作为细菌呼吸的氢受体加入培养基中,当细菌生长时,细菌在脱氢酶的作用下,无色的TTC生成不溶于水的红色三苯甲腙。根据颜色变化能够准确且直观地判断细菌是否生长。
1.2.4 计算方法 树脂吸附量Q(mg/g)、吸附效率q(mg/(g·h))按下列公式计算:Q(mg/g)=(ρ0ν0-ρ1ν1)/m,q(mg/(g·h))=Q/Δt。式中:ρ0ν0为浓缩发酵液质量浓度(mg/mL)和体积(mL);ρ1ν1为吸附后剩余浓缩发酵液质量浓度(mg/mL)和体积(mL);m为处理好的湿树脂质量(g);Δt为吸附时间(h)[13]。
2 结果与分析
2.1 静态分析
2.1.1 树脂筛选 树脂筛选试验中,当吸附时间相同(0.5 h)时,AB-8树脂的吸附效率高于其他树脂(图1A),对比四种大孔吸附树脂的性能(表1)发现,这可能是由于AB-8树脂相对XAD-16和HP20,属于弱极性树脂[14],在吸附过程中不仅能够吸附带有极性基团的非极性化合物也能够吸附极性化合物。而与极性相似的XAD-7HP相比,AB-8则具有更大的比表面积和更小的孔径,使得在单位时间内AB-8树脂的吸附量更大,所以后续试验选择使用AB-8树脂作为试验树脂。
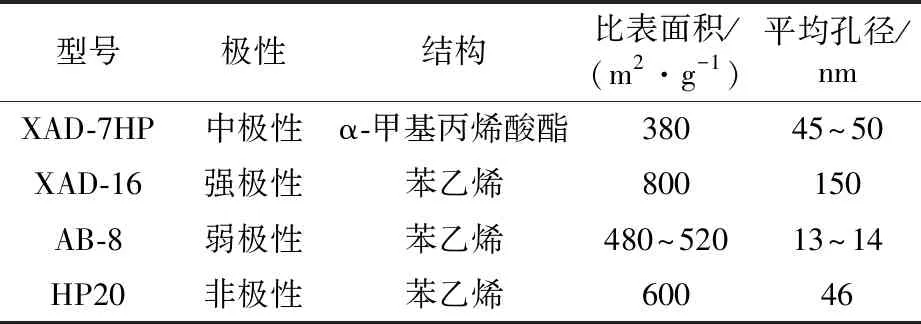
表1 四种大孔吸附树脂性能比较Table 1 General properties of four microporous resins
2.1.2 不同pH对AB-8树脂吸附效率的影响 AB-8树脂在不同pH条件下对菌株S10T浓缩发酵液的吸附效率影响试验表明,浓缩发酵液的不同pH值对于树脂吸附效率的影响并没有明显差异。但pH值为9时,吸附效率最高,说明AB-8适宜在弱碱性条件下对菌株S10T浓缩发酵液中的活性产物进行吸附。因此在后续化合物提取试验中,需将发酵液的pH值调为9(图1B)。
2.1.3 AB-8树脂静态饱和吸附量 AB-8树脂饱和吸附量的测定结果见表2。测定结果表明,AB-8树脂吸附菌株S10T浓缩发酵液4 h后,剩余浓缩发酵液中抗菌活性物质的含量基本达到平衡状态,表明4 h后大孔吸附树脂的吸附能力已经饱和,树脂的吸附量为138 mg/g。AB-8对菌株S10T浓缩发酵液的静态饱和吸附动力曲线及吸附效率曲线见图1C。
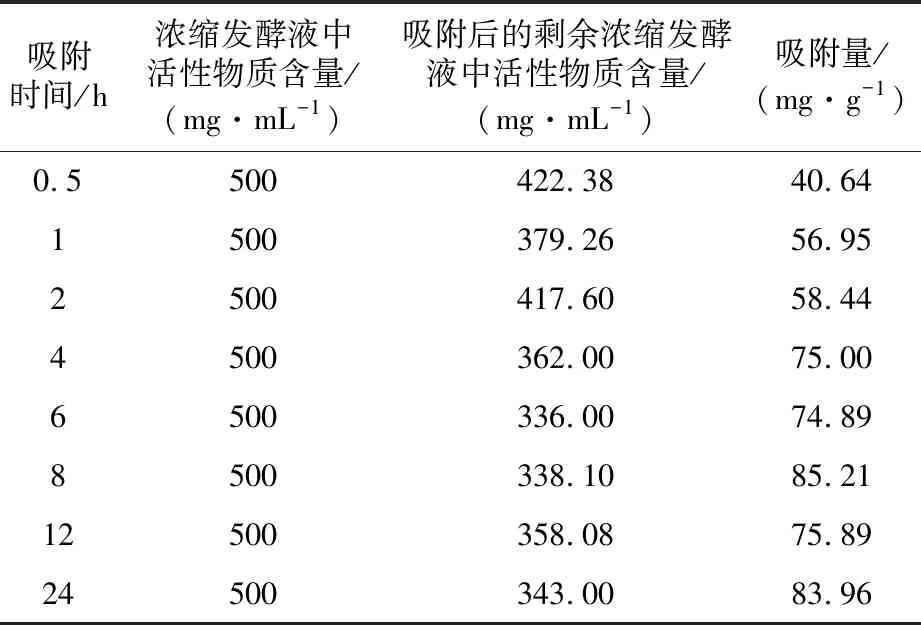
表2 AB-8静态饱和吸附试验结果Table 2 Result of the AB-8 static saturation adsorption
2.1.4 最佳甲醇洗脱浓度试验 设置0~100%11个梯度,使用30%~100%(体积分数,下同)的甲醇洗脱均有较好的洗脱效果(图1D),抗菌试验结果表明0~10%的洗脱液不具有抑菌活性。在后续分离试验中,可用10%的甲醇洗脱杂质,70%的甲醇作为洗脱液浓缩抗菌活性物质用于后期分离。
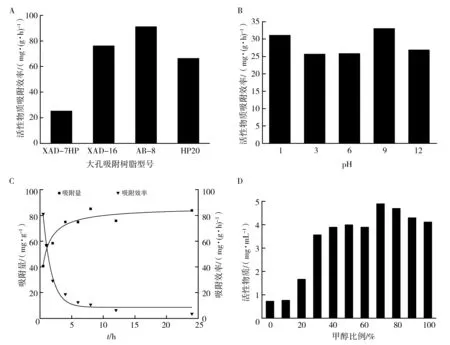
图1 大孔吸附树脂对发酵液静态吸附结果Fig.1 Results of static adsorption of fermentation broth by macroporous adsorption resinA:大孔树脂筛选结果;B:不同pH对AB-8树脂吸附效率的影响;C:AB-8树脂静态饱和吸附动力学及吸附效率曲线;D:不同比例甲醇洗脱试验结果A:Screening results of macroporous resin;B:The effect of different pH on the adsorption efficiency of AB-8;C:AB-8 resin static saturated adsorption kinetics curve;D:Different ratio of methanol elution results
2.2 活性化合物分离
2.2.1 活性化合物分离结果 初步使用200目正向硅胶,共分离得到了20个流份,分别为Fr.1~Fr.20。采用5种测活菌株金黄色萄葡球菌(Staphylococcusaureus)、苏云金芽胞杆菌(Bacillusthuringiensis)、藤黄微球菌(Micrococcusluteus)、铜绿假单胞菌(Pseudomonasaeruginosa)和大肠埃希菌(Escherichiacoli)检测了Fr.1~Fr.20的抑菌活性,其中除Fr.8、Fr.12和Fr.19外,其他流份都具有抑菌活性(图2)。使用反相硅胶和葡聚糖凝胶对Fr.13和Fr.14进行下一步分离得到一个纯的化合物,该化合物为白色粉末状固体,易溶于甲醇和DMSO等有机溶剂。HPLC检测该化合物保留时间为2.86 min(图3A),具有较高的纯度,峰面积占比为93.12%。
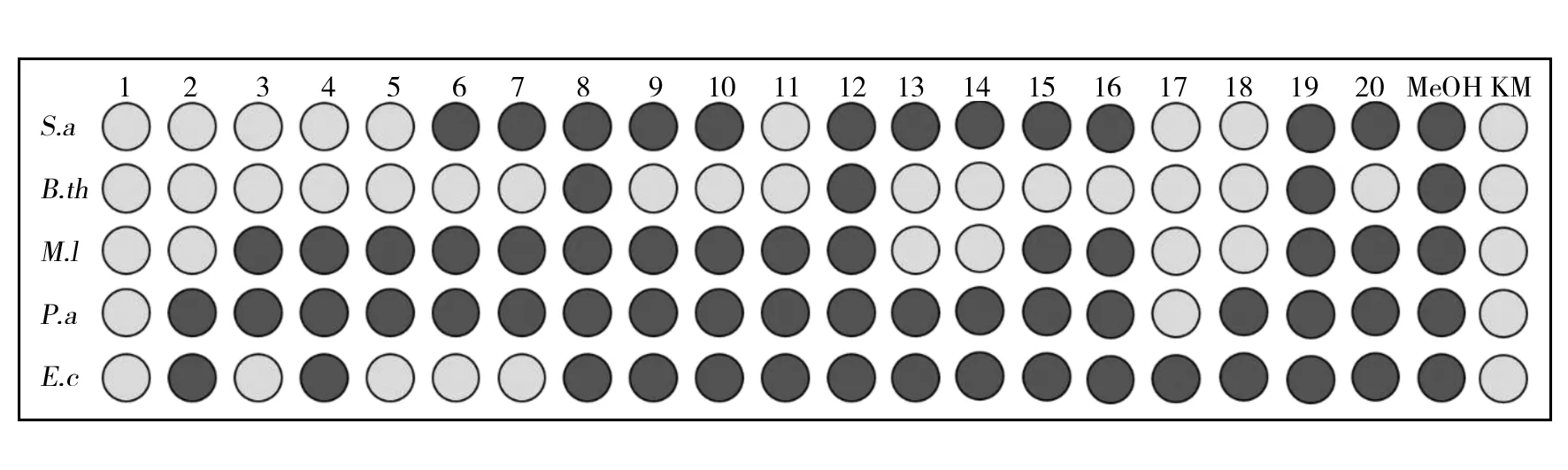
图2 Fr.1~Fr.20抑菌活性检测结果Fig.2 Fr.1-Fr.20 antibacterial activity test results图中深灰色为无抑菌活性,浅灰色为有抑菌活性;MeOH为甲醇,作为阴性对照;KM为卡那霉素(质量浓度10 mg/mL)作为阳性对照Dark gray indicates no antibacterial activity;and light gray indicates antibacterial activity;MeOH was methanol,used as a negative control;and KM was kanamycin used as positive control with concentration 10 mg/mL
2.2.2 活性化合物结构鉴定 使用LC-HR-MS对该化合物的分子量进行了表征,该化合物质核比为268.103 0(图3B),计算质核比为268.104 6,其误差值为5.97×10-6。结合1H-NMR和13C-NMR,得到了该化合物的结构(图3C),根据文献调研发现该化合物为阿糖腺苷(9-beta-D-Arabinofuranosyladenine,Ara-a,Vidarabine),是第一个得到美国食品药品管理局(FDA)认证的核苷类抗生素。1H-NMR和13C-NMR结果如下:1H-NMR (400 MHz,DMSO-d6) δ 8.35 (s,1H),8.14 (s,1H),7.42 (s,2H),5.83 (s,1H),5.40 (s,2H),5.19 (s,1H),4.59 (s,1H),4.14 (s,1H),3.98 (s,1H),3.67 (s,1H),3.56 (s,1H),3.27 (s,14H),2.52 (s,4H)。13C-NMR (101 MHz,DMSO-d6) δ156.64,152.85,149.54,140.38,119.83。
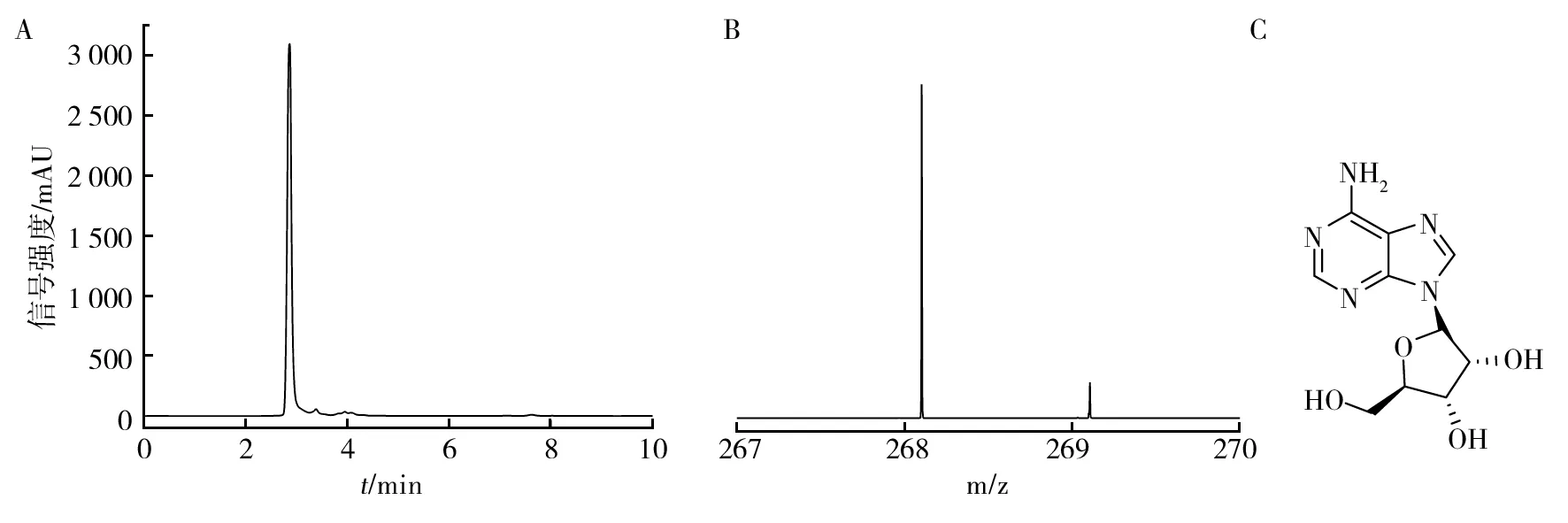
图3 阿糖腺苷质核比及结构Fig.3 The m/z and structure of vidarabineA:阿糖腺苷HPLC图谱;B:阿糖腺苷质核比;C:阿糖腺苷结构A:The HPLC spectrum of vidarabine;B:The m/z of vidarabine,C:The structure of vidarabine
3 讨 论
本研究采用大孔树脂吸附、正向硅胶、反相硅胶和葡聚糖凝胶逐步分离的方法,从柴达木沙漠链霉菌S10T中分离得到了阿糖腺苷。目前核苷类抗生素仍然依靠化学合成方法,在立体异构的化合物合成时通常需要较为苛刻的反应条件,如需要重金属试剂参与反应或需要较高的反应能量[15],存在选择性差、中间产物多和流程复杂等局限性[16-18],因此从链霉菌中直接分离的方法对于发现核苷类抗生素仍然是必要的。
阿糖腺苷是一种核苷类抗生素,具有抑制多种病毒DNA聚合酶的活性,是一种有效的抗病毒药物。阿糖腺苷首次发现于海绵中[19],随后Satoshi Omura等在链霉菌中也分离得到了阿糖腺苷,并发现其对刺胆草、马地丁和藜麦具有较强的除草活性[20]。除此之外,阿糖腺苷最主要的生物活性为抗病毒活性,它能够转化为腺嘌呤三磷酸腺苷来抑制病毒DNA聚合酶。据Kamiyama等[21]报道,阿糖腺苷具有抑制阿昔洛韦抗性HSV(单纯疱疹病毒)和VZV(水痘带状疱疹病毒)的活性。但是阿糖腺苷的抑菌活性未见报道,本研究也对该化合物进行了抑菌活性检测,几种测试菌测活结果显示,该化合物并不具有抑菌活性。
Suhadolnik等[22]对阿糖腺苷在Streptomycesantibioticus中的生物合成进行了阐述。Wu等[23]发现在S.antibioticus中,阿糖腺苷与另一种治疗血液肿瘤的药物喷司他丁(pentostatin)由同一个生物合成基因簇负责合成。在菌株S10T中,通过对基因簇中的各个蛋白质序列进行比对发现,这些基因并非成簇存在,且PenF与菌株S10T中的蛋白序列不存在相似性(表3),因此在菌株S10T中可能存在与S.antibioticus不同的生物合成途径。
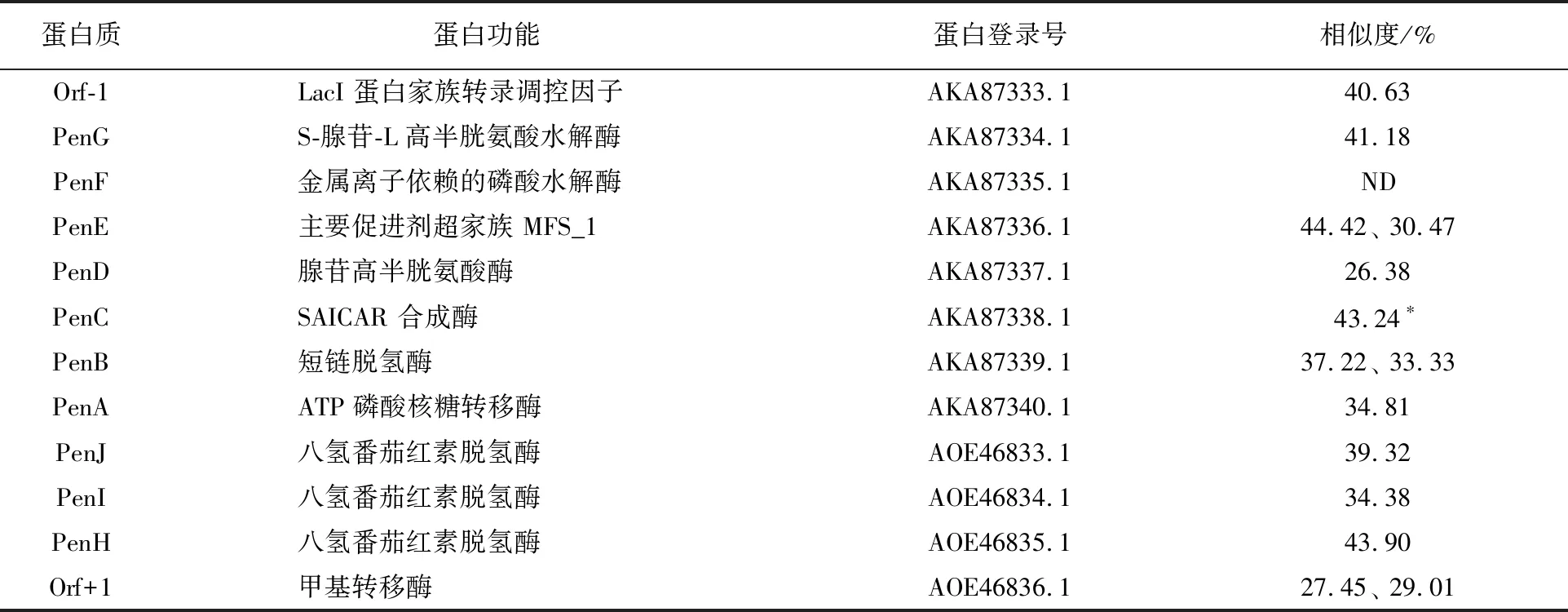
表3 S. antibioticus中阿糖腺苷合成相关基因与菌株S10T中相关基因相似性对比Table 3 The relactive biosysthesis gene of Ara-A analyze between S.antibioticus and S10T
目前对于阿糖腺苷生物合成的研究报道仅S.antibioticus一株链霉菌,未见其他生物合成途径的报道。本研究同时还分析了菌株S10T的次级代谢产物LC-HR-MS谱,从中并未找到喷司他丁的相对分子质量,这说明菌株S10T仅能合成阿糖腺苷而不合成喷司他丁。因此可以证实菌株S10T中确实存在着与报道完全不同的阿糖腺苷合成途径。
本研究从柴达木沙漠链霉菌S10T分离的化合物组分中发现,除阿糖腺苷外,其他组分对金黄色葡萄球菌和藤黄微球菌均具有抑菌活性,与阳性对照卡那霉素相比具有更高的抑菌效价。这也说明柴达木沙漠链霉菌S10T具有非常强大的抑菌活性产物合成能力,相关的生物活性还有待挖掘,以期能够发现更多的活性天然产物。