维拉帕米对铜绿假单胞菌群体感应抑制作用的体外研究
2022-10-10胡庭刚晏子俊伍晓萍吴贤丽夏靓婧
胡庭刚,晏子俊,伍晓萍,吴贤丽,夏靓婧,陈 彤*
(1.攀枝花市第三人民医院,四川 攀枝花 617002;2.昆明医科大学药学院暨云南省天然药物药理重点实验室,云南 昆明 650500;3.攀枝花市中心医院,四川 攀枝花 617067;4.山东第一医科大学(山东省医学科学院) 药物研究所,山东 济南 271016)
细菌耐药性已成为全球面临的问题,现有抗生素已无法满足临床治疗需求[1]。铜绿假单胞菌(Pseudomonasaeruginosa,PA)是医院内重要的条件致病菌,可产生毒力因子及生物被膜而引起各种感染,现已被认作是医院的主要病原菌。2021年上半年中国CHINET耐药菌种分布结果显示,PA占临床总分离率7.47%,排在第5位。PA具有超强耐药性[2-3],其耐药机制包括群体感应(Quorum sensing,QS)、产生修饰酶或灭活酶、主动外排、外膜孔蛋白缺失或通透性降低等[5-7],多重耐药PA的出现,使得临床治疗变得越来越棘手,严重威胁人类健康[4]。因此,探究抗菌新策略对治疗PA感染刻不容缓。QS是细菌细胞密度依赖的一种基因表达现象[8],有受体蛋白、合成酶蛋白参与,合成酶蛋白产生N-酰基高丝氨酸内酯(AHL)作为自体诱导物(AIs),当AIs密度达阈值时可与受体蛋白结合,启动相关基因转录[9],激活特定信号分子调控特定基因表达,促进细胞适应外界环境,协调细菌群体产生耐药性、免疫逃逸、生物被膜、毒力因子等,发挥致病作用[10]。Reuter等[11]研究证实PA的QS与其致病力密切相关。王帅涛等[12]研究表明PA生物被膜受QS调控。Soukarieh等[13]研究表明PA的QS与耐药性相关。因此,细菌QS可作为药物作用靶点,研发QS抑制剂从而发挥抗菌增效作用[14-16]。诸多学者一直致力于QS抑制剂的研发。现有QS抑制剂根据来源分为天然、合成化合物及临床已有药物,其中天然化合物有人参[17]、丁香油[18]等植物来源的提取化合物,合成化合物有呋喃酮类[19]、低分子量海藻酸盐低聚物[20]等,临床已有药物有多尼培南[21]、氯硝柳胺[22]等。研究发现,QS抑制剂与传统抗菌药物不同,作用机制特殊,较少出现耐药,具有增效作用,有效缓解PA耐药[23-24]。维拉帕米作为一种钙离子拮抗药物,临床应用广泛,尝试将其开发作为QS抑制剂的潜在药物,可充分发挥老药新用的优势,减少未知风险的发生,对发现新的QS抑制剂有重要意义。因此,本研究首次以钙离子拮抗药中的维拉帕米作为QS抑制剂,对维拉帕米抑制PA的QS进行体外研究,以明确维拉帕米是否具有抗菌增效作用及其可能机制,为研发抗菌增效药物提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株 铜绿假单胞菌(Pseudomonaaeruginosa,PA)标准菌株(ATCC27853)购自四川省临床检验中心,由攀枝花市中心医院中心实验室保存。
1.1.2 培养基 ①LB肉汤培养基(生工生物工程);②M-H肉汤培养基(郑州安图生物)。
1.1.3 主要试剂与仪器设备 维拉帕米(中国药品检验总所),纯度>99.9%;脱脂奶粉(英国oxoid);弹性酶-刚果红(ECR)(美国Sigma-Aldrich);琼脂粉(英国oxoid);DMSO(科隆化学品);其他试剂均为西亚试剂。细菌多点接种仪(MIT-P,日本SAKUMA);比浊仪(DensiCHEK,法国生物梅里埃);酶标仪(SUNRISE,九州通医药集团);生化培养箱(HPS-400B,北京东联哈尔);万分之一分析天平(ESJ200-4,沈阳龙腾电子);电热鼓风干燥箱(101-4AS,北京市永光明医疗);超声波清洗机(SB25-12DT,宁波新芝生物科技)。
1.2 方法
1.2.1 体外药敏试验 参考谭丽等[25]方法测定最小抑制浓度(Minimal inhibit concentration,MIC)。按照CLSI M100-S21[26]的要求,将PA转种平板,分离纯化,挑取过夜菌落接种,调整浊度至0.5麦氏浊度单位(1×108cfu/mL),采用M-H肉汤将其稀释为1×106cfu/mL菌液。选用倍比稀释法制备维拉帕米溶液,用M-H肉汤将其稀释至质量浓度分别为0.5、1、2、4、8、16、32、64、128、256、512 μg/mL。将稀释的维拉帕米药液与1×106cfu/mL的PA菌液按同等体积混匀,于96孔板中各加入100 μL上述混合液,作为实验孔。取M-H肉汤每孔100 μL,各浓度组分别设置3个平行孔做为对照。将加样后的微孔板于振荡器混匀,生化培养箱35 ℃培养48 h。600 nm处酶标仪测各孔吸光度值A600。PA未生长的孔含有的药物浓度即为MIC。
1.2.2 生长曲线的绘制 调整菌液浊度至0.5麦氏浊度单位,再用M-H肉汤稀释得5×104cfu/mL菌液。倍比稀释法制备维拉帕米溶液,用M-H肉汤稀释质量浓度至4、8、16、32、64、128、256、512 μg/mL。参照1.2.1中实验组设置方法,于加样后0、1.5、3、4、6、8、10、12、14、16、18、20、22、24 h测定A600。以时间(h)为横坐标,A600为纵坐标,绘制维拉帕米作用PA的24 h生长曲线。
1.2.3 维拉帕米对PA毒力因子表达的影响实验①维拉帕米菌液的制备:调整菌液浊度至0.5麦氏浊度单位,再用M-H肉汤稀释得到5×104cfu/mL的菌液。倍比稀释法制备维拉帕米溶液,用M-H肉汤稀释质量浓度至8、16、32、64、128、256、512 μg/mL。参照1.2.1中实验组设置方法,制得含维拉帕米质量浓度分别为4、8、16、32、64、128、256、512 μg/mL的菌液,有氧条件下培养24 h,测A600。②维拉帕米对PA弹性蛋白酶表达的影响:取适量①中的含药菌液,12 000 r/min、4 ℃离心8 min。移液枪取上清液经0.22 μm有机滤膜过滤,将滤液与ECR缓冲液按同体积比例混匀,于垂直混合仪15 r/min、37 ℃反应16 h,加入适量EDTA (120 mmol/L) 溶液,置于冰上10 min,终止反应。再于2 000 r/min、4 ℃离心8 min,取150 μL上清液加入96孔板,酶标仪测定A495。设置菌液对照组和0.5% DMSO对照组,各浓度组设置3个平行孔。A495/A600比值表示弹性蛋白酶活性。③维拉帕米对PA蛋白水解酶表达的影响:取适量①中的含药菌液,经0.22 μm有机滤膜过滤,取滤液150 μL置于含小孔的脱脂牛奶琼脂平板,37 ℃反应24 h。设置菌液对照组和0.5% DMSO对照组,各浓度组设置3个平行孔。反应24 h后,小孔出现透明圈,测定其直径L,L/A600比值即为蛋白水解酶活性。④维拉帕米对PA绿脓毒素表达的影响:取适量①中的含药菌液,8 000 r/min、25 ℃离心10 min后,移液枪取4 mL上清液,加入3 mL CHCl3,混匀,放置5 min,于8 000 r/min、25 ℃离心5 min,取2.5 mL的CHCl3层,加入一定量HCl,混匀,放置5 min,再于8 000 r/min、25 ℃离心5 min后,取HCl层测A520。设置菌液对照组和0.5% DMSO对照组,各浓度组设置3个平行孔。A520/A600比值表示菌液中绿脓毒素的含量。
2 结果与分析
2.1 维拉帕米体外抗PA的最低抑菌浓度
对照组(0.5% DMSO、M-H肉汤)中PA生长良好,表明无抗菌作用。维拉帕米抗PA的MIC90为512 μg/mL,见表1。

表1 维拉帕米体外抗PA的最低抑菌浓度(n=3)Table 1 The results of verapamil against PA activity(n=3)
2.2 维拉帕米体外影响PA的生长曲线
由图1可知,对照组(0.5% DMSO)对PA的生长无影响。加样3 h后,当维拉帕米质量浓度为512 μg/mL时,明显抑制PA生长(P<0.01);加样4 h后,当维拉帕米质量浓度为256、128、64 μg/mL时,对PA生长的抑制作用明显(P<0.01);加样8 h后,当维拉帕米质量浓度为32、16 μg/mL时,对PA生长中期具有一定的抑制作用(P<0.05)。当维拉帕米质量浓度为8、4 μg/mL时,对PA的生长无明显抑制作用。
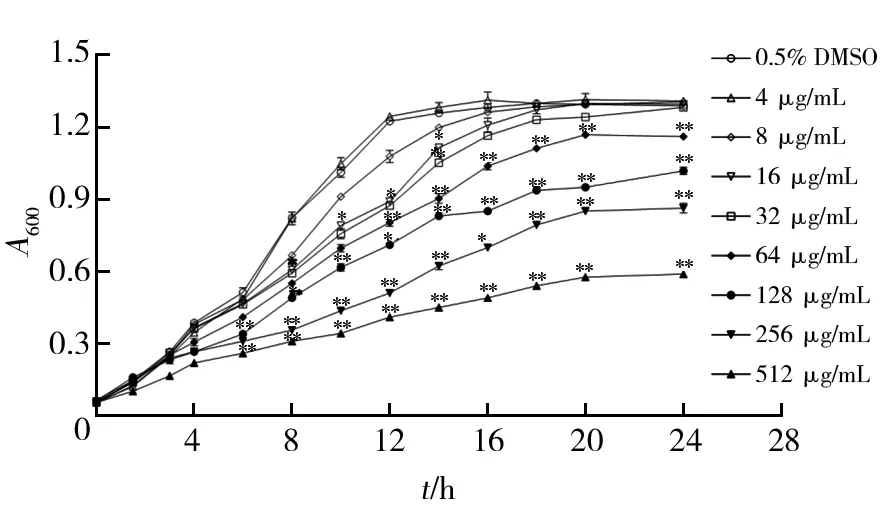
图1 维拉帕米体外影响PA 的生长曲线Fig.1 The growth curve of verapamil on PA n=3)与对照组相比,*P<0.05;**P<0.01,下图同VS.control group,*P<0.05;**P<0.01,the same below
2.3 维拉帕米对PA毒力因子表达的影响
2.3.1 维拉帕米对PA弹性蛋白酶表达的影响 由图2可知,两组对照组对PA的弹性蛋白酶均无影响。与菌液对照组相比,维拉帕米质量浓度为256、128、64、32、16 μg/mL时,可明显抑制弹性蛋白酶的表达(P<0.01),8 μg/mL时也可抑制弹性蛋白酶的表达(P<0.05),且表现出浓度依赖性。维拉帕米质量浓度为4 μg/mL时对弹性蛋白酶无抑制作用。
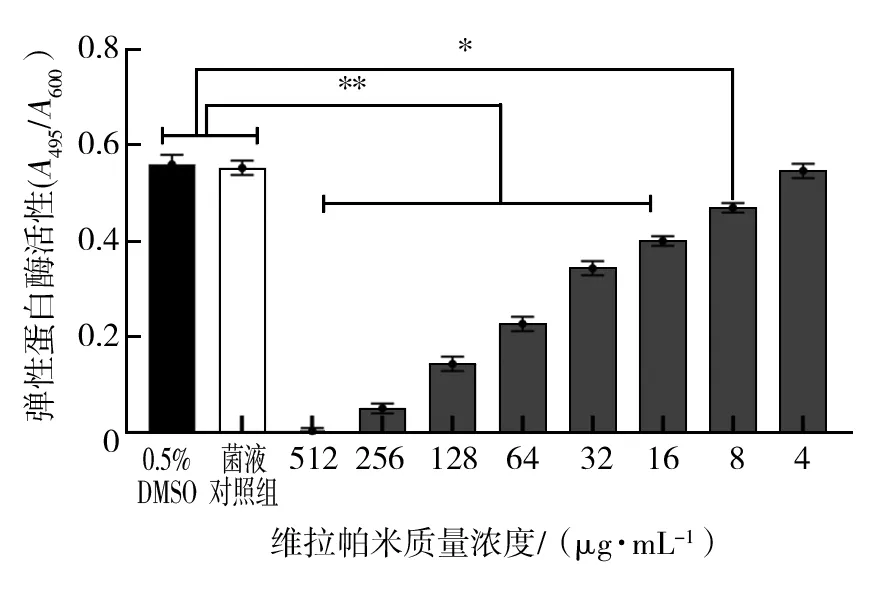
图2 维拉帕米对PA弹性蛋白酶的影响Fig.2 Effect of verapamil on expression
2.3.2 维拉帕米对PA蛋白水解酶表达的影响 由图3可知,两组对照组对PA的蛋白水解酶均无影响。与菌液对照组相比,维拉帕米质量浓度为512、256、128、64、32 μg/mL时,明显抑制蛋白水解酶的活性(P<0.01),质量浓度为16 μg/mL时,对蛋白水解酶也有抑制作用(P<0.05),抑制作用有浓度依赖。维拉帕米质量浓度为8、4 μg/mL时对蛋白水解酶活性无抑制作用。
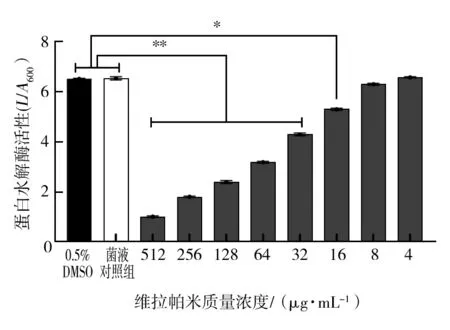
图3 维拉帕米对PA蛋白水解酶表达的影响Fig.3 Effect of verapamil on the expression of PA proteolytic enzymes n=3)
2.3.3 维拉帕米对PA绿脓毒素表达的影响 由图4可知,两组对照组对PA绿脓毒素的表达无明显影响。与菌液对照组相比,维拉帕米质量浓度为512、256、128、64、32 μg/mL时,对绿脓毒素有明显抑制(P<0.01),浓度为16 μg/mL时,也有一定的抑制作用(P<0.05),抑制作用有浓度依赖。维拉帕米质量浓度为8、4 μg/mL时对绿脓毒素无抑制作用。
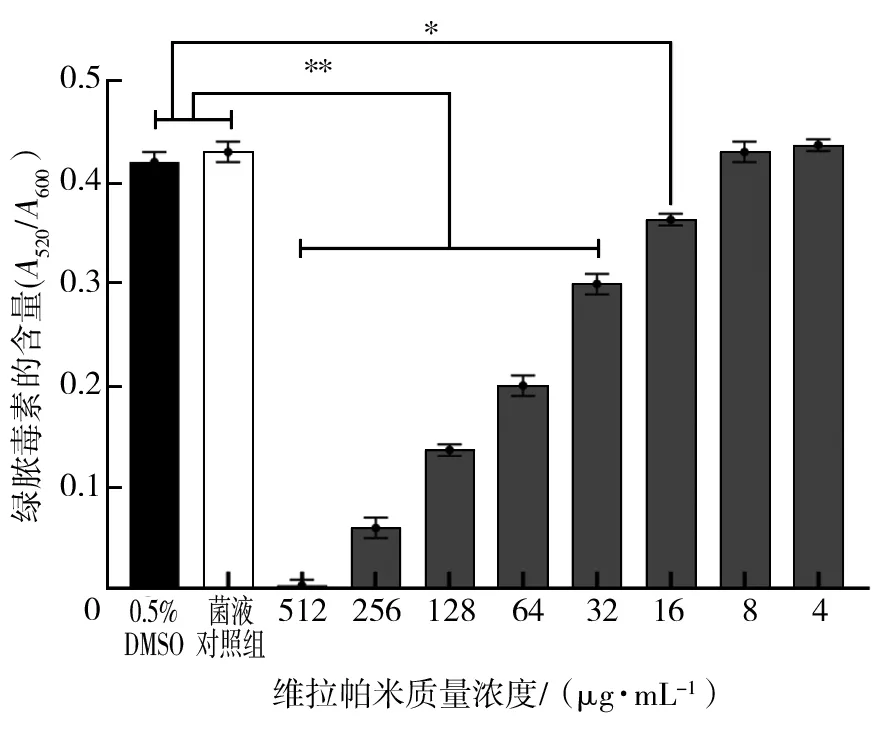
图4 维拉帕米对PA绿脓毒素表达的影响Fig.4 Effect of verapamil on expression of PA green pyotoxin n=3)
3 讨 论
研究细菌毒力因子表达解决药物耐药性,已逐渐成为当前抗感染治疗研究领域的热点[1,27-28]。PA耐药机制复杂,具有多系统参与、耐药率高的特点,临床培养常为多重耐药菌,难治愈[29-31]。现有文献表明抗PA感染包括干扰或影响毒力因子表达、破坏细菌黏附、抑制铁代谢过程、干扰药物外排泵、调节宿主免疫、影响生物被膜形成及抑制细菌QS系统等方法[32-33],而抑制PA的QS可有效抑制其毒力因子表达[34-35]。
维拉帕米是罂粟碱衍生物,为苯烷胺类钙离子拮抗药,常用于心绞痛、心律失常及原发性高血压等治疗,本身无抗菌活性,但其对PA可能具备抑制细菌QS的作用。在本研究测定维拉帕米MIC实验中,当维拉帕米质量浓度为128 μg/mL时可抑制50%菌株生长,MIC90为512 μg/mL,最低抑菌浓度范围为128~512 μg/mL。与地尔硫卓(MIC90>512 μg/mL[10])相比,维拉帕米抗菌活性稍好;与硝苯地平(MIC90为256 μg/mL[4])相比,维拉帕米抗菌活性稍差。维拉帕米体外对PA生长曲线的影响表明,维拉帕米质量浓度为16 μg/mL时,开始表现出对PA生长的抑制,随着浓度增加,抑制作用逐渐增大。上述结果表明维拉帕米对PA有抑制作用,初步明确维拉帕米可能具有抑制QS的作用。
研究证实PA毒力因子的表达与QS密切相关[10,36]。QS参与PA特定基因的调控,可影响PA的弹性蛋白酶、蛋白水解酶、绿脓毒素表达[37]。本研究中,当维拉帕米质量浓度为8 μg/mL时,开始表现出抑制弹性蛋白酶的活性,而16 μg/mL时明显抑制。当维拉帕米质量浓度为16 μg/mL时,开始表现出抑制蛋白水解酶的活性和绿脓毒素的表达,而32 μg/mL时,明显抑制。可能原因为QS由特异性受体和AIs组成,而PA的膜蛋白具备类似真核生物ESCRT-III蛋白的钙信号转导系统,该系统可根据外界环境刺激调节胞内外钙离子浓度,胞内钙离子可与AIs的特异受体结合,特异受体与AIs结合位点暴露,从而增加毒力因子表达[38-39]。研究还表明钙离子参与细菌自身生理活性调控,一定程度上可增强细菌运动迁移能力,改变细菌鞭毛运动方向,影响生物被膜形成[40-41]。因此,虽未发现低浓度维拉帕米具有抑制PA生长的作用,但其可能影响钙离子分布,从而一定程度上抑制QS,影响毒力因子表达和生物被膜形成。上述研究表明,维拉帕米可影响弹性蛋白酶、蛋白水解酶、绿脓毒素的表达,进一步明确维拉帕米具有抑制QS的作用。
本研究通过体外研究明确了维拉帕米具有抑制QS的作用,而维拉帕米与抗菌药物联用是否能发挥协同抗菌作用,是否增加细菌对抗菌药物敏感性等问题有待进一步研究,并为研发新型抗菌制剂提供参考。