微生物菌肥对寒地大豆根围土壤细菌群落和产量的影响
2022-10-10胡基华陈静宇张淑梅吴皓琼
胡基华,李 萌,曹 旭,陈静宇,姜 威,张淑梅,李 晶,2,吴皓琼*
(1.黑龙江省科学院 微生物研究所,黑龙江 哈尔滨 150010;2.黑龙江省科学院 高技术研究院,黑龙江 哈尔滨 150020)
大豆(Glycinemax)是重要的粮食作物和经济作物,在食用、饲用、工业等方面用途广泛,也是世界上蛋白质和油脂最重要的来源之一[1],国内外市场对大豆需求很大。2017年农业部在《全国种植业结构调整规划》中明确指出,调整和优化东北春大豆种植业结构,因地制宜扩种大豆,但是目前仍存在供不应求的现象[2-3]。东北地区受气候限制,大豆一年一季,为了追求产量而大量施用化肥,导致土壤有机质含量下降和土壤酸化,对当前农业的可持续发展造成了严重威胁。微生物菌肥作为一种新型绿色肥料,能有效提高土壤肥力和增加作物产量。微生物菌剂可以提高玉米[4]、水稻[5]、棉花[6]、烤烟[7]、番茄[8]和芥菜[9]等作物的产量和品质,复合微生物菌肥配施化肥可以提高生菜可溶性糖和维生素C含量[10],提高产量的同时还降低了番茄的总酸和硝酸盐含量,使品质更佳[11];同时能改良土壤环境,有降低水体和土壤磷污染风险的功能[9]。微生物菌肥还可以有效缓解农作物因连作和工业化肥滥用产生的问题,起到良性调节作用,产生正向效果[12]。研究表明胶冻样类芽胞杆菌(Paenibacillusmucilaginosus)和巨大芽胞杆菌(Bacillusmegaterium)具有解钾和解磷的作用,有效促进土壤中矿物态钾、磷的释放,修复污染土壤,促进作物生长的作用[13-14];解淀粉芽胞杆菌(Bacillusamyloliquefaciens)具有抗病促生长,提高土壤酶活性改善理化性质的作用[15-16],枯草芽胞杆菌(Bacillussubtilis)在田间作为大豆、玉米、马铃薯等农作物的种肥和底肥,具有抗病、抗逆、增产且有效降解药害的作用[17-18]。农田土壤微生物多样性是维持土壤健康和土壤质量的关键[19-21]。土壤微生物群落组成和生物学活性受土壤、施肥、作物枯枝落叶降解以及根系分泌物影响,参与土壤养分转化、有机质分解以及维持养分平衡的物质循环过程。因此,了解土壤微生物群落结构和生物活性,不仅是对土壤肥力的评价过程,也是解析农田生态系统物质循环机制的重要途径。土壤中的细菌对于土壤的氮磷循环、养分吸收、稳定土壤生态系统、保存土壤肥力等方面具有至关重要的作用[22-24]。本研究在东北大田条件下,通过减施化肥配施微生物菌肥以大豆荚期根围土壤为研究材料,采取 Illumina MiSeq 高通量测序技术,对根围土壤细菌群落结构组成、丰度特征及差异变化进行研究,揭示了施肥方式对大豆根围细菌群落和多样性的影响。对大豆生长指标和产量进行测定,为进一步制定合理科学的施肥方案、构造优良的作物生长环境提供参考,以期达到不增加生产成本的前提下提升农作物产量、保护黑土地的目的。
1 材料与方法
1.1 材料
1.1.1 菌株 解淀粉芽胞杆菌(Bacillusamyloliquefaciens)、胶冻样类芽胞杆菌(Paenibacillusmucilaginosus)和巨大芽胞杆菌(Bacillusmegaterium),由黑龙江省科学院微生物研究所生物工程重点实验室分离保存。
1.1.2 试验材料 ①微生物菌肥:福太尔微生物颗粒剂(枯草芽胞杆菌Bacillussubtilis5×108cfu/g)和福太尔微生物复合颗粒剂(解淀粉芽胞杆菌、胶冻样类芽胞杆菌和巨大芽胞杆菌 5×108cfu/g,三种菌有效活菌数的比例为8∶1∶1),由黑龙江龙泰生物技术开发有限公司提供。大豆专用肥掺混肥N14-P24-K13,由同江市测土配方施肥配肥站提供。②大豆品种:大豆品种为当地主推品种“合农69”。③土样采集:大豆荚期每个田间试验小区随机在3株大豆根围3~5 cm处取土样30 g,每个小区的3份土样混装在一个袋中,将土壤样品过80目筛,去除植物杂质,每组样品3个重复,存放于-80 ℃超低温冰柜,备用。④作物生长指标测定:大豆成熟期每个小区随机选取10株测量株高、荚数和粒数,各处理小区籽粒晒干后测产。
1.1.3 主要试剂与仪器设备 氯化钠、磷酸氢二钾、无水乙醇等常规药品;Biosharp BS-90-D培养板(北京兰杰柯科技有限公司)。智城超净工作台(ZHJH-C1115C,北京中仪友信科技有限公司);振荡培养箱(ZQLY-300V,上海知楚仪器有限公司);德国赛多利斯高速冷冻离心机(Sigma 3-18K,上海创未生物技术有限公司);METTLER TOLEDO pH计(FE28,梅特勒-托利多仪器(上海)有限公司);紫外可见分光光度计(Spectrum SP-1920,上海圣科仪器设备有限公司);英国NEW BRUNSWICK超低温冰柜(Premium U410,北京盛科信德科技有限公司)。
1.2 方法
1.2.1 试验方法 实验在黑龙江省同江市三村镇三村村进行,实验地点土壤有机质35 g/kg,全氮154 mg/kg,土壤有效磷25 mg/kg,速效钾83.7 mg/kg,pH值6.3,前茬作物为大豆。采用田间小区试验,每个小区20 m2,每个处理3次重复,随机排列。共设置6个处理:ck为空白对照(不施肥);cf为施用大豆专用肥N14-P24-K13(施肥量20 g/m2);cfb为减施15%化肥配施福太尔微生物颗粒剂(化肥/福太尔微生物颗粒剂=17 g/6 g);cm为单施福太尔微生物复合颗粒剂(6 g/m2);cfm为减施15%化肥配施福太尔微生物复合颗粒剂(化肥/福太尔微生物复合颗粒剂=17 g/6 g);b为单施福太尔微生物颗粒剂(6 g/m2),每个小区用量120 g(6 g/m2),大豆专用肥掺混肥N14-P24-K13(30 g/m2)随种子一起下地,播种时一次性施用。其他田间管理措施均与当地大田生产一致。
1.2.2 16S rDNA提取与检测 微生物DNA的提取根据QIAamp DNA Mini kit(Qiagen)用户指导手册的方法进行。对于抽提完成的DNA,利用0.8%琼脂糖凝胶电泳进行分子大小判断,紫外分光光度计对DNA进行定量。鉴于多样性项目的特殊性,上述两个检测方法仅供参考,样品质量是否合格以后续 PCR 是否能够扩增出有效的目标条带为准。
1.2.3 PCR扩增细菌16S rDNA基因功能基因的不同区域 PCR扩增选用细菌16S rDNA V3~V4区特异性引物[25],338F (5′-ACTCCTACGGGAGG-CAGCA-3′),806R(5′-GGACTACHVGGGTWTCTAAT-3′)。程序:98 ℃(30 s),25~27cycles:98 ℃(15 s),50 ℃(30 s),72 ℃(30 s),72 ℃(5 min)。扩增结果进行2%琼脂糖凝胶电泳,切取目的片段,然后用Axygen凝胶回收试剂盒回收目的片段。
1.2.4 文库构建、质检和测序 利用Illumina公司的TruSeq Nano DNA LT Library Prep Kit建库。利用试剂盒中的 End Repair Mix2进行末端修复,将DNA 5′端突出的碱基切除,3′端缺失的碱基补齐,同时在5′端加上一个磷酸基团,通过2%琼脂糖凝胶电泳对文库做最终的片段选择与纯化。在 Agilent Bioanalyzer机器上用Agilent High Sensitivity DNA Kit对文库做2100质检,利用 Quant-iTPicoGreen dsDNA Assay Kit在Promega QuantiFluor上对文库进行定量,浓度在2 nmol/L 以上合格的文库在 MiSeq 机器上利用MiSeq Reagent Kit V3(600 cycles)进行2×300 bp的双端测序。利用UPARSE[26]以97%序列一致性(Identity)进行聚类,序列拼接使用软件 FLASH(Fast Length Adjustment of Short reads,v1.2.11)[27],利用重叠关系将双末端测序得到的成对reads组装成一条序列,得到高变区的Tags。
1.2.5 数据分析 通过fastq-join软件,得到高变区的Tags。聚类分析通过QIIME(v1.9.1)软件进行,使用所有样品中序列数最少的样品序列数的75%进行抽样分析,迭代100次之后综合统计得到最终的聚类树。QIIME软件[28]对OTU进行物种分类并分别在门、纲、目、科、属几个分类等级对各个样品做物种profiling面积图和柱状图。OTU代表序列使用pynast与 greengene数据库比对,Beta多样性通过QIIME(v1.9.1)进行,LeFSe分析利用在线分析网站 http://huttenhower.sph.harvard.edu/galaxy/进行,数据处理采用Excel 2007和SPSS 17.0软件进行分析。
2 结果与分析
2.1 不同施肥处理大豆的生长性状
由表1可知,几种处理中,cf、cm和b处理对株高影响较大,但差异不明显;cf处理对荚数和粒数的影响最大,cm和b处理最小;产量cfb处理为最高值(2 995.55±445.16) kg/hm2,cm、b和ck处理相对较低。增长百分比分别为3.39%(ck)、4.72%(cf)、3.29%(cfm)、76.48%(cm)和51.74%(b),cfm处理的产量为(2 900.0±699.48) kg/hm2,为各处理中第二高值,比cf处理提高了1.38%,结果表明,减施化肥配施微生物菌肥可以达到保产增收的作用。
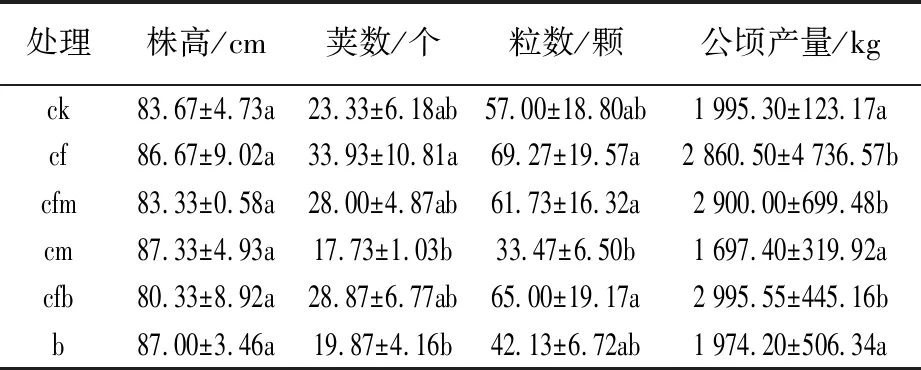
表1 不同施肥处理大豆生长性状比较Table 1 Comparison of Glycine max growth traits under different fertilization modes
2.2 不同处理土壤微生物群落丰度及多样性
6 种处理 3 个重复共 18个样本,共获得 581 170 条高质量序列。平均每个样本 32 287条;Tag 平均长度为 415 bp。土壤细菌覆盖度(coverage) 指数为 0.909 8~1.000,测序数据量合理,测序数据基本涵盖土壤中所有细菌类群,能体现土壤环境中细菌特征。按97%相似度进行归并共产生23 902个OTU,多样性Simpson指数最高值为cm处理(0.99±0.001),Shannon指数最高值为ck (8.315±0.031);丰富度Chao1指数显示最高值为cfm处理(1 776.07±56.336);可视物种observed_species最高值为ck (1 343.533±20.608)。几种指数的最低值均为cfb处理,分别为(0.983±0.003)(simpson)、(7.629±0.155)(shannon)、(1 482.041±8.407)(chao1)和 (1 099.533±28.405)(observed_species)(表2)。
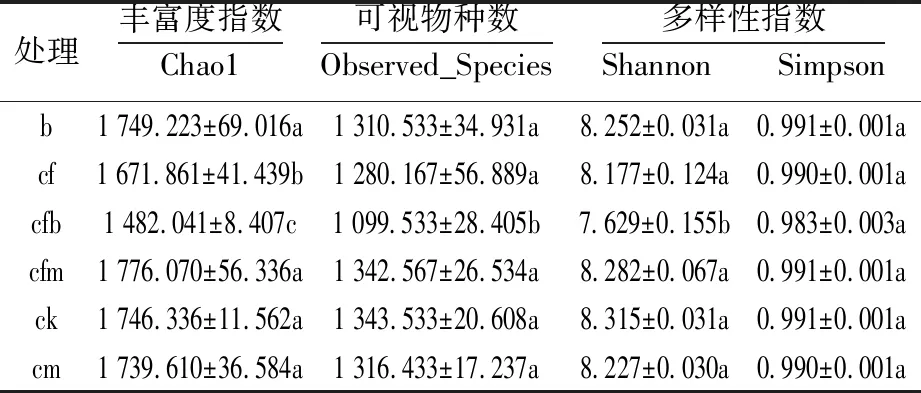
表2 Alpha 多样性指数Table 2 Alpha diversity index
基于OTU样品PCA(Principal Component Analysis) 分析结果显示,6组样品分为两大组,cf和cfb为一组,ck、b、cfm和cm为另一组(图 1)。由此可见,同一种地块相同作物不同施肥方式,对根围细菌群落组成产生一定的影响。
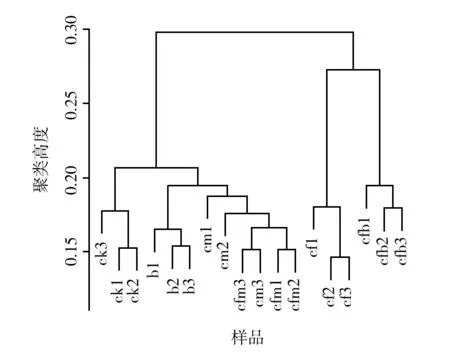
图1 不同处理土壤微生物群落丰度及多样性 PCoA 分析图Fig.1 The PCoA Analysis diagram of soil microbial community abundance and diversity in different treatments
2.3 不同处理根围土壤细菌群落组成
18个样本中共注释 20个门,82个纲,179个目,299个科,509个属。门水平丰度大于1%的有8个,分别为放线菌门(Actinobacteria,34.38%)、变形菌门(Proteobacteria,31.52%)、酸杆菌门(Acidobacteria,13.63%)、绿弯菌门(Chloroflexi,6.63%)、芽单胞菌门(Gemmatimonadetes,5.90%)、拟杆菌门(Bacteroidetes,1.82%)、Patescibacteria(1.80%)和WPS-2(1.62%)(图 2 A)。其中cfb处理的优势菌门为变形菌门,其他几个处理的优势菌门为放线菌门。目、科和属水平未鉴定属为优势属,占比25.23%(图2B),大于1%的有26个,分别为Gaiellales/Other(7.38%)、酸杆菌目(Acidobacteriales/Other,6.75%)、Frankiales/Other(4.43%)、鞘脂单胞菌属(Sphingomonas,3.95%)、嗜酸栖热菌属(Acidothermus,3.54%)、芽单胞菌属(Gemmatimonas,3.25%)、罗河杆菌属(Rhodanobacter,3.16%)、慢生根瘤菌属(Bradyrhizobium,2.70%)、芽单胞菌科(Gemmatimonadaceae/Other,2.59%)、链霉菌属(Streptomyces,2.58%)、CandidatusSolibacter(2.55%)、黄杆菌科(Xanthobacteraceae/Other,2.18%)、褚氏杆菌属(Chujaibacter,2.03%)、AD3/Other(1.67%)、WPS-2/Other(1.62%)、Saccharimonadales/Other(1.61%)、IMCC26256/Other(1.57%)、Ellin6067(1.41%)、Jatrophihabitans(1.36%)、SC-I-84/Other(1.31%)、芽生球菌属(Blastococcus,1.16%)、苔藓杆菌属(Bryobacter,1.12%)、Haliangium(1.10%)、Micropepsaceae/Other(1.04%)、锥杆菌属(Conexibacter,1.03%)和Elsterales/Other(1.02%)。其中褚氏杆菌属是cfb处理的优势属,酸杆菌目/Other是ck的优势目,Gaiellales/Other是其他4种处理的优势属(图2B)。
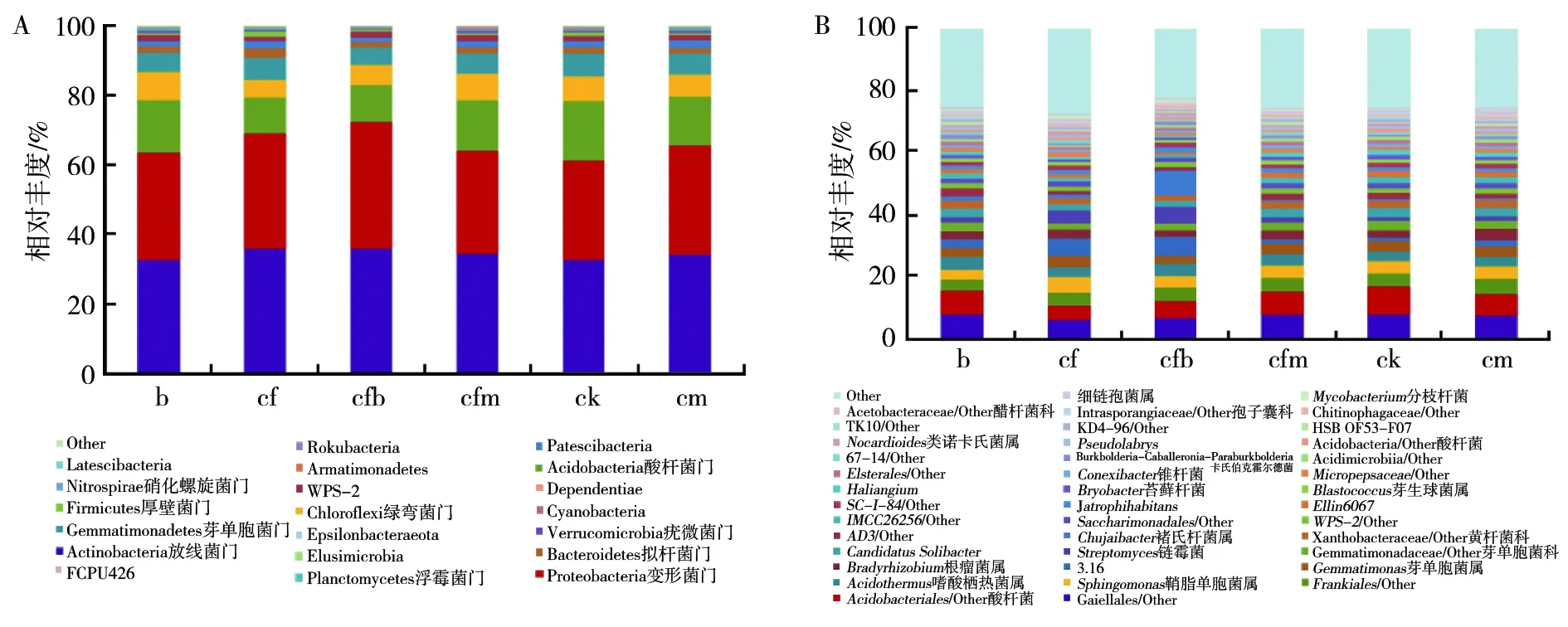
图2 物种 profiling 面积图和柱状图 Fig.2 Species profiling area chart and histogramA:门水平物种柱状图;B:属水平物种柱状图。每根柱子代表一个样品,一个颜色代表一个分类,色块的高度代表各物种分类的丰度A:Histogram of phylum horizontal species;B:Histogram of genus horizontal species.Each column represents a sample,a color represents a category,and the height of the color block represents the abundance of each subject category
2.4 属水平样本间差异比较
属水平Heatmap热图分析结果显示,高丰度菌属有芽单胞菌属、鞘脂单胞菌属、嗜酸栖热菌属、念珠菌固体杆菌属(CandidatusSolibacter)、慢生根瘤菌属、链霉菌属、罗丹杆菌属(Rhodanobacter)、褚氏杆菌属、锥杆菌属、芽生球菌属、Bryobacter、Haliangium、Jatrophihabitans、Ellin6067(图3);低丰度菌属有节杆菌属(Arthrobacter)、单胞菌属、厌氧黏细菌属(Anaeromyxobacter)、根瘤菌属(Rhizobium)等23个属(图3)。cf和cfb处理丰度高的菌群有链霉菌和罗丹杆菌,cf气微菌属(Aeromicrobium)丰度高于其他处理,cfb 处理中褚氏杆菌属丰度高于其他处理;ck处理的MND1菌属丰度高于其他处理,同时重生放线菌属(Actinospica)低于其他处理;对每种处理高丰度和低丰度菌属进行统计(P﹤0.05),结果显示,cfb 与 cf 丰度具有相似性,cm和cfm具有相似性,与PCA和PCoA分析结果相对应。芽胞菌属在低丰度区,几种处理丰度分别为0.002 007(b)、0.001 522(cf)、0.002 530(cfb)、0.001 847(cfm)、0.002 075(ck)和0.001 905(cm)。cf处理显示值最低,而减施化肥15%配施福太尔微生物颗粒剂(cfb)处理的值最高。
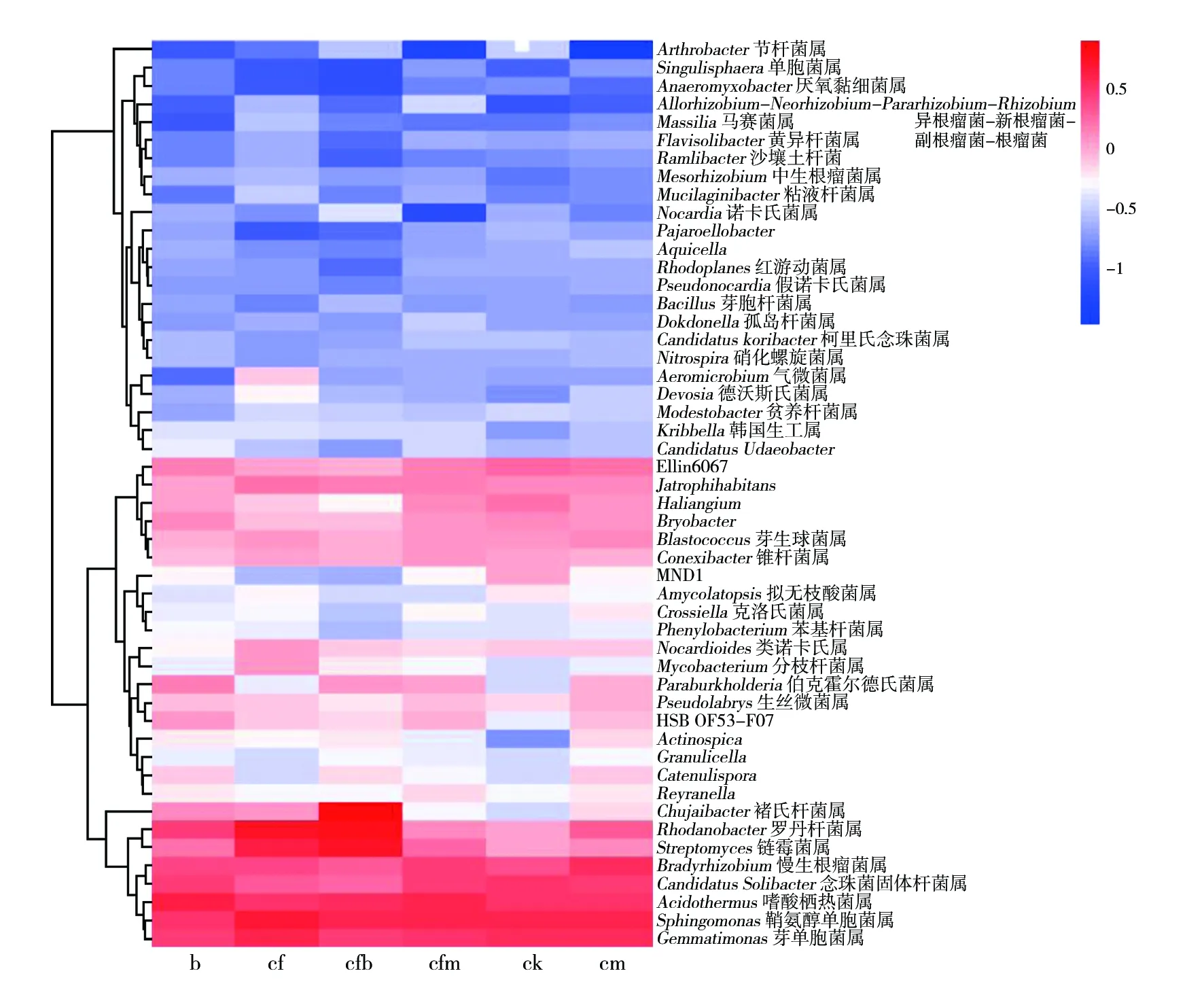
图3 属水平Heatmap物种分析热图Fig.3 Species analysis heat map of the genus-level Heatmap根据每个物种在每个样品的相对丰度进行物种热图分析,横向聚类表示该物种在各样品丰度相似情况,距离越近,枝长越短,说明两物种在各样品间的组成越相似。红色代表高丰度,蓝色代表低丰度Perform species heat map analysis based on the relative abundance of each species in each sample.Horizontal clustering means that the species is similar in abundance in each sample.The closer the distance,the shorter the branch length,indicating that the two species are between each sample.The more similar the composition.Red represents high abundance and blue represents low abundance
为进一步统计6组之间的差异性,利用LEfSe分别检测了LDA分值大于3.0的显著差异物种(图4)。如图4所示,与各组相比cm组α-变形菌门(Alphaproteobacteria)丰度较高,克洛氏菌属(Crossella)、Pseudolabrys、Diplorickettsiaceae丰度均显著增高;ck组酸杆菌门丰度较高,苔藓杆菌属(Bryobacter)丰度显著增高;cfm组Reyranellales显著增高;cfb组变形菌门丰度较高,褚氏杆菌属、罗丹杆菌属、链霉菌属、卡斯特兰尼氏菌属(Castellaniella)丰度显著增高,与其他处理差异明显;cf组放线菌门丰度较高,鞘脂单胞菌属、分枝杆菌属(Mycobacterium)、类诺卡氏菌属(Nocardioides)、气微菌属(Aeromicrobium)、黄杆菌属(Flavobacterium)、德沃斯氏菌属(Devosia)丰度显著增高;b组绿弯菌门丰度较高,嗜酸栖热菌属、细链孢菌属(Catenulispora)丰度显著增高。
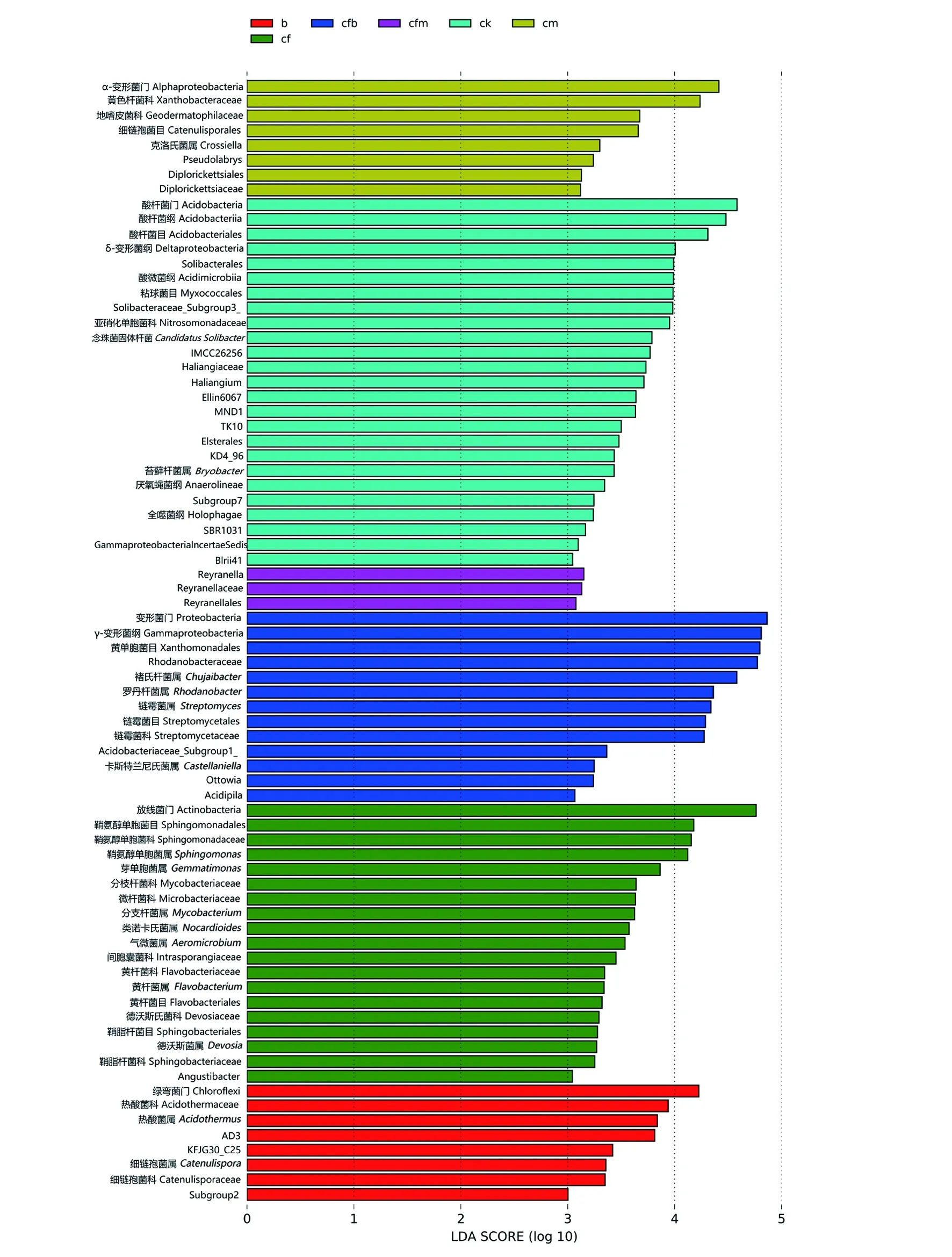
图4 以LEfSe算法计算各组中有显著差异的微生物群落Fig.4 Microbial communities with significant differences in each group calculated by LEfSe algorithmLDA score 大于预设值的显著差异物种,默认分值为 3.0,超过该值差异显著。柱状图的长短代表的是 LDA score,即不同组间显著差异物种的影响程度,该值越大,差异越大the figure shows the significantly different species whose LDA score is greater than the preset value.The default score is 3.0,and the difference beyond this value is significant.The length of the histogram represents the LDA score,that is,the influence degree of significantly different species among different groups.The greater the value,the greater the difference
3 讨 论
本研究通过减施化肥配施微生物菌肥,研究了不同施肥方式对大豆生长指标和根围微生物多样性组成的影响。实验结果显示,株高最高值为cm处理,(87.33±4.93)cm,最低值为cfb处理,(80.33±8.92)cm;荚数和粒数的前三位分别为cf、cfb和cfm,最低值为cm处理;产量最高为cfb处理,(2 995.55±445.16)kg/hm2,最低值为cm处理,(1 697.40±319.92)kg/hm2,产量从高到低排序为cfb>cfm>cf>ck>b>cm(表1)。株高与公顷产量呈负相关,荚数和粒数与产量呈正相关。减施化肥配施福太尔微生物颗粒剂(cfb)可以有效提高大豆的产量,这与对芥菜的研究结果相一致[9]。
存在于土壤中的微生物群落是评价根围土壤质量的指标之一,土壤微生物区系内类群丰富多样、代谢活跃是土壤健康的表现[29]。在农业生产中,微生物的作用和应用越来越受到关注。大豆荚期是大豆营养生长和生殖生长并重期,水分和养分需求的高峰期,对荚期土壤进行高通量测序可以快速全面地分析大豆根围土壤微生物的群落结构[30-31]。本研究中不同处理间的Simpson指数并无明显差异,cfb处理的Chao1、Observed_Species和Shannon指数最低,与其他处理差异明显(表1),说明减施化肥配施福太尔微生物颗粒剂会影响大豆根围土壤的细菌群落多样性和丰富度指数,对根围细菌群落组成产生一定的影响(图1),门水平丰富度指数结果显示放线菌门是优势菌门,其次是变形菌门和酸杆菌门(图2A),cfb处理的优势菌门是变形菌门,已有研究表明变形菌门细菌一般生长在营养丰富的环境,表明微生物菌肥的施用增加了土壤养分含量。酸杆菌是土壤中的一类重要菌群,在土壤中可降解植物残体,参与铁循环、单碳化合物代谢以及光合作用等物质循环和生态环境构建过程[32]。目和属水平大于1%的有Gaiellales/Other、酸杆菌目、Frankiales/Other、鞘脂单胞菌属、嗜酸栖热菌属、芽单胞菌属、罗河杆菌属和根瘤菌属等26个菌属(图2B)。研究表明根瘤菌通过侵染豆科植物根部与该植物共生形成根瘤结构,从而增加植物根部对氮素的吸收[33]、提高抗逆性[34-36]、改良土壤结构[37]、提高难溶性养分的溶解度等优势。几种处理中cfb的产量最高,与其他处理相比较,其芽胞杆菌丰度也是最高的。研究表明,芽胞杆菌目前被普遍认为是植物促生菌和生防菌,同样也是一种溶磷菌[38-39],可以将难溶性磷溶解供植物生长发育,防止植物病害发生[40-41];同时土壤水分是影响芽胞杆菌属的重要生态因子,表明各处理均增加了土壤含水量,有利于芽胞杆菌属的生长[42]。未鉴定属占25.23%,说明未知菌很多,还有待于进一步研究鉴定。同时,大豆根围土壤中有大量的细菌资源有待开拓利用。热图分析结果显示,施肥方式会影响根围土壤的菌群丰度,各处理属水平具有差异性,褚氏杆菌属是cfb处理的优势属,在对香蕉枯萎病的研究中发现,褚氏杆菌属是健康植株的优势菌属[12],该属对大豆的促产作用还需进一步研究。LEfSe结果显示每种处理门水平差异均不同,属水平也具有差异性,这也进一步说明施肥方式可以调节大豆根围微生物群落的组成。菌群功能与大豆生长及产量之间的关系还有待于下一步的实验验证。