盐酸纳美芬对创伤性休克大鼠ROS/MAPK通路及肠屏障损伤的影响
2022-10-09李仲琪侯树爱徐超宋旭李剑李绪刚
李仲琪 侯树爱 徐超 宋旭 李剑 李绪刚
(1日照市人民医院重症医学科,山东 日照 276800;2日照市中心医院卒中中心)
创伤失血性休克(THS)是临床急诊常见的高死亡率疾病,其病理生理机制主要是严重外伤和疾病失血,使机体有效循环血量下降、微循环障碍发生、细胞氧代谢紊乱等,导致全身炎症反应和多器官功能障碍,最终导致器官衰竭〔1〕,且受害人群主要是45岁以下的青壮年〔2〕。肠道是机体最大的内毒素库,生理状态下肠黏膜屏障功能完好,防治多种致病微生物和毒素入侵,而THS早期肠道屏障功能即遭到破坏,细菌侵入机体循环,引发全身毒性反应,导致多器官功能损害〔3〕。有研究发现活性氧(ROS)介导的肠道黏膜损伤和总抗氧化能力的丧失是THS引起的肠道损伤和功能障碍的关键〔4〕。ROS是重要的细胞内第二信使,可通过多种信号途径,如丝裂原活化蛋白激酶(MAPK)和核因子(NF)-κB,介导炎性细胞因子的产生〔5〕。盐酸纳美芬为新型阿片受体拮抗药〔6〕,药理研究表明,盐酸纳美芬可降低炎症介质的释放和自由基的产生,改善脑细胞能量代谢,具有神经保护作用〔7,8〕;当前已在临床上用于治疗创伤性休克,可积极影响血流动力学(心率、平均动脉压),明显降低血浆肿瘤坏死因子(TNF)-α、一氧化氮(NO)和内毒素(ET)水平〔9〕;还可以通过调节神经递质与氧化应激指标水平,预防机体内氧化应激反应,帮助急性酒精中毒昏迷患者尽快苏醒〔10〕。但盐酸纳美芬对创伤性休克的保护机制尚不明确,对THS肠黏膜屏障损伤的影响尚无文献报道,本研究通过建立创伤失血性休克大鼠模型,探究盐酸纳美芬对创伤性休克肠黏膜屏障损伤的影响及可能的作用机制。
1 材料与方法
1.1实验动物 SPF级健康SD雄性大鼠70只,体重(280±20)g,购自北京维通利华实验动物技术有限公司,许可证号为SCXK(京)2016-0011。所有动物严格按照动物饲养规则喂养,温度为24℃,湿度为50%,12 h明暗交替,自由饮水和摄食。适应性饲养1 w后开始实验。
1.2药品及试剂 盐酸纳美芬注射液(北京四环制药有限公司,批准文号:国药准字H20120125,1 ml:0.1 mg);乳酸钠林格注射液(辅仁药业集团有限公司,批准文号:国药准字H20103236,500 ml);戊巴比妥钠(中国医药集团上海化学试剂公司,批号:F20020915,每瓶25 g);肝素钠(Solarbio,H8060,每瓶1 g);大鼠TNF-α(RA20035)、ET(RA20354)、D乳酸(LA,RA20770)及二胺氧化酶(DAO,RA20028)酶联免疫吸附试验(ELISA)试剂盒均购自武汉贝茵莱生物科技有限公司,ROS测定试剂盒(化学荧光法,E004-1-1)、总超氧化物歧化酶(SOD)测定试剂盒(WST-1法,A001-3-2)、丙二醛(MDA)测定试剂盒(TBA法,A003-1-2)均购自南京建成生物工程研究所;兔抗p38MAPK抗体(ab170099)、兔抗磷酸化(p)-p38MAPK抗体(ab38238)、兔抗GAPDH抗体(ab9485)、山羊抗兔IgG H&L辣根过氧化物酶(HRP,ab205718)均购自英国abcam公司;苏木素-伊红(HE)染色试剂、放射免疫沉淀测定(RIPA)裂解液和二喹啉甲酸(BCA)试剂盒(碧云天生物科技公司,批号分别为C0105、P0013B、P0012S);聚乙烯导管(美国BD公司,批号:80430022)、多功能酶标仪(iMark680,Bio-Rad公司)、电动显微镜(日本Olympus公司)、BL-420F生物功能实验系统(成都泰盟科技有限公司)。
1.3方法
1.3.1动物分组及模型复制 从70只大鼠中随机选取12只为假手术(Sham)组,其余大鼠参照文献〔4,11,12〕采用双侧股骨中上段闭合性骨折+股动脉放血的方法复制THS大鼠模型。具体方法为:各组大鼠术前禁食12 h,戊巴比妥钠(30 mg/kg)腹腔注射麻醉,大鼠仰卧位固定于手术台上,暴露一侧颈内动脉、静脉,显微镜下放置导管,连接BL-420生物技能实验系统,动态监测大鼠的平均动脉压,同时经静脉导管注入肝素(125 U/kg),使全身肝素化。用骨钳夹大鼠股骨造成双侧股骨完全性骨折,之后暴露股动脉进行插管放血(放出的血液存储于无菌无热原的瓶子中,加入肝素10 U/ml抗凝),使平均动脉压降至40 mmHg,维持血压1 h。1 h后经静脉缓慢回输抽出的血液,加2倍放血量的乳酸钠林格液进行复苏,复苏后缝合血管和伤口,建立大鼠创伤失血性休克模型。假手术组进行相同的手术操作,但不进行创伤、放血、回输血液及复苏过程。复苏前若大鼠出现死亡,补充新大鼠。实验过程中死亡10只,剩余48只大鼠分为THS组、盐酸纳美芬低、中、高剂量组(0.05、0.10、0.20 mg/kg)〔13〕,每组12只。
1.3.2给药 盐酸纳美芬各剂量组在复苏的同时静脉注射相应剂量的盐酸纳美芬注射液。盐酸纳美芬成人每日给药剂量为0.5 mg,给药剂量按成人平均体重60 kg体表面积换算,大鼠对应给药剂量为成人的6.3倍,则大鼠每日给药剂量为0.05 mg/kg,因此设置低、中、高剂量药物剂量为0.05、0.10、0.20 mg/kg。
1.4检测指标
1.4.1HE染色及Chiu评分 各组于给药结束24 h后,戊巴比妥腹腔注射麻醉,腹主动脉取血,取血完成后,在距回盲部5 cm处环切回肠组织样本。取部分肠组织4%的多聚甲醛固定,石蜡包埋切片,进行HE染色,二甲苯及梯度酒精脱蜡入水,蒸馏水冲洗,苏木素染色8 min,自来水冲去浮色,1%盐酸酒精分色,伊红染色5 min,自来水流水洗3次,至无色,梯度乙醇脱水,二甲苯透明,中性树脂封片,光镜下观察肠黏膜损伤情况,采用Chiu评分法〔14〕评价回肠黏膜损伤程度,评分标准:0分,无明显损伤,黏膜绒毛结构正常;1分,肠黏膜绒毛顶端上皮下间隙增宽,少量中性粒细胞浸润;2分, 绒毛上皮下间隙进一步扩大,绒毛顶尖端上皮抬高与固有层分离;3分,绒毛两边上皮成块脱落,大量中性粒细胞浸润及淋巴细胞增生;4分,上皮完全脱落,仅存固有层结构;5分,黏膜固有层崩解,出现出血和溃疡。每只动物观察10个高倍镜视野,取其平均值。
1.4.2检测血清中TNF-α、ET、D-LA含量及DAO活性 取1.4.1中血清,ELISA检测血清中DAO活性、D-LA、ET及TNF-α含量。
1.4.3检测肠组织DAO活性、SOD、MDA、ROS水平 取大鼠小肠组织,制备10%的组织匀浆,按照试剂盒说明书的操作检测匀浆中DAO活性、SOD、MDA、ROS水平。
1.4.4Western印迹检测肠组织p38MAPK、p-p38MAPK蛋白表达 称取部分肠组织,放入组织冻存管中,液氮保存,按照试剂盒说明书的操作提取组织中的总蛋白,BCA法测定蛋白浓度,取等量蛋白质样品(30 μg/孔)上样,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),湿转法转膜,5%脱脂奶粉封闭,加入一抗(p38MAPK,p-p38MAPK,按1∶1 000的比例稀释;GAPDH,1∶2 000稀释),4℃下孵育过夜,辣根过氧化物酶(HRP)标记的羊抗兔IgG二抗(1∶5 000)室温孵育1 h,电化学发光试剂(ECL)显色,以GAPDH为内参,通过与内参的灰度比,得出目的条带的相对表达水平。
1.5统计学分析 采用SPSS22.0软件进行t检验、方差分析、组间采用SNK-q检验。
2 结 果
2.1盐酸纳美芬对THS大鼠肠黏膜组织病理学变化的影响 Sham组大鼠肠黏膜上皮细胞层完整,固有层内仅见极少量淋巴细胞,未见中性粒细胞浸润,肠黏膜细胞无明显病理改变;THS组大鼠肠黏膜上皮细胞层下间质水肿,间隙增宽,小肠绒毛生长稀疏、水肿、长短不一,部分绒毛脱落,固有层大量中性粒细胞浸润及淋巴细胞增生,部分肠黏膜固有层内腺体有灶性坏死,形成糜烂点;盐酸纳美芬高、中剂量组小肠绒毛水肿、脱落情况明显减轻,固有层可见少量中性粒细胞及淋巴细胞浸润,未见上皮细胞坏死;见图1。Chiu评分结果显示,与Sham组〔(0.45±0.11)分〕相比,THS组大鼠肠黏膜损伤评分显著升高〔(4.21±0.46)分,P<0.05〕;与THS组相比,盐酸纳美芬高、中剂量组肠黏膜损伤评分明显降低〔(2.85±0.34)分、(3.38±0.47)分,P<0.05〕,盐酸纳美芬低剂量组肠黏膜损伤评分〔(3.72±0.42)分〕有所降低,但差异无统计学意义(P>0.05)。

图1 光镜下小肠黏膜形态学改变(HE染色,×200)
2.2盐酸纳美芬对THS大鼠血清TNF-α、ET、D-LA含量及DAO活性的影响 与Sham组相比,THS组血清TNF-α、ET、D-LA含量及DAO活性显著升高(P<0.05);与THS组相比,盐酸纳美芬高、中剂量组TNF-α、ET、D-LA含量及DAO活性明显降低(P<0.05)。见表1。
2.3盐酸纳美芬对THS大鼠肠组织DAO活性、ROS、SOD、MDA水平的影响 与Sham组相比,THS组肠组织ROS、MDA水平显著升高,DAO活性、SOD水平显著降低(P<0.05);与THS组相比,盐酸纳美芬高、中、低剂量组(除MDA外)肠组织ROS、MDA水平明显降低,DAO活性、SOD水平明显升高(P<0.05)。见表1。
2.4盐酸纳美芬对THS大鼠肠组织p38MAPK、p-p38MAPK蛋白表达的影响 与Sham组相比,THS组肠组织p-p38MAPK/p38MAPK蛋白表达显著升高(P<0.05);与THS组相比,盐酸纳美芬高、中、低剂量组肠组织p-p38MAPK/p38MAPK蛋白表达明显降低(P<0.05)。见表1、图2。
表1 盐酸纳美芬对THS大鼠血清TNF-α、ET、D-LA含量、DAO活性及肠组织DAO活性、 ROS、SOD、MDA水平及p-p38MAPK/p38MAPK蛋白表达的影响
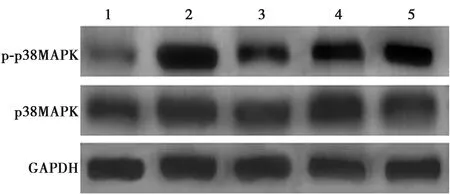
1~8:Sham组,THS组,盐酸纳美芬高剂量组,盐酸纳美芬中剂量组,盐酸纳美芬低剂量组图2 Western印迹检测大鼠肠组织 p-p38MAPK/p38MAPK蛋白
3 讨 论
肠屏障功能障碍与THS引起的多器官功能障碍综合征(MODS)的发展有关,是导致多器官衰竭的启动因素,也是THS死亡的重要原因之一。肠道是机体发生缺血时出现反应最为敏感的器官之一,尤其是在THS发生时,肠道损伤发生最早,且恢复最晚;且两者常相互影响,休克的发生可导致肠黏膜屏障损伤,而肠黏膜屏障损伤可进一步加重休克;然而,THS诱导的肠道屏障损伤的机制仍知之甚少。液体复苏或尽快恢复血管内容积被认为是治疗THS并降低死亡率的最有效措施〔15〕,但是,由于缺血再灌注损伤(IRI)和MODS,液体复苏后死亡率仍然很高〔16〕。因此,充分了解其发病机制,防止休克时肠黏膜屏障损伤对抗休克治疗起到非常重要的作用。
盐酸纳美芬是常见的纯阿片受体阻滞药物,有研究报道,盐酸纳美芬可抑制炎症介质释放、减少自由基产生和小胶质细胞活化,有效改善创伤性颅脑损伤症状;可明显降低急性酒精中毒昏迷患者血清β内啡肽(EP)、MDA水平,升高SOD水平,缩短患者苏醒时间和症状消失时间,且疗效好、安全性高〔10〕;临床已用于创伤性休克的治疗,可有效降低创伤性休克患者血清NO、ET、心肌肌钙蛋白(cTn)I水平,减轻休克症状〔17〕;但盐酸纳美芬是否能改善休克复苏后肠道形态学损伤和屏障功能相关指标至今未有文献报道。血清ET、D-LA和DAO的水平是肠屏障功能受损的标志物,正常情况下在血清中的含量很少,当肠道屏障功能损害时,肠道内ET、DAO、D-LA大量释放入血,使血清中ET、DAO、D-LA升高,肠组织中DAO活性降低〔18〕。邓哲等〔14〕研究发现,大鼠创伤性休克后2 h,即出现小肠黏膜Chiu评分、肠组织MDA含量、血浆TNF-α和D-LA含量增加,而肠组织DAO活性降低;本研究结果与上述研究结果一致,提示盐酸纳美芬可增强THS大鼠肠黏膜屏障功能,改善肠黏膜损伤。
ROS的过度积累会破坏细胞体内稳态,导致氧化应激和细胞功能障碍〔19〕。ROS可通过多种信号途径,介导胞内氧化应激状态和炎性细胞因子的产生,其中MAPK级联通路是重要的调节通路。Jordan等〔4〕发现THS发生3 h时肠道黏液层已被ROS破坏,黏液抗氧化能力下降,肠屏障渗透性增加,用自由基清除剂二甲亚砜(DMSO)可以消除THS诱导的肠道屏障破坏;Barrett等〔20〕使用THS的小鼠模型模拟患者的临床状态,发现THS发生后,大量的ROS释放,可导致内皮屏障功能丧失,引起器官损伤;清除ROS可减轻热应激引起的肠道损伤和细胞凋亡〔21〕。MAPK通路已被充分证明在氧化应激诱导的肠细胞损伤和肠炎症中被激活〔22〕。罗丽芳等〔23〕、曹军军等〔24〕研究发现ROS可激活p38MAPK通路,引起心肌纤维化和细胞凋亡,加入抗氧剂后,ROS水平明显降低,p38MAPK蛋白磷酸化明显减少,证明p38MAPK通路的激活可能是由于ROS水平的升高;Jiao等〔25〕研究发现双酚A暴露可增加细胞内ROS,通过激活ROS-p38MAPK通路,导致肠上皮细胞线粒体功能障碍、氧化应激和细胞凋亡,损害肠道物理屏障功能,谷氨酰胺可通过使ROS-p38MAPK通路正常化修复肠损伤。本研究结果提示盐酸纳美芬可能通过降低ROS,抑制p38MAPK蛋白磷酸化,改善氧化应激状态,降低炎性细胞因子的产生。
