血管内皮生长因子、单核细胞趋化蛋白1、分化抑制因子1在脑胶质瘤中的表达及与血管生成的相关性分析*
2022-10-08吴佩涛丁凡欧阳伟王少兵
吴佩涛,丁凡,欧阳伟,王少兵
(1.湖北省中西医结合医院神经外科,湖北武汉 430000;2.武汉普仁医院脊髓病中心,湖北武汉 430081)
脑胶质瘤属于一种原发性颅脑肿瘤疾病,具有高度侵袭性、肿瘤生长无明确边界、细胞无限增生三大特征[1]。流行病学发现,恶性脑胶质瘤的5年生存率<5%,5年病死率仅次于胰腺癌、肺癌[2]。有研究证实,血管为肿瘤提供营养物质并促进代谢产物排出,而血管新生化程度与肿瘤细胞增殖、生物侵袭性、恶性程度、预后等密切相关[3-4]。因此,寻找一种对肿瘤早期诊断、血管生成评估、预后判断的可靠方法尤为关键。
脑胶质瘤细胞可产生或通过旁分泌方式与肿瘤细胞或血管内皮细胞表面的血管内皮生长因子(vascular endothelial growth factor, VEGF)受体特异性结合,直接刺激内皮细胞增殖,减少血管密度,促进血管生成[5]。作为转录因子的共同作用分子,分化抑制因子(inhibitor of differentiation 1, Id1)高表达可激活VEGF 转录,促进血管内皮细胞增殖,进而抑制胶质瘤生长[6]。单核细胞趋化蛋白1(monocyte chemotactic protein-1, MCP-1)是CC 类趋化因子之一,可由内皮细胞、单核细胞、肿瘤组织等分泌,在维持肿瘤细胞生长等生物学行为中发挥重要作用[7]。本研究进一步分析VEGF、MCP-1、Id1 在脑胶质瘤中的表达及与血管生成的相关性,为临床防治本病提供潜在靶点。
1 资料与方法
1.1 一般资料
选取2018年4月—2020年5月湖北省中西医结合医院脑胶质瘤患者150 例作为病例组。其中男性82 例,女性68 例;年龄33~62 岁,平均(51.43±6.58)岁;体质量指数(22.46±2.15)kg/m2;肿瘤直径:<5 cm 79 例,≥5 cm 71 例;肿瘤部位:小脑幕下70 例,小脑幕上80 例;分化程度:低分化61 例,中高分化89 例;脑胶质瘤Kemohan 分级:Ⅰ、Ⅱ级59 例患者作为低级别组,Ⅲ、Ⅳ级91 例患者作为高级别组。纳入标准:①符合《临床神经外科学》[8]的脑胶质瘤诊断标准;②原发脑胶质瘤;③镜下接受脑胶质瘤切除术治疗;④经手术病理学及术前影像学明确病情;⑤未接受放化疗;⑥卡氏评分>70分。排除标准:①伴有其他恶性肿瘤;②合并免疫系统、血液系统、内分泌系统疾病;③重要脏器功能严重受损,如心、肝、肾等;④入组前接受放化疗、激素治疗;⑤预计生存时间<1年。另选取本院因脑外伤后行颅内减压术的50 例非肿瘤患者作为对照组。其中男性29例,女性21例;年龄32~68 岁,平均(52.64±7.02)岁;体质量指数(22.03±2.67)kg/m2;经手术病理证实为正常脑组织。两组一般资料比较,差异无统计学意义(P>0.05),具有可对比性。本研究经医院医学伦理委员会批准,患者家属均签署知情同意书。
1.2 方法
1.2.1 血清指标检测术前采集所有患者空腹静脉血4 mL,常温静置30 min,2 000 r/min离心15 min,取上层血清,置于-80℃冰箱冷冻保存。通过酶联免疫吸附试验(广东固康生物科技有限公司)测定血清VEGF、MCP-1 水平,双抗体夹心酶联免疫吸附试验(上海羽哚生物科技有限公司)测定血清Id1 水平,所有操作严格按照试剂盒说明书执行。
1.2.2 肿瘤微血管密度(MVD)计数术后采集所有患者脑组织标本,置于-80℃冰箱冷冻保存,用10%浓度的甲醇浸泡脑组织,石蜡包埋,切片。将脑组织切片置于光学显微镜(CX21 型,日本Olympus株式会社)下观察,并确定独立微血管,以CD105为特异性标志物,取5 个视野的微血管数平均值作为MVD 值。
1.3 统计学方法
数据分析采用SPSS 23.0 统计软件。计量资料以均数±标准差(±s)表示;比较用t检验;相关性分析用Pearson 法; 绘制受试者工作特征(receiver operating characteristic,ROC)曲线。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者血清VEGF、MCP-1、Id1水平比较
两组患者血清VEGF、MCP-1、Id1 水平比较,差异有统计学意义(P<0.05),病例组血清VEGF、Id1水平较对照组高,MCP-1 水平较对照组低。见表1。
表1 两组患者血清VEGF、MCP-1、Id1水平比较 (±s)
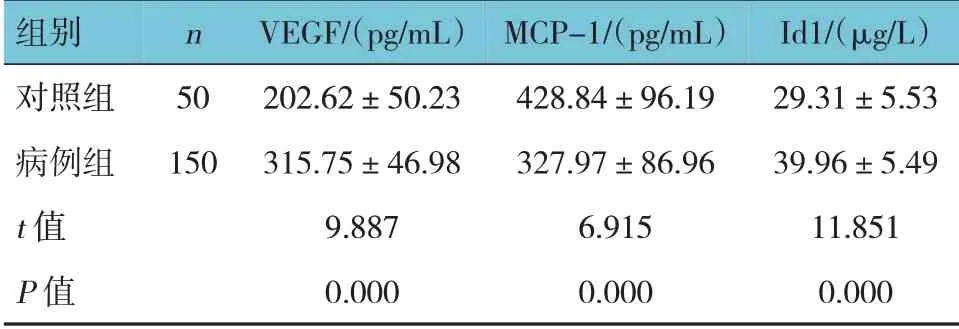
表1 两组患者血清VEGF、MCP-1、Id1水平比较 (±s)
组别对照组病例组t 值P 值n 50 150 VEGF/(pg/mL)202.62±50.23 315.75±46.98 9.887 0.000 MCP-1/(pg/mL)428.84±96.19 327.97±86.96 6.915 0.000 Id1/(μg/L)29.31±5.53 39.96±5.49 11.851 0.000
2.2 血清VEGF、MCP-1、Id1 水平预测脑胶质瘤发生的价值
ROC 曲线结果显示,血清VEGF、MCP-1、Id1 水平及3 者联合预测胶质瘤发生的AUC 分别为0.873(95% CI:0.823,0.923)、0.776(95% CI:0.699,0.853)、0.898(95% CI:0.850,0.946)、0.908(95% CI:0.851,0.978)。见表2 和图1、2。
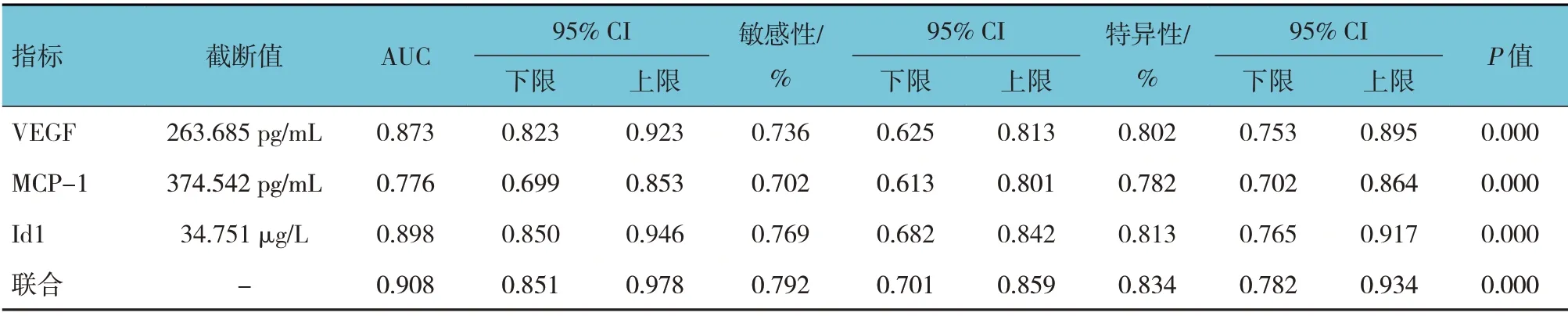
表2 血清VEGF、MCP-1、Id1水平预测脑胶质瘤发生的价值
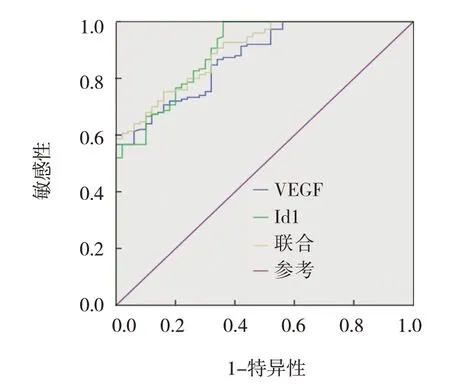
图1 血清VEGF、Id1水平及联合预测胶质瘤发生的ROC曲线
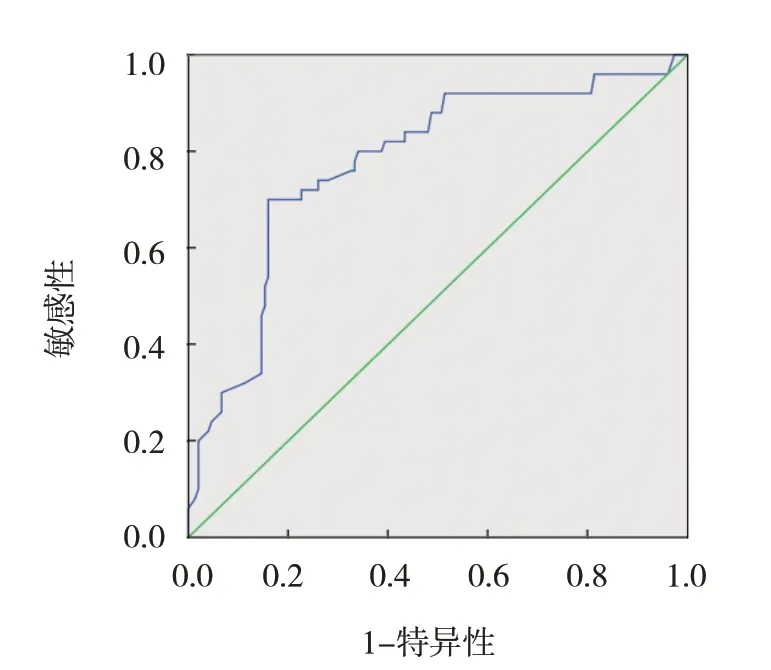
图2 血清MCP-1水平预测胶质瘤发生的ROC曲线
2.3 不同级别脑胶质瘤患者血清VEGF、MCP-1、Id1水平及MVD比较
不同级别脑胶质瘤患者血清VEGF、MCP-1、Id1水平及MVD 比较,差异有统计学意义(P<0.05),高级别组血清VEGF、Id1 水平及MVD 较低级别组高,MCP-1 水平较低级别组低。见表3。
表3 不同级别脑胶质瘤患者血清VEGF、MCP-1、Id1水平及MVD比较 (±s)

表3 不同级别脑胶质瘤患者血清VEGF、MCP-1、Id1水平及MVD比较 (±s)
组别低级别组高级别组t 值P 值n 59 91 VEGF/(pg/mL)284.65±43.77 367.74±59.35 9.243 0.000 MCP-1/(pg/mL)374.45±59.75 300.48±43.77 8.740 0.000 Id1/(μg/L)34.18±4.76 43.85±6.29 10.080 0.000 MVD/(个/视野)24.96±8.05 57.65±9.72 21.487 0.000
2.4 脑胶质瘤患者血清VEGF、MCP-1、Id1 水平与MVD的相关性分析
Pearson 相关性分析显示,脑胶质瘤患者MVD 与血清VEGF 水平、Id1 水平呈正相关(r=0.532、0.697,均P=0.000),与MCP-1 水平呈负相关(r=-0.395,P=0.003)。
3 讨论
VEGF 是血管生成的主要调控因子,具有刺激内皮细胞分化、提高血管通透性、抑制成熟树突细胞及内皮细胞凋亡、促进内皮细胞分化及迁移、介导血管形成等生物学作用[9]。有研究报道,由VEGF 介导的沿血管基底膜侵袭是脑胶质瘤最常见的侵袭途径,间接证实了VEGF 在胶质瘤血管新生、细胞增殖及侵袭、转移中发挥重要作用[10]。SEYEDMIRZAEI 等[11]在1 项Meta 分析中提到,脑胶质瘤患者血清VEGF 水平比健康者高,且不同级别脑胶质瘤患者的血清VEGF水平存在明显差异。SHAMSDIN 等[12]研究报道,中枢神经系统肿瘤患者血清VEGF 水平升高,且VEGF 水平与脑胶质瘤患者炎症反应、预后密切相关。本研究中,病例组血清VEGF 水平较对照组高,预测脑胶质瘤发生的AUC 为0.873,且高级别组血清VEGF 水平比低级别组高,再次证实VEGF 高表达可能会增加脑胶质瘤的发生风险,加重病情程度及细胞恶性生物学行为,其原因在于高表达的VEGF 可增加血管通透性,诱导血管持续生成,促进血液纤维蛋白原外渗,形成肿瘤周围水肿,为脑胶质瘤细胞快速生长及细胞侵袭提供了血液、营养供应,加剧脑胶质瘤病情[13]。
MCP-1 可由诸多组织细胞分泌,可调节记忆性T 细胞、单核细胞、中性粒细胞的浸润、迁移[14]。张景杰等[15]研究发现,脑胶质Ⅰ级、Ⅱ级、Ⅲ级、Ⅳ级患者血清MCP-1 水平低于健康对照组,且动态观察血清MCP-1 水平有利于判断微创手术效果及评估预后。本研究中病例组血清MCP-1 水平比对照组低,高级别组血清MCP-1 水平比低级别组低,表明脑胶质瘤患者血清MCP-1 水平下调,且与级别程度呈负相关,分析其原因可能与MCP-1 具有抑制抗肿瘤免疫应答、促进肿瘤细胞生长、趋化炎症细胞浸润等机制有关;同时MCP-1 可对肿瘤相关巨噬细胞产生趋化作用,促使其分泌VEGF、IL-8 等因子诱导血管生成,刺激局部组织血管化;此外,肿瘤相关巨噬细胞可分泌降解细胞外基质的金属蛋白酶2、金属蛋白酶9 等,从而损伤细胞外基质稳定性,促进肿瘤侵袭、生长;而高级别胶质瘤可破坏血脑屏障,进一步促使MCP-1更容易穿过血脑屏障而进入肿瘤组织内部[16]。
Id1 是转录因子的共同作用分子,其异常升高可通过多条信号通路控制Rb 蛋白活性以促进肿瘤细胞增殖[17]。SOROCEANU 等[18]实验发现,Id1 表达上升与培养的脑胶质瘤细胞侵袭性呈正比,而沉默Id1表达可延长脑胶质瘤模型大鼠的生存期,降低肿瘤细胞侵袭性。周保丹[19]研究报道,脑胶质瘤中Id1 蛋白过表达,且其表达与患者临床病理分级、侵袭程度、预后有关。本研究结果显示,脑胶质瘤患者血清Id1 水平上升,且与级别程度呈正相关,与上述研究相似,故推测Id1 可能成为脑胶质瘤治疗的潜在分子靶点,作用机制可能与Id1 可通过降低肿瘤细胞黏附力,促进上皮细胞间质转化及血管内皮祖细胞增殖,从而加剧肿瘤侵袭有关。
MVD 是用免疫组织化学法标记肿瘤组织中的微血管,可间接反映肿瘤血管生成能力。本研究发现,高级别组MVD 比低级别组高,支持脑胶质瘤的富血管性的说法,且病理学分级恶性程度越高,其MVD 越高,新生血管数量越多。Pearson 相关分析结果显示,脑胶质瘤患者MVD 与血清VEGF、Id1 水平呈正相关,与MCP-1 水平呈负相关,提示血清VEGF、Id1 水平高表达及MCP-1 水平低表达可分别促进脑胶质瘤新生血管生成,为脑胶质瘤细胞的侵袭、增殖、浸润等恶性生物学行为提供充足的血液、营养供应。进一步绘制ROC 曲线发现,血清VEGF、MCP-1、Id1 水平及联合预测脑胶质瘤发生的AUC 分别为0.873、0.776、0.898 和0.908,提示临床应密切监测血清VEGF、MCP-1、Id1 水平变化,识别脑胶质瘤高危人群,指导抗血管生成治疗方案,以抑制脑胶质瘤新生血管生成,预防细胞侵袭、浸润。
综上所述,脑胶质瘤患者血清VEGF、Id1 水平上调,MCP-1 水平下调,三项指标与肿瘤血管生成密切相关,且可有效预测脑胶质瘤的发生。但由于例数有限、随访时间有限,肿瘤血管生成受诸多因素影响,故针对VEGF、MCP-1、Id1 在脑胶质瘤发生、血管生成中的确切意义仍需进一步探讨。
