外泌体源性microRNA-124对急性创伤性脊髓损伤大鼠脊髓小胶质细胞活化及炎症反应的影响*
2022-10-08高迎吉朱中蛟杨秀玲
高迎吉,朱中蛟,杨秀玲
(1.临沂市人民医院脊柱外科,山东临沂 276002;2.滕州市中心医院脊柱外科,山东滕州 277599;3.山东大学齐鲁医院肿瘤内科,山东济南 250012)
急性创伤性脊髓损伤(acute spinal cord injury,ASCI)是一种突发性中枢神经系统创伤,可导致脊髓中血管破裂,神经元迅速死亡[1]。神经炎症是ASCI 重要的病理生理机制,其中小胶质细胞(Microglia, MG)发挥重要作用,活化MG 中的M1 型可释放炎症因子,M2 型可释放抑炎因子[2]。因此,促进ASCI 后M1 型MG 向M2 型转化是改善预后的重要措施。有研究发现,microRNA-124(miR-124)特异性表达于MG 中,上调其表达可促进M1 型MG 向M2 型转化,但裸露miR-124 易被降解,无法稳定地在中枢神经系统发挥作用,故探究可完整递送miRNA 的方式具有必要性[3]。外泌体(Exosomes,Exos)是一种由自体细胞分泌的纳米级囊泡样小体,通过转运RNA、生物活性磷脂、蛋白质等参与细胞与内环境的信号传递及物质运输,已逐渐用于递送载体、参与器官间联系及组织稳态维持[4]。本研究通过复制ASCI 大鼠模型,观察Exos 源性miR-124 对其脊髓MG 活化及炎症反应的影响,并探讨其作用机制。
1 材料与方法
1.1 材料
1.1.1 细胞系、实验动物人源胚胎肾(human emborynic kidney, HEK)239 细胞系购自南京森贝伽生物科技有限公司。SPF 级SD 大鼠35 只,6 周龄,体重(200±20)g,购自上海灵畅生物科技有限公司,实验动物生产许可证号:SCXK(沪)2018-0003,实验动物使用许可证号:SYXK(沪)2022-0004。
1.1.2 主要试剂miR-124-mimics 过表达质粒(上海汉恒生物科技有限公司),LipofectamineTM3000 试剂盒(上海吉玛制药技术有限公司),Exos 提取试剂盒(上海贝博生物科技公司),兔抗人CD9、CD63 一抗,兔抗鼠核苷酸结合寡聚化结构域样受体3(nucleotide-bindingoligomerizationdomain-like receptor 3, NLRP3)、半胱氨酸天冬氨酸蛋白酶-1(Caspase-1)、P2X7 一抗、小鼠抗大鼠Iba-1、CD32、CD206 抗体(美国Abcam 公司),肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白细胞介素-6(Interleukin-6, IL-6)、白细胞介素-8(interleukin-8,IL-8)酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)试剂盒(上海酶联生物科技有限公司)。
1.1.3 主要仪器StepOne Puls 实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRT-PCR)仪(美国ABI 公司),JEM-2100Plus 透射电子显微镜(日本电子株式会社),Stat Fax-4200 酶标仪(美国Awareness 公司)。
1.2 方法
1.2.1 细胞培养及转染HEK239 细胞置于37℃、5%二氧化碳CO2、饱和湿度的DMEM 培养基中(含10%胎牛血清、L-谷氨酰胺、1%非必需氨基酸、青霉素100 u/mL、链霉素100 μg/mL)。取对数期HEK239 细胞,PBS 洗涤,按1×105个/mL 接种至6 孔板,待细胞再次融合达75%,分为空白组、转染组。空白组不处理,转染组按照LipofectamineTM3000 试剂盒说明书步骤,转染miR-124-mimics 质粒。每组设置5 个复孔,每2 天更换1 次培养基,2~3 周后形成单克隆细胞系用于后续实验。
1.2.2 qRT-PCR检测转染后细胞miR-124、Exos源性miR-124、脊髓组织miR-124的表达取空白组、转染组细胞,用TRIzol 试剂提取总RNA,逆转录为cDNA,按照荧光定量试剂盒说明书操作,反应体系:双倍核酸染料12 μL,正反向引物(10 μmol/L)各1 μL,模板cDNA 2 μL,补充dd H2O 至总体积20 μL。反应条件:90℃预变性10 min,94℃变性20 s,62℃退火30 s,72℃延伸25 s,共40 个循环。以U6为内参基因,2-ΔΔCt为目的基因相对表达强度,引物序列见表1。取空白组、转染组Exos,检测Exos 源性miR-124 相对表达量。取冷冻保存的脊髓组织,眼科剪剪碎,PBS 匀浆,注入离心管内,离心后取上清液,检测脊髓组织中miR-124 相对表达量。
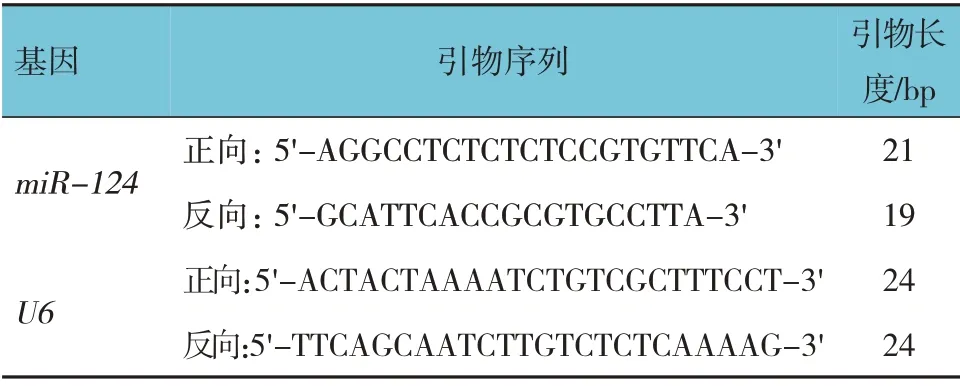
表1 qRT-PCR引物序列
1.2.3 分离含miR-124 的Exos 并鉴定DMEM 培养基(含10%胎牛血清)12 000 r/min 离心15 h,取上清液。空白组、转染组细胞置于37℃、5% CO2、饱和湿度的DMEM 培养基中(含10%胎牛血清、1%青霉素)培养5 d。3 500 r/min 离心10 min,取上清液,采用Exos 提取试剂盒提取Exos,根据试剂盒说明书步骤进行操作。取Exos 10 μL,滴至载样铜网并静置2 min,去除浮液,1%磷钨酸溶液染色5 min,去除染液,自然晾干,在透射电镜下观察其形态。
1.2.4 Western bloting 检测空白组、转染组Exos 膜表面特异性标志蛋白的表达和脊髓组织NLRP3、Caspase-1、P2X7 蛋白的表达取Exos 50 μL,加入裂解液50 μL(含蛋白酶抑制剂),4℃振荡25 min。离心取上清液,BCA 蛋白定量试剂盒定量,加入上样缓冲液,沸水浴变性5 min。每孔40 μg 上样,电泳后湿转至硝酸纤维素膜上,封闭液封闭2 h,加入兔抗人CD9、CD63 一抗(1∶500),4℃孵育过夜,洗涤,加入山羊抗兔二抗(1∶2 000),室温孵育2 h,洗涤、曝光、显影,凝胶成像系统分析,以CD9、CD63 与内参GAPDH 的灰度值比值表示蛋白相对表达量。
取冷冻保存的脊髓组织,操作方法同上,加入兔抗大鼠NLRP3、Caspase-1、P2X7 一抗(1∶500),检测脊髓组织NLRP3、Caspase-1、P2X7 蛋白相对表达量。
1.2.5 ASCI 大鼠模型的复制及分组腹腔注射戊巴比妥钠麻醉大鼠,保持其俯卧体位,将T10椎体作为中心行矢状切口,显露T9~T11椎板,去除T10椎板和韧带,显露硬脊膜。采用纽约大学脊髓损伤打击器固定大鼠,将撞击棒(直径2.5 mm,重量10 g)从25 mm 位置自由下落撞击脊髓,自撞击棒下落到抬起时间间隔10 s。模型复制成功标准:脊髓被击打后表面迅速淤血、水肿,击打瞬间大鼠表现为后肢放射性迅速收回、抖动[5]。模型复制成功后清洗周围组织,常规缝合、抗感染。
从35 只大鼠中随机选取10 只仅咬除椎板显露脊髓,不进行损伤处理,设为假手术组,其余25 只复制ASCI 模型,模型复制成功20 只,随机分为ASCI 组、实验组,每组10 只。模型复制成功后24 h,实验组经尾静脉注射Exos 3×109个微粒(通过纳米颗粒跟踪分析仪Nanosight NS300 system 控制Exos量),假手术组及ASCI 组注射等量PBS 溶液[6]。
1.2.6 标本采集干预后3 d,颈椎脱臼法处死大鼠,于冰盘上迅速分离大鼠T9~T11节段脊髓,转移至EP 管中封闭保存,取5 只大鼠的脊髓组织-80℃冷冻保存,用于miR-124 相对表达量、MG 占比、脊髓组织炎症因子水平的检测,另外5 只大鼠的脊髓组织分成两份,一份固定于4%多聚甲醛24 h,另一份置入-80℃冰箱冷冻保存用于检测蛋白相对表达量。
1.2.7 流式细胞术检测脊髓组织MG 占比取脊髓组织,胰蛋白酶消化后离心,经密度梯度离心法分离出单个核细胞,用10%胎牛血清重悬,在单核细胞悬液中加入小鼠抗大鼠Iba-1、CD32、CD206 抗体,避光孵育30 min,离心弃上清液,PBS 洗涤,1%多聚甲醛定容,300 目细胞滤网过滤,4℃遮光保存,以阴性对照管设门,采用多参数流式细胞术检测定脊髓组织MG 中Iba-1+/CD32+、Iba-1+/CD206+占比。
1.2.8 ELISA 检测脊髓组织TNF-α、IL-6、IL-8水平取冷冻保存的脊髓组织,匀浆后采用ELISA检测TNF-α、IL-6、IL-8 水平,根据试剂盒说明书操作步骤,经酶标仪测定570 nm 波长处吸光度值,画出曲线,计算样本浓度。
1.2.9 苏木精-伊红(Hematoxylin-eosin,HE)染色观察脊髓组织病理学变化取脊髓组织切片,常规水化,冲洗,苏木精染液染色5 min,冲洗,分化液分化,冲洗,蓝化液反蓝,伊红染色2 min,漂洗,常规脱水、透明,滴入中性树脂封固,显微镜下观察脊髓组织病理学变化。
1.3 统计学方法
数据分析采用SPSS 19.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验或方差分析,进一步两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组细胞转染后miR-124相对表达量比较
空白组与转染组miR-124 相对表达量分别为(0.95±0.12)和(2.38±0.27),经t检验,差异有统计学意义(t=10.822,P=0.000),转染组高于空白组。
2.2 Exos形态
透射电镜观察结果显示,Exos 膜结构完整,大小不一,大部分呈杯形或圆形,直径30~100 nm,与Exos 特征相符。见图1。
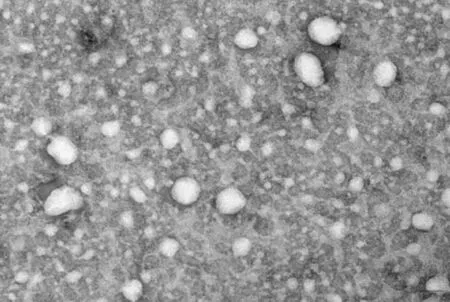
图1 透射电镜观察Exos形态 (×70 000)
2.3 含miR-124的Exos鉴定结果
空白组与转染组CD9、CD63 蛋白及miR-124相对表达量的比较,经t检验,差异均有统计学意义(P<0.05),转染组CD9、CD63 蛋白及miR-124相对表达量升高。见表2 和图2。
表2 两组细胞CD9、CD63 蛋白、miR-124 相对表达量比较 (±s)
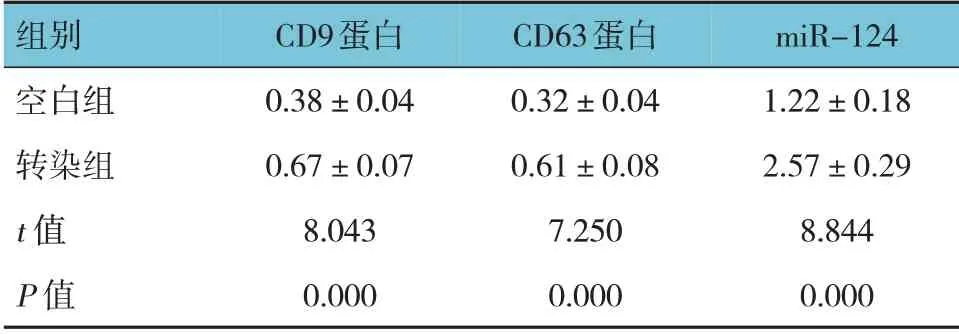
表2 两组细胞CD9、CD63 蛋白、miR-124 相对表达量比较 (±s)
组别空白组转染组t 值P 值CD9蛋白0.38±0.04 0.67±0.07 8.043 0.000 CD63蛋白0.32±0.04 0.61±0.08 7.250 0.000 miR-124 1.22±0.18 2.57±0.29 8.844 0.000
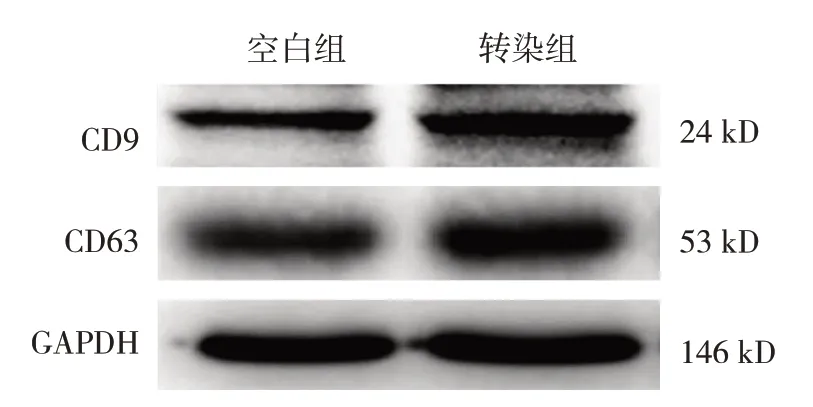
图2 空白组、转染组CD9、CD63蛋白的表达
2.4 3 组大鼠脊髓组织miR-124 相对表达量比较
假手术组、ASCI 组、实验组大鼠脊髓组织miR-124 相对表达量分别为(1.02±0.17)、(1.04±0.15)、(2.10±0.34),经方差分析,差异有统计学意义(F=34.287,P=0.000)。进一步两两比较结果:与假手术组、ASCI 组比较,实验组脊髓组织miR-124 相对表达量升高(P<0.05);假手术组与ASCI 组脊髓组织miR-124 相对表达量比较,差异无统计学意义(P>0.05)。
2.5 3组大鼠脊髓组织MG占比比较
假手术组、ASCI 组、实验组大鼠脊髓组织Iba-1+/CD32+、Iba-1+/CD206+占比比较,经方差分析,差异均有统计学意义(P<0.05)。进一步两两比较结果:与假手术组比较,ASCI 组脊髓组织Iba-1+/CD32+、Iba-1+/CD206+占比均升高(P<0.05);与ASCI 组比较,实验组脊髓组织Iba-1+/CD32+占比降低(P<0.05),Iba-1+/CD206+占比升高(P<0.05)。见表3。
表3 3组大鼠脊髓组织MG占比比较 (n=5,%,±s)

表3 3组大鼠脊髓组织MG占比比较 (n=5,%,±s)
注:①与假手术组比较,P <0.05;②与ASCI组比较,P <0.05。
组别假手术组ASCI组实验组F 值P 值Iba-1+/CD206+25.47±4.21 39.65±5.07①54.87±6.39②38.484 0.000 Iba-1+/CD32+20.19±3.57 44.28±5.31①29.36±4.92②34.039 0.000
2.6 3组大鼠脊髓组织TNF-α、IL-6、IL-8水平比较
假手术组、ASCI 组、实验组大鼠脊髓组织TNFα、IL-6、IL-8 水平比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:与假手术组比较,ASCI 组脊髓组织TNF-α、IL-6、IL-8 水平升高(P<0.05);与ASCI 组比较,实验组脊髓组织TNF-α、IL-6、IL-8 水平降低(P<0.05)。见表4。
表4 3组大鼠脊髓组织TNF-α、IL-6、IL-8水平比较(n=5,±s)
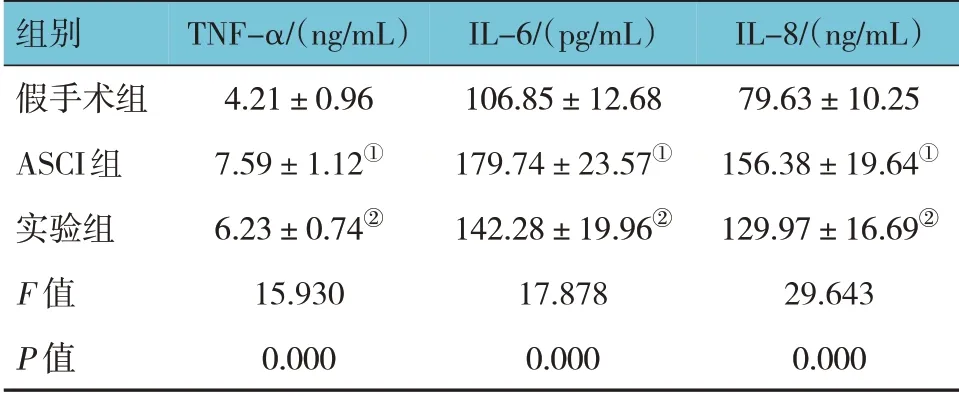
表4 3组大鼠脊髓组织TNF-α、IL-6、IL-8水平比较(n=5,±s)
注:①与假手术组比较,P <0.05;②与ASCI组比较,P <0.05。
组别假手术组ASCI组实验组F 值P 值IL-8/(ng/mL)79.63±10.25 156.38±19.64①129.97±16.69②29.643 0.000 TNF-α/(ng/mL)4.21±0.96 7.59±1.12①6.23±0.74②15.930 0.000 IL-6/(pg/mL)106.85±12.68 179.74±23.57①142.28±19.96②17.878 0.000
2.7 3组大鼠脊髓组织病理学改变
假手术组大鼠脊髓组织未观察到明显的炎症细胞浸润。ASCI 组可观察到大量炎症细胞浸润,表现为典型的“血管袖套样”,且部分炎症细胞浸润至脑实质中。实验组血管周围与脑实质中有炎症细胞浸润,但不及ASCI 组炎症细胞数量多,程度较轻。见图3。
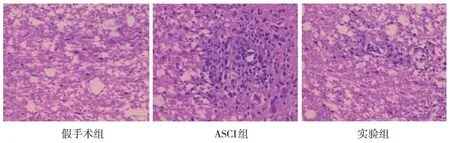
图3 3组大鼠脊髓组织病理切片 (HE染色×200)
2.8 3组大鼠脊髓组织NLRP3、Caspase-1、P2X7蛋白相对表达量比较
假手术组、ASCI 组、实验组大鼠脊髓组织NLRP3、Caspase-1、P2X7 蛋白相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:与假手术组比较,ASCI 组脊髓组织NLRP3、Caspase-1、P2X7 蛋白相对表达量升高(P<0.05);与ASCI 组比较,实验组脊髓组织NLRP3、Caspase-1、P2X7 蛋白相对表达量降低(P<0.05)。见表5 和图4。
表5 3组大鼠脊髓组织NLRP3、Caspase-1、P2X7蛋白相对表达量比较 (n=5,±s)
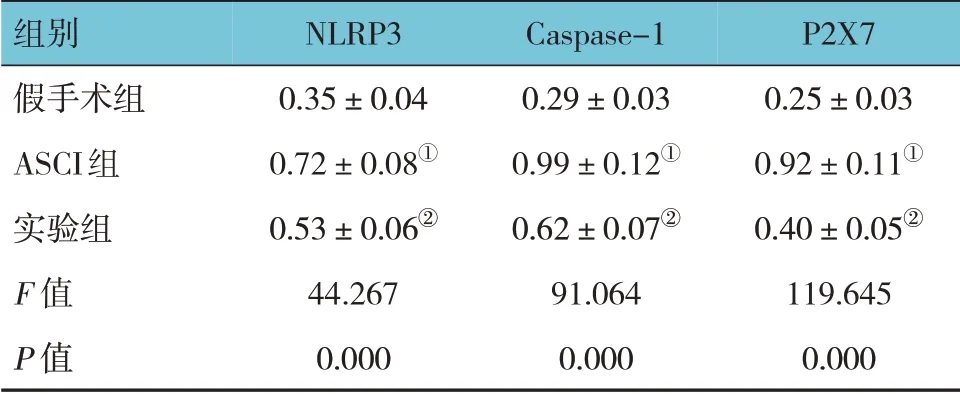
表5 3组大鼠脊髓组织NLRP3、Caspase-1、P2X7蛋白相对表达量比较 (n=5,±s)
注:①与假手术组比较,P <0.05;②与ASCI组比较,P <0.05。
组别假手术组ASCI组实验组F 值P 值P2X7 0.25±0.03 0.92±0.11①0.40±0.05②119.645 0.000 NLRP3 0.35±0.04 0.72±0.08①0.53±0.06②44.267 0.000 Caspase-1 0.29±0.03 0.99±0.12①0.62±0.07②91.064 0.000
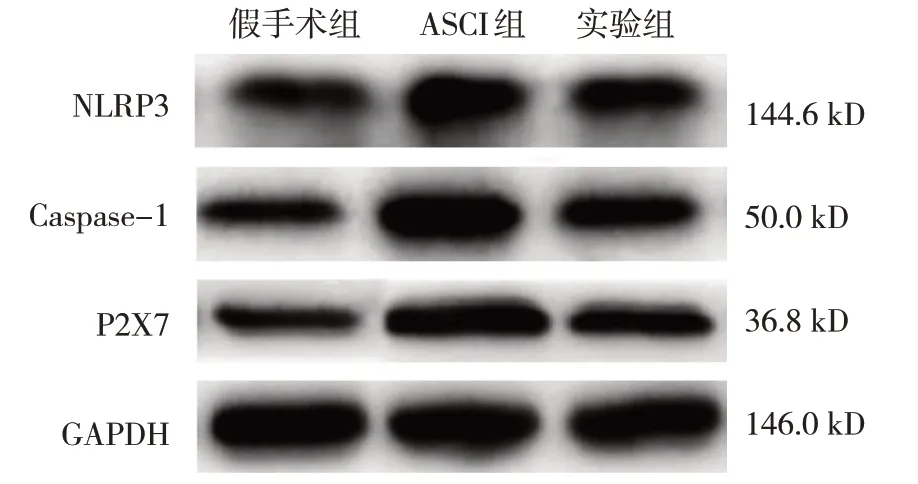
图4 各组大鼠脊髓组织NLRP3、Caspase-1、P2X7蛋白的表达
3 讨论
ASCI 引发的局部病理损伤表现为区域性、不完全性,并造成血管痉挛、局部炎症、组织水肿缺血、离子失衡、代谢紊乱及氨基酸毒性等复杂级联反应,进而损伤神经细胞并致其脱髓鞘,生成胶质瘢痕影响轴突正常生长,最终导致不可逆性神经功能损害[7-8]。MG 广泛分布于神经系统,其作为巨噬细胞具有呈递抗原、吞噬病原体、为神经元提供营养支持等作用,与炎症产生关系密切。ASCI 后中枢系统感受到强烈刺激,MG 转变为M1、M2 两种极化类型,M1 型通过分泌蛋白酶、炎症因子等加剧脊髓损伤,并诱导炎症细胞迁移至损伤区域,而M2 型可分泌抗炎因子从而减轻炎症反应及组织损伤[9]。由此可见,活化MG 在调控ASCI 后的炎症反应中占据重要地位。
miR-124 被证实大量表达于哺乳动物脑及脊髓神经元中,在癫痫、帕金森病及脑缺血等中枢神经系统疾病中起关键作用,并可促进MG 从促炎M1 型转化为抑炎M2 型[10-12]。李昊天等[13]发现,上调miR-124 可抑制脊髓损伤大鼠氧化应激导致的神经元凋亡,减轻脊髓损伤,提示其在治疗脊髓损伤方面的潜能。将Exos 作为将miR-124 输送至中枢神经系统的载体与自然生理学状态更为接近,且体积微小、容易获取及保存、无免疫排斥、免疫原性低。此外,该基因修饰方式可促进Exos 表面表达特定的受体和配体,从而使其具有结合特定细胞的功能。杨永祥等[14]研究发现,Exos 源性miR-146a 可提高N9 型MG 中miR-146a 相对表达量,进而调控下游靶向因子抑制N9 型MG 介导的炎症反应,表明Exos 可作为将miRNA 递送给受体细胞的有效载体。本研究结果显示,与ASCI 组比较,实验组脊髓组织Iba-1+/CD32+占比降低,Iba-1+/CD206+占比升高,且TNFα、IL-6、IL-8 水平降低,提示Exos 源性miR-124 可促进ASCI 大鼠脊髓M1 型MG 转化为M2 型,从而减轻脊髓炎症反应。
NOD 样受体是机体重要的模式识别受体,NLRP3 是其中主要类型之一,被激活后与Caspase-1、ASC 组成炎症小体。NLRP3 炎症小体是一种可激活炎症反应的多蛋白复合物,在先天性免疫及炎症相关疾病进程中发挥重要作用,可响应微生物感染与细胞损伤,具有抗微生物及免疫调节作用,通过介导Caspase-1 激活和促炎TNF-α、IL-6、IL-8 等炎症因子分泌,导致细胞焦亡[15-16]。ZHAO 等[17]发现,通过抑制NLRP3 炎症小体激活、调节巨噬细胞极化可有效减少神经胶质瘢痕形成并促进轴突生长,从而治疗急性脊髓损伤,提示NLRP3 炎症小体可作为脊髓损伤治疗中的有效靶点。本研究结果显示,与假手术组比较,ASCI 组脊髓组织NLRP3、Caspase-1、P2X7 蛋白相对表达量升高,经实验组干预后均有所降低,提示P2X7-NLRP3/Caspase-1 信号通路在ASCI中被异常激活,Exos 源性miR-124 可能通过抑制该通路活性发挥治疗ASCI 的作用。
综上所述,Exos 源性miR-124 可促进ASCI 大鼠脊髓M1 型MG 转化为M2 型,减轻炎症反应,推测其作用机制与抑制P2X7-NLRP3/Caspase-1 信号通路活性有关。
