通腑茯苓饮联合电针治疗大鼠骶上脊髓损伤后神经源性膀胱的作用机制研究*
2022-10-08张昱孔繁林吴磊
张昱,孔繁林,吴磊
[1.山西白求恩医院(山西医学科学院),山西太原 030032;2.山西农业大学生命科学学院,山西晋中 030801]
神经源性膀胱(neurogenic bladder, NB)是由于中枢神经系统损伤导致的膀胱尿道功能障碍,主要表现为尿不畅或潴留,严重时引发尿路感染或肾衰竭,造成死亡[1]。脊柱损伤是造成NB 的主要原因,其中以骶上脊髓损伤(suprasacral spinal cord injury,SSCI)最常见[2]。中医将其归为“癃闭”“遗溺”等范畴[3]。目前NB 主要采用手术和保守治疗,但手术效果有限且创伤较大,中医以汤药与针灸治疗最常见。目前针对SSCI 后NB 采用针刺较多,而汤药与针灸联合治疗的研究较少,且尚无确切的作用机制[4]。为提高疗效,本研究选用中药与电针联合治疗。汤药选用通腑茯苓饮进行调理,该药方是根据《金匮要略》中葵子茯苓散加减而来,具有通调水道、行气利水的功效[5]。针刺则选用长强穴和维胞穴进行电针治疗。长强穴属督脉,位于脊柱骨的尾端,督阳初始之处,能够增强督脉阳气,调畅通淋,治疗大小便难解;维胞穴则位于下腹部,主治遗尿,尿潴留等,具有调理冲任,行气止痛的功效[6]。为探究其联合治疗的效果及作用机制,本研究复制SSCI后NB 大鼠模型,探究通腑茯苓饮联合电针治疗大鼠SSCI 后NB 的作用机制。
1 材料与方法
1.1 实验动物
45 只SPF 级、SD 雌性大鼠,体重190~220 g,平均(205±15)g,购自斯贝福(北京)生物技术有限公司,实验动物生产许可证号:SCXK(京)2016-0002,实验动物使用许可证号:SYXK(京)2019-0030。
1.2 主要试剂与仪器
1.2.1 主要试剂通腑茯苓饮所用药材(山西国药医药集团有限公司),戊巴比妥钠(CAS 号:57-33-0,上海谱析生物科技有限公司,货号:XY-TP276000),中性甲醛(CAS 号:50-00-0,上海远慕生物科技有限公司,货号:YR0267),TRIzol 试剂盒(武汉纯度生物科技有限公司,货号:CD-13433-ML),实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRT-PCR)试剂盒(广州市锐博生物科技有限公司,货号:MQPS),神经生长因子(nerve growth factor, NGF)、神经生长因子受体(nerve growth factor receptor, TrkA)单克隆抗体(北京安诺伦生物科技有限公司,NGF 抗体货号:LM12882;TrkA 抗体货号:LM21146)。
1.2.2 主要仪器咬骨钳(苏州威邦医疗器械有限公司),一次性针灸针(型号:25mm,北京汉医医疗器械中心),SDZ-Ⅱ型华佗牌电针治疗仪(苏州医疗用品厂有限公司),基础电泳仪(型号:Mini-protean tetra mini,美国Bio-Rad 公司),真空干燥箱(型号:FD8-3T,美国GOLD-SIM 公司),紫外分光光度计(型号:BioSpectrometerD30,德国Eppendorf 公司)。
1.3 方法
1.3.1 SSCI 模型的复制及分组所有大鼠饲养于SPF 区域,温度保持在20℃左右,湿度为55%~60%,大鼠食量一般为100 g/(kg·d),每日给予充足的饲料和水。根据Hassan Shakerl 脊髓横断法[7],复制大鼠SSCI 模型。采用随机数字表法将45 只雌性大鼠分为对照组(8 只)和实验组(37 只)。实验组大鼠腹腔注射1%戊巴比妥钠(40 mg/kg)麻醉后复制SSCI 模型。将大鼠俯卧固定,脊柱胸椎下段消毒、备皮,找到T10椎体,从此处切开皮肤,分离皮下组织,暴露T10、T11棘突及椎板,用咬骨钳咬除T10椎板及两侧关节突,暴露出脊髓并将其切断(可反复切割,确保脊髓完全切断,无神经纤维残留),观察大鼠生命体征后缝合。大鼠清醒后,采用病理评分评估大鼠脊髓横断情况[7]:0 分(后肢瘫痪,无任何运动)表明脊髓横断成功。术后抗感染治疗7 d,每日手法排尿,并记录尿量。2 周后膀胱出现尿潴留,表明大鼠SSCI 后NB 模型复制成功。实验组5 只大鼠模型复制失败(3 只死亡,2 只未出现尿潴留),其余大鼠随机分为模型组、通腑茯苓饮组、电针组及联合组,每组8 只。
1.3.2 药物处理通腑茯苓饮组方:茯苓10 g、车前子15 g、乌药6 g、琥珀3 g、黄芪30 g、白术20 g、泽泻10 g、冬葵子10 g、通草6 g、滑石10 g、牛膝15 g,制成生药含量为1 g/mL 的通腑茯苓饮,备用。模型复制成功后,根据人与大鼠的体重及给药剂量换算公式[9],通腑茯苓饮组给予通腑茯苓饮6.25 g/(kg·d),连续服用14 d;电针组采用0.3 mm×25.0 mm 的电针,对长强穴和维胞穴进行针刺,电针仪参数设定为10/50 Hz(疏波10 Hz/5 s,密波50 Hz/9 s),留针20 min,1 次/d,连续14 d。
1.3.3 标本采集及处理最后一次治疗后对大鼠进行尿流动力学检测。检测后所有大鼠腹腔注射1%戊巴比妥钠(40 mg/kg)麻醉,采用手法辅助大鼠排尿,记录其残余尿量。在麻醉状态下剥离大鼠背部皮肤、肌肉及组织,分离暴露胸椎段T8~T12脊髓,切除T9~T10脊髓后用生理盐水冲洗,每组4 只大鼠的脊髓于4%中性甲醛中固定,用于苏木精-伊红(hematoxylin-eosin, HE)染色;另4 只大鼠的脊髓置于-80℃冷冻保存,用于检测mRNA 和蛋白的表达。
1.3.4 大鼠尿流动力学检测排空膀胱后,大鼠仰卧位固定,将三通导管中的空气排空,一端由尿道插入膀胱并固定,一端连接测压通道,另一侧连接微量灌注泵,记录膀胱基础压力后,向膀胱中匀速注入温生理盐水(0.2 mL/min),密切观察膀胱压力变化,当尿道口有液体流出时,记录此时压力值,为膀胱漏尿点压力,此时注入的生理盐水容量为膀胱最大容量。液体流出后继续注入温生理盐水,至逼尿肌压力稳定,根据公式计算得出膀胱顺应性。膀胱顺应性=膀胱容量的变化/压力变化。
1.3.5 大鼠脊髓组织HE 染色及病理学评分取固定好的脊髓组织标本,70%乙醇脱水,透明,石蜡包埋,切片厚约4 μm,HE 染色,封片后置于光镜下观察脊髓组织病理变化,并进行病理学评分。0 分:无炎症细胞浸润,1 分:炎症细胞仅出现在血管周围;2~4 分:脊髓周围出现轻、中、重度炎症细胞浸润[10]。
1.3.6 qRT-PCR 检测大鼠脊髓组织NGF、TrkA mRNA 的表达取部分冷冻保存的脊髓组织,根据TRIzol 试剂盒说明书提取脊髓组织总RNA,采用紫外吸收法检测纯度及浓度,以总RNA 为模板,逆转录为cDNA,qPCR 反应体系:SYBR 4 μL,正反向引物各1 μL,cDNA 模板4 μL,H2O 加至20 μL;扩增条件:95℃预变性2 min;95℃变性10 s,58℃退火15 s,72℃延伸10 s,共40 个循环。β-actin 为内参基因,采用2-ΔΔCT法计算脊髓组织NGF、TrkA mRNA 相对表达量,NGF、TrkA 及内参引物序列见表1。

表1 qRT-PCR引物序列
1.3.7 Western blotting 检测大鼠脊髓组织NGF、TrkA 蛋白的表达取冷冻保存的脊髓组织研磨匀浆,加入裂解液对组织进行裂解,测定蛋白浓度,电泳分离目的蛋白,采用PVDF 膜进行转膜,用Western洗涤液洗去转膜液,封闭1 h,按一抗说明书进行稀释,加入一抗NGF、TrkA 及内参后在4℃条件下,摇床孵育过夜,再加入山羊抗兔二抗,孵育2 h,最后显影得到结果[11]。蛋白相对表达量=目的蛋白积分光密度值(IOD)/β-Actin IOD。
1.4 统计学方法
数据分析采用SPSS 22.0 统计软件。符合正态分布的计量资料以均数±标准差(±s)表示,比较用单因素方差分析,进一步两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠膀胱重量、残余尿量比较
对照组、模型组、通腑茯苓饮组、电针组及联合组大鼠膀胱重量、残余尿量比较,经方差分析,差异有统计学意义(F=90.861 和27.951,均P=0.000)。进一步两两比较结果:与对照组比较,模型组、通腑茯苓饮组、电针组及联合组的膀胱重量、残余尿量增加(P<0.05);与模型组比较,通腑茯苓饮组、电针组及联合组的膀胱重量、残余尿量减少(P<0.05);与通腑茯苓饮组比较,电针组及联合组的膀胱重量、残余尿量减少(P<0.05),与电针组比较,联合组的膀胱重量、残余尿量减少(P<0.05)。见表2。
表2 各组大鼠膀胱重量、残余尿量比较 (n=8,±s)
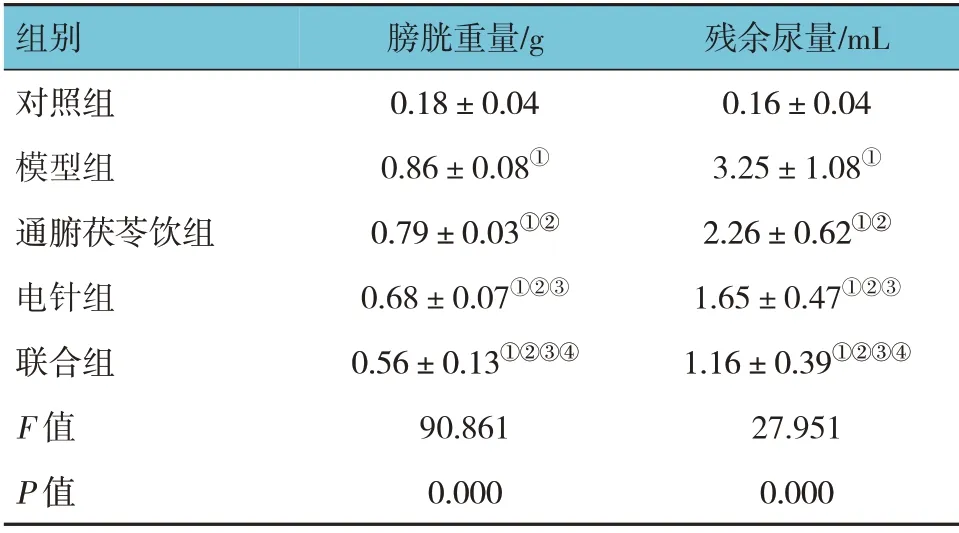
表2 各组大鼠膀胱重量、残余尿量比较 (n=8,±s)
注:①与对照组比较,P <0.05;②与模型组比较,P <0.05;③与通腑茯苓饮组比较,P <0.05;④与电针组比较,P <0.05。
组别对照组模型组通腑茯苓饮组电针组联合组F 值P 值膀胱重量/g 0.18±0.04 0.86±0.08①0.79±0.03①②0.68±0.07①②③0.56±0.13①②③④90.861 0.000残余尿量/mL 0.16±0.04 3.25±1.08①2.26±0.62①②1.65±0.47①②③1.16±0.39①②③④27.951 0.000
2.2 各组大鼠尿流动力学指标比较
对照组、模型组、通腑茯苓饮组、电针组及联合组大鼠膀胱漏尿点压力、膀胱顺应性及膀胱最大容量比较,经方差分析,差异有统计学意义(F=25.988、23.317 和63.828,均P=0.000)。进一步两两比较结果:与对照组比较,模型组、通腑茯苓饮组、电针组及联合组的膀胱漏尿点压力升高,膀胱顺应性降低、膀胱最大容量减少(P<0.05);与模型组比较,通腑茯苓饮组、电针组及联合组的膀胱漏尿点压力降低,膀胱顺应性升高、膀胱最大容量增加(P<0.05);与通腑茯苓饮组比较,电针组及联合组的膀胱漏尿点压力降低,膀胱顺应性升高、膀胱最大容量增加(P<0.05),与电针组比较,联合组的膀胱漏尿点压力降低,膀胱顺应性升高、膀胱最大容量增加(P<0.05)。见表3。
表3 各组大鼠尿流动力学指标比较 (n=8,±s)
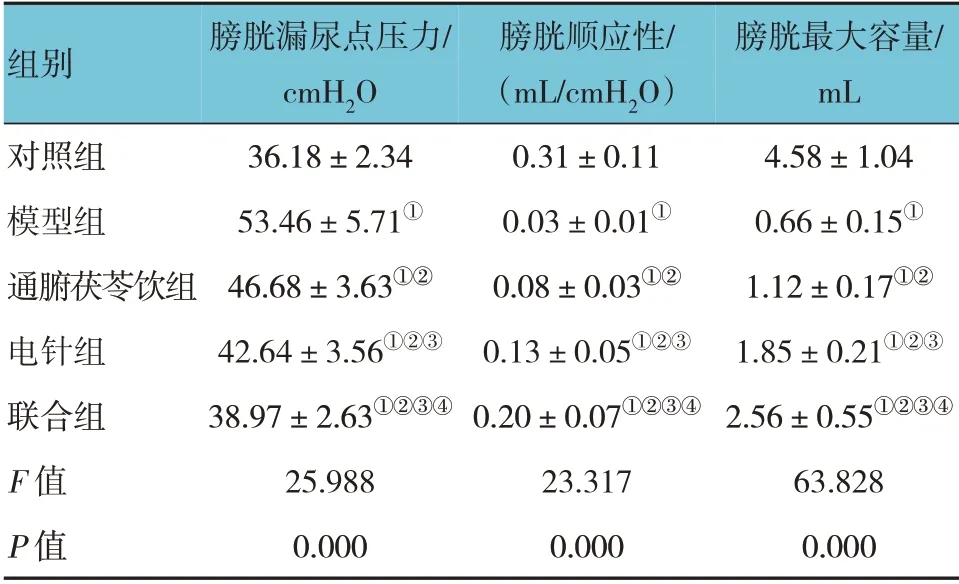
表3 各组大鼠尿流动力学指标比较 (n=8,±s)
注:①与对照组比较,P <0.05;②与模型组比较,P <0.05;③与通腑茯苓饮组比较,P <0.05;④与电针组比较,P <0.05。
膀胱最大容量/mL 4.58±1.04 0.66±0.15①1.12±0.17①②1.85±0.21①②③2.56±0.55①②③④63.828 0.000组别对照组模型组通腑茯苓饮组电针组联合组F 值P 值膀胱漏尿点压力/cmH2O 36.18±2.34 53.46±5.71①46.68±3.63①②42.64±3.56①②③38.97±2.63①②③④25.988 0.000膀胱顺应性/(mL/cmH2O)0.31±0.11 0.03±0.01①0.08±0.03①②0.13±0.05①②③0.20±0.07①②③④23.317 0.000
2.3 各组大鼠脊髓组织病理变化及评分比较
HE 染色结果显示,对照组脊髓结构完整,神经细胞核膜清晰,分布均匀,无明显炎症细胞浸润;模型组可见炎症细胞浸润,血管周围可见“管套状”结构;与模型组比较,通腑茯苓饮组、电针组及联合组炎症细胞浸润减少,局部可见“管套状结构”。见图1。
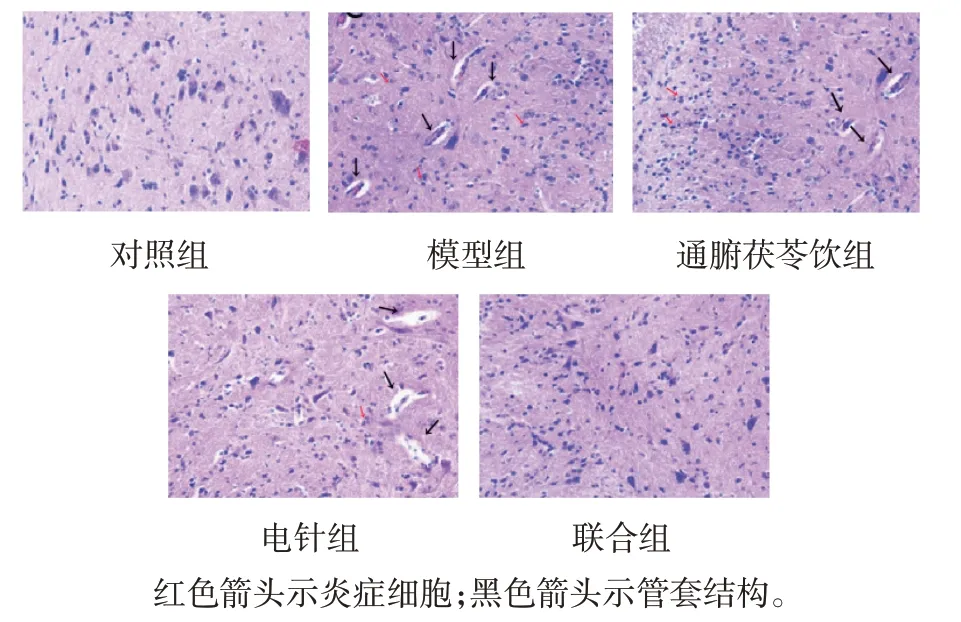
图1 各组大鼠脊髓组织病理切片 (HE染色×200)
对照组、模型组、通腑茯苓饮组、电针组及联合组大鼠脊髓组织病理评分分别为(0.00+0.00)分、(3.61±0.38)分、(2.68±0.28)分、(1.91±0.20)分和(1.02±0.11)分,经方差分析,差异有统计学意义(F=143.713,P=0.000)。进一步两两比较结果:与对照组比较,模型组、通腑茯苓饮组、电针组及联合组病理评分升高(P<0.05);与模型组比较,通腑茯苓饮组、电针组及联合组病理评分降低(P<0.05);与通腑茯苓饮组比较,电针组及联合组病理评分降低(P<0.05),与电针组比较,联合组病理评分降低(P<0.05)。
2.4 各组大鼠脊髓组织NGF、TrkA mRNA 相对表达量比较
对照组、模型组、通腑茯苓饮组、电针组及联合组大鼠脊髓组织NGF、TrkA mRNA 相对表达量比较,经方差分析,差异有统计学意义(F=63.286 和141.237 均P=0.000)。进一步两两比较结果:与对照组比较,模型组、通腑茯苓饮组、电针组及联合组NGF、TrkA mRNA 相对表达量降低(P<0.05);与模型组比较,通腑茯苓饮组、电针组及联合组NGF、TrkA mRNA 相对表达量升高(P<0.05);与通腑茯苓饮组比较,电针组及联合组NGF、TrkA mRNA 相对表达量升高(P<0.05),与电针组比较,联合组NGF、TrkA mRNA 相对表达量升高(P<0.05)。见表4。
表4 各组大鼠脊髓组织NGF、TrkA mRNA相对表达量比较 (n=4,±s)
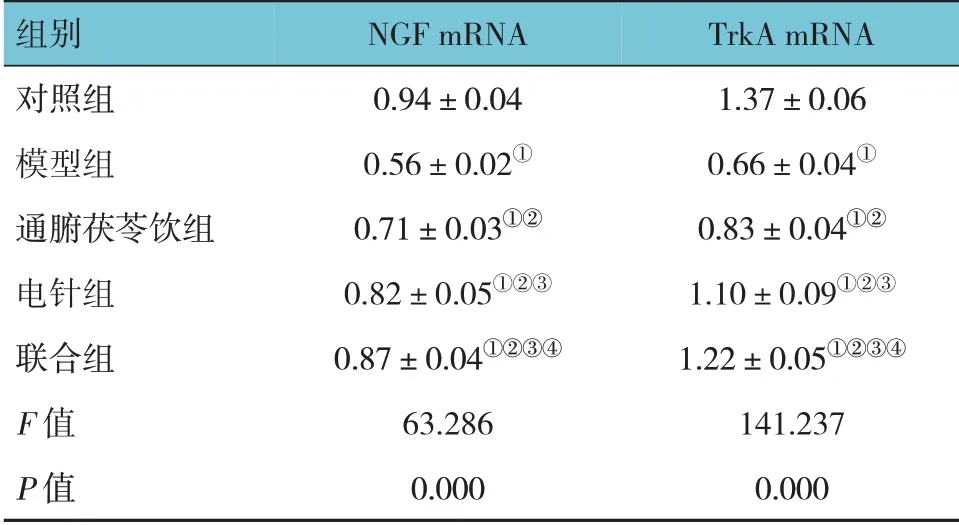
表4 各组大鼠脊髓组织NGF、TrkA mRNA相对表达量比较 (n=4,±s)
注:①与对照组比较,P <0.05;②与模型组比较,P <0.05;③与通腑茯苓饮组比较,P <0.05;④与电针组比较,P <0.05。
TrkA mRNA 1.37±0.06 0.66±0.04①0.83±0.04①②1.10±0.09①②③1.22±0.05①②③④141.237 0.000组别对照组模型组通腑茯苓饮组电针组联合组F 值P 值NGF mRNA 0.94±0.04 0.56±0.02①0.71±0.03①②0.82±0.05①②③0.87±0.04①②③④63.286 0.000
2.5 各组大鼠脊髓组织NGF、TrkA 蛋白相对表达量比较
对照组、模型组、通腑茯苓饮组、电针组及联合组大鼠脊髓组织NGF、TrkA 蛋白相对表达量比较,经方差分析,差异有统计学意义(F=239.253 和72.746 均P=0.000)。进一步两两比较结果:与对照组比较,模型组、通腑茯苓饮组、电针组及联合组NGF、TrkA 蛋白相对表达量降低(P<0.05);与模型组比较,通腑茯苓饮组、电针组及联合组NGF、TrkA蛋白相对表达量升高(P<0.05);与通腑茯苓饮组比较,电针组及联合组NGF、TrkA 蛋白相对表达量升高(P<0.05),与电针组比较,联合组NGF、TrkA 蛋白相对表达量升高(P<0.05)。见表5 和图2。
表5 各组大鼠脊髓组织NGF、TrkA蛋白相对表达量比较(n=4,±s)
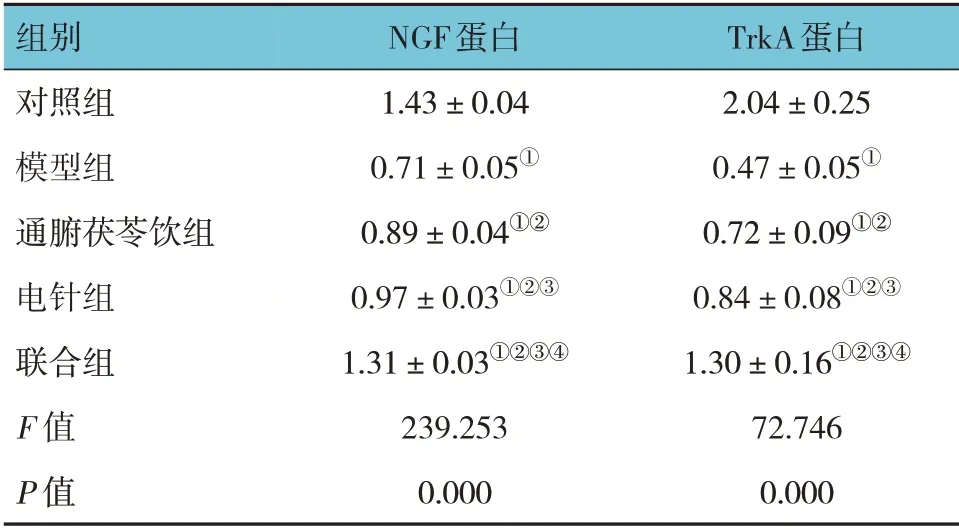
表5 各组大鼠脊髓组织NGF、TrkA蛋白相对表达量比较(n=4,±s)
注:①与对照组比较,P <0.05;②与模型组比较,P <0.05;③与通腑茯苓饮组比较,P <0.05;④与电针组比较,P <0.05。
TrkA蛋白2.04±0.25 0.47±0.05①0.72±0.09①②0.84±0.08①②③1.30±0.16①②③④72.746 0.000组别对照组模型组通腑茯苓饮组电针组联合组F 值P 值NGF蛋白1.43±0.04 0.71±0.05①0.89±0.04①②0.97±0.03①②③1.31±0.03①②③④239.253 0.000

图2 各组大鼠脊髓组织NGF、TrkA蛋白的表达
3 讨论
SSCI 后NB 是由中枢神经系统受损导致,中医认为SSCI 后NB 的病机为淤血凝滞、督脉不同。电针能够促进内源性神经干细胞增殖分化,有利于神经细胞的恢复。中医常用电针治疗NB,其在穴位功效的基础上,采用电刺激,在穴位之间形成电流,更深度刺激穴位发挥功效。廖福金等[12]研究结果显示,针刺长强穴能够改善SSCI 后NB 大鼠的排尿能力,改善膀胱功能。因此,本研究选用长强穴和维胞穴进行电针刺激,2 个穴位能够在体内形成一条电流,起到通督补肾、恢复膀胱气化的作用[13]。加之通腑茯苓饮的利水、理气加速代谢的作用,通过多方面对SSCI 后NB 进行调理,但其作用机制尚不确切。NGF、TrkA 对中枢神经元的发育、再生及功能特性的表达均有一定的调控作用。有研究证实,NGF、TrkA 能够加速神经元的修复[14],因此推测NGF-TrkA 信号通路在NB 中发挥一定作用。
本研究通过Hassan Shakerl 脊髓横断法复制SSCI 模型,该方法能够完全横断脊髓并准确定位脊髓损伤部位,有利于后续切片观察,且较为简便。采用通腑茯苓饮、电针及两者联合对SSCI 后NB 的作用进行比较,结果表明通腑茯苓饮、电针治疗SSCI 后NB 均有一定疗效,其中联合治疗对于膀胱功能及尿流动力学指标的改善效果更明显。本研究中大鼠脊髓组织病理变化及病理评分结果同样证实联合治疗对大鼠脊髓组织的修复作用更明显,能减少炎症细胞浸润。分析其原因为通腑茯苓饮由茯苓、车前子、乌药、琥珀、黄芪、白术、泽泻、冬葵子、通草、滑石、牛膝组成;其中茯苓健脾利水;车前子利水通淋;乌药温肾行气,肾气化生,致膀胱气化,尿液排出;琥珀宣窍;重用黄芪补气升阳,健脾益肺,利水消肿、活血化瘀,于补益中兼具通泻之功;白术、泽泻健脾利水,佐以冬葵子、滑石、通草,增强滑窍利水通淋之功;牛膝通经活血、利水通淋、祛除邪结[15]。通腑茯苓饮联合电针刺激长强穴及维胞穴,能够发挥通调水道、行气利水的功效,同时强督脉阳气,调畅通淋,多种作用途径增强膀胱功能,使其效果显著优于通腑茯苓饮及电针单独治疗。
NGF 是神经营养因子中的一种,对神经的生长、损伤过程均有一定影响。此外,NGF 还可以保护细胞免受氧化应激损伤,TrkA 是NGF 受体,能够促进神经元出芽,修复受损的神经回路[16]。当脊髓受损时,NGF 能促进神经细胞凋亡。本研究结果表明,SSCI 后NB 大鼠脊髓组织NGF、TrkA mRNA 和蛋白相对表达量降低,可能是检测时NGF、TrkA 已处于高峰后的下降时期。经电针或通腑茯苓饮治疗后,NGF、TrkA mRNA 和蛋白相对表达量升高,而两者联合治疗后NGF、TrkA mRNA 和蛋白相对表达量接近正常水平。分析期原因为NGF 与受体TrkA 特异性结合后激活NGF,能够维持神经元活性,加速突触成熟,使轴突延长,促进中枢神经系统的发育和修复[17]。通腑茯苓饮可能通过激活P13K/Akt 信号通路,抑制脊髓损伤神经细胞的凋亡,促进神经元的出芽及神经回路的重建,加速神经再生,从而减轻脊髓损伤[18]。本研究结果提示通腑茯苓饮联合电针能够有效激活NGF-TrkA 信号通路,减轻SSCI 后NB 对大鼠膀胱及脊髓的损伤。
综上所述,通腑茯苓饮联合电针能够改善SSCI后NB 大鼠膀胱功能,其作用机制可能与NGF-TrkA信号通路有关。未来可对NGF、TrkA 上下游蛋白进行深入研究,进一步验证通腑茯苓饮联合电针对NGF-TrkA 信号通路的调控作用,为治疗SSCI 后NB提供科学依据。
