高级别宫颈上皮内瘤变宫颈锥切术后高危型人乳头瘤病毒转归影响因素
2022-10-05林俊
林 俊
浙江省嘉兴市妇幼保健院(314000)
宫颈鳞状上皮内病变(SIL)分为低级别宫颈鳞状上皮内病变(LSIL)和高级别宫颈鳞状上皮内病变(HSIL)。20%~45%不予干预者HSIL会进展为宫颈浸润癌[1]。子宫颈锥切术是HSIL主要治疗方案,可有效阻断疾病进展,但部分患者术后仍会复发甚至进展为更严重病变,这可能与高危型人乳头瘤病毒(HR-HPV)持续感染有关[2]。故宫颈锥切术后随访管理尤为重要。本研究对HR-HPV感染的HSIL患者宫颈锥切术后定期随访,分析术后HR-HPV转归及其影响因素,为HSIL患者术后临床管理提供参考。
1 资料与方法
1.1 一般资料
选择2017年2月—2019年4月于本院妇科因HSIL行宫颈锥切术患者229例,术前HPV分型检测证实伴有HR-HPV感染,术后病理证实切缘为阴性。排除标准:①术前或随访期间应用过针对HR-HPV的治疗;②伴有其他性传播疾病或免疫系统疾病,如梅毒、系统性红斑狼疮等;③既往进行过宫颈治疗;④妊娠期。剔除术后随访期间因各种原因失访者。研究对象均知情同意,本研究经院伦理委员会审核。
1.2 手术及检测方法
1.2.1宫颈锥切术患者常规消毒、铺巾,充分暴露宫颈,利多卡因局麻,于宫颈部碘不着色区以外0.5cm处圆锥形切除部分宫颈,深度2.5cm,创面电凝止血,切除的宫颈组织常规病理检查。
1.2.2HR-HPV检测患者取膀胱截石位,充分暴露宫颈,应用专用细胞刷于宫颈鳞柱状交界处规范取材,将细胞刷置于保存液中。HR-HPV由本院检验科检测,采用膜芯片导流杂交基因分型技术行HPV 分型(16、18、31、33、35、39、45、51、52、56、58、59、66、68)。
1.3 术后随访
分别于术后6、12、18、24个月行HR-HPV检测。HR-HPV转阴:连续2次HR-HPV检测均为阴性。HR-HPV持续感染:术后24个月同一种亚型HR-HPV感染持续阳性。
1.4 统计学方法
采用SPSS 23.0统计软件。计量资料组间比较采用t检验,HR-HPV转阴率比较采用χ2检验,HR-HPV持续感染的影响因素分析采用logistic回归,预测效能采用受试者工作曲线(ROC)分析。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
纳入研究229例,年龄(37.5±9.7)岁,体质指数(21.8±5.5)kg/m2;术后6、12、18、24个月HR-HPV转阴率分别为61.1%(140/229)、71.6%(164/229)、78.2%(179/229)、84.3%(193/229),HR-HPV持续感染率为15.7%(36/229)。无再发感染病例。
2.2 不同临床特征患者HR-HPV转阴率比较
术后6、12个月HR-HPV转阴率年龄≥40岁患者低于年龄<40岁患者(P<0.05),术后18、24个月HR-HPV转阴率不同年龄组间无差异(P>0.05);单一亚型感染与多种亚型感染的患者术后6、12、18、24个月HR-HPV转阴率均无差异(P>0.05)。HPV16/18感染的患者术后6、12、18、24个月HR-HPV转阴率低于其他HPV亚型感染患者(P<0.05)。见表1。

表1 不同年龄患者HR-HPV转阴率比较[例(%)]
2.3 HR-HPV持续感染高危因素
logistic回归分析,年龄≥40岁、HPV16/18感染是HR-HPV持续感染的独立危险因素(P<0.05);多种亚型感染与HR-HPV持续感染无相关性(P>0.05)。见表2。
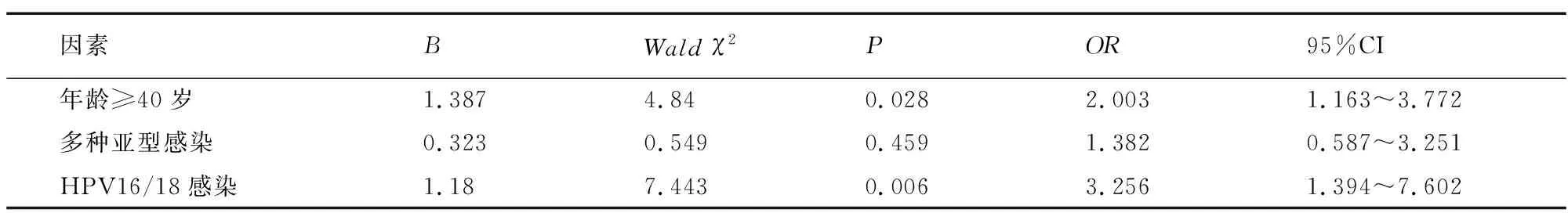
表2 HR-HPV持续感染的高危因素
2.4 预测术后HR-HPV持续感染效能
ROC曲线分析显示,年龄≥40岁、多种亚型感染及HPV16/18感染对HR-HPV持续感染的AUC分别为0.549、0.583、0.542,均不具有预测效能(P>0.05)。
3 讨论
研究表明,HSIL进展为宫颈浸润癌的几率明显高于LSIL[3],宫颈锥切术可以有效的阻断疾病进展,是治疗HSIL的常用方法[4]。已经明确HR-HPV持续感染是宫颈癌发生的独立危险因素[5]。对于接受治疗的HSIL患者,若术后HR-HPV病毒未转阴,则可以通过隐匿感染的形式重新侵入移行带,引起疾病的复发甚至加重。可见,HR-HPV检测成为了宫颈癌前病变治疗后随访的重要监测项目之一[6]。HSIL患者在宫颈锥切术HR-HPV转阴时间各研究不尽相同。有研究[7]发现HR-HPV 转阴率在术后 4、8、12、18、24 个月分别为50.0%、71.2%、77.6%、84.6%、86.5%;颜莉莉[8]对350例HSIL患者术后12、24、48个月随访发现,HR-HPV转阴率分别为76.70%、77.80%、72.20%。本研究术后6、12、18、24个月HR-HPV的转阴率分别为61.1%、71.6%、78.2%、84.3%,术后6个月HR-HPV转阴率低于既往文献,考虑原因可能为本研究病例数有限,以及随访间隔时间不同导致。
宫颈锥切术后HR-HPV持续感染可能与宫颈病变级别、HR-HPV病毒载量、切缘阳性密切相关。以治疗后6个月为界限,HPV持续感染患者活检病理高级别病变及切缘阳性的比率高于HPV阴性组[9]。有研究以每10年为一年龄段分组进行研究,发现≥50岁的HSIL患者锥切术后6个月HR-HPV转阴率低于较年轻者[10]。HPV16/18亚型是患者感染的最常见亚型,也是与宫颈癌关系最密切的亚型,其致癌潜力最强[11]。国内学者张阳[12]应用Kaplan-Meier 法分析病毒消退时间发现,HPV16/18亚型感染的患者术后病毒消退时间明显长于其他亚型感染;然而,另有研究发现[13]HPV16/18亚型感染与非HPV16/18亚型感染的患者锥切术后HR-HPV转阴率并无统计学差异。关于多种亚型感染是否会影响术后HR-HPV的转归尚无明确定论。有研究发现[14]术前是否多重感染与术后HR-HPV的转归无明显相关;但有学者[15]发现了不同的结论,HPV多种亚型感染的患者更易出现术后12个月HR-HPV持续感染。
本研究为了规避病变级别及切缘状态对研究结果的影响,仅选择HSIL且病理证实锥切术后切缘为阴性的患者作为研究对象。研究发现年龄≥40岁的患者术后6、12个月HR-HPV转阴率低于年龄<40岁患者;HPV16/18感染的患者术后6、12、18、24个月HR-HPV转阴率均低于其他HPV亚型感染患者,且年龄≥40岁、HPV16/18感染是术后24个月HR-HPV持续感染的独立危险因素,说明年龄、HPV感染的亚型与术后HR-HPV消退有关,对于HSIL患者,具备年龄偏大或HPV16/18亚型感染需引起临床重视。本研究未发现多种亚型感染与术后24个月HR-HPV持续感染有相关性,推测对于多重感染的患者术后并不需要增加随访频率。值得一提的,尽管患者年龄、HPV感染亚型与HSIL患者宫颈锥切术后24个月持续感染有关,但二者对HR-HPV持续感染并不具有预测价值,不能作为预测术后HR-HPV转阴的指标。
对于HSIL患者,宫颈锥切术后并非一劳永逸,监测HPV转归是临床管理的重要内容之一。对于年龄偏大、HPV亚型为16/18的患者,需充分告知术后HPV转阴时间可能较长,临床需密切随访,必要时及时干预。然而,对于各种宫颈癌前病变治疗术后HPV转归时间还需要不断探索,以标准化、规范化的随访流程及诊断指标,更好地指导临床。
