scFv-DEC205-Trap重组包涵体靶向抗原复性及过程的优化①
2022-10-02佟春玉张喆林王森郑小会韩玉芳崔玉东宋博翠
佟春玉 张喆林 王森 郑小会 韩玉芳 崔玉东 宋博翠
(黑龙江八一农垦大学生命科学技术学院,大庆 163000)
金黄色葡萄球菌已经成为全世界人类细菌疾病的罪魁祸首之一。金黄色葡萄球菌亚单位疫苗的研发主要从其致病性的毒力因子为出发点,本实验选取的是金黄色葡萄球菌靶向RNAⅢ激活蛋白(target of RNAⅢactivating protein,TRAP)蛋白[1]。TRAP是一种膜相关的167个氨基酸所组成的蛋白,没有跨膜结构域,在金黄色葡萄球菌中高度保守,且为金黄色葡萄球菌所特有[2]。金黄色葡萄球菌毒力因子的产生是通过组氨酸磷酸化TRAP的靶点和激活AGR基因位点来调节的。RNAⅢ激活蛋白(RAP)的磷酸化导致agr群体感应系统的激活,从而产生一种称为RNAⅢ的调节性mRNA分子,并导致毒素的产生。因此,TRAP蛋白在金黄色葡萄球菌毒力致病性方面占据着极其重要的地位,在所有菌株中都是保守的,可作为葡萄球菌疫苗候选抗原。
虽然体液免疫是抵御金黄色葡萄球菌感染的重要措施,但这种抗体反应不足以清除细菌或减少炎症反应,因此金黄色葡萄球菌疫苗要在体液免疫基础上引起足够强的细胞免疫才能抵御金黄色葡萄球菌的侵染,而树突状细胞(dendritic cell,DC)是能专职激活细胞免疫的抗原提呈细胞。DC是哺乳动物体内最强的抗原提呈细胞,唯一可以激活初始T细胞的抗原提呈细胞,将疫苗靶向到DC成为近年的研究热点。DEC205是上个世纪末SWIGGARD等在小鼠树突细胞表面发现的[3]。DEC205为C型凝集素受体,具有高效靶向性,能准确高效且特异地靶向提呈抗原。
重组表达系统主要包括真核表达系统和原核表达系统,原核表达系统相对于真核系统来说操作更加简单,表达量更高,适用于无修饰的蛋白。因此,大肠杆菌表达系统常常作为实验的首选,具有异源表达量高、基因组清楚、周期短、抗感染能力强、遗传背景清楚等优点[4]。但蛋白质在大肠杆菌表达系统中快速、大量表达时常形成包涵体,包涵体大小50~500 nm,形状不固定,只溶一些盐酸胍、尿素等变性剂。包涵体形成过程中蛋白质的氨基酸排列顺序是正确无误的,但进行空间折叠形成高级结构过程中出现错误,所以没有生物活性。包涵体一般含有一半以上的重组蛋白,其余为RNA聚合酶、核糖体元件、外膜蛋白、质粒DNA等杂质。所以在包涵体进行溶解前一般需要对包涵体进行洗涤处理,目的是除去大多数的杂质,方便后续复性步骤[5-6]。包涵体在溶解的过程中高级结构遭到破坏,从而失去了生物活性,因此对重组蛋白进行复性操作成为重中之重。复性过程主要是变性的蛋白重新折叠的过程,但是在这个过程中会发生错误折叠和聚集等现象。传统的蛋白复性方法主要包括稀释复性法、透析复性法、超滤复性法,近几年来柱层析复性法、低分子添加物辅助复性法和分子伴侣辅助复性法等成为研究热点[7-8]。稀释复性法的优点是简单、可使还原剂及变性剂下降到一定浓度、复性蛋白易于后续检测。缺点是需要大量的复性缓冲液、生产成本高、不利于工业化生产[9]。透析复性法优点是不需要增加溶液的体积,缺点是实验时间长、容易形成沉淀、不适合产业化生产。超滤复性的优点是复性速度快,缺点只适合小量的样品,会在处理过程中出现不可逆的变性风险。低分子添加物辅助复性法和分子伴侣辅助复性法优点是操作简便、成本低以及复性率极高。低分子添加物辅助复性法中的添加物主要分为两种类型:一类是折叠助剂,包括硫酸铵盐、精氨酸等,功能是增加分子间的相互作用和稳定蛋白的天然构象;二类是聚集抑制剂,主要包括一些变形剂如盐酸胍和尿素、表面活性剂如吐温(Tween)、SDS等,功能是减弱分子内疏水作用抑制聚集的发生。Tween比PEG4000和PEG6000抑制蛋白聚集作用更强。L-精氨酸可提高蛋白复性效率[10]。阳离子表面活性剂和β-环糊精有助于蛋白折叠[11]。
为解决金黄色葡萄球菌免疫问题,实验构建了由靶向树突状细胞的DEC205单链抗体(scFv-DEC205)和金黄色葡萄球菌抗原Trap的靶向疫苗候选体重组抗原scFv-DEC205-Trap,但其诱导表达后主要以不可溶的包涵体形式存在,由于包涵体复性折叠的机制目前尚不清楚,体外复性率极低,如何从所形成的包涵体中提取、复性scFv-DEC205-Trap蛋白并保持良好的抗原性和靶向性,是本文要解决的问题。
1 材料与方法
1.1材料
1.1.1菌株和质粒金黄色葡萄球菌Newman株由八一农大生命学院实验室储存,重组菌株BL21(DE3)/pET-32a/scFVDEC205-TRAP质粒均由上海生工合成。
1.1.2主要实验试剂SacⅠ、HindⅢ、Cutsmart Buffer购自BioLab®公司;质粒DNA提取试剂盒购自Omega Bio-Tek公司;DL 5000 DNA Marker购自北京博迈德生物技术有限公司;PageRulerTMPrestained Protein Ladder购自Coolaber公司;琼脂糖、LB固体与液体培养基购自青岛海博生物有限公司;牛血清白蛋白(BSA)购自Sigma-Aldrich公司;山羊抗小鼠IgG/辣椒根酶标记购自天根生化科技(北京)有限公司;Tris-HCl、Tris、NaCl、尿素、EDTA、吐温80、甘油、PEG 6000、PEG 8000、TritonX-100、精氨酸购自纳川生物技术有限公司。
1.2方法
1.2.1BL21(DE3)/pET-32a/scFv-DEC205-Trap菌株鉴定
1.2.1.1质粒的提取与双酶切鉴定从-80℃冰箱中取出BL21(DE3)/pET-32a/scFv-DEC205-Trap菌株(由上海生工合成),放入冰盒中融化至液体,进行菌种的复苏实验。首先在超净工作台中将提前灭菌的含氨苄青霉素的LB固体培养基进行倒板,待固体培养基凝固后,轻轻挑取菌株进行划线处理,置于37℃恒温培养箱中培养12 h,12 h后挑取长势良好的单菌落,接种于3 ml含Amp+的LB液体培养基中,在37℃、180 r/min振荡摇床摇12 h,然后吸取2 ml菌液提取基因质粒。根据质粒提取试剂盒配套方案进行质粒提取,提取后的质粒使用Nanodrop2000/2000C分光光度计测定质粒浓度,根据公式计算出质粒加入量,采用限制性内切酶SacⅠ进行单酶切,SacⅠ和HindⅢ双酶切(酶切体系:SacⅠ1 μl,HindⅢ1 μl,重组质粒8 μl,Cutsmart Buffer 2 μl,ddH2O 8 μl)37℃水浴30 min,1%琼脂糖凝胶电泳验证,观察实验结果。
1.2.1.2基因测序对双酶切鉴定正确的菌株送往吉林省库美有限公司进行测序,测得序列与已发表序列进行比对(图1),并将鉴定无误的菌株扩大培养,冷冻保存。
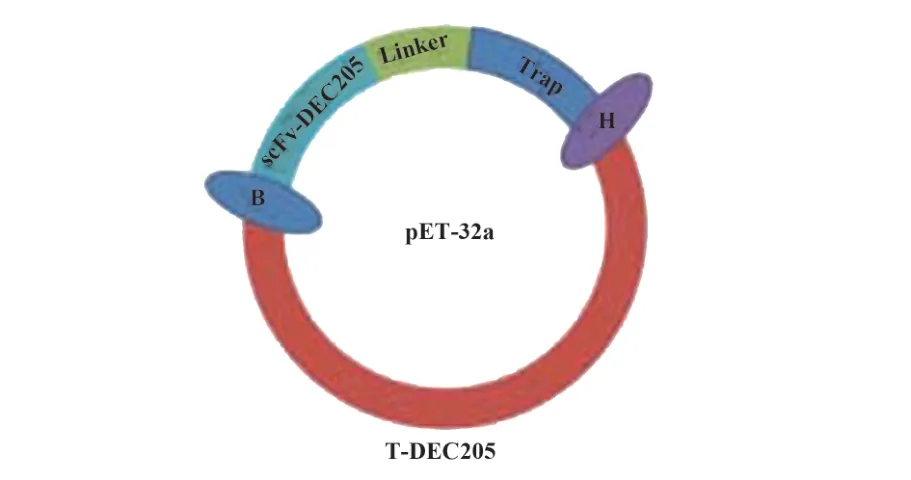
图1 重组蛋白表达载体质粒示意图Fig.1 Schematic diagram of fusion protein expression vector plasmid
1.2.1.3SDS-Page鉴定将活化的BL21(DE3)/pET-32a/scFv-DEC205-Trap重组菌以1∶100比例接种至Amp+抗性LB液体培养基,在37℃,180 r/min条件下培养,直至菌液OD600nm值在0.6~0.8之间。加终浓度0.1 mmol/L的IPTG诱导表达4 h后,吸取1 ml菌液,8 000 r/min离心10 min,弃上清,加入40 μl无菌ddH2O重悬沉淀,再加5×上样缓冲液(含β-巯基乙醇)10 μl,涡旋混匀后,100℃沸水浴10 min,冷却至室温,取5 μl样品进行SDS-PAGE分析。首先组装仪器进行验漏,配置分离胶,等待30 min后配置浓缩胶并插梳子,静置30 min后点样,首先80 V恒压电泳至样品进入分离胶层,调节电压至120 V,直至溴酚蓝到达分离胶底部终止电泳。进行切胶后小心取下凝胶放入考马斯蓝R-250染色液中染色20 min,在脱色液中进行脱色,直到条带清晰可见,进行拍照。
1.2.2scFv-DEC205-Trap诱导表达将活化的重组菌株scFv-DEC205-Trap以1∶100接种至Amp+抗性LB液体培养基,37℃,180 r/min摇床中振荡培养,直至菌液OD600为0.6~0.8,停止培养。加终浓度0.1 mmol/L的IPTG诱导表达4 h,4℃8 000 r/min离心10 min收集菌体,用缓冲液(50 mmol/L Tris-HCl pH=8.0,100 mmol/L NaCl)洗涤菌体2次,然后用溶液(50 mmol/L Tris-HCl pH=8.0,100 mmol/L NaCl,1%Triton X-100)重悬菌体(溶液与菌液比例约为20 ml∶200 ml),冰浴超声破碎菌体15 min(功率:150 W,破碎/间隔时间为:5 s/5 s)。
1.2.3scFv-DEC205-Trap包涵体沉降将超声波破碎后的混悬液用涡旋机涡旋混匀后,取4管(每管200 μl)混悬液,分别以100 g、400 g、900 g、6 200 g离心3 min,然后取沉淀和上清,进行SDS-PAGE电泳。
1.2.4scFv-DEC205-Trap包涵体洗涤选取最优离心条件离心后的包涵体,分别用洗涤液Ⅰ(50 mmol/L Tris-HCl pH=8.0,100 mmol/L NaCl,0.5%Triton X-100,2 mol/L尿素)、洗涤液Ⅱ(100 mmol/L Tris-HCl pH=8.0,300 mmol/L NaCl,3%Triton X-100)各洗涤1次,洗涤时需在4℃冷冻摇床上振摇30 min,收集大量的scFv-DEC205-Trap离心沉淀物。
1.2.5scFv-DEC205-Trap包涵体溶解探索影响scFv-DEC205-Trap包涵体溶解的4个条件包括溶解溶液、溶解温度、溶解时间以及是否振荡进行单因素优化,设计详见表1。
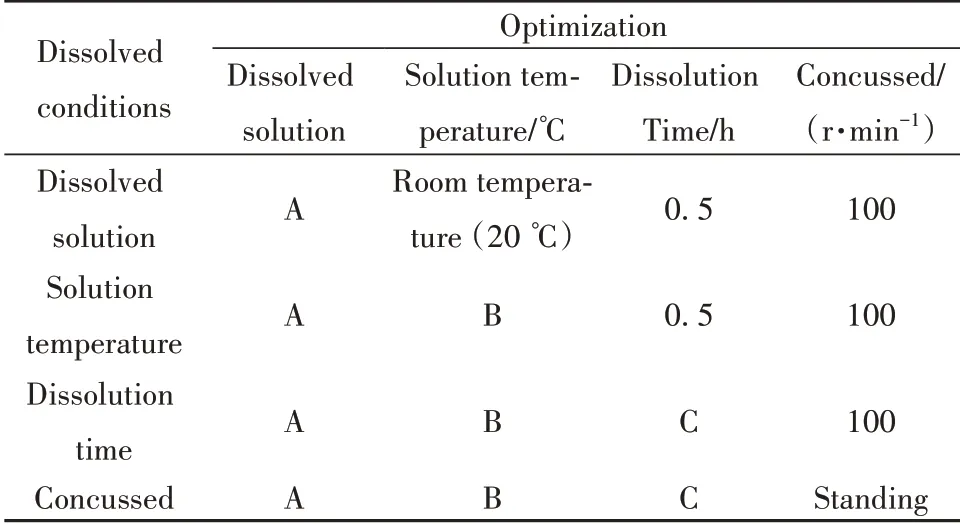
表1 溶解条件优化表Tab.1 Optimization of dissolved conditions
取4管洗涤后的包涵体混悬液,每管200 μl,8 000 r/min离心10 min,弃尽上清,称取每管包涵体重量,按照1 g湿重包涵体中加入20 ml溶解液的比例分别加入2、4、6、8 mol/L的尿素溶液,室温条件下,100 r/min振荡0.5 h溶解包涵体,离心后取上清进行SDS-PAGE检测;同样方法取4管包涵体混悬液,用最优尿素溶解溶液A,分别在4℃、20℃、30℃、40℃条件下,100 r/min振荡0.5 h溶解包涵体,离心后取上清SDS-PAGE检测;再取4管包涵体混悬液,用最优的尿素溶液A和温度B,100 r/min分别振荡0.5 h、1 h、1.5 h、2 h、12 h,5个时间溶解包涵体,离心后取上清SDS-PAGE检测;取2管包涵体混悬液,用优化后的A、B、C条件,分别以100 r/min振荡、静置溶解包涵体,离心后取上清SDS-PAGE检测(每组实验重复3次)。
1.2.6scFv-DEC205-Trap包涵体复性100 mmol/L Tris-HCl(pH=8.0)缓冲液中分别加入复性添加剂0.3 mol/L精氨酸、10%甘油、0.2%吐温80、5%PEG 6000、5%PEG 8000(表2),作为包涵体复性缓冲液,每种缓冲液分别以25∶1、20∶1、15∶1、10∶1、5∶1的比例稀释包涵体溶解液,4℃振荡24 h,8 000 r/min离心3 min,采用酶标仪测定上清蛋白浓度,同时进行聚丙烯酰胺凝胶电泳检测,每组实验重复3次,选择效果最佳的复性添加剂。

表2 不同添加剂的scFv-DEC205-Trap包涵体复性缓冲液Tab.2 Buffer with different additives for renaturation of scFv-DEC205-Trap inclusion bodies
1.2.7Western blot鉴定复性后的scFv-DEC205-Trap聚丙烯酰胺凝胶电泳,115 mA恒流跑1.5 h后将蛋白转印至硝酸纤维素(NC)膜上,观察Marker是否转移成功,如果转移成功,用ddH2O水冲洗NC膜,并将NC膜放入5%脱脂乳中37℃密封1 h;弃掉密封液,加入适量PBST溶液振荡洗涤4次,15 min/次;弃尽PBST溶液,按1∶5 000比例稀释scFv-DEC205-Trap小鼠免疫后血清作为一抗溶液,室温孵育1 h;弃尽一抗溶液。重复上述一抗步骤,按1∶5 000比例稀释HRP标记的羊抗鼠IgG二抗溶液,室温孵育1 h后;弃尽二抗溶液。取出NC膜用ddH2O冲洗干净,使用ECL显色液显色,观察并记录实验结果。
2 结果
2.1重组质粒的鉴定结果对合成的含有scFv-DEC205-Trap目的基因的重组质粒进行提取,使用限制性内切酶SacⅠ进行单酶切和SacⅠ和HindⅢ进行双酶切鉴定,酶切产物的琼脂糖凝胶电泳结果如图2。结果显示:scFv-DEC205-Trap质粒在1 248 bp处可见清晰条带,同时双酶切之后条带与空载体条带大小相同,说明scFv-DEC205-Trap原核表达载体构建成功。
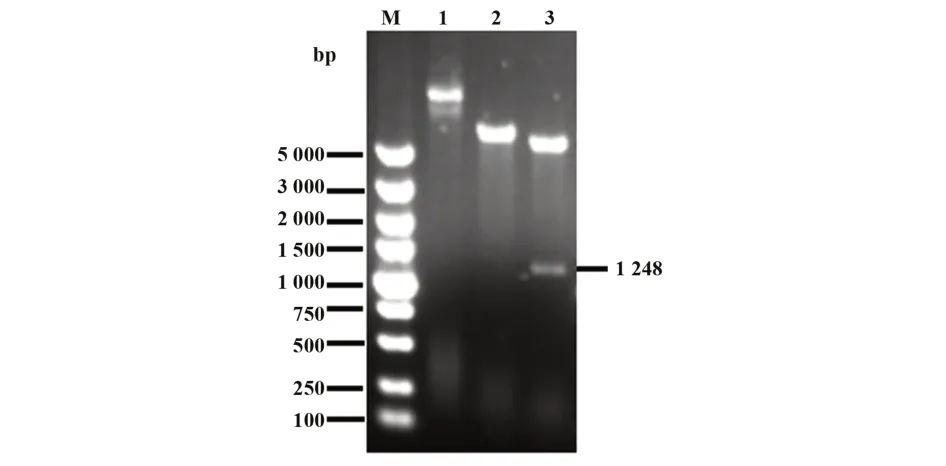
图2 scFv-DEC205-Trap质粒酶切鉴定结果Fig.2 Identification of scFv-DEC205-Trap plasmid by restriction enzyme digestion
2.2靶向重组蛋白的可溶性检测结果将质粒鉴定结果正确的scFv-DEC205-Trap用IPTG诱导后,为了尽量得到更多的蛋白,对菌液进行超声波破碎,再对超声波的沉淀与上清液分别进行聚丙烯酰胺凝胶电泳检测。结果如图3所示:scFv-DEC205-Trap蛋白在67 kD处的沉淀中的蛋白条带明显多于上清液,说明scFv-DEC205-Trap蛋白主要为不可溶蛋白。

图3 scFv-DEC205-Trap蛋白可溶性检测结果Fig.3 Soluble detection of scFv-DEC205-Trap protein
2.3scFv-DEC205-Trap包涵体沉降结果 经诱导表达后的scFv-DEC205-Trap菌株,分别以100 g、400 g、900 g、6 200 g离心力来沉淀菌体,再进行超声波破碎,之后采取聚丙烯酰胺凝胶电泳进行检测。结果显示:scFv-DEC205-Trap菌株经诱导后高效表达,且主要以不可溶性的包涵体形式存在,凝胶电泳结果显示在离心力大于400 g离心3 min以上,96%的包涵体蛋白可以沉淀下来(图4)。
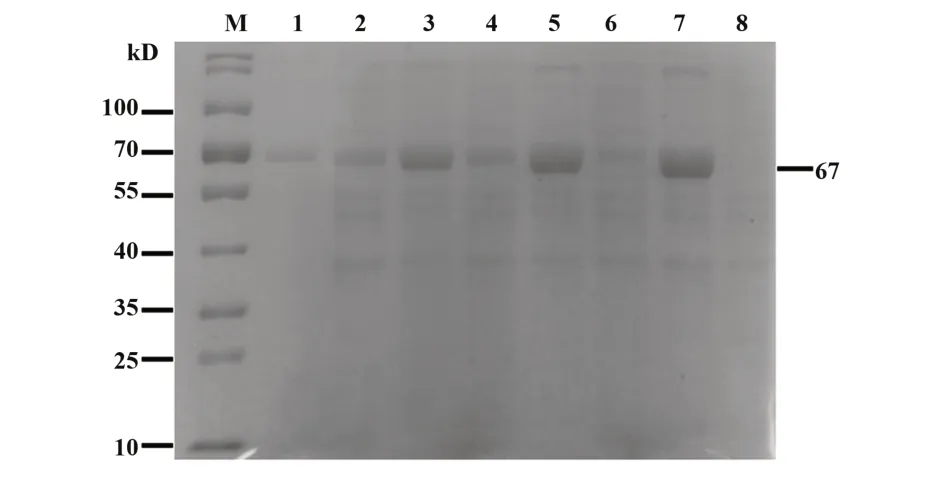
图4 scFv-DEC205-Trap包涵体沉降结果Fig.4 scFv-DEC205-Trap settlement results of inclusion body
2.4scFv-DEC205-Trap包涵体溶解结果用含2、4、6、8 mol/L 4个梯度的尿素溶液溶解包涵体,离心后取上清进行聚丙烯酰胺凝胶电泳。结果显示,4个梯度的尿素溶液溶解效果呈不断上升趋势,所以含8 mol/L的尿素溶液溶解效果最佳(图5A);以4℃、20℃、30℃、40℃4个温度溶解包涵体,结果显示,在4~40℃的温度范围内包涵体溶解效果大致相同,所以在4~40℃温度范围内均可使包涵体溶解(图5B);以0.5 h、1 h、1.5 h、2 h、12 h不同时间溶解包涵体,结果显示,0.5 h以上即可使包涵体溶解,但12 h溶解的效果最佳(图5C);100 r/min振荡、静置溶解包涵体,结果显示,振荡、静置对包涵体溶解无影响(图5D)。综上所述,本实验的最优选择是8 mol/L尿素溶液,室温条件下,振荡后静置0.5 h溶解scFv-DEC205-Trap包涵体效果最好。
2.5scFv-DEC205-Trap包涵体复性结果分别以25∶1、20∶1、15∶1、10∶1、5∶1比例在不同复性添加剂中稀释包涵体变性液,经过酶标仪浓度测定结果显示(图6):精氨酸复性添加剂缓冲液5倍稀释包涵体变性液,复性率高于其他组;复性添加剂PEG6000/8000复性率低于其他组;同时取5倍稀释的复性添加剂进行聚丙烯酰胺凝胶电泳,进一步证明了上述结论。综上,选择0.3 mol/L精氨酸的100 mmol/L Tris-HCl缓冲液5倍稀释包涵体变性液复性效果最好。
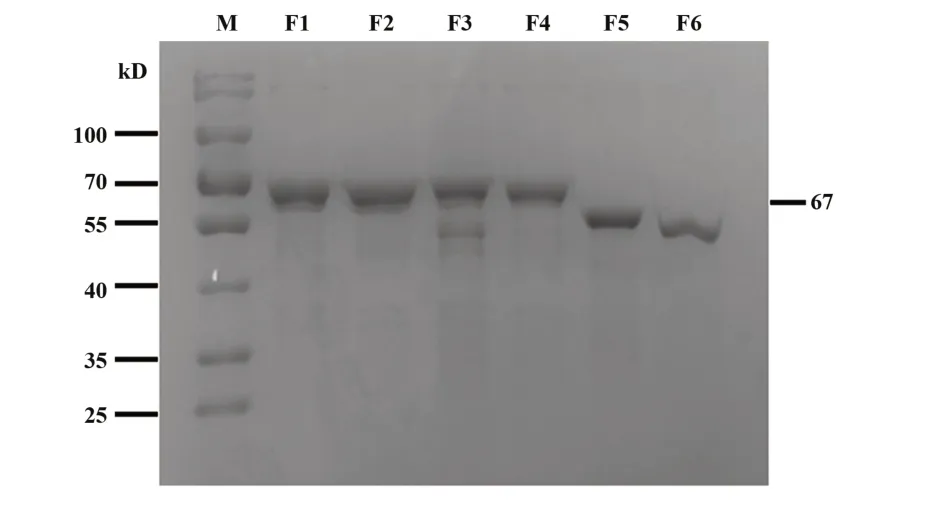
图6 包涵体复性结果Fig.6 Inclusion body renaturation
2.6复性后scFv-DEC205-Trap蛋白免疫原性验证将纯化后的蛋白进行Western blot分析,以验证重组蛋白在复性后的免疫原性,结果蛋白分别在67 kD处出现明显可见的单一条带,如图7,与预期相符,说明重组蛋白复性成功且免疫原性良好。
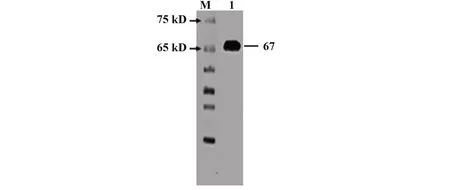
图7 Western blot结果Fig.7 Western blot result
3 讨论
本实验将TRAP蛋白基因与scFv-DEC205基因片段进行连接,构建Trap-scFv-DEC205重组基因表达载体,通过IPTG诱导表达后,成功表达出scFv-DEC205-Trap重 组 蛋 白。scFv-DEC205-Trap大 部 分表达蛋白以不可溶的包涵体形式而存在。实验对scFv-DEC205-Trap重组包涵体蛋白沉降条件、重组包涵体蛋白溶解的最佳条件以及包涵体复性条件和复性方法等进行研究。结果显示,在离心速度大于400 g,离心时间3 min以上96%的包涵体蛋白就会发生沉降;含8 mol/L的尿素溶解液在4~40℃的摇床培养0.5 h以上包涵体蛋白就可达到充分溶解。用不同添加剂缓冲液5倍稀释复性包涵体蛋白,缓冲液pH=8.0复性最合适,0.3 mol/L精氨酸的100 mmol/L Tris-HCl缓冲液5倍稀释包涵体变性液复性效果最好。
本实验探讨不同的离心力对包涵体沉降的影响,结果显示较小的离心力可使96%的包涵体蛋白沉降,说明包涵体蛋白的密度比较大,利用差速离心法不能去除像细胞碎片这类的杂质。因此,本实验采取包涵体洗涤处理,随着洗涤次数的增加,目的蛋白含量不断减少,而杂蛋白并未明显减少,这说明了在异源的表达过程中,不仅目的蛋白以包涵体的形式存在,杂蛋白也会以包涵体的形式存在,而且通过实验证明采取洗涤方法不能去除杂蛋白。实验探讨包涵体溶解实验中,溶解温度,溶解时间,溶解过程中是否振荡对溶解的效果并无影响,经分析得到的可能结论是scFv-DEC205-Trap包涵体蛋白在实验设计的溶解条件下就已达到了溶解能力的上限。为了节约成本,快速简便地获得包涵体蛋白,本实验采用低分子添加物和分子伴侣辅助稀释复性法复性包涵体蛋白。分别以100 mmol/L Tris-HCl(pH=8.0)缓冲液为对照,并向其中分别加入复性添加剂0.3 mol/L精氨酸、10%甘油、0.2%吐温80、5%PEG6000和5%PEG8000,并以不同的比例稀释复性缓冲液。其中精氨酸和甘油的作用是促进复性中间体向自然态折叠;吐温80和PEG是聚集抑制剂,抑制复性中间体的聚集。从促进中间体向自然态折叠和抑制中间体向聚集态折叠两个不同角度来探索不同小分子复性添加剂对复性的影响。结果表明:在复性缓冲溶液中添加0.3 mol/L精氨酸的复性率效果最好,这与余秀娟团队研究[10]的结果一致。PEG复性缓冲液复性率低于不添加任何物质缓冲液复性率,可能原因是PEG存在占位效应,诱导蛋白质自我形成沉淀。
