木香烃内酯通过内质网应激和自噬诱导骨肉瘤细胞凋亡①
2022-10-02刘景新陈余兴王贵海南西部中心医院骨科儋州571700
刘景新 陈余兴 王贵(海南西部中心医院骨科,儋州 571700)
骨肉瘤(osteosarcoma,OS)是一种由成骨间充质细胞引起的骨骼系统原发性恶性肿瘤,多发于15~19岁的青少年。该疾病发病率高,预后差,具有较高的侵袭性和转移性,确诊时约有20%的患者发生远端转移,严重威胁患者生命安全[1-2]。近年来,手术和化疗的改进使得OS患者的五年生存率从不足20%提高至65%~75%,但OS患者一旦出现肿瘤复发或者耐药性,常规的治疗策略很难有效延长患者生存期[3]。因此,临床亟需探寻新的OS治疗策略。
内质网应激是内质网功能紊乱引起的错误折叠或未折叠蛋白质积聚状态,过度的内质网应激会诱导细胞凋亡[4-5]。细胞自噬是细胞进行代谢更新的重要途径,其与肿瘤的能量代谢、炎症反应、化疗耐药性等密切相关[6-7]。研究发现,自噬影响多种抗肿瘤药物诱导肿瘤细胞凋亡过程[8]。内质网应激与自噬均对肿瘤细胞的生存状态有一定影响。
木香烃内酯(costunolide,Cos)是一种活性倍半萜内酯,来源于云木香、雪莲花、月桂等多种药用植物,具有抗炎、抗氧化、抗肿瘤等生物学活性[9]。FU等[10]研究报道,Cos通过激活ROS/MAPK信号通路对肾细胞癌细胞自噬和凋亡起调控作用。Cos还可通过激活凋亡和自噬通路抑制卵巢癌OAW42-A多药耐药细胞的生长[11]。Cos对多种肿瘤细胞具有抑制增殖、诱导凋亡的作用,有望成为新一代抗癌药物。但关于Cos在OS中的作用及内在分子机制的相关研究较少。因此,本研究以OS细胞为研究对象,从内质网应激和自噬的角度探讨Cos对OS细胞凋亡的影响及其可能的分子机制,以期为Cos的开发利用和OS的治疗提供实验依据。
1 材料与方法
1.1材料人OS MG63细胞株(上海斯信生物科技有限公司);Cos(纯度≥98%,成都曼斯特生物科技有限公司),用二甲基亚砜(dimethyl sulfoxide,DMSO)溶解配制成溶液,保存备用;RPMI1640培养基,胎牛血清(fetal bovine serum,FBS)、胰蛋白酶、青霉素及链霉素溶液(美国Gibco公司);CCK-8试剂盒(美国APExBIO公司);膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)/碘化丙啶(PI)凋亡检测试剂盒(北京索莱宝科技有限公司);RIPA细胞裂解液、BCA检测试剂盒(上海碧云天生物技术有限公司);兔B淋巴细胞瘤-2(B lymphoma-2,Bcl-2)、Bcl-2结合抗凋亡基因(Bax)、Caspase-3、Cleaved Caspase-3、内质网应激蛋白真核生物翻译起始因子2α(eIF2α)、C/EBP同源蛋白(C/EBP homologous protein,CHOP)、蛋白激酶R样内质网激酶(protein kinase-like endoplasmic reticulum kinase,PERK)、自噬蛋白微管相关蛋白轻链3B-Ⅱ(microtubule-associated protein light chain 3B-Ⅱ,LC3B-Ⅱ)、Beclin-1、p62、β-actin单克隆抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔IgG(H+L)(英国Abcam公司);ECL化学发光显色液(苏州新赛美生物科技有限公司)。
1.2方法
1.2.1细胞培养将解冻、复苏的MG63细胞培养于含10%FBS、1%青霉素和链霉素的RPMI1640完全培养基中,置于37℃、5%CO2的恒温培养箱中培养,每2 d更换1次培养液,根据细胞形态传代培养,取对数生长期的细胞进行实验。
1.2.2CCK-8法检测细胞增殖能力消化重悬MG63细胞,取100 μl细胞悬液以5×105个/ml密度接种于96孔板,待细胞贴壁后,用不同浓度(5、10、15、20、25、40 μmol/L)Cos处理细胞24 h、48 h、72 h,同时设置阴性对照(采用DMSO处理)和空白对照(无细胞),每孔设置5个复孔。细胞培养结束后,磷酸盐缓冲液(PBS)洗涤1次,每孔加入10 μl CCK-8溶液,37℃避光孵育4 h,采用多功能酶标仪测定每孔在450 nm处的吸光度(OD),计算细胞增殖抑制率,用Logit法计算半数抑制浓度(half maximal inhibitory concentration,IC50)。细胞增殖活力(%)=(OD药物组-OD空白对照)/(OD阴性对照-OD空白对照)×100%。实验重复3次。
1.2.3划痕试验检测细胞迁移能力调整MG63细胞密度为5×105个/ml,均匀接种于6孔板,每孔设5个复孔,待细胞贴壁生长为适宜密度后,弃去培养液,用高温灭菌的移液枪头匀速在6孔板内每孔正中间垂直划线,用灭菌的PBS小心洗去细胞碎片,将培养基更换为无血清的RPMI1640培养基,在0 h于倒置显微镜下观察拍照并做好标记,用20 μmol/L浓度的Cos处理细胞,阴性对照采用DMSO处理,培养48 h后,于倒置显微镜下观察拍照并标记,计算细胞迁移率,实验重复3次。细胞迁移率(%)=(0 h划痕距离-48 h划痕距离)/0 h划痕距离×100%。
1.2.4Transwell小室法测定细胞侵袭能力预先将稀释好的Matrigel基质胶工作液加入Transwell小室。室温放置8 h,固化培养基,接种细胞前对基底膜进行水化。取对数生长期MG63细胞,以5×105个/ml的细胞密度接种于Transwell小室,每孔加入200 μl细胞悬液,下室加入500 μl含10%FBS的RPMI1640培养基,每组设置5个复孔。用20 μmol/L浓度的Cos处理细胞,阴性对照采用DMSO处理,将Transwell小室置入37℃、5%CO2的培养箱中培养48 h,弃去培养液,无菌棉签轻轻擦去上层细胞,PBS洗涤3次,4%多聚甲醛固定,20 min后室温下用0.1%结晶紫染色30 min,PBS洗去染液,自然晾干,倒置显微镜下观察计数,结晶紫染色细胞数即为侵袭细胞数。细胞侵袭率(%)=药物组穿膜细胞数/阴性对照组穿膜细胞数×100%。实验重复3次。
1.2.5Annexin V-FITC/PI双染法检测细胞凋亡率将MG63细胞以5×105个/ml的密度接种于60 mm培养皿,加入3 ml培养基,于37℃、5%CO2的恒温培养箱中培养24 h,阴性对照组采用DMSO处理,Cos组采用20 μmol/L的Cos处理,每孔设置5个复孔。细胞处理48 h后,使用0.25%胰蛋白酶消化,收集细胞,PBS洗涤2次,加入100 μl的结合缓冲液重悬细胞,分别加入Annexin V-FITC与PI荧光染液各5 μl,室温下避光孵育20 min,采用流式细胞仪检测细胞凋亡情况。实验重复3次。
1.2.6Western blot法检测相关蛋白表达水平取对数生长期MG63细胞,重悬调整密度为1×107个/ml,于37℃、5%CO2的恒温培养箱中培养至细胞贴壁。将细胞分为4组:阴性对照组(DMSO处理),Cos组(20 μmol/L Cos处理),Cos+内质网应激抑制剂牛磺熊去氧胆酸(tauroursodeoxycholic acid,TUDC)组(20 μmol/L Cos和500 mg/L TUDC处理)或Cos+自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)组(20 μmol/L Cos和3 mmol/L 3-MA处理)。细胞处理48 h后,收集各组细胞,加入RIPA缓冲液裂解细胞,在4℃、12 000 r/min条件下离心15 min,提取总蛋白,BCA法检测蛋白浓度。取等量的蛋白提取液进行SDS-PAGE电泳,湿法转移至PVDF膜,用含5%脱脂奶粉的TBST缓冲液封闭2 h,分别加入凋亡蛋白Bcl-2抗体(1∶1 000)、Bax抗体(1∶1 000)、Caspase-3抗体(1∶1 000)、Cleaved Caspase-3抗体(1∶1 000)、内质网应激蛋白eIF2α抗体(1∶1 000)、CHOP抗体(1∶1 000)、PERK抗体(1∶1 000)、自噬蛋白LC3B-Ⅱ抗体(1∶1 000)、Beclin-1抗体(1∶1 000)、p62抗体(1∶1 000),4℃孵育过夜,TBST洗涤10 min×3次,加入相应HRP标记的羊抗兔IgG(H+L)(1∶5 000),室温孵育1 h,TBST洗涤10 min×3次,用ECL发光液显影,以β-actin为内参,分析各条带灰度值,计算目的蛋白相对表达量。
1.3统计学分析采用SPSS17.0和GraphPad Prism7.0软件进行实验数据处理分析,实验结果以±s表示,组间比较采用t检验,多组间比较采用单因素方差(One-way ANOVA)分析。P<0.05表示差异有统计学意义。
2 结果
2.1Cos对OS细胞增殖、迁移、侵袭的影响分别使用5、10、15、20、25、40 μmol/L的Cos处理MG36细胞24 h、48 h、72 h,CCK-8试验结果显示,相同作用时间时,随着Cos浓度的升高,MG36细胞增殖活力逐渐降低(P<0.05);相同药物浓度时,随着Cos浓度作用时间的延长,MG36细胞增殖活力逐渐降低(P<0.05)。说明Cos对MG36细胞增殖的抑制作用具有浓度和时间依赖性(图1A)。因Cos作用24 h时对MG63细胞的增殖抑制效果不明显,72 h时Cos会过度抑制MG63细胞增殖,而48 h时Cos抑制MG63细胞增殖效果最为有效,故本研究采用48 h作为Cos处理细胞的时间。Cos处理MG36细胞48 h的IC50值为19.21 μmol/L,因此,选取20 μmol/L的Cos用于后续试验。划痕试验和Transwell小室试验结果显示,与阴性对照组比较,20 μmol/L Cos处理的MG36细胞迁移、侵袭能力明显下降,差异均有统计学意义(P<0.05,图1B、C)。
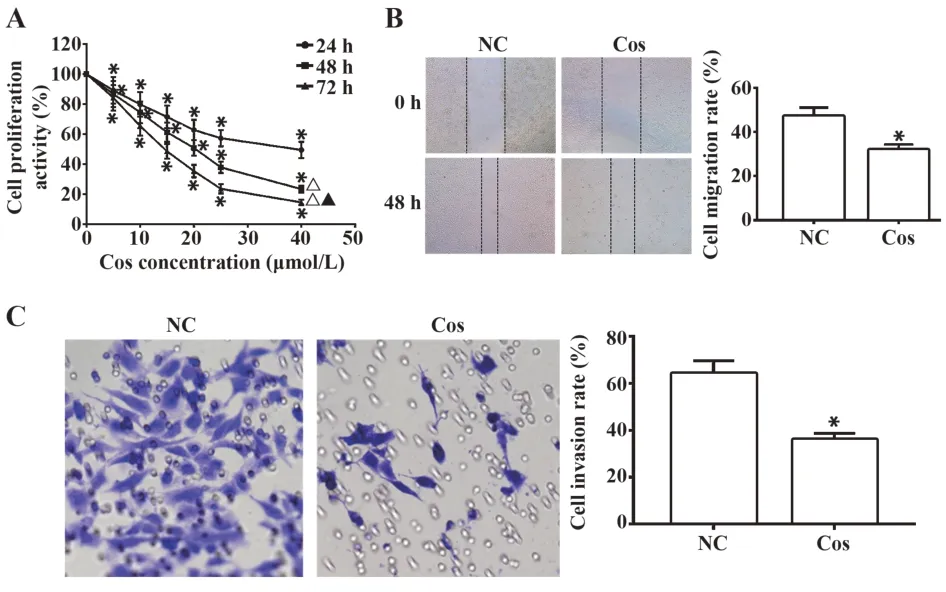
图1 Cos对OS细胞增殖、迁移、侵袭的影响Fig.1 Effects of Cos on proliferation,migration and invasion of OS cells
2.2Cos对OS细胞凋亡的影响与阴性对照组比较,20 μmol/L Cos干预MG36细胞48 h后,细胞凋亡率明显升高,差异具有统计学意义(P<0.05,图2)。
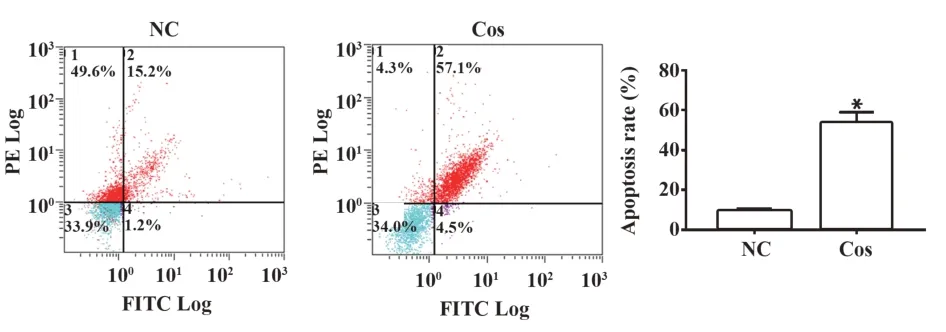
图2 Cos对OS细胞凋亡的影响Fig.2 Effect of Cos on OS cell apoptosis
2.3Cos对OS细胞内质网应激相关蛋白表达的影响与阴性对照组比较,Cos显著上调MG36细胞的eIF2α、CHOP、PERK蛋白表达水平,差异均有统计学意义(P<0.05,图3)。
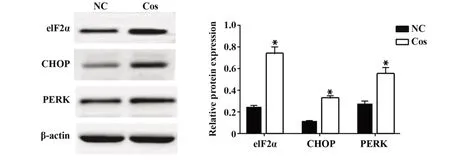
图3 Cos对OS细胞内质网应激相关蛋白表达的影响Fig.3 Effect of Cos on endoplasmic reticulum stress related protein expression in OS cells
2.4内质网应激参与Cos诱导的OS细胞凋亡与阴性对照组比较,Cos组Bcl-2蛋白表达水平降低,Bax、Caspase-3、Cleaved Caspase-3蛋白表达水平升高,差异具有统计学意义(P<0.05);与Cos组比较,Cos+TUDC组Bcl-2蛋白表 达 水平升 高,Bax、Caspase-3、Cleaved Caspase-3蛋白表达水平降低,差异具有统计学意义(P<0.05,图4)。
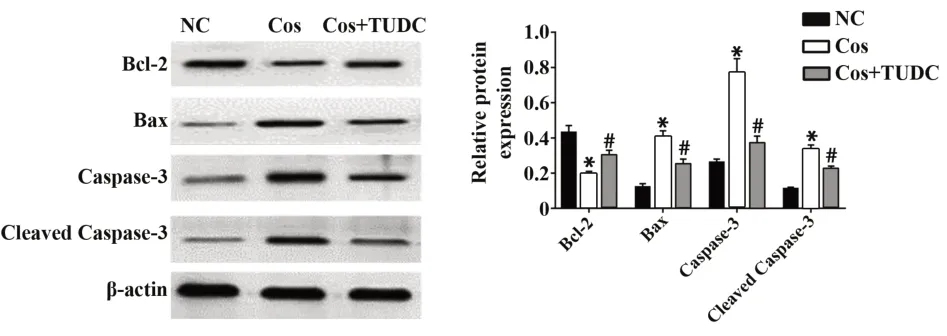
图4 内质网应激参与Cos诱导的OS细胞凋亡Fig.4 Endoplasmic reticulum stress is involved in Cos induced OS cell apoptosis
2.5Cos对OS细胞自噬相关蛋白表达的影响与阴性对照组比较,Cos显著上调MG36细胞的LC3B-Ⅱ、Beclin-1蛋白表达水平,下调p62蛋白表达水平,差异均有统计学意义(P<0.05,图5)。

图5 Cos对OS细胞自噬相关蛋白表达的影响Fig.5 Effect of Cos on autophagy related protein expression in OS cells
2.6自噬参与Cos诱导的OS细胞凋亡与阴性对照组比较,Cos组Bcl-2蛋白表达水平降低,Bax、Caspase-3、Cleaved Caspase-3蛋白表达水平升高,差异具有统计学意义(P<0.05);与Cos组比较,Cos+3-MA组Bcl-2蛋白表达水 平升高,Bax、Caspase-3、Cleaved Caspase-3蛋白表达水平降低,差异具有统计学意义(P<0.05,图6)。
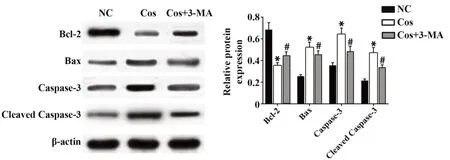
图6 自噬参与Cos诱导的OS细胞凋亡Fig.6 Autophagy is involved in Cos induced apoptosis of OS cells
3 讨论
OS是一种高度恶性肿瘤,其典型组织学特征为重度非典型性和多形性,瘤细胞大小不等,形态不一,治疗难度较大[12]。尽管临床有手术、放化疗等多种治疗方法,但由于OS转移潜能高,预后差,患者生存率仍较低。积极探索新的、更有效的治疗方法,改善OS患者生存率及生活质量尤为必要。近年来,中药抗肿瘤活性的研究成为热点。Cos是多种药用植物的主要活性成分,据报道,Cos具有抑制肿瘤增殖和异种移植瘤生长的效果[13]。PENG等[14]研究报道Cos联合去氢木香内酯通过c-Myc/p53和AKT/14-3-3途径诱导细胞周期阻滞和凋亡抑制乳腺癌。WEI等[15]研究表明Cos可诱导H1299肺癌细胞凋亡并抑制其迁移和侵袭。本研究结果显示,Cos能够显著抑制MG36细胞增殖,并且其抑制作用呈浓度和时间依赖性。同时,Cos还可有效降低MG36细胞的迁移、侵袭能力,促进OS细胞凋亡。该结果与JIN等[16]的研究结果一致,进一步证实Cos可抑制OS细胞的迁移和侵袭,Cos具有抗OS的作用。
CHOP是内质网应激诱导细胞凋亡的标志性蛋白,PERK是具有内质网腔结合域和蛋白激酶活性的细胞因子,内质网应激初期,启动的PERK信号通路中PERK通过发生自体二聚化活化eIF2α,可促进细胞存活,但持久或过度的内质网应激会活化相关因子诱发细胞凋亡,最终促进CHOP的表达[17-18]。细胞凋亡过程中,抗凋亡Bcl-2蛋白、促凋亡Bax蛋白、凋亡核心蛋白Caspase-3以及活化的Cleaved Caspase-3蛋白均会异常表达。LIANG等[19]研究发现苦参碱通过上调Bax和Fas/FasL表达及下调Bcl-2表达诱导人OS细胞凋亡。WANG等[20]发现Cos通过内质网应激途径诱导肺腺癌细胞凋亡。本研究结果显示,Cos可通过上调MG36细胞的eIF2α、CHOP、PERK蛋白表达水平激活内质网应激,而内质网应激抑制剂TUDC可以显著上调Cos处理的MG36细胞Bcl-2蛋白表达量,显著下调Bax、Caspase-3、Cleaved Caspase-3蛋白表达量。该结果提示,内质网应激促进Cos诱导的MG36细胞凋亡。
自噬是细胞自我吞噬的过程,属于一种降解机制,帮助清除老化、受损的细胞器,维持细胞稳态。大量研究证实,自噬在肿瘤的发生、发展中发挥重要作用,其可替代凋亡缺陷细胞抑制肿瘤,同时,诱导细胞自噬也可抑制细胞的抗癌活性[21-22]。LC3是自噬中的关键蛋白,其转化为LC3B-Ⅱ是自噬激活的重要标志。Beclin-1是一种抑癌基因,其编码的蛋白是调控自噬过程的关键蛋白,可通过参与自噬体的形成调节自噬活性。p62是一种泛素结合蛋白,在自噬信号转导中起关键作用,其水平可间接反映自噬小体清除水平[23]。WANG等[24]报道松属素通过升高Beclin-1和LC3B-Ⅱ的水平、降低p62表达激活自噬,进而调控糖皮质激素诱导的细胞凋亡。本研究结果显示,Cos可显著上调MG36细胞的LC3B-Ⅱ、Beclin-1蛋白表达量,下调p62蛋白表达量。提示Cos激活MG36细胞自噬。为探讨Cos处理的OS细胞中自噬对细胞凋亡的影响作用,本研究使用自噬抑制剂3-MA处理MG36细胞,结果显示,3-MA显著上调Cos处理的MG36细 胞Bcl-2蛋白表达量,下调Bax、Caspase-3、Cleaved Caspase-3蛋白表达量。提示抑制自噬能够有效减弱Cos诱导的细胞凋亡,自噬参与Cos诱导的MG36细胞凋亡。
综上所述,Cos能够抑制OS细胞的增殖、迁移和侵袭能力,诱导OS细胞凋亡。其作用机制可能是通过介导细胞内质网应激和自噬诱导细胞凋亡。本研究从内质网应激和自噬方面揭示了Cos抗OS的活性,为探索OS的治疗提供了新思路。Cos可能通过其他信号通路发挥抗OS的作用,后期需要进一步揭示Cos抗OS的分子机制。
