BMSC-Exo通过Wnt/β-catenin途径参与股骨头坏死大鼠软骨细胞增殖、迁移和凋亡的机制研究
2022-10-02龚东亮付文芹复旦大学附属中山医院青浦分院骨科上海201799
龚东亮 付文芹(复旦大学附属中山医院青浦分院骨科,上海 201799)
股骨头坏死(femoral head necrosis,FHN)的发生与软骨丧失密切相关,Wnt/β-catenin是一类与胚胎骨骼形成、组织修复和关节稳态有关的经典通路,并参与激素诱导的FHN[1]。Wnt/β-catenin通路调节多个信号级联反应,具有促进骨肉瘤细胞增殖、迁移和抑制凋亡的作用,Wnt/β-catenin通路可能通过促进软骨的再生缓解FHN[2]。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)具有组织修复能力,研究证实了由BMSCs分泌的外泌体(exosomes,Exo)具有治疗FHN的作用,但其机制仍不清楚[3]。BMSCs具有强大的分泌功能,研究显示其分泌的Exo可缓解软骨退变损伤[4]。本文主要分析BMSCs-Exo通过Wnt/β-catenin途径对FHN大鼠软骨细胞的迁移、增殖和凋亡的影响。
1 材料与方法
1.1材料Sprague-Dawley(SD)大鼠由上海斯莱克实验动物责任有限公司提供[许可证号:SCXK(沪)2012-003](SPF级,雄性,8~10周龄,270~290 g)。氨基甲酸乙酯(上海清溪化学技术有限公司,中国);DMEM培养基、胎牛血清(Gibco公司,美国);FACSCantoⅡ流式细胞仪和染色试剂(BD公司,美国);RNAspin Mini(GE Healthcare,美国);Bestar qPCR RT和BestarTMqPCR试剂盒(DBI Bioscience公司,德国);ECL显色试剂盒(Thermo Fisher公司,美国);抗体、一抗和山羊抗免疫球蛋白G(IgG)二抗(1∶1 000稀释,#ab6721)(Abcam公司,美国);硝酸纤维素膜(EMD Millipore,美国);显微镜(Carl Zeiss公司,德国);NanoSight NS300粒度仪(马尔文公司,英国)。
1.2方法
1.2.1BMSCs-Exo的分离和培养根据参考文献[5],通过腹膜内注射氨基甲酸乙酯(20%生理盐水,5 ml/kg)麻醉大鼠。采用灭菌的磷酸缓冲液从大鼠的胫骨和股骨中冲洗出骨髓,通过过滤器过滤并悬浮于DMEM培养基中,补充10%的胎牛血清、10 U/ml的青霉素和100 μg/ml的链霉素。随后将细胞在37℃、含5%CO2的环境中培养24 h。当细胞达到90%汇合时,胰蛋白酶消化,然后重新铺板在25 cm2培养瓶中为第0代。本研究使用了第3代BMSCs。
使用50 ml无血清DMEM培养基在烧瓶中培养BMSCs,加入100 μmol/L的H2O2处理24 h,将上清液分别以300 g,10 min、2 000 g,10 min和10 000 g,60 min梯度离心以去除残留的细胞碎片,以120 000 g梯度在4℃下离心90 min分离外泌体。通过NanoSight NS300粒度仪检测和观察分离的外泌体。
1.2.2FHN大鼠软骨细胞培养、分组和干预根据参考文献[6],臀肌肉内注射地塞米松(20 mg/kg,1次/周),每天在跑步机上强迫跑步60 min(1 km/h,1次/周)。8周后对大鼠进行安乐死解剖验证FHN的建模结果。提取软骨组织,按照参考文献[6]方法构建原代FHN软骨细胞,培养方法同1.2.1。
将FHN软骨细胞分为对照组、BMSCs-Exo 50组和BMSCs-Exo 100组,分别在培养基中加入终浓度为0、50和100 μg/ml的BMSCs-Exo培养[7],48 h后收集细胞进行检测。
1.2.3检测方法
1.2.3.1CCK-8检测增殖将1×105个处理后的细胞(150 μl)接种于96孔板,分别在培养第48 h加入10 μl CCK-8试剂并在37℃下孵育显色,酶标仪检测在450 nm下每孔吸光度(OD)值。
1.2.3.2划痕愈合实验检测迁移将培养的单层细胞使用200 μl塑料移液器吸头做划痕,在0 h拍照记录划痕宽度。然后在无血清培养基中继续培养24 h,计算划痕前缘迁移距离百分比。
1.2.3.3流式细胞术检测凋亡将处理后的细胞以不含EDTA的0.25%胰蛋白酶消化,将1×106个细胞先后用预冷的PBS和5%牛血清白蛋白(BSA)洗涤3次,以2 000 r/min离心收集。向细胞中加入300 μl的5%BSA和700 μl 70%预冷乙醇,低温过夜。细胞以2 000 r/min离心5 min收集并使用PBS洗涤。将Molt4细胞与100 μl结合缓冲液和5 μl的Annexin-V-FITC(20 μg/ml)静置15 min在黑暗中孵化,然后将150 μl结合缓冲液和10 μl的PI(50 μg/ml)加入试管中静置15 min,在黑暗中孵化通过FACSCantoⅡ流式细胞仪测量凋亡率。
1.2.3.4RT-qPCR使用RNAspin Mini试剂盒从细胞中提取RNA,使用Bestar qPCR RT试剂盒将其逆转转录为cDNA,条件如下:37℃,15 min;98℃,5 min。使用BestarTMqPCR预混液进行qPCR实验,条件如下:95℃,2 min;94℃,20 s;58℃,20 s,72℃延伸4 min。使用Agilent Stratagene Mx3000P序列检测系统进行RT-qPCR分析。采用比较循环阈值并以GAPDH作为内参计算mRNA相对表达水平。
1.2.3.5Western blot细胞研磨后于放射免疫沉淀测定裂解缓冲液中在冰上裂解并收集总蛋白。通过8%SDS-PAGE分离每个样品中等量(50 μg)的蛋白质,并将其转移至硝酸纤维素膜。室温下将膜浸入5%脱脂牛奶中2 h封闭非特异性抗原。随后,将膜与分别与一抗(1∶800)在4℃下孵育过夜,然后将膜与山羊抗免IgG二抗在室温下孵育1 h。使用化学发光试剂显示,使用Quantum One软件分析灰度计算蛋白相对于GAPDH的表达量。
1.3统计学处理平行实验次数和每项指标检测次数均为3。数据以±s表示。统计分析使用SPSS19软件。进行方差分析,两两比较使用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1BMSCs对FHN软骨细胞增殖的影响三组的OD值比较差异有统计学意义(P<0.05)。BMSCs-Exo 50组的OD值显著高于对照组(P<0.05),BMSCs-Exo 100组的OD值显著高于对照组和BMSCs-Exo 50组(P<0.05),见表1。
表1 BMSCs对FHN软骨细胞增殖的影响(±s)Tab.1 Effects of BMSCs on proliferation of FHN chondrocytes(±s)

表1 BMSCs对FHN软骨细胞增殖的影响(±s)Tab.1 Effects of BMSCs on proliferation of FHN chondrocytes(±s)
Note:Compared with control group,1)P<0.05;compared with BMSCs-Exo 50 group,2)P<0.05.
Groups Control BMSCs-Exo 50 BMSCs-Exo 100 OD value 0.66±0.06 0.78±0.071)0.89±0.081)2)
2.2BMSCs对FHN软骨细胞迁移的影响三组细胞的迁移能力比较差异有统计学意义(P<0.05)。BMSCs-Exo 50组的划痕前缘迁移距离百分比显著高于对照组(P<0.05),BMSCs-Exo 100组的划痕前缘迁移距离百分比显著高于对照组和BMSCs-Exo 50组(P<0.05),见图1、表2。
表2 BMSCs对FHN软骨细胞迁移的影响(±s)Tab.2 Effects of BMSCs on migration of FHN chondrocytes(±s)

表2 BMSCs对FHN软骨细胞迁移的影响(±s)Tab.2 Effects of BMSCs on migration of FHN chondrocytes(±s)
Note:Compared with control group,1)P<0.05;compared with BMSCs-Exo 50 group,2)P<0.05.
Groups Control BMSCs-Exo 50 BMSCs-Exo 100 Percentage of migration distance of scratch front edge(%)27.32±0.94 45.59±1.451)61.44±1.761)2)

图1 划痕愈合实验检测BMSCs对FHN软骨细胞迁移的影响Fig.1 Scratch healing test to detect effect of BMSCs on migration of FHN chondrocytes
2.3BMSCs对FHN软骨细胞凋亡的影响三组比较凋亡率差异有统计学意义(P<0.05)。BMSCs-Exo 50组的凋亡率显著低于对照组(P<0.05),BMSCs-Exo 100组的凋亡率显著低于对照组和BMSCs-Exo 50组(P<0.05),见图2、表3。
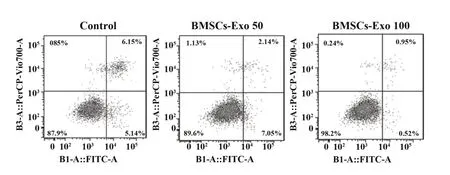
图2 流式细胞术检测BMSCs对FHN软骨细胞凋亡的影响Fig.2 Flow cytometry to detect effect of BMSCs on apoptosis of FHN chondrocytes
表3 BMSCs对FHN软骨细胞凋亡的影响(±s)Tab.3 Effects of BMSCs on apoptosis of FHN chondrocytes(±s)

表3 BMSCs对FHN软骨细胞凋亡的影响(±s)Tab.3 Effects of BMSCs on apoptosis of FHN chondrocytes(±s)
Note:Compared with control group,1)P<0.05;compared with BMSCs-Exo 100 group,2)P<0.05.
Groups Control BMSCs-Exo 50 BMSCs-Exo 100 Apoptosis rate(%)6.42±0.65 2.55±0.241)1.03±0.111)2)
2.4BMSCs对FHN软骨细胞中Wnt和β-catenin mRNA的影响三组FHN软骨细胞中Wnt和βcatenin mRNA水平比较差异有统计学意义(P<0.05),BMSCs-Exo 50组的Wnt和β-catenin mRNA水平显著高于对照组(P<0.05),BMSCs-Exo 100组的Wnt和β-catenin mRNA水平显著高于对照组和BMSCs-Exo 50组(P<0.05),见表4。
表4 BMSCs对FHN软骨细胞中Wnt和β-catenin mRNA的影响(±s)Tab.4 Effects of BMSCs on Wnt and β-catenin mRNA in FHN chondrocytes(±s)
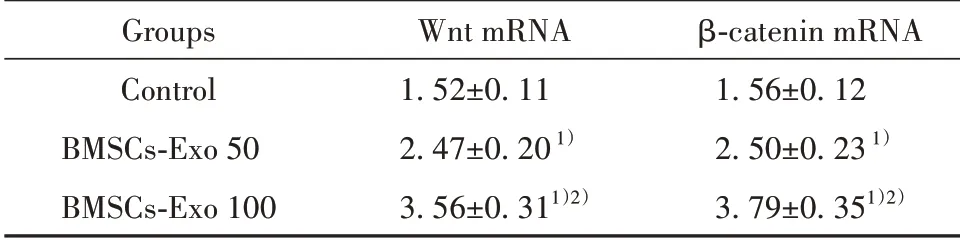
表4 BMSCs对FHN软骨细胞中Wnt和β-catenin mRNA的影响(±s)Tab.4 Effects of BMSCs on Wnt and β-catenin mRNA in FHN chondrocytes(±s)
Note:Compared with control group,1)P<0.05;compared with BMSCs-Exo 50 group,2)P<0.05.
Groups Control BMSCs-Exo 50 BMSCs-Exo 100 Wnt mRNA 1.52±0.11 2.47±0.201)3.56±0.311)2)β-catenin mRNA 1.56±0.12 2.50±0.231)3.79±0.351)2)
2.5BMSCs对FHN软骨中Wnt/β-catenin通路中蛋白表达水平的影响三组FHN软骨细胞中Wnt和β-catenin蛋白水平比较差异有统计学意义(P<0.05),BMSCs-Exo 50组的Wnt和β-catenin蛋白水平显著高于对照组(P<0.05),BMSCs-Exo 100组的Wnt和β-catenin蛋白水平显著高于对照组和BMSCs-Exo 50组(P<0.05),见图3、表5。
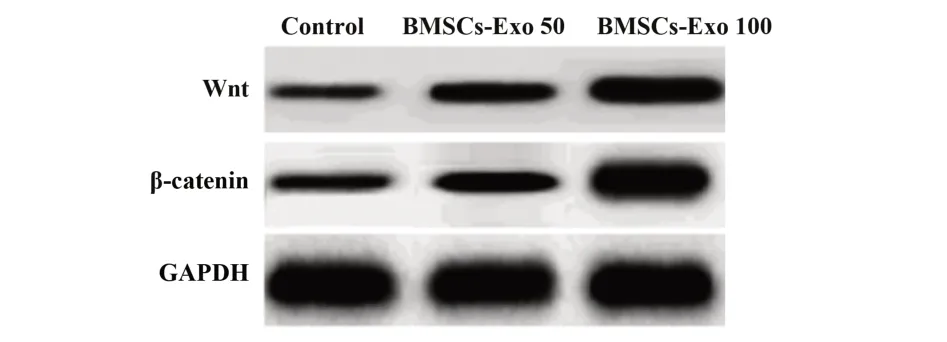
图3 Western blot检 测BMSCs对FHN软 骨 中Wnt/β-catenin通路中蛋白表达水平的影响Fig.3 Western blot detection of effect of BMSCs on protein expression level of Wnt/β-catenin pathway in FHN cartilage
表5 BMSCs对FHN软骨细胞中Wnt和β-catenin蛋白表达水平的影响(±s)Tab.5 Effects of BMSCs on Wnt and β-catenin protein in FHN chondrocytes(±s)

表5 BMSCs对FHN软骨细胞中Wnt和β-catenin蛋白表达水平的影响(±s)Tab.5 Effects of BMSCs on Wnt and β-catenin protein in FHN chondrocytes(±s)
Note:Compared with control group,1)P<0.05;compared with BMSCs-Exo 50 group,2)P<0.05.
Groups Control BMSCs-Exo 50 BMSCs-Exo 100 Wnt protein 0.87±0.07 1.26±0.101)2.35±0.191)2)β-catenin protein 0.94±0.08 1.40±0.121)2.71±0.241)2)
3 讨论
FHN的病理形态学表现为股骨头塌陷变形、小梁骨不连续和软骨下骨结构破坏,其中软骨的结构性改变和丢失是导致股骨头关节功能丧失的关键[8]。髋关节置换术是根治乳腺癌的重要手段,然而该方法花费较大且手术风险较高,且目前尚无缓解FHN进展的特效药物。寻找有效抑制FHN进展和治疗FHN的方法具有重要临床意义。
BMSCs是源于骨髓的具有自我更新能力的多能细胞群,大量研究表明其具有组织修复能力,在组织损伤后,BMSCs会募集到病灶处并发挥增殖、分化和分泌能力[9]。Exo细胞外囊泡的一种,其大小通常在40~200 nm,BMSCs中富含大量微小RNA和蛋白质,BMSCs-Exo与细胞融合后会调节细胞的和生物学行为[10]。最新研究结果显示,BMSCs分泌的Exo能有效缓解骨关节炎症反应恢复关节功能[11]。也有研究显示BMSCs-Exo能够缓解软骨损伤[12]。本研究分析不同剂量BMSCs-Exo对FHN来源的大鼠软骨细胞的影响。结果显示BMSCs-Exo能够剂量依赖性地促进FHN来源的大鼠软骨细胞增殖和迁移,并抑制其凋亡。软骨细胞的凋亡和结构性改变会使股骨表面粗糙,从而影响关节功能并对患者生活造成严重影响,而促进软骨再生可有效缓解FHN。近年来研究显示BMSCs-Exo能够促进骨肉瘤细胞的增殖和迁移[13]。郝海珍等[14]研究显示BMSCs-Exo能够缓解缺血再灌注引起的神经元凋亡。本研究结果提示BMSCs-Exo能够通过抑制软骨凋亡、促进软骨细胞增殖和迁移,从而促进软骨的再生,恢复股骨功能缓解FHN。
为进一步分析BMSCs-Exo调控FHN大鼠软骨细胞的机制,本研究检测了Wnt/β-catenin通路的蛋白水平。β-catenin是细胞质中的多功能蛋白,并且是Wnt信号通路中调节基因转录的关键分子,β-catenin可进入细胞核调控基因的转录。Wnt/β-catenin途径在软骨细胞的形成、分化及细胞外基质的代谢过程中起关键作用[15]。此外,Wnt/β-catenin也是促进细胞增殖和迁移、抑制凋亡的关键细胞内通路,FHN中Wnt/β-catenin通路被抑制,而恢复Wnt/β-catenin的表达水平能够缓解FHN[16]。本研究结果显示BMSCs-Exo能够剂量依赖性地提高FHN大鼠软骨细胞中Wnt和β-catenin转录和翻译的水平。LI等[17]的研究结果显示BMSCs-Exo通过提高Wnt/β-catenin通路促进BMSCs的增殖和向软骨细胞分化。也有研究显示BMSCs-Exo能够通过上调Wnt/β-catenin通路抑制神肾癌细胞凋亡并促进其增殖和迁移[18]。提示BMSCs-Exo可能通过促进Wnt/β-catenin通路中关键基因的转录和翻译水平促进FHN大鼠软骨细胞的增殖和侵袭,并抑制凋亡。
综上所述,BMSCs-Exo可能通过促进Wnt/β-catenin通路促进FHN大鼠软骨细胞的增殖和侵袭,并抑制凋亡,从而促进软骨生成治疗FHN。但BMSCs-Exo治疗FHN的作用仍需要体内实验验证,且BMSCs-Exo中内含物复杂,关于相关分子机制仍需要深入研究。
