黄芩苷对脓毒症急性肺损伤小鼠TLR4/NF-κB通路及Treg/Th17平衡的影响①
2022-10-02徐玲文王华兵王倩揭凤英邓淑萍董芳武汉市第三医院重症医学科武汉430060
徐玲文 王华兵 王倩 揭凤英 邓淑萍 董芳(武汉市第三医院重症医学科,武汉 430060)
脓毒症是临床危重患者的一种常见全身性炎症反应综合征,累及体内多种器官,可发展为多器官功能衰竭、脓毒性休克。急性肺损伤是脓毒症最常见的并发症,其在脓毒症患者中发生率很高,是加速患者死亡的重要因素[1]。脓毒症发生时,大量炎症细胞在肺组织聚集、浸润,活性氧、自由基过量产生,炎症细胞因子表达增加,Th17/Treg平衡向Th17转移,引发严重氧化应激和炎症反应,造成肺组织损伤,因此,抑制炎症,降低氧化应激水平是治疗脓毒症急性肺损伤的有效手段[2-3]。TLR4/NF-κB信号通路参与介导氧化应激、炎症反应、细胞凋亡等生理病理过程,下调该信号表达可通过抑制Th17细胞分化,促使Treg细胞分化,改善Th17/Treg失衡来减轻结肠炎小鼠的结肠炎症,还可通过抑制炎症反应,提高机体抗氧化作用来减轻急性肺损伤[4-6],因此TLR4/NF-κB通路可能是脓毒症急性肺损伤治疗靶点之一。黄芩苷(Baicalin,BA)属于黄酮类化合物,是中药黄芩的主要有效成分,可降低炎症因子表达,抑制炎症,减轻关节炎大鼠关节病理损伤,并可改善LPS诱导的小鼠肺炎症状[7-8];BA还能抑制Th17细胞分化,促进Treg激活,减轻二氧化硅诱导的肺纤维化和肺组织炎症损伤[9],但BA对脓毒症急性肺损伤小鼠TLR4/NF-κB通路及Treg/Th17平衡的影响目前还未有明确报道,本文通过诱导复制脓毒症急性肺损伤小鼠模型,对此进行初步研讨。
1 材料与方法
1.1材料
1.1.1实验动物BALB/c小鼠购自武汉生物制品研究所有限责任公司,生产许可证号:SCXK(鄂)2017-0013,清洁级,雄性,体质量18~22 g。饲养于本院动物房,自然照明,温度25℃,相对湿度50%,自由进食、饮水,环境保持清洁、安静,通风良好。
1.1.2主要药品及试剂BA(BR:90%,JK30647)由武汉琼格生物科技有限公司提供;脂多糖(CD-07378-ML)由武汉纯度生物科技有限公司提供;地塞米松(50-02-2)由武汉泽诺生物科技有限公司提供;SOD检测试剂盒(A001-3-2)、MDA检测试剂盒(A003-1-2)由南京建成生物工程研究所提供;总蛋白提取试剂盒(BB-3101)、核蛋白提取试剂盒(BB-3102)由上海贝博生物科技有限公司提供;红细胞裂解液(R1010)由北京索莱宝科技有限公司提供;标记藻红蛋白(phycoerythrin,PE)的抗小鼠IL-17抗体(12-9171-80)、标记异硫氰酸荧光素(fluorescein isothiocyanate,FITC)的抗小鼠CD4抗体(11-0041-82)由美国Invitrogen公司提供;小鼠TNF-α ELISA试 剂 盒(ab212073)、小 鼠IL-6 ELISA试 剂 盒(ab203360)、小鼠IL-17 ELISA试剂盒(ab210898)、小鼠TGF-β ELISA试剂盒(ab119557)、HE染色试剂盒(ab245880)、兔源GAPDH一抗(ab9485)、BCA蛋白检测试剂盒(ab102536)、兔源TLR4一抗(ab217274)、兔 源MyD88一 抗(ab219413)、兔 源PCNA一 抗(ab92552)、兔源NF-κB p65一抗(ab16502)、羊抗兔二抗(ab150077)由美国Abcam公司提供。
1.1.3主要仪器全自动血气分析检测仪由德国MICROM公司提供;酶标仪(Elx800)由美国Bio-Rad公司提供;流式细胞仪(BD LSRFortessaTM)由美国BD公司提供;光学显微镜(E200)由日本尼康公司提供;切片机(CM3050S)由德国Leica公司提供;凝胶成像仪(GelSMART)由北京大龙兴创实验仪器有限公司提供;垂直电泳仪及转移系统由北京六一生物科技有限公司提供等。
1.2方法
1.2.1脓毒症急性肺损伤小鼠模型建立及分组给药将脂多糖溶于0.9%氯化钠溶液中,配制为5 mg/ml的溶液,以10 mg/kg腹腔注射建立脓毒症急性肺损伤小鼠模型[10]。共造模65只,成功60只,随机分为模型组、地塞米松组、BA低、中、高剂量组,每组12只,另取12只小鼠腹腔注射等剂量0.9%氯化钠溶液,设定为对照组。
参照文献[11],以0.9%氯化钠溶液溶解BA、地塞米松后混匀,制得浓度为7.5、15、30 mg/ml的BA药液和浓度为0.72 mg/ml的地塞米松药液,BA低、中、高剂量组分别以10 ml/kg灌胃3种浓度的BA药液,同时腹腔注射10 ml/kg剂量的0.9%氯化钠溶液;地塞米松组腹腔注射7.2 mg/kg剂量的地塞米松药液[12],同时灌胃10 ml/kg剂量的0.9%氯化钠溶液;模型组和对照组灌胃10 ml/kg剂量的0.9%氯化钠溶液,同时腹腔注射10 ml/kg剂量的0.9%氯化钠溶液,均1次/d,持续14 d。
1.2.2标本采集及肺W/D检测第14天给药后24 h,以乙醚气体麻醉小鼠,采用颈椎脱臼法处死后解剖,采集腹主动脉血3 ml,取1.0 ml进行动脉血气指标检测,再取1.0 ml适量红细胞裂解液后检测外周血Th17/Treg,剩余1 ml静置15 min,4℃、3 000 r/min,离心15 min,收集上清液,获得血清保存在-80℃中备用。分离双肺,左右肺剪开,左肺称量湿重,置于60℃烘烤箱中烘干,称量干重,计算湿干比,即W/D;右肺剪取约1.0 g组织,剪碎,采用总蛋白提取试剂盒和核蛋白提取试剂盒分别提取0.5 g肺组织中总蛋白与核蛋白,通过BCA法分别测定两者总浓度后煮沸变性,在-80℃保存备用;剩余右肺组织经0.9%氯化钠溶液漂洗后,进行固定、脱水、透明、包埋处理,最后将组织块放入切片机中切片,得到厚度为4 μm的薄片备用。
1.2.3小鼠动脉血气指标检测将1.2.2中动脉血置于全自动血气分析检测仪,参照仪器说明书对动脉血二氧化碳分压(arterial partial pressure of carbon dioxide,PaCO2)与动脉血氧分压(arterial partial pressure of oxygen,PaO2)进行检测,计算氧合指数(oxygenation index,OI),OI=PaO2/0.21。
1.2.4小鼠肺组织病理形态检测取出1.2.2中肺组织薄片,浸入二甲苯中脱蜡处理,然后经水化后以试剂盒进行HE染色,具体步骤参照其说明书进行,将染色后的肺组织薄片以蒸馏水快速漂洗后脱水、透明,最后小心铺上载玻片后封片,于光学显微镜下观察肺组织染色情况并拍照。
1.2.5小鼠外周血Th17/Treg检测1.2.2中加入适量红细胞裂解液的外周血,冰水浴中30 min,4℃下1 000 g离心3 min获得细胞沉淀,经预冷的PBS洗涤后重悬,计数后将其细胞密度调至1×106个/ml,取1 ml细胞悬液,加入标记PE的抗小鼠IL-17抗体(Th17细胞标志)与标记FITC的抗小鼠CD4抗体(Treg细胞标志),混匀后4℃避光孵育20 min,4℃下1 000 g离心3 min获得细胞沉淀,经预冷的PBS洗涤、重悬并混匀,采用流式细胞仪测出Treg与Th17细胞比例,得到Th17/Treg。
1.2.6小鼠血清TNF-α、IL-6、IL-17、TGF-β及肺组织SOD、MDA水平检测1.2.2中蛋白样品液和血清于4℃冰箱中解冻,各取400 μl以各自试剂盒测定其中TNF-α、IL-6、IL-17、TGF-β、SOD及MDA含量,参照说明书进行具体操作,剩余肺组织蛋白样品液保存在-80℃中,进行后续蛋白表达检测。
1.2.7小鼠肺组织TLR4/NF-κB通路相关蛋白表达检测1.2.5中剩余蛋白样品液置于4℃冰箱中解冻,煮沸6 min后,分别取20 μg各组蛋白上样,做电泳实验分离蛋白,然后马上湿转法转移蛋白,以5%脱脂牛奶室温封闭所得硝酸纤维膜上蛋白2 h,以薄刀片切下NF-κB p65、TLR4、MyD88、GAPDH、PCNA 5个目的蛋白条带,以稀释比例均为1∶2 000的相对应兔源一抗溶液4℃孵育9 h,TBST缓冲液洗3次后以羊抗兔二抗溶液室温孵育90 min(稀释比例为1∶1 500),ECL显影液显色后拍照,采用Image J软件分析获得各蛋白图像灰度值,以GAPDH作为总蛋白内参,PCNA作为核蛋白内参,定量后统计获得各目的蛋白相对表达。
1.3统计学分析以±s表示计量资料,用统计学软件SPSS20.0对上述数据进行统计分析,多组间比较进行单因素方差分析,进一步两两比较行LSD-t检验,P<0.05表明差异有统计学意义。
2 结果
2.1脓毒症急性肺损伤小鼠模型的建立腹腔注射脂多糖24 h后,小鼠毛色干枯,食欲减退,呼吸困难,发生喘息,检测小鼠动脉血气相关指标显示,与对照组相比,模型组小鼠PaCO2明显升高(P<0.05),PaO2、OI明显降低(P<0.05),表明模型建立成功。
2.2BA对小鼠肺W/D的影响与对照组相比,模型组小鼠肺W/D明显升高(P<0.05)。与模型组相比,各给药组小鼠肺W/D降低,且BA低、中、高剂量组三组之间呈剂量依赖性(P<0.05)。BA高剂量组与地塞米松组相比,小鼠肺W/D差异无统计学意义(P>0.05),见表1。
表1 各组小鼠肺W/D比较(±s,n=12)Tab.1 Comparison of lung W/D of mice in each group(±s,n=12)
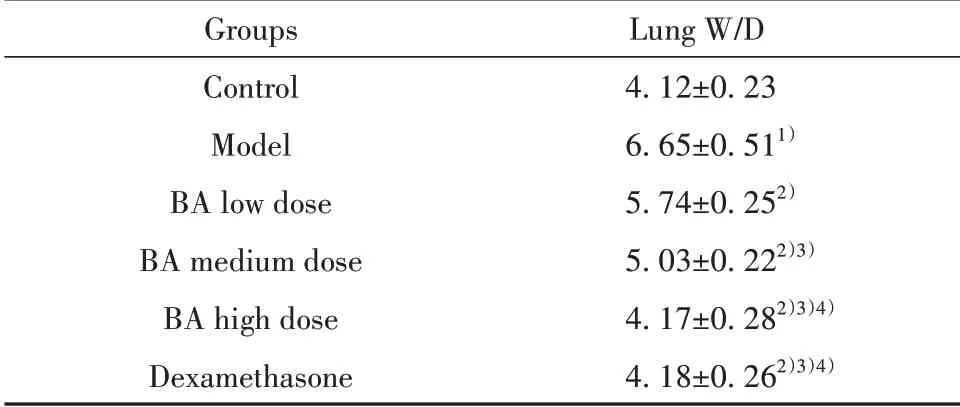
表1 各组小鼠肺W/D比较(±s,n=12)Tab.1 Comparison of lung W/D of mice in each group(±s,n=12)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with BA low dose group,3)P<0.05;compared with BA medium dose group,4)P<0.05.
Groups Control Model BA low dose BA medium dose BA high dose Dexamethasone Lung W/D 4.12±0.23 6.65±0.511)5.74±0.252)5.03±0.222)3)4.17±0.282)3)4)4.18±0.262)3)4)
2.3BA对小鼠动脉血气相关指标的影响与对照组相比,模型组小鼠PaCO2明显升高(P<0.05),PaO2、OI明显降低(P<0.05)。与模型组相比,各给药组小鼠PaCO2降低,PaO2、OI升高,且BA低、中、高剂量组三组之间呈剂量依赖性(P<0.05)。BA高剂量组与地塞米松组相比,各指标间差异无统计学意义(P>0.05),见表2。
表2 各组小鼠动脉血气相关指标比较(±s,n=12,mmHg)Tab.2 Comparison of arterial blood gas related indexes of mice in each group(±s,n=12,mmHg)
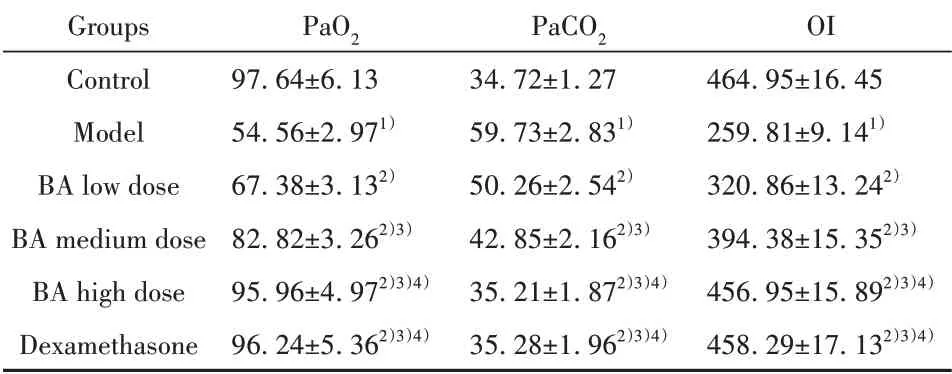
表2 各组小鼠动脉血气相关指标比较(±s,n=12,mmHg)Tab.2 Comparison of arterial blood gas related indexes of mice in each group(±s,n=12,mmHg)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with BA low dose group,3)P<0.05;compared with BA medium dose group,4)P<0.05.
Groups Control Model BA low dose BA medium dose BA high dose Dexamethasone PaO2 97.64±6.13 54.56±2.971)67.38±3.132)82.82±3.262)3)95.96±4.972)3)4)96.24±5.362)3)4)PaCO2 34.72±1.27 59.73±2.831)50.26±2.542)42.85±2.162)3)35.21±1.872)3)4)35.28±1.962)3)4)OI 464.95±16.45 259.81±9.141)320.86±13.242)394.38±15.352)3)456.95±15.892)3)4)458.29±17.132)3)4)
2.4BA对小鼠肺组织病理形态的影响对照组小鼠肺组织结构完好,无损伤。模型组小鼠肺泡萎缩、肺泡壁变厚,肺间质充血、水肿,并伴随大量炎症细胞浸润,肺组织发生严重病理损伤。与模型组相比,各给药组小鼠肺组织病理损伤均有减轻,且减轻程度随BA剂量升高而增强。BA高剂量组与地塞米松组小鼠肺组织基本恢复正常,两者相比,肺组织病理形态无明显差异,见图1。
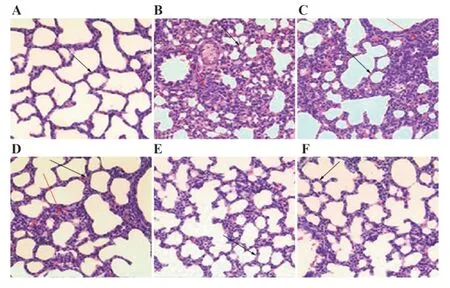
图1 HE染色检测各组小鼠肺组织病理形态(×400)Fig.1 HE staining was used to detect pathological morphology of lung tissue of mice in each group(×400)
2.5BA对小鼠肺组织SOD、MDA水平的影响与对照组相比,模型组小鼠肺组织SOD水平明显降低(P<0.05),MDA水平明显升高(P<0.05)。与模型组相比,各给药组小鼠肺组织SOD水平升高,MDA水平降低,且BA不同剂量组之间呈剂量依赖性(P<0.05)。BA高剂量组与地塞米松组相比,各指标间差异无统计学意义(P>0.05),见表3。
表3 各组小鼠肺组织SOD、MDA水平比较(±s,n=12)Tab.3 Comparison of SOD and MDA levels in lung tissue of mice in each group(±s,n=12)
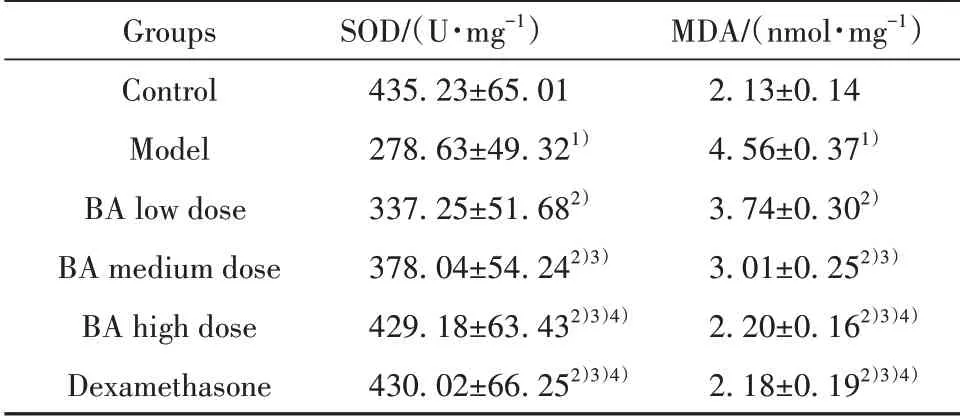
表3 各组小鼠肺组织SOD、MDA水平比较(±s,n=12)Tab.3 Comparison of SOD and MDA levels in lung tissue of mice in each group(±s,n=12)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with BA low dose group,3)P<0.05;compared with BA medium dose group,4)P<0.05.
Groups Control Model BA low dose BA medium dose BA high dose Dexamethasone SOD/(U·mg-1)435.23±65.01 278.63±49.321)337.25±51.682)378.04±54.242)3)429.18±63.432)3)4)430.02±66.252)3)4)MDA/(nmol·mg-1)2.13±0.14 4.56±0.371)3.74±0.302)3.01±0.252)3)2.20±0.162)3)4)2.18±0.192)3)4)
2.6BA对小鼠外周血Th17/Treg免疫平衡的影响与对照组相比,模型组小鼠外周血Th17/Treg明显升高(P<0.05)。与模型组相比,各给药组小鼠外周血Th17/Treg降低,且BA不同剂量组之间呈剂量依赖性(P<0.05)。BA高剂量组与地塞米松组相比,外周血Th17/Treg差异无统计学意义(P>0.05),见图2、表4。
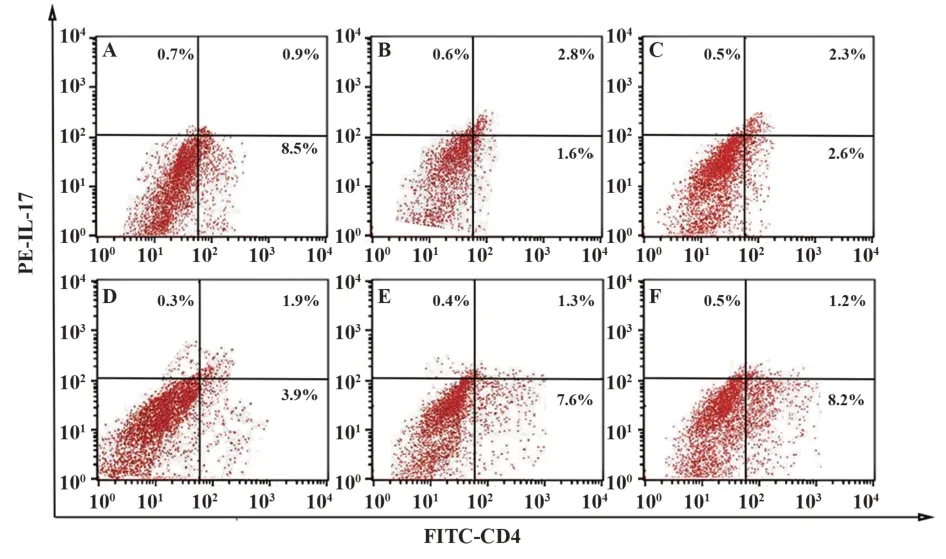
图2 流式细胞检测各组小鼠外周血Th17、Treg亚群比例Fig.2 Flow cytometry was used to detect proportion of Th17 and Treg subsets in peripheral blood of mice in each group
表4 各组小鼠外周血Th17/Treg比较(±s,n=12)Tab.4 Comparison of Th17/Treg in peripheral blood of mice in each group(xˉ±s,n=12)
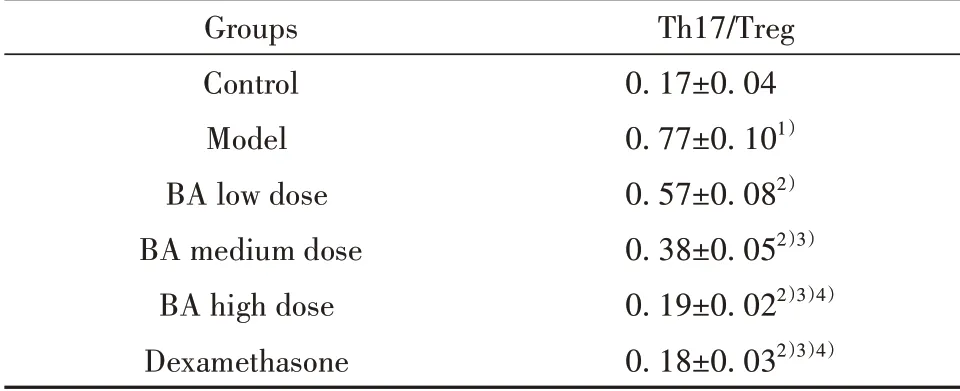
表4 各组小鼠外周血Th17/Treg比较(±s,n=12)Tab.4 Comparison of Th17/Treg in peripheral blood of mice in each group(xˉ±s,n=12)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with BA low dose group,3)P<0.05;compared with BA medium dose group,4)P<0.05.
Groups Control Model BA low dose BA medium dose BA high dose Dexamethasone Th17/Treg 0.17±0.04 0.77±0.101)0.57±0.082)0.38±0.052)3)0.19±0.022)3)4)0.18±0.032)3)4)
2.7BA对小鼠血清细胞因子TNF-α、IL-6、IL-17及TGF-β水平的影响与对照组相比,模型组小鼠血清细胞因子TNF-α、IL-6、IL-17水平明显升高(P<0.05),TGF-β水平明显降低(P<0.05)。与模型组相比,各给药组小鼠血清细胞因子TNF-α、IL-6、IL-17水平降低,TGF-β水平升高,且BA低、中、高剂量组三组之间呈剂量依赖性(P<0.05)。BA高剂量组与地塞米松组相比,各指标间差异无统计学意义(P>0.05),见表5。
表5 各组小鼠血清细胞因子TNF-α、IL-6、IL-17及TGF-β水平比较(±s,n=12,pg/ml)Tab.5 Comparison of serum levels of cytokines TNF-α,IL-6,IL-17 and TGF-β in each group(±s,n=12,pg/ml)
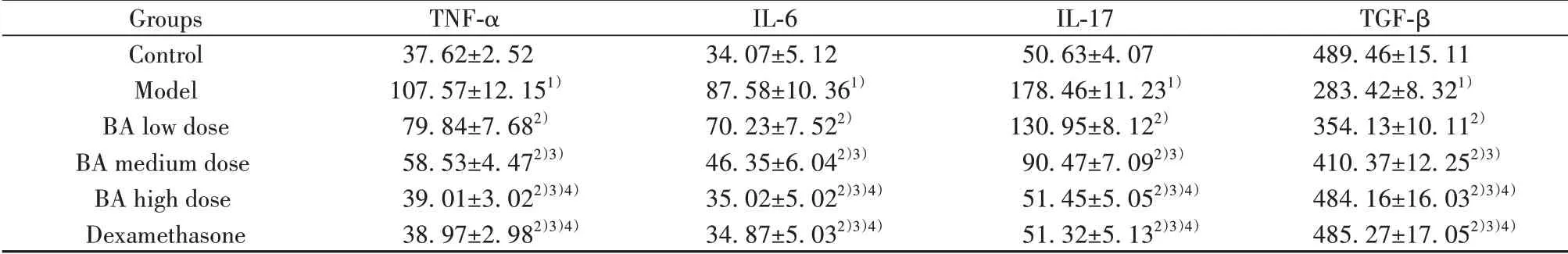
表5 各组小鼠血清细胞因子TNF-α、IL-6、IL-17及TGF-β水平比较(±s,n=12,pg/ml)Tab.5 Comparison of serum levels of cytokines TNF-α,IL-6,IL-17 and TGF-β in each group(±s,n=12,pg/ml)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with BA low dose group,3)P<0.05;compared with BA medium dose group,4)P<0.05.
Groups Control Model BA low dose BA medium dose BA high dose Dexamethasone TNF-α 37.62±2.52 107.57±12.151)79.84±7.682)58.53±4.472)3)39.01±3.022)3)4)38.97±2.982)3)4)IL-6 34.07±5.12 87.58±10.361)70.23±7.522)46.35±6.042)3)35.02±5.022)3)4)34.87±5.032)3)4)IL-17 50.63±4.07 178.46±11.231)130.95±8.122)90.47±7.092)3)51.45±5.052)3)4)51.32±5.132)3)4)TGF-β 489.46±15.11 283.42±8.321)354.13±10.112)410.37±12.252)3)484.16±16.032)3)4)485.27±17.052)3)4)
2.8BA对小鼠肺组织TLR4/NF-κB通路相关蛋白表达的影响与对照组相比,模型组小鼠肺组织TLR4、MyD88、核NF-κB p65蛋白表达水平明显升高(P<0.05)。与模型组相比,各给药组小鼠肺组织TLR4、MyD88、核NF-κB p65蛋白表达水平降低,且BA低剂量组、BA中剂量组、BA高剂量组三组之间呈剂量依赖性(P<0.05)。BA高剂量组与地塞米松组相比,各指标之间差异无统计学意义(P>0.05),见图3、表6。
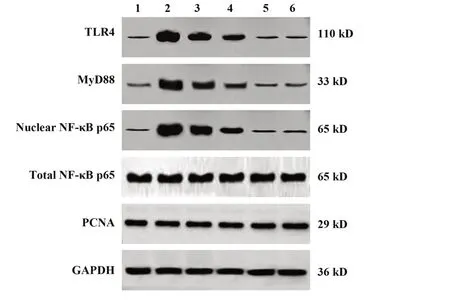
图3 免疫印迹检测各组小鼠肺组织TLR4/NF-κB通路相关蛋白表达Fig.3 Expression of TLR4/NF-κB pathway related proteins in lung tissue of mice in each group was detected by Western blot
表6 各组小鼠肺组织TLR4/NF-κB通路相关蛋白相对表达水平比较(xˉ±s,n=12)Tab.6 Comparison of relative expression levels of TLR4/NF-κB pathway related proteins in lung tissues of mice in each group(±s,n=12)
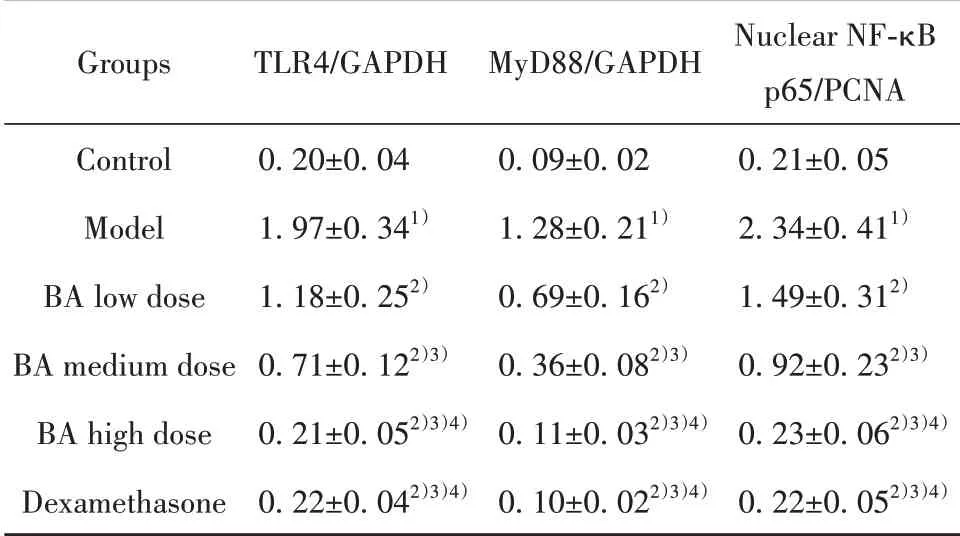
表6 各组小鼠肺组织TLR4/NF-κB通路相关蛋白相对表达水平比较(xˉ±s,n=12)Tab.6 Comparison of relative expression levels of TLR4/NF-κB pathway related proteins in lung tissues of mice in each group(±s,n=12)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05;compared with BA low dose group,3)P<0.05;compared with BA medium dose group,4)P<0.05.
Groups Control Model BA low dose BA medium dose BA high dose Dexamethasone TLR4/GAPDH 0.20±0.04 1.97±0.341)1.18±0.252)0.71±0.122)3)0.21±0.052)3)4)0.22±0.042)3)4)MyD88/GAPDH 0.09±0.02 1.28±0.211)0.69±0.162)0.36±0.082)3)0.11±0.032)3)4)0.10±0.022)3)4)Nuclear NF-κB p65/PCNA 0.21±0.05 2.34±0.411)1.49±0.312)0.92±0.232)3)0.23±0.062)3)4)0.22±0.052)3)4)
3 讨论
脓毒症在临床中属于危急重症,病情进展迅速,患者死亡率高,合并急性肺损伤是脓毒症患者最常见的并发症,可导致患者肺功能衰竭,严重威胁其生命安全,因此防治急性肺损伤是临床治疗脓毒症需解决的重点措施[1,13]。Th17/Treg平衡向Th17转移失衡可造成免疫功能障碍,Th17合成分泌的促炎因子IL-17水平升高,Treg合成分泌的抑炎因子TGF-β水平降低,诱导剧烈的炎症与氧化应激,是引发急性肺损伤的关键致病基础[2-3,14]。脂多糖属于一种内毒素,腹腔注射后会引发严重的炎症及氧化应激,导致休克、多器官功能衰竭等症状,与人类脓毒症的病理过程相似,常用于制备脓毒症动物模型[15]。
本研究采用腹腔注射脂多糖的方法诱导建立脓毒症急性肺损伤小鼠模型,结果显示,模型组小鼠肺泡萎缩,肺泡壁变厚,肺间质充血、水肿,并伴随大量炎症细胞浸润,肺组织呈现明显的病理损伤,肺W/D、动脉血气指标PaCO2、Th17/Treg、血清促炎因子IL-6、IL-17与TNF-α、肺组织氧化应激标志物MDA含量明显升高,SOD含量、血清抑炎因子TGF-β水平明显降低,另外动脉血气指标PaO2、OI亦明显降低,表明脂多糖可上调促炎因子表达,引发严重的炎症反应,提高氧化应激水平,导致肺水肿和肺组织损伤,损害肺功能,提示模型建立成功。
BA是黄芩根部含有的活性成分,具有降血脂、消炎抗菌、抗氧化、增强免疫力等广泛的药理功效,可抑制冠心病和类风湿关节炎患者机体炎症反应,改善其临床症状,BA还可显著降低新生大鼠肺组织Akt和NF-κB P65蛋白磷酸化水平,减轻其低氧诱导的肺损伤[16-17]。本研究结果显示,以BA处理脓毒症急性肺损伤小鼠,可减轻其肺组织病理损伤,降低肺W/D、动脉血气指标PaCO2、Th17/Treg、血清TNF-α、IL-6及IL-17水平、肺组织MDA水平,升高动脉血气指标PaO2、OI、血清TGF-β水平、肺组织SOD水平,且呈剂量依赖性,表明BA可降低脓毒症小鼠氧化应激水平,抑制炎症反应,促使Treg/Th17平衡向Treg偏移,缓解肺水肿,减轻肺组织损伤,改善肺功能,并随剂量升高而作用增强。
TLR4/NF-κB通路是调控氧化应激、炎症、免疫调节的关键信号通路,下调TLR4表达可抑制NF-κB向核内转移,调控Th17/Treg免疫平衡,修复结肠炎小鼠体内其向Th17的偏移,还能阻止炎症因子表达,进而抑制炎症,减轻急性肺损伤,并改善慢性阻塞性肺疾病症状,还可修复小鼠Th17/Treg平衡向Th17偏移,缓解结肠炎小鼠临床症状[4-6,18],由此推测调控TLR4/NF-κB信号传导可能是BA减轻脓毒症小鼠急性肺损伤的药理机制,本研究结果显示,与对照组相比,模型组小鼠肺组织MyD88、TLR4及核NF-κB p65蛋白表达水平明显升高,经BA处理后,上述蛋白表达水平降低,且BA各组之间呈剂量依赖性,表明BA可抑制TLR4/NF-κB通路表达,减轻脓毒症小鼠急性肺损伤,修复其肺功能。
综上所述,BA可抑制TLR4表达,减弱NF-κB核转移,降低氧化应激水平,阻止炎症发生及进展,修复Treg/Th17平衡向Th17的偏移,缓解肺水肿及肺组织损伤,减轻肺功能衰竭症状,下调TLR4/NF-κB信号通路表达可能是其起效的分子机制之一,但本研究只做了初步研究,其更确切详尽的作用机制还需后续进行深入研究。
