泌乳早期奶牛瘤胃微生物与牛奶脂肪酸组成的变化
2022-09-30胡立萍沈子亮于紫桐张琦绮毛永江杨章平张慧敏
胡立萍,沈子亮,王 全,于紫桐,张琦绮,毛永江,杨章平,张慧敏
(扬州大学动物科学与技术学院,扬州 225009)
奶牛的泌乳初期一般指产后15 d,又称为围产后期,产后16~100 d为泌乳盛期。泌乳早期,特别是在奶牛产犊后的第1个月,高水平的产奶加上低采食量容易造成能量负平衡,更易造成代谢紊乱,影响奶牛健康和生育能力。在泌乳30 d内,奶牛从泌乳初期过渡到泌乳盛期,在这两个状态的转变中,奶牛在生理和代谢上,都要经历很大的变化和一系列应激,包括泌乳启动、适应日粮、环境改变等。这些应激在很大程度上影响奶牛的健康水平及生产性能。因此,泌乳30 d对奶牛来说是一个挑战。
奶牛产犊后,牧场会提高精饲料比例,为瘤胃细菌提供更易获得的能量来源,瘤胃微生物组成也随之改变。蒋涛发现,泌乳初期和泌乳盛期奶牛瘤胃中细菌群落组成在属分类水平上存在明显差异,泌乳7 d瘤胃液中普雷沃菌属和罗氏菌属丰度显著高于泌乳50 d。同时,随着产奶量的增加,奶牛摄取的营养物质远远达不到产奶量的要求,这时就要动员体内储存的脂肪,以弥补泌乳早期的能量不足。前期研究表明,牛奶脂肪酸中的C4~C14及一半的C16:0在乳腺中生成,其余长链脂肪酸(long chain fatty acid, LCFA)则来源于血液外源转化,而血液中的LCFA主要来自饲料、瘤胃微生物或体脂动员。在饲喂良好、体况正常的奶牛中,脂解和体脂动员的脂肪酸占牛奶脂肪酸的5%,但在泌乳早期,当奶牛处于能量负平衡时,比例可提高至20%。樊永亮发现,泌乳3和30 d乳中脂肪酸组成差异较大,随着泌乳时间的延长,C4~C16的含量逐渐上升,而C18:0、C18:1cis9、C18:2cis9,12的含量逐渐下降。由此可见,生理阶段会影响奶牛瘤胃细菌的组成和乳腺中脂肪酸的代谢,但鲜有文献分析泌乳早期瘤胃微生物组成对牛乳中脂肪酸组成的影响。本研究旨在分析泌乳早期奶牛瘤胃微生物组成及牛乳脂肪酸组成的变化,探究瘤胃微生物组成与乳脂代谢之间的关联,为产后奶牛营养调控和提高原料乳品质提供理论基础。
1 材料与方法
1.1 试验动物与样品采集
选取江苏省某奶牛场2~3胎次、健康无病且305 d产奶量、年龄、体况评分和预产期相近的荷斯坦牛50头,每日采用全混合日粮(TMR)饲喂2次,饲粮组成及营养水平见表1。分别于每头牛的泌乳7 d(泌乳初期)及30 d(泌乳盛期)采集奶样和瘤胃液样品,记录采样当日干物质采食量及产奶量,每头奶牛采集100 mL混合奶样(早、中、晚的比例4∶3∶3),混匀后用于乳品质指标及乳脂肪酸的测定。饲喂2 h后,固定牛只,通过牛口腔导管采集瘤胃液20 mL,立即液氮保存,用于瘤胃微生物组的测定。
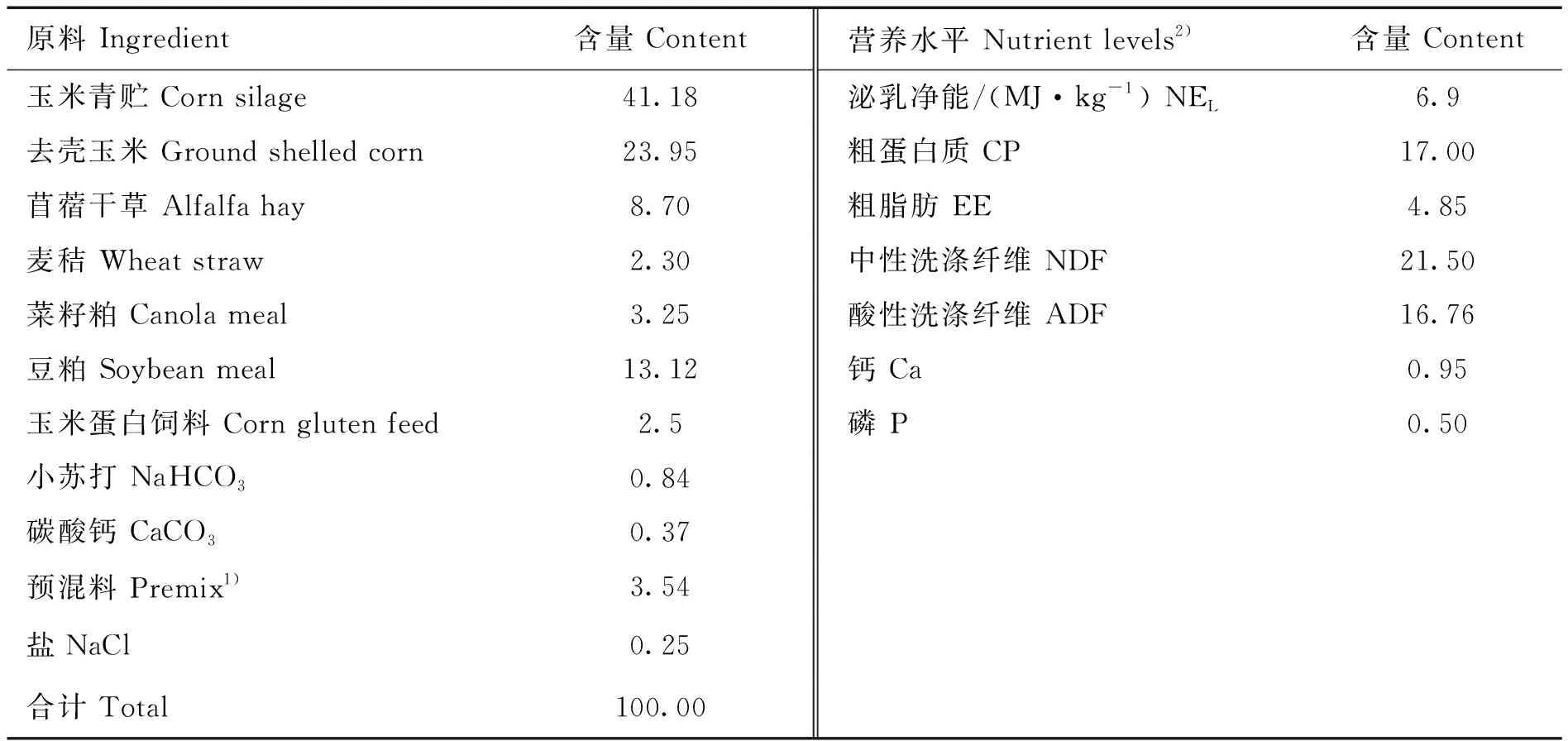
表1 日粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of the diet (dry matter basis) %
1.2 乳成分及乳脂肪酸的测定
利用MilkoScan FT-1型多功能乳品分析仪(multifunctional dairy analyzer, Foss Electric, 丹麦)测定乳成分。
奶样离心后取上层脂肪,装入带盖玻璃瓶中,加入乙醚∶二氯甲烷∶己烷(1∶10∶89),加入C11:0,作为内标,加入乙酸甲酯,混匀后加入氢氧化钠甲醇溶液,旋涡震荡,室温静置10 min;离心后,转移上清至气相小瓶中,氮吹仪吹干至0.5 mL,过滤后取1 μL进行气相色谱检测,脂肪酸甲酯标准品为GLC-463, 674, 481B(NuChek Prep,美国),检测仪器为7890-B气相色谱仪,色谱柱为DB-HP毛细管气相色谱柱(100 m×0.25 mm×0.25 μm,Agilent,美国),具体检测步骤参照文献[12]进行,脂肪酸的含量为每种脂肪酸的峰面积占该样品中所有脂肪酸峰面积之和的百分比,使用单个脂肪酸含量计算饱和脂肪酸(saturated fatty acid, SFA)、单不饱和脂肪酸(monounsaturated fatty acid, MUFA)、多不饱和脂肪酸(polyunsaturated fatty acid, PUFA)、短链脂肪酸(short chain fatty acid, SCFA)、中链脂肪酸(medium chain fatty acid, MCFA)、LCFA、反式脂肪酸(trans fatty acid, TRANS)和奇数碳脂肪酸(odd-carbon fatty acid, ODFA)。
1.3 Illumina测序
采用QIAamp PowerFecal DNA提取试剂盒(Qiagen,美国)提取瘤胃微生物DNA,具体方法参照说明书。使用NanoDrop1000(Thermo Fisher Scientific,美国)测定DNA浓度,使用0.8%()琼脂糖凝胶电泳分析DNA完整性。提取的DNA标准化至40 ng·μL进行测序。利用Illumina HiSeq V2平台对16S rRNA的V3-V4区进行测序(引物序列为:341F,5′-CCTACGGGNGGCWGCAG-3′;806R,5′-GGACTACHVGGGTATCTAAT-3′),测序服务委托广州基迪奥生物科技有限公司。
1.4 测序数据分析
首先利用R语言中的DADA2工具包,对原始数据进行去重、校正、降噪、去嵌合体,获得扩增序列变体(amplicon sequence variant,ASV)的序列和丰度信息,比对SILVA数据库(132)获得物种分类注释信息。根据ASV丰度信息获得各层级的物种丰度信息。使用R语言ggplot2包(2.2.1)绘制物种丰度堆叠图;使用QIIME(1.9.1)分析α多样性指数,Chao1和Observed species代表了细菌群落的丰富度,Shannon和Simpson指数则反映了细菌群落的物种多样性;利用PICRUSt(2.1.4)进行细菌的KEGG代谢通路预测,分类并富集到KEGG的level 3水平;并利用R语言Vegan包(2.5.3)分析两组间物种丰度差异、α多样性指数的差异、主成分分析(PCA)及功能差异。
1.5 统计分析
采用SPSS 16.0软件中的单因素方差分析模型(one-way ANOVA,LSD)分析不同泌乳天数奶牛生产性能(干物质采食量、日产奶量、乳脂率等)及乳脂肪酸含量的组间差异,并采用皮尔森相关系数(pearson correlation coefficient)评价瘤胃微生物丰度和乳脂肪酸含量的相关性(|r|≥0.25)。试验结果用“平均值±标准误(Mean±SE)”表示,<0.01表示差异极显著,<0.05表示差异显著,0.05<<0.1表示有显著趋势。
2 结 果
2.1 泌乳7和30 d生产性能的比较
如表2,泌乳7 d的干物质采食量为15.79 kg·d,日产奶量为26.81 kg,均极显著低于泌乳30 d的干物质采食量(18.87 kg·d)和日产奶量(37.47 kg)(<0.01),而泌乳7 d的乳脂率(4.49%)、乳蛋白率(3.76%)和体细胞评分(3.19)极显著高于泌乳30 d的乳脂率(3.62%)、乳蛋白率(3.09%)和体细胞评分(1.74)(<0.01)。体细胞数在两个泌乳日间存在降低的趋势(<0.1),而乳中脂蛋白比和尿素氮含量在两个泌乳日间差异不显著(>0.05)。
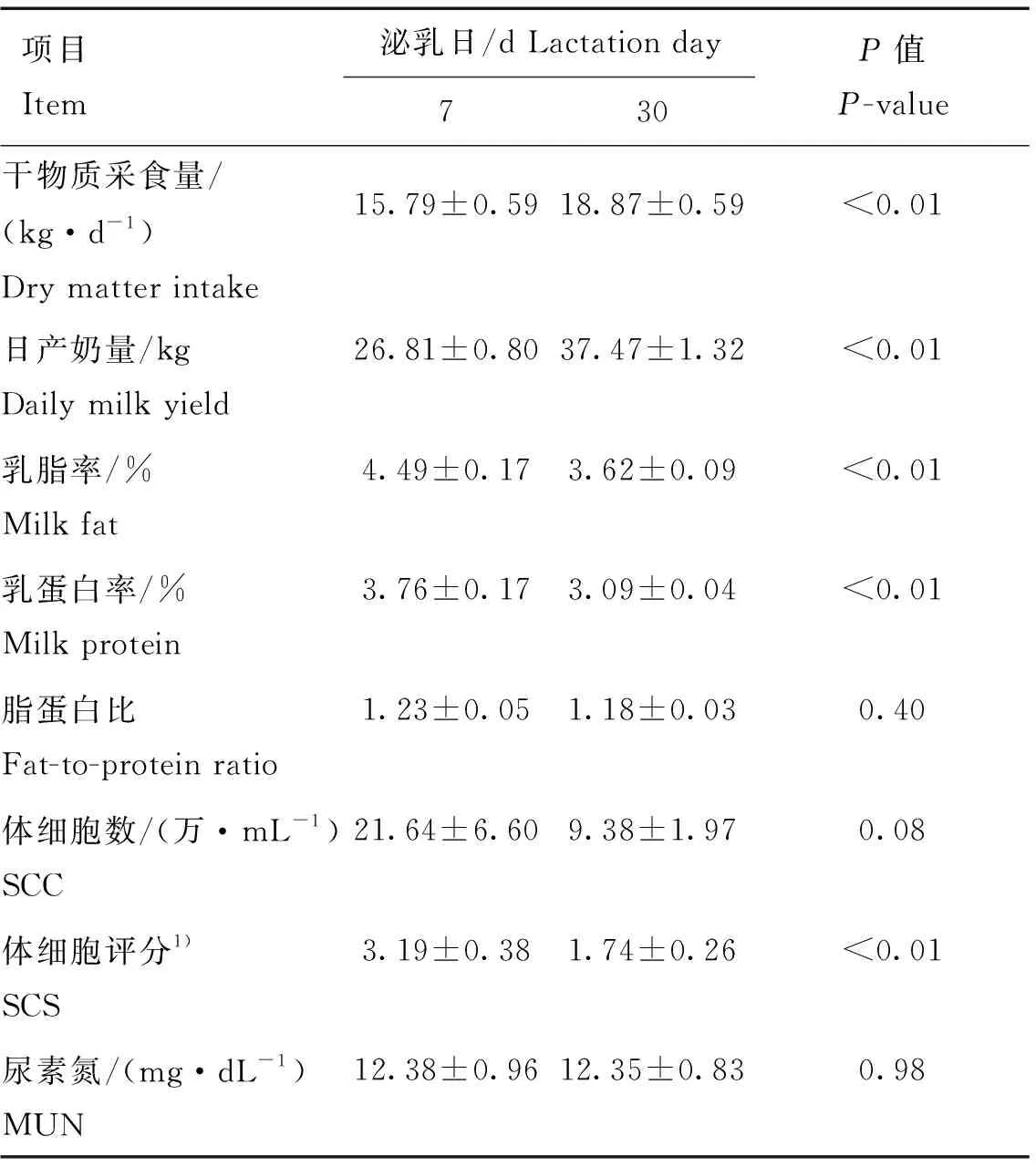
表2 泌乳7和30 d生产性能的比较分析Table 2 Comparative analysis of production performance between d7 and d30
2.2 泌乳7和30 d乳脂肪酸成分的比较
在本研究中,用气相色谱法共检出49种乳脂肪酸,其中16种脂肪酸含量在泌乳初期变化显著(<0.05),如表3所示,泌乳7 d牛奶中的C6:0、C8:0、C10:0、C12:0、C14:0、C14:1trans9、C14:1cis9、C15:1trans10、MCFA和SFA的比例显著低于泌乳30 d(<0.05),相反地,C17:0、C17:1cis10、C18:1trans6、C18:1trans11、C18:1cis9、C18:1cis11、C19:1trans10、C22:5cis4,7,10,13,16、LCFA、MUFA和TRANS的比例显著高于泌乳30 d(<0.05)。
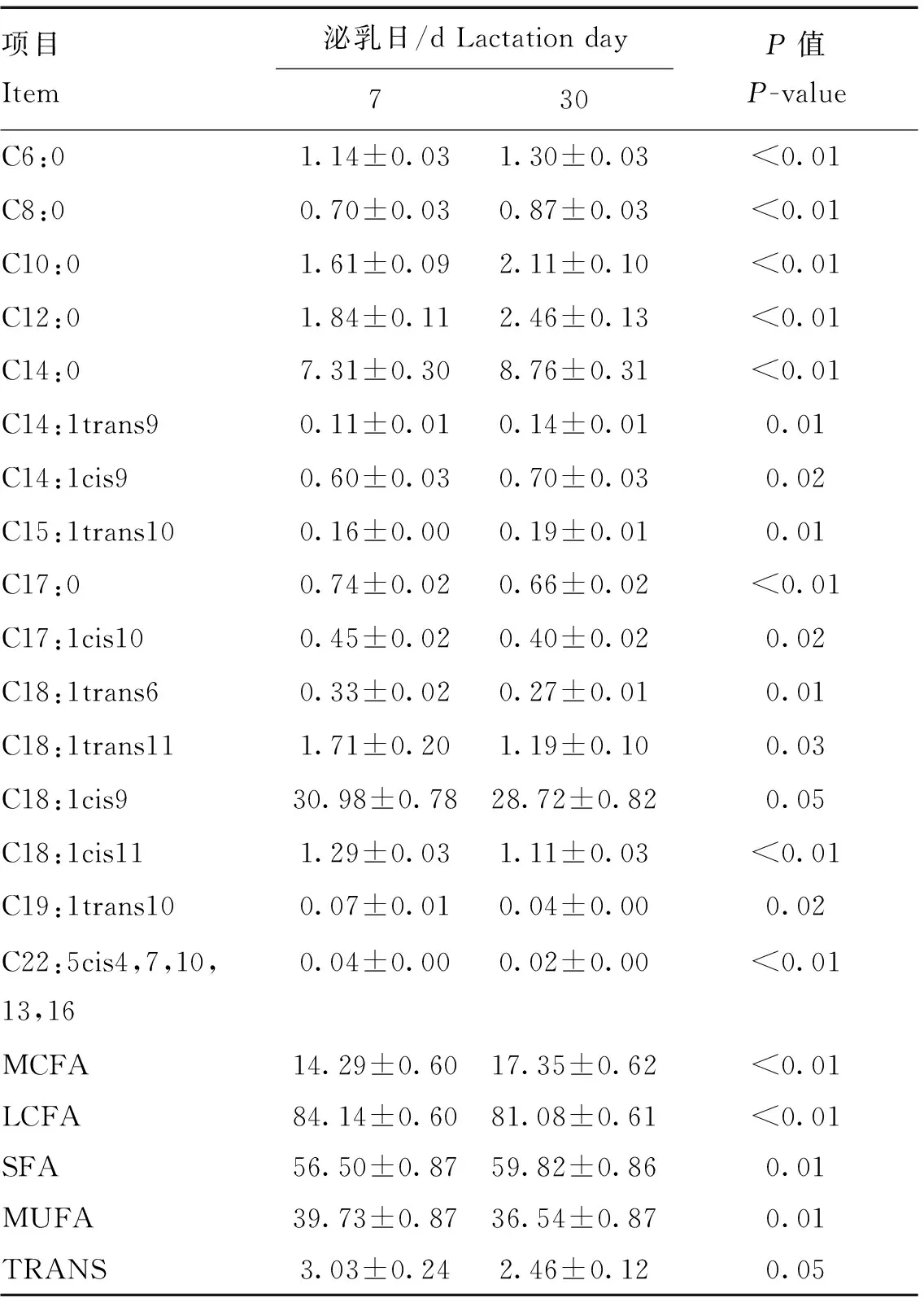
表3 泌乳7和30 d差异乳脂肪酸的比较分析Table 3 Comparative analysis of different milk fatty acids between d7 and d30 %
2.3 瘤胃菌群多样性分析
测序数据经质控处理后,每个瘤胃液样品平均获得52 506条reads,经DADA2软件处理后,每个样品有6 322个ASV,用于下游分析。瘤胃细菌群落的α多样性和β多样性分析显示两个泌乳日瘤胃细菌的α指数(Chao1、Observed、Shannon、Simpson)之间均不存在显著差异(>0.05),表明泌乳7和30 d奶牛瘤胃细菌的丰富度与多样性无差异(图1)。
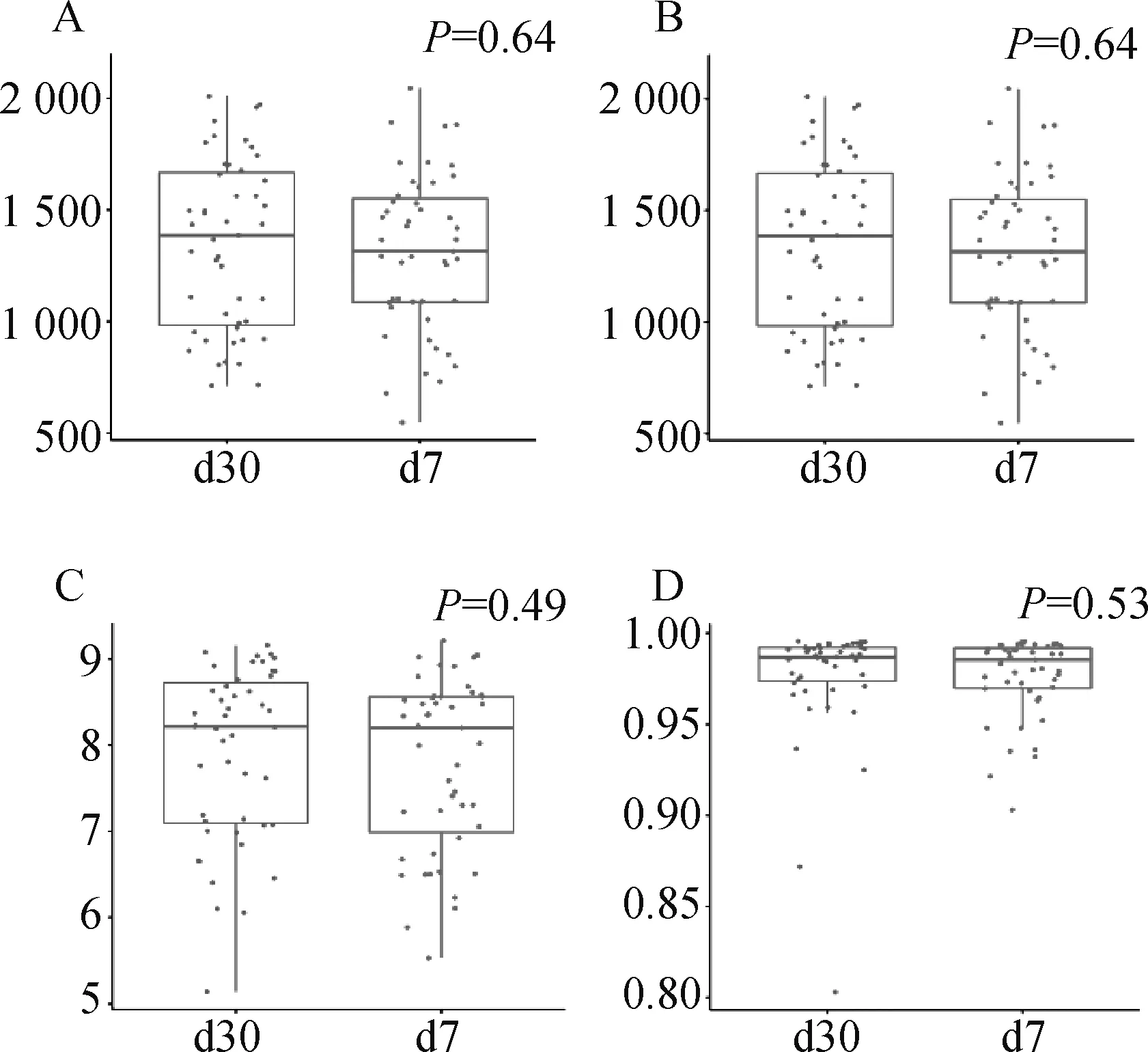
A. Chao1指数;B. Observed;C. Shannon;D. SimpsonA. Chao1 index; B. Observed; C. Shannon; D. Simpson图1 瘤胃细菌菌群α多样性指数Fig.1 Alpha diversity index of rumen bacterial community
PCA主坐标分析结果如图2所示,第1主坐标(PC1)和第二主坐标(PC2)的贡献率分别为99.5%和0.3%,且两个泌乳日奶牛瘤胃细菌群落结构未明显区分开,说明奶牛泌乳7和30 d之间的瘤胃细菌组成结构差异不显著(>0.05)。
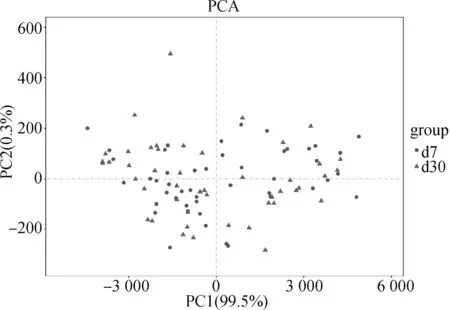
圆点表示泌乳7 d,三角表示泌乳30 dCircles represent d7, while triangles represent d30图2 奶牛瘤胃细菌菌群PCA图Fig.2 PCA graph of rumen bacterial community in dairy cows
2.4 瘤胃菌群结构分析
试验共检测到29个菌门,其中表达丰度最高的18个菌门如图3所示。厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)占到总量的84%以上。在属水平上,94个瘤胃液样品共检测到178个属,普雷沃氏菌属(_1)占比最高,可达到总菌属的13.93%。

图3 奶牛瘤胃细菌物种门水平分布堆叠图Fig.3 Stack diagram of rumen bacterial species distribution at phylum level
如图4所示,在属水平上,相对丰度>1%的差异微生物有9种,与泌乳7 d相比,泌乳30 d奶牛瘤胃内的瘤胃梭菌属(_1)、瘤胃球菌属(__014和__005)、梭菌属(___1)和小杆菌属()的相对丰度显著增加(<0.05)。而球藻菌属()、弯曲菌属()和真细菌属(__)的丰度显著降低(<0.05)。

图4 泌乳7和30 d瘤胃差异微生物Fig.4 Different rumen bacteria between d7 and d30
2.5 瘤胃菌群功能预测
将两组间的差异微生物进行KEGG富集分析(表4),发现泌乳天数不同,差异瘤胃微生物主要富集在脂质及免疫代谢通路中,如线粒体中脂肪酸的伸长、糖胺聚糖生物合成(<0.1)等。

表4 差异微生物的KEGG富集分析Table 4 KEGG pathway enrichment of different rumen bacteria
2.6 牛奶脂肪酸与瘤胃微生物关联分析
将泌乳7和30 d奶牛乳中差异脂肪酸与差异瘤胃微生物进行相关性分析,结果如图6所示。瘤胃内丰度与乳中LCFA、MUFA和TRANS含量显著正相关(<0.05),如C17:0、C17:1cis10、C18:1trans6、C18:1trans11、C18:1cis9、C18:1cis11和C19:1trans10,而与MCFA和SFA含量显著负相关(<0.05),如C6:0、C8:0、C10:0、C12:0和C14:0。与C14:1cis9呈正相关(<0.05),_与C18:1trans6和C22:5cis4,7,10,13,16含量呈负相关(<0.05)。_1、__005均与C15:1trans10呈正相关(<0.05),与C17:0、C18:1trans6、C18:1trans11、C19:1trans10和TRANS呈极显著负相关(<0.01)。__005和__014均与C22:5cis4,7,10,13,16含量呈负相关(<0.05)。图6中大部分微生物的丰度均与C17:0、C18:1trans6、C18:1trans11和C19:1trans10的含量相关。和与这些脂肪酸含量显著正相关(<0.05),而_1和__005与这些脂肪酸含量显著负相关(<0.05)。

*. 差异显著(P<0.05);**. 差异极显著(P<0.01)*. Significant difference (P<0.05); **. Extremely significant difference(P<0.01)图5 乳脂肪酸与瘤胃微生物关联分析Fig.5 The correlation between rumen bacteria and milk fatty acids
3 讨 论
3.1 泌乳早期奶牛生产性能的变化
随着泌乳时间的延长,奶牛的采食量不断上升,其干物质采食量在泌乳8~10周可达到高峰。本研究发现,泌乳7 d采食量显著低于泌乳30 d,说明围产后期奶牛采食量显著低于泌乳盛期,围产后期采食量低可能是由于产犊后奶牛日粮成分的突然改变引发奶牛厌食,通常瘤胃要4~6周才能适应高精日粮,还可能与瘤胃pH的变化有关,表现为瘤胃运动减弱,食物郁积,排空弛缓,进而引起采食量下降。此外,在泌乳早期,随着泌乳时间的延长,乳中的乳蛋白率和乳脂率逐渐下降。陈永华等发现,泌乳7 d的乳脂率为5.00%,高于常乳的乳脂率(3.46%),而泌乳7 d的乳蛋白率(3.11%)和常乳(3.01%)接近。雷晓薇等发现,健康奶牛泌乳开始时,牛奶中的体细胞数会立刻上升,在泌乳35 d会迅速下降。泌乳初期乳中体细胞数高,并不一定表明奶牛出现了乳房炎的症状,这可能是一种泌乳初期的乳腺生理特征,此时,细胞可通过乳腺上皮细胞间紧密连接中的漏洞逃逸至牛奶中。这些结论与本研究结果相一致,即泌乳7 d的乳脂率、乳蛋白率和体细胞评分显著高于泌乳30 d,此外,本研究还发现,泌乳7 d的日产奶量显著低于泌乳30 d。在之前的研究中也发现泌乳早期产奶量是逐渐升高的,这与采食量不断上升有关。
3.2 泌乳早期奶牛乳脂肪酸组成的变化
牛奶脂肪酸中的C4~C14及一半的C16:0在乳腺中生成,其余LCFA则来源于血液外源转化。本研究发现泌乳7 d牛奶的中链饱和脂肪酸含量(C6~C14)显著低于泌乳30 d,而长链单不饱和脂肪酸(C18:1、C19:1trans10)则呈相反的趋势,泌乳7 d显著高于泌乳30 d。由此可见,与泌乳30 d相比,泌乳7 d时,乳腺合成的脂肪酸少,而LCFA多,可能与泌乳初期的体脂动员有关。奶牛产犊后,泌乳的能量需要急剧增加,干物质采食量不足,机体被迫动用储备体脂获得能量。动员体脂进入血液后,形成非酯化脂肪酸,在泌乳早期,血液中40%以上的非酯化脂肪酸被用于合成乳脂。此外,Bionaz和Loor发现,泌乳初期的乳腺上皮细胞内,从血液中摄取LCFA相关的基因表达量较高。Kay等比较了泌乳1周和8周时牛奶脂肪酸组成的差异,结果发现泌乳1周奶牛牛奶中的C6:0、C8:0、C10:0、C12:0、C14:0低于泌乳8周的,而泌乳1周的C17:0、C18:1cis9高于泌乳8周的,其变化趋势与本文的研究一致。C18:1cis9有降低血脂血压、抗血栓、抑敏抗炎、抑制癌症转移等生理功能,且乳品质越高,其LCFA、PUFA比例越高。本研究发现,泌乳7 d牛奶中的C22:5cis4,7,10,13,16含量显著高于30 d,多项研究表明C22:5cis4,7,10,13,16对降低炎症和改善血脂有直接作用,其脂质衍生物可促进炎症因子的降解。付力立比较了泌乳首日与泌乳21 d牛奶的代谢组差异,结果表明,两个泌乳日乳中共存在97种差异显著的代谢物。泌乳首日乳中多种PUFA(C18:2cis9,12、C20:4cis5,8,11,14)的含量显著高于泌乳21 d,这些脂肪酸在炎症调控的生理机能中尤为重要,因此,泌乳初期中优质脂类的存在主要是为新生犊牛羸弱的身体提供被动免疫以及激活主动免疫,从而促进初生犊牛的存活。
3.3 泌乳早期瘤胃细菌组成的变化
许多研究表明,瘤胃微生物区系在各泌乳阶段显著不同,Derakhshani等比较了奶牛泌乳10、20及28 d瘤胃细菌的变化,发现产后随着干物质采食量的上升,、和等与蛋白质降解、淀粉水解有关的菌群丰度显著升高,且这些微生物主要富集在能量代谢通路上,表明瘤胃微生物在一定程度上适应了高精料日粮。不同生理时期奶牛瘤胃微生物的结构和组成存在显著差异,可能因为不同泌乳时期奶牛瘤胃中微生物群落的适应性存在差异,或者是不同生理时期奶牛所面临的内部和外部应激不一样所致。本研究发现,泌乳30 d奶牛瘤胃内、、和的相对丰度显著高于泌乳7 d。Bach等的发现与本试验结果相同,奶牛泌乳21 d时,瘤胃内的-014和的相对丰度高于泌乳7 d。此外,高产奶牛瘤胃内和的丰度高于低产奶牛。和是瘤胃内主要的纤维素降解菌,同时也是潜在的有益细菌,它们可参与消化道环境的调节,与炎症和细胞毒性因子的释放有关,并与免疫调节和健康的内稳态有关。由此可见,泌乳30 d内,奶牛瘤胃的纤维素降解能力逐渐上升。纤维素降解菌可发酵饲粮,产生乙酸、丁酸、H和CO。Sawanon等发现,瘤胃内纤维素降解菌(瘤胃球菌)丰度与瘤胃内乙酸浓度显著正相关。在泌乳早期,瘤胃内发酵菌的数量和比例发生改变,瘤胃内的发酵参数也会发生改变。Cersosimo等发现,泌乳盛期(泌乳93 d)奶牛瘤胃内乙酸浓度显著高于泌乳初期(泌乳3 d)。由此可见,泌乳30 d内,瘤胃内的纤维素降解菌丰度上升,可导致瘤胃内乙酸浓度上升。瘤胃内是一种蛋白质降解菌,其丰度与牛奶中的MUN含量正相关,这与本文报道不同,虽然丰度在两个泌乳日差异显著,乳中尿素氮含量差异却不显著。
此外,本研究还发现,泌乳30 d瘤胃内、和丰度显著低于泌乳7 d,是一种潜在的硝酸盐还原菌,当动物肠道机能紊乱时,硝酸盐还原菌会大量繁殖,此外,当饲料中添加硝酸盐时,瘤胃内的丰度会上升。可释放丁酸盐或丙酸盐等代谢产物,与乙酸相比,这类代谢物可为奶牛提供更高的能量。由此可见,泌乳30 d内,奶牛瘤胃机能逐渐恢复,潜在的致病菌丰度逐渐下降,这也与文献报道相一致。
3.4 瘤胃细菌与乳脂肪酸的相关性
许多研究表明,瘤胃菌群与奶牛的生产性能显著相关,Jami等发现,产奶量与瘤胃微生物多样性密切相关,且s的比例与乳脂率呈极显著正相关。奶牛瘤胃内、和的丰度与乳蛋白率显著正相关。本研究发现,瘤胃与乳中MCFA(C6~C14)具有显著的相关性,而其余细菌与MCFA无显著相关性。这表明瘤胃细菌对乳中脂肪酸的从头合成影响不大,这与Buitenhuis等报道一致,即瘤胃微生物对乳中MCFA含量影响较小,他们还发现瘤胃细菌对乳中ODFA和C18多不饱和脂肪酸的影响更为明显。虽然本研究并未发现瘤胃细菌对C18多不饱和脂肪酸的影响,但随着纤维素降解细菌丰度的增加,如-1、__005,乳中C17:0、C18:1trans6、C18:1trans11和C19:1trans10的含量会显著降低。而和丰度则与乳中的这些脂肪酸的含量显著正相关。Vlaeminck等研究表明,反刍动物乳中的ODFA一般来源于瘤胃细菌的细胞膜,当瘤胃微生物死亡进入小肠后,这些ODFA会被宿主消化吸收后沉积到奶中。瘤胃细菌可发酵饲粮产生挥发性脂肪酸,然后利用这些代谢产物合成细菌自身的脂类等物质。如瘤胃微生物在脂肪酸合成酶作用下,以丙酸和戊酸为前体合成ODFA。不同类型瘤胃微生物合成的脂肪酸组成不同。纤维素降解菌的升高可提高异构脂肪酸的比例,而反式异构脂肪酸和ODFA在淀粉分解菌中较丰富。Liu等发现,牦牛瘤胃内_-010和-011与瘤胃内戊酸浓度负相关,而戊酸是微生物合成ODFA的底物,由此可见,瘤胃内的纤维素降解菌-1、__005与乳中C17:0含量负相关的原因可能与瘤胃内的戊酸浓度有关。Liu等发现瘤胃内、和丰度与乳中C13:0含量相关,提示乳中C13:0可能反映了瘤胃纤维素降解菌的数量。因此推测,C17:0可能反映了泌乳初期瘤胃中纤维素降解菌-1、__005的数量。
乳中的反式脂肪酸主要来源于奶牛瘤胃内饲粮PUFA的不完全生物氢化产物。Kennelly等研究表明,牛奶中C18反式脂肪酸浓度的增加与饲喂高精料奶牛的乳脂降低有关,因为这类脂肪酸可抑制乳腺组织中脂肪酸的从头合成和甘油三酯的合成。研究发现,瘤胃微生物按照参与生物氢化的过程可分为A、B两类:A类微生物将C18:2n6及C18:3n3转换为C18:1trans11;B类微生物将C18:1trans11转化为C18:0。目前已发现、、、、等微生物属于A类微生物。Huws等发现和在瘤胃生物氢化过程中起着重要的作用。本研究发现泌乳30 d乳中C18:1trans6和C18:1trans11的含量低于泌乳7 d,可能与瘤胃内丰度变化相关。
4 结 论
泌乳7 d奶牛的干物质采食量和产奶量低于泌乳30 d,但其乳脂率、乳蛋白率和体细胞评分均高于泌乳30 d,且16种乳脂肪酸含量在两个泌乳日间变化显著。奶牛泌乳30 d瘤胃内纤维素降解菌丰度高于泌乳7 d,而硝酸盐还原菌和真细菌丰度低于泌乳7 d。相关性分析显示瘤胃微生物对乳中MCFA含量影响较小,且纤维素降解细菌(1、005)与乳中C17:0、C18:1trans6、C18:1trans11和C19:1trans10的含量显著负相关。
