盐酸小檗碱与左氧氟沙星联合抑制MRSA及其机制研究
2022-09-30操庆国蔡佳惠任成万李昀庭
操庆国,郭 钦,彭 凯,蔡佳惠,任成万,李昀庭
(1.江苏农林职业技术学院茶与食品科技学院,句容 212400; 2.江苏大学食品与生物工程学院,镇江 212013)
耐甲氧西林金黄色葡萄球菌(methicillin-resistant,MRSA)是一种高度且多重耐药的食源性致病菌,已被列为3大世界最难解决的感染性疾患之一。MRSA基因组中含有葡萄球菌染色体盒,后者携带基因,其编码新的青霉素结合蛋白(penicillin binding proteins,PBPs)PBP2a,具有转糖基酶和转肽酶活力,通过催化转肽反应合成肽聚糖。PBPs是细菌细胞膜上能与β-内酰胺类抗生素结合的蛋白质,MRSA中包含6种PBPs(PBP1、PBP2、PBP3、PBP3’、PBP4和独特的PBP2a)。PBP2a和β-内酰胺类抗生素几乎没有亲和力,当其他PBPs与β-内酰胺类抗生素结合失去活性后,PBP2a仍可继续参与肽聚糖合成,因此MRSA对几乎所有β-内酰胺类抗生素均耐药。此外,、和等基因也对MRSA的耐药性起重要作用。MRSA是导致化脓性关节炎、皮肤和软组织感染、肺炎、脑膜炎和心内膜炎等严重感染的主要细菌病原体之一。MRSA分泌的肠毒素热稳定性较好,100 ℃处理30 min后仍保持活性,是高温灭菌后引起食物MRSA中毒的主要原因。
MRSA可通过食物链传播,近年来,世界范围内从肉类到乳制品等多种食品中都发现了MRSA。易受MRSA污染的食物包括发酵制品、乳制品和肉鱼类制品等。Jones等在2002年首次报道了由社区获得性MRSA引起的食物中毒。检测美国5个城市的136份肉类样品发现, 42%的猪肉感染了葡萄球菌(SA),其中,64%为MRSA感染。在瑞士和日本的肉类产品中,SA的检出率分别为23%和65%。食用被MRSA污染的食物,极易引起呕吐、腹泻、肠胃炎等,严重时会引起食物中毒,甚至危及生命。MRSA对食品安全构成了巨大威胁,占北美细菌性食物中毒的9.52%,每年约造成1.5亿美元的经济损失。
目前,MRSA已发生转移,通过环境、畜牧业、食物链等进入人体,对人类健康造成严重威胁。2005年,首次证实猪源MRSA可通过猪传给人群。Boer等在264/2217份样本中发现MRSA(11.9%),Neeling等在荷兰9个屠宰场中抽取的209/540头猪鼻腔中有MRSA,每个屠宰场中均有生猪被检出带有MRSA。由于MRSA对四环素类、林可胺类、氨基糖苷类、大环内酯类和氟喹诺酮类等多种抗菌药物也有耐药性,使防治MRSA引起的牲畜感染非常困难,高效、安全的动物源MRSA新型抗菌药物急需开发。
新型抗生素研发一般需要10~15年,而细菌耐药性产生仅需要2~3年,因此天然产物与抗生素联合抑菌被视作防治MRSA的研究热点之一。已发现的PBP2a天然产物抑制剂包括黄芩中的黄芩苷、绿茶中的儿茶素和表没食子儿茶素没食子酸酯(EGCg)、大角莲中的柯里拉京和玫瑰中的鞣质和特里马素等。此外,小舌菊和四环素联用、黄连叶精油或姜花素D或刺苞菊醛和庆大霉素联用、鼠尾草酸和诺氟沙星等的联用皆能协同降低抗生素对MRSA的MIC,但协同抑菌机制并未得到清晰的阐明。本研究从多种天然产物中进行抗MRSA筛选,并与抗生素进行联合抑菌试验,同时阐释天然产物与抗生素联合抑制MRSA的分子机制,为降低畜牧养殖中抗生素的使用、提高肉奶类食品安全奠定基础。
1 材料与方法
1.1 材料和仪器
金黄色葡萄球菌(ATCC 6538)购自武汉大学菌种保藏中心,MRSA(ATCC 33591)购自美国模式菌种保藏中心(American type culture collection,ATCC),盐酸小檗碱(BBR)购自西安优硕生物科技有限公司,阿莫西林、左氧氟沙星、万古霉素、氯霉素、头孢唑林、青霉素、四环素均购自上海原叶生物有限公司;RNAprep Pure提取试剂盒、PrimeScriptTMRT reagent Kit with gDNA Eraser 逆转录试剂盒、SYBRR Premix Ex TaqTM‖PCR试剂盒购自北京宝日医生物有限公司(TaKaRa),牛肉浸粉购自青岛海博生物技术有限公司,其他试剂均为分析纯,购自上海国药集团。
超净工作台购自苏净化设备有限公司,LRH系列生化培养箱购自一恒科学仪器有限公司,高压灭菌锅购自鸟取三洋电机,HYG-C型多功能摇床购自太仓试验设备厂。
1.2 试验方法
1.2.1 最低抑菌浓度(MIC)和最低杀菌浓度(MBC)检测
1.2.1.1 天然产物配制:称取BBR 0.1 g,振荡后均匀溶解于1 mL水中,浓度为 0.1 g·mL,过滤除菌后,4 ℃保存。
1.2.1.2 抗生素配制:称取7种抗生素0.012 8 g,溶解于1 mL无菌水中,浓度为12.8 mg·mL,过滤除菌后,-20 ℃避光保存。
1.2.1.3 MIC/MBC测定:按照微量肉汤稀释法进行。96孔板横排前十孔每孔加入10 μL 水解酪蛋白培养基(MH培养基)后,在第1孔内加入10 μL BBR或者抗生素,均匀震荡后,吸出10 μL加入至第2孔,依次梯度稀释,直至第10孔。之后,每孔加入90 μL细菌培养液,使终体积为100 μL,细菌终浓度为5×10CFU·mL。第11孔中加入100 μL的菌液作为阳性对照,第12孔采用空白NB培养基作为阴性对照。将96孔板在37 ℃培养24~48 h,以24 h无菌生长的最低浓度为MIC,48 h后肉眼无细菌生长的试管中取100 μL菌液涂平板;过夜培养后平板无菌生长的对应肉汤管中的最低药物浓度,即是MBC。每个试验重复3次,每次3个平行。
1.2.1.4 联合抑菌和FIC测定:采用棋盘法进行,96孔板中每横排从左至右依次加入5 μL抗生素(终浓度为2MIC~1/64MIC),每纵列从上至下依次加入5 μL BBR(终浓度为1/2 MIC~1/32 MIC),再加入90 μL菌液(终浓度为5×10CFU·mL),终体积100 μL。分别加入100 μL的菌液和空白培养基为阳性和阴性对照。37 ℃培养24 h,无菌生长的最低浓度为抗生素和BBR联合抑菌MIC。
抑菌浓度指数(fractional inhibitory concentration, FIC)计算方法:
FIC=MIC(联合)/MIC(BBR)+MIC(联合)/MIC(抗生素)
协同:FIC≤0.5;相加:0.5
1.2.2 时间杀灭曲线测定 设置BBR组(1/4 MIC BBR、1/2 MIC BBR和MIC BBR)、MIC抗生素组和联合组(1/8 MIC BBR+1/32 MIC 抗生素),以无药物加入的NB培养液为对照,分别加入细菌培养物,使终浓度为1×10CFU·mL。7组试管于37 ℃ 振荡培养,定时取样,稀释后,涂NB平板,37 ℃培养12~24 h 后计数。以时间为横坐标,以菌落总数的对数为纵坐标绘图,即时间杀灭曲线。
1.2.3 电导率测定 取100 μL细菌过夜培养物,稀释50倍后,分别加入BBR、抗生素和联合抑菌液,37 ℃ 振荡培养。于0、1、2、4、6、8 h分别定时取样,5 000 r·min离心10 min,吸取上清液,无菌水均匀稀释,测定电导率。每个试验重复3次,每次3个平行。
1.2.4 膜电位测定 细菌于NB培养基中37 ℃培养12 h,取100 μL过夜培养物分别转接到含有BBR、抗生素和联合抑菌液的培养基中,混合均匀,取100 μL混合液加入96孔板中,过夜培养。用5 μmol·LDiBAC4(3) 缓冲液清洗96孔板3次,加入180 μL 5 μmol·LDiBAC4(3)的缓冲液进行染色,37 ℃孵育30 min,多功能酶标仪3 min检测一次荧光强度。以无细菌的培养基为空白对照。
1.2.5 碱性磷酸酶(AKP)的测定 取100 μL细菌过夜培养物加入5 mL NB培养基中,再分别加入BBR、抗生素和联合抑菌液,37 ℃ 下振荡培养,0、1、2、4、6、8 h 定时取500 μL样品,5 000 r·min离心10 min,用试剂盒测定AKP含量。
1.2.6 荧光实时定量PCR(RT-PCR) 细菌过夜活化,1∶100的比例转接到分别含有BBR、抗生素和联合抑菌液的NB培养基中,37 ℃培养12 h,提取mRNA,再逆转录成cDNA。以cDNA为模板,16S rRNA为内参基因,使用荧光定量试剂盒,测定的表达水平。反应程序:95 ℃ 预变性 30 s;95 ℃ 变性5 s,50~ 60 ℃ 退火30 s,72 ℃ 延伸30 s,40个循环;熔解曲线从 65 ℃ 升至 95 ℃,每5 s升温0.5 ℃。
1.2.7 转录组学检测 送北京诺禾致源有限公司协作完成。具体操作为提取样品的总mRNA,使用fragmentation buffer随机将其打断成短片段,按照链特异性建库的方式建库。在M-MuLV逆转录酶体系中,将片段化的mRNA作为模板,随机寡核苷酸作为引物,合成cDNA第一条链,随后用RNaseH降解RNA链,将dNTPs(将dNTP中的dTTP用dUTP取代)作为原料在DNA polymerase I 体系下合成cDNA第二条链(使第二条链中包含A/U/C/G),再用AMPure XP beads筛选250~300 bp的cDNA,通过cDNA末端修复、加A尾、连接测序接头,并借助USER酶降解含U的cDNA第二链,再进行PCR扩增并获得文库。
库检合格后,根据有效浓度及目标下机数据量的需求对不同文库pooling后,再按照边合成边测序(sequencing by synthesis)的原理进行Illumina测序。添加4种荧光标记的dNTP、DNA聚合酶以及接头引物于测序的flow cell中进行扩增,当测序簇延伸互补链时,每添加一个被荧光标记的dNTP即可释放出相对应的荧光,并利用软件将测序仪接收到的荧光信号转化为测序峰,从而获得待测片段的序列信息。
1.2.8 生物信息学分析 对转录组学测序结果进行GO富集、KEGG富集和差异基因筛选。值≤0.05的通路定义为在显著差异表达基因中显著富集的通路。应用DESeq2方法计算不同样本之间基因表达量的差异,具有统计学显著差异的确定为差异表达基因。值<0.05,FDR≤0.01和差异表达倍数≥2的基因即显著差异表达基因。
2 结 果
2.1 抗生素和BBR单独作用于SA/MRSA的MIC
BBR与抗生素单独作用于SA/MRSA的MIC/MBC见表1。7种抗生素对SA/MRSA均有抑菌效果,但对MRSA的MIC显著高于SA,除万古霉素和氯霉素以外,其他5种抗生素对MRSA的MIC比SA高了100倍~2 000倍之多。其中,阿莫西林对SA的抑菌效果最佳,MIC为0.5 μg·mL;万古霉素对MRSA的抑菌效果最佳,MIC为2 μg·mL。BBR对SA和MRSA的抑菌效果一致,均为1 250 μg·mL。
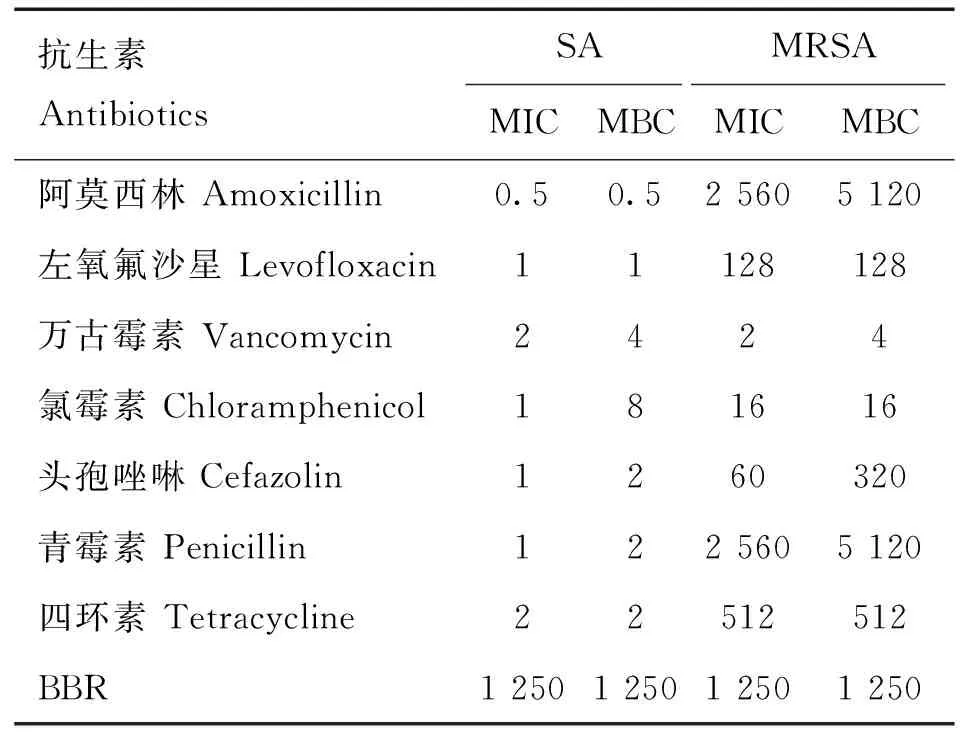
表1 不同抗生素对SA/MRSA的MIC和MBCTable 1 MICs and MBCs of different antibiotics against SA/MRSA μg·mL-1
2.2 抗生素和BBR联用的FIC
BBR和7种抗生素联用对SA均具有协同抑菌作用,但只与4种抗生素联用能协同抑制MRSA(表2)。其中,1/32 MIC BBR+1/64 MIC青霉素联用对SA具有最小的FIC值0.047,但对MRSA却呈现无关作用;1/32 MIC BBR+1/32 MIC阿莫西林联用对MRSA具有最小的FIC值0.063,1/16 MIC BBR+1/4 MIC左氧氟沙星对SA和MRSA的FIC均为0.313。由于阿莫西林对MRSA的MIC太高,为5 120 μg·mL,而左氧氟沙星仅为128 μg·mL,因此选择左氧氟沙星进行之后的试验。联合抑菌结果表明,BBR不但能够直接抑制MRSA,而且与β-内酰胺类抗生素联合使用能够恢复其对MRSA菌株的敏感性。
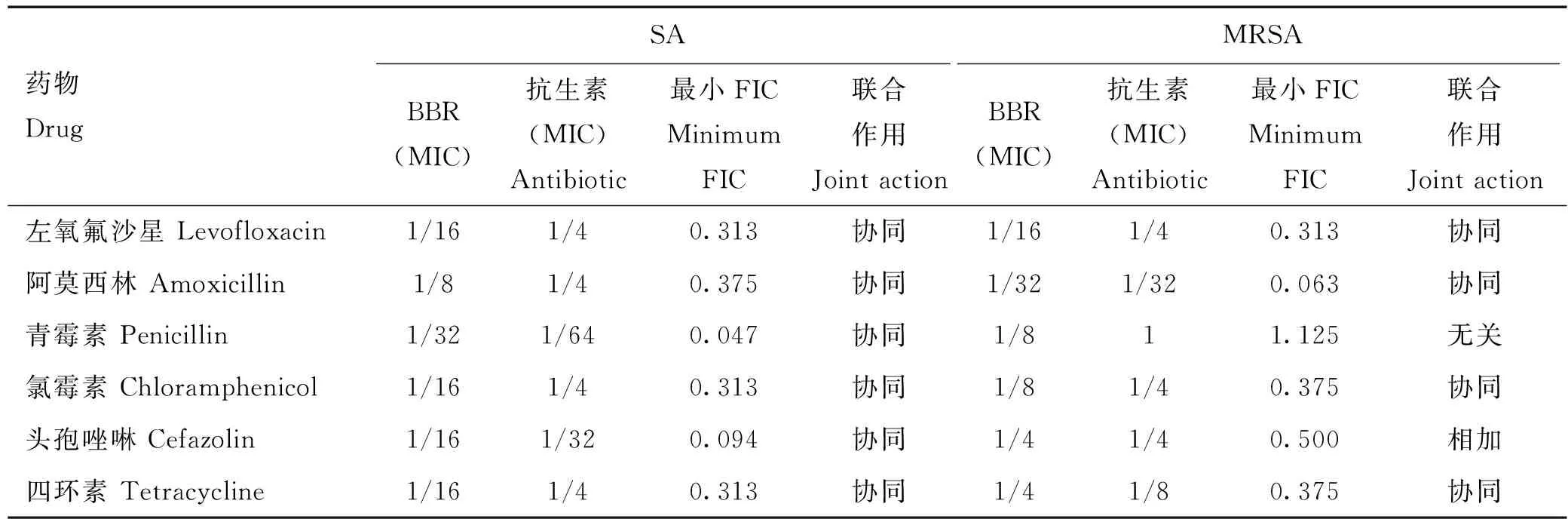
表2 BBR与各抗生素联用对SA/MRSA作用对比Table 2 Comparison of the effects of BBR combined with various antibiotics on SA/MRSA
2.3 时间杀灭曲线
为了进一步评价BBR和左氧氟沙星的杀菌效果,作者测定了它们单独和联合分别作用于MRSA的时间杀灭曲线。当MRSA初始接种浓度为1×10CFU·mL时,24 h后MIC BBR组细菌显著下降,为(5.57±0.21)×10CFU·mL(<0.05);而1/4 MIC BBR组和1/2 MIC BBR组则分别为(6.17±0.15)×10和(6.3±0.2)×10CFU·mL,对照组细菌数可达(1.16±0.04)×10CFU·mL(图1a)。24 h后,MIC左氧氟沙星组细菌数为(6.07±0.29)×10CFU·mL,而联合组则为(4.7±0.2)×10CFU·mL(图1b)。联合组的抑菌效果不如左氧氟沙星单独作用,原因可能是因为复配浓度大幅度降低的原因,但两者联用依然可以抑制MRSA的生长繁殖,达到有效的MIC水平。
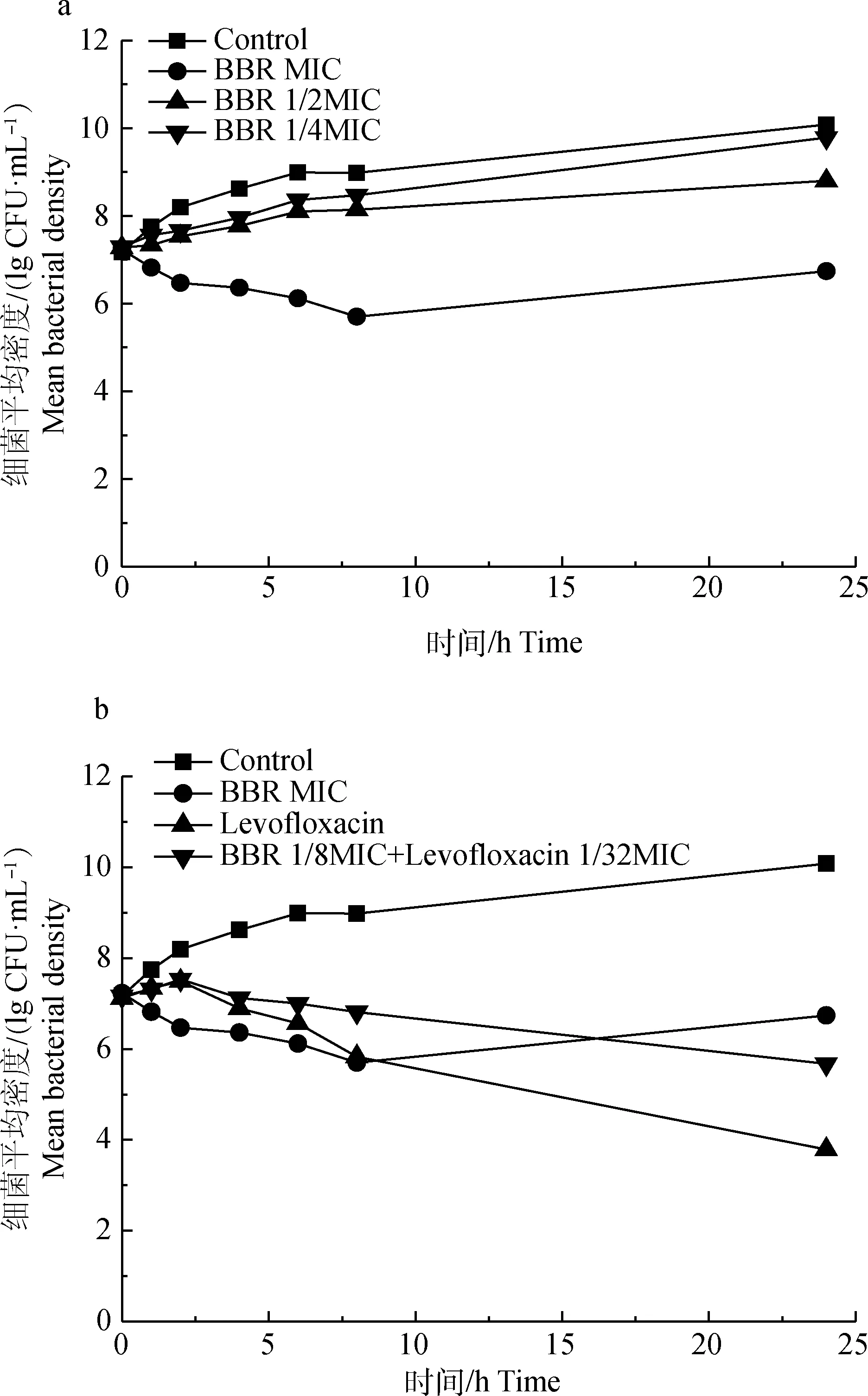
a.BBR; b. BBR和左氧氟沙星联合a.BBR; b. The combination of BBR and levofloxacin图1 对MRSA的时间杀灭曲线Fig.1 Time-kill curve of drugs against MRSA
2.4 BBR和抗生素联用破坏MRSA细胞结构
电导率可以衡量细菌细胞膜的通透性,电导率越大,细胞膜被破坏越严重,因此可通过菌液电导率的变化判断细菌细胞膜的受损情况。结果表明,对照组菌液8 h内电导率无显著变化, BBR+左氧氟沙星联合组电导率变化率显著高于对照组但低于BBR组(<0.05)(图2a)。

a.电导率变化;b.荧光强度变化;c.AKP活性a. Conductivity change; b. Fluorescence intensity change; c. AKP activity图2 BBR和抗生素联用破坏MRSA细胞结构Fig.2 The combination of BBR and antibiotics destroyed the cell structure of MRSA
DiBAC4(3)是一种亲脂性阴离子荧光染料,本身无荧光,但它能和细胞质中的蛋白质结合产生强烈荧光,当细胞膜受损,细胞荧光会大幅度增加。结果表明,对照组菌液30 min内荧光强度无显著变化,联合组的荧光强度显著高于对照组而低于BBR组(图2b)。
AKP的活性表明细菌细胞壁的破损程度。8 h内,对照组AKP活性无显著变化,而联合组AKP活性显著高于对照组却显著低于BBR组(<0.05)(图2c)。
2.5 BBR和抗生素联用下调mecA表达
图3表明,BBR显著下调了的相对表达水平,且呈现浓度依赖,与对照组相比,添加1/4 MIC、1/8 MIC和1/32 MIC BBR的分别降低为对照组的16.69%、5.26%和75.19%(<0.05),说明可能是BBR的作用靶点之一。左氧氟沙星组表达上调26.82倍,而联合组却显著降低的相对表达水平为对照的1.35%(<0.05)。BBR作用于,使得MRSA细胞壁完整性降低,而左氧氟沙星作用于拓扑异构酶II,两者联用能大幅度协同下调的表达。

1. 对照组; 2. 1/4MIC BBR; 3. 1/8MIC BBR; 4. 1/32MIC BBR; 5. 1/64MIC万古霉素; 6. 1/64MIC 万古霉素+1/8MIC BBR; 7. 1/8MIC氯霉素; 8. 1/8MIC 氯霉素+1/4MIC BBR; 9. 1/32MIC左氧氟沙星; 10. 1/32MIC左氧氟沙星+1/8MIC BBR; 11. 1/32MIC阿莫西林; 12. 1/32MIC阿莫西林+BBR 1/8MIC; 13. 1/16MIC红霉素; 14. 1/16MIC 红霉素+BBR 1/8MIC; 15. 1/8MIC四环素; 16. 1/8MIC四环素+BBR 1/4MIC; 17. 1/64MIC磺胺甲恶唑; 18. 1/64MIC磺胺甲恶唑+1/32MIC BBR组1. Control group; 2. BBR 1/4MIC group; 3. BBR 1/8MIC group; 4. BBR 1/32MIC group; 5. Vancomycin 1/64MIC group; 6. Vancomycin 1/64MIC+BBR 1/8MIC group; 7. Chloramphenicol 1/8MIC group; 8. Chloramphenicol 1/8MIC +BBR 1/4MIC group; 9. Levofloxacin 1/32MIC group; 10. Levofloxacin 1/32MIC+BBR 1/8MIC group; 11. Amoxicillin 1/32MIC group; 12. Amoxicillin 1/32MIC+BBR 1/8MIC group; 13. Erythromycin 1/16MIC group; 14. Erythromycin 1/16MIC+BBR 1/16MIC group; 15. Tetracycline 1/8MIC group; 16. Tetracycline 1/8MIC+BBR 1/4MIC group; 17. Sulfamethoxazole 1/64MIC group; 18. Sulfamethoxazole 1/64MIC+BBR 1/32MIC group图3 mecA基因表达变化Fig.3 The mecA expression change of MRSA
2.6 BBR和左氧氟沙星联用的分子机制
GO富集结果(图4)表明,BBR影响MRSA 73个基因的表达,重要的上调基因功能包括氧化还原、氨基酸和维生素的合成与代谢,重要的下调基因功能包括转录和同化。
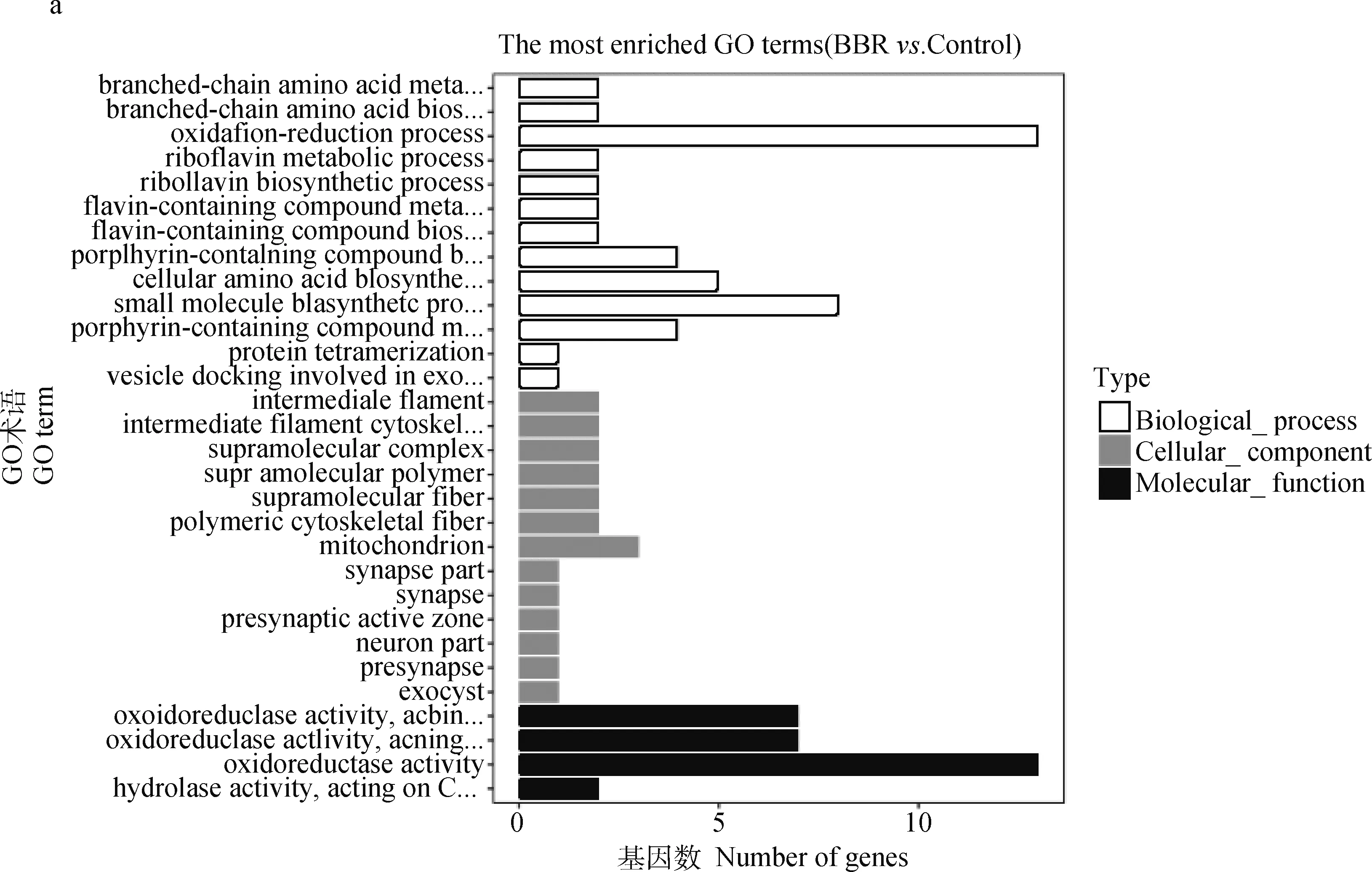


a. BBR; b. 左氧氟沙星;c. 联合组a. BBR; b. Levofloxacin; c. Combination group图4 差异表达基因GO富集Fig.4 Go enrichment of differentially expressed genes
左氧氟沙星影响MRSA 114个基因的表达,重要的上调基因功能包括有机氮化合物的合成和代谢、细胞酰胺合成和代谢过程以及碳水化合物跨膜转运,重要的下调基因功能包括药物反应、发展过程、对化学物质的反应和磷脂生物合成过程。细胞膜由磷脂双分子层构成,左氧氟沙星使得磷脂合成受到抑制,则细胞膜更易受到破坏,细菌细胞膜通透性增加、细胞形态难以维持。这可能是两者联用导致表达下调的原因之一。
联合组影响MRSA 95个基因的表达,重要的上调基因功能包括维生素合成和代谢、细胞骨架组织、嘧啶化合物代谢过程和硫化合物的生物合成过程,重要的下调基因功能主要包括氨基酸、阴离子、有机酸和羧酸的运输和跨膜转运。
表3~5总结了BBR、左氧氟沙星和联合组的KEGG富集结果。其中,与BBR抑菌有关的可能为维生素B2代谢、β-内酰胺抗性、双组分系统和多样环境中的微生物代谢,与左氧氟沙星组抑菌有关可能为甘油磷脂代谢,与联合组抑菌有关的代谢通路可能为维生素B2代谢和ABC转运体。
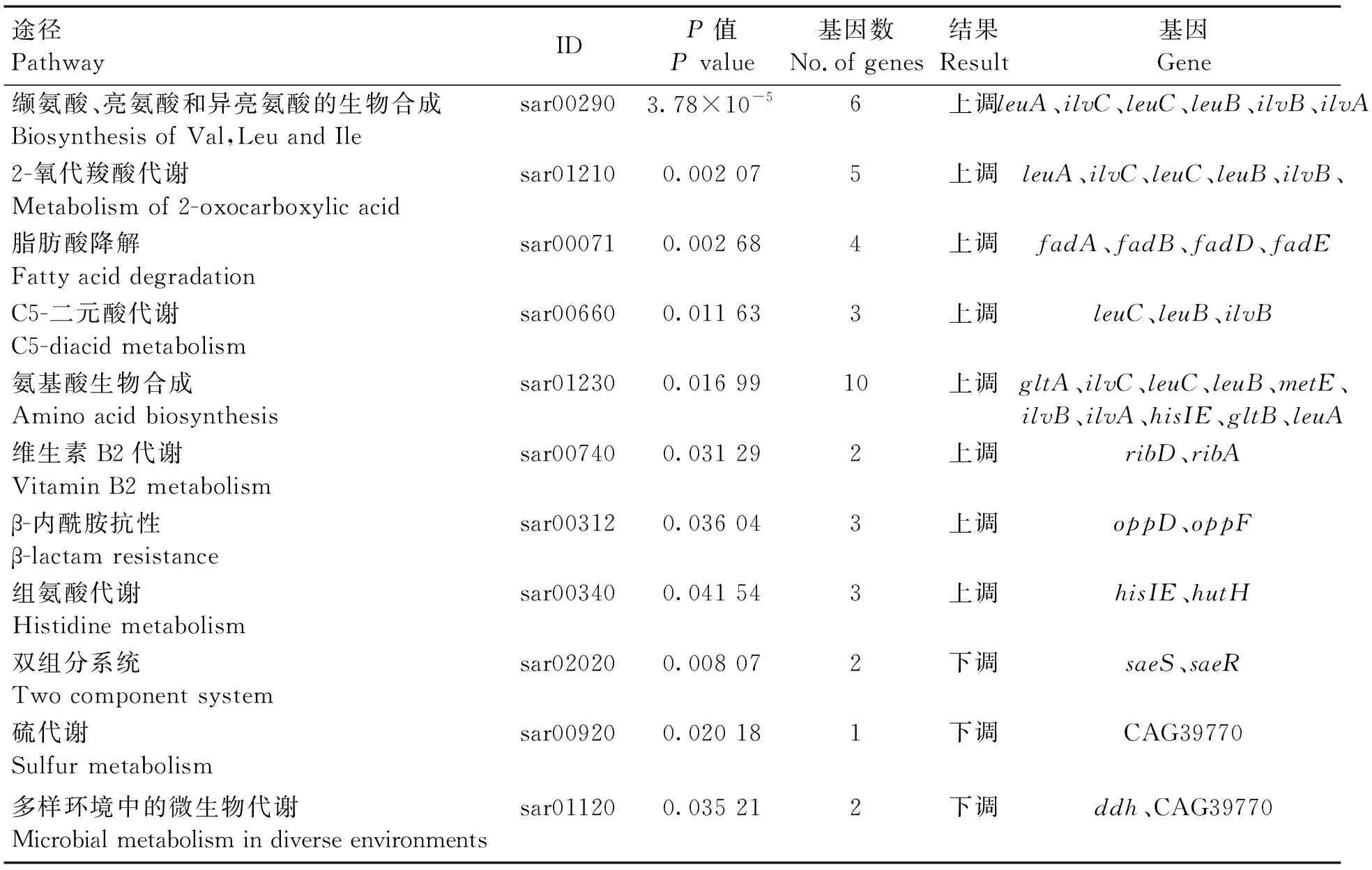
表3 BBR KEGG 富集汇总Table 3 KEGG enrichment summary of the BBR group

表4 左氧氟沙星组主要代谢通路的 KEGG 富集汇总Table 4 KEGG enrichment summary of the levofloxacin group

表5 联合组 KEGG 富集汇总Table 5 KEGG enrichment summary of the combination group
2.7 重要的差异表达基因
与对照组相比,BBR、左氧氟沙星和联合组的重要差异表达基因如表6。BBR组和基因表达量与对照组相比分别下调为对照的42.92%和44.05%;BBR组、左氧氟沙星组及联合组中基因表达量均显著下调,分别下调为对照组的46.73%、36.63%和43.67%;在组和联合组均表现为上调,上调倍数分别为2.69和3.64倍。
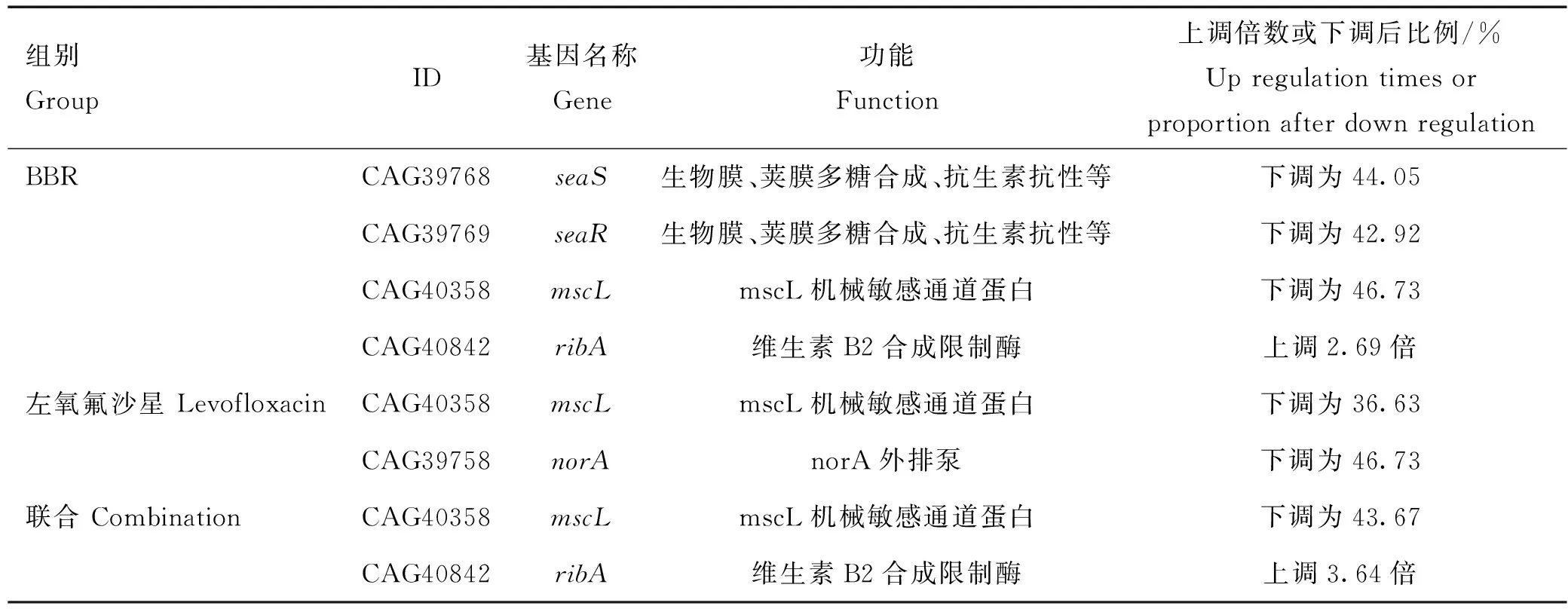
表6 重要差异表达基因Table 6 Important differentially expressed genes
3 讨 论
β-内酰胺类抗生素的β-内酰胺核能不可逆地与PBPs的Ser 403位点结合,竞争转肽酶的活性位点从而阻止肽聚糖合成,抑制细胞壁合成,导致细菌死亡。当正常PBPs与β-内酰胺类抗生素结合失去活性时,PBP2a可以代替它们合成继续肽聚糖,从而维持MRSA的生长繁殖。
虽然阿莫西林、青霉素和头孢唑林均作用于MRSA的细胞壁,但它们和BBR联用产生的抑菌效果不同,推测可能是由于它们对MRSA细胞壁的作用靶点不同。PBP2a在其余PBPs失去活性后仍能维持MRSA的细胞壁形态。研究认为,两种药物联用时,作用靶位相同会产生拮抗作用,当联用的两种药物分别作用于不同的PBPs时可产生协同作用;或者两种药物联用,而其中一种发挥β-内酰胺酶作用时,亦可产生协同作用。青霉素作用位点为PBP1,头孢唑林抗菌的作用位点主要为PBP1和PBP3,低浓度的阿莫西林可使PBP4及PBP5达到部分饱和。当三者和BBR联用,头孢唑林和阿莫西林继续协同抑制SA和MRSA,青霉素则失去协同抑制MRSA的效果,这也许说明BBR对MRSA的一个作用位点可能是PBP1。左氧氟沙星主要作用靶位是拓扑异构酶II,因此和BBR具有协同作用。
BBR组的电导率和荧光强度显著高于抗生素组和联合组,可能是因为其能够增加细胞膜通透性,促进物质泄漏。细胞膜不是左氧氟沙星的作用靶点,而BBR可通过增加细胞膜通透性,从而与其产生协同抑菌作用。BBR与左氧氟沙星联用时,荧光强度显著大于对应抗生素组,表明MRSA细胞产生超极化现象,抗生素更易进入细胞内。BBR能提高提升细胞壁通透性,当其降低浓度与左氧氟沙星联用时,细菌AKP活性增高,表明联用后细胞壁进一步受到破坏,细胞形态完整性难以维持,抗生素更容易突破胞壁屏障,进入细胞体内,从而造成更好的杀菌效果。
天然产物往往具有多种抑菌机制,基因可能只是其中一个靶点,为了进一步寻找联合抑菌机制,作者对BBR组、左氧氟沙星组和联合组进行了转录学的研究,对其差异基因进行GO富集、KEGG分析和显著差异基因的比较。
ABC转运体中的fhuA是一种铬铁-铁受体,属于外膜蛋白家族,它与能量转换蛋白TonB一起,介导含铁载体通过革兰阴性菌外膜的主动转运。ABC转运体可催化脂双层的脂类在两层之间翻转,对膜的发生和功能具有重要的意义,还与细菌对药物的抗性有关,其表达下调也许说明MRSA细胞内药物的聚集。
和基因调控MRSA中一种保守的双组分调节系统(two-component regulatory systems, TCSs),参与生物膜的生成、荚膜多糖的合成、自我分解、抗生素抗性及血红素毒素的抗性等。和编码感应器蛋白(如Spa和Fnba)及细胞壁相关蛋白(如Eap和Emp)。受到外界信号激活后发生自主磷酸化,随后磷酸化,磷酸化的结合到P1启动子区,和RNA聚合酶共同调控转录过程。BBR可通过下调和基因表达,抑制MRSA细胞膜、细胞壁合成和抗生素抗性基因的表达。
和可能是BBR和左氧氟沙星联合抑菌的重要差异基因。
维生素 B2在生物氧化过程中发挥递氧的作用,参与糖、蛋白质和脂肪代谢。基因表达上调不仅限制维生素B2的合成,其基因编码的双功能酶的催化还会导致下游产物5-氨基-6-(D-核糖氨基)尿嘧啶的积累,这种高活性嘧啶二酮化合物对细胞的毒害作用可造成细胞自溶。是MRSA的固有多药耐药外排泵,与MRSA的耐药性极度相关。受到左氧氟沙星的诱导后,的表达大幅度增加,从而使进入细胞内的药物被更多更快的泵出体内,最终造成细胞耐药。很多文献已经证实这点,并以为调控靶点,寻找天然外排泵抑制剂。
是一种机械敏感通道(mechanosensitive channels, MS),是一种跨膜通道蛋白,可感受细胞膜表面的张力。起到“紧急释放阀”的作用,当细菌的外部环境渗透压急剧变化引起细胞膨胀,细胞膜上产生张力时,直接感知张力形成一个直径约为3 nm的通道,释放胞内物质维持渗透压的平衡,从而避免细胞的裂解。基因的下调直接限制了这一调控机制,使得MRSA对外界渗透压变化的耐受能力显著降低,较小的渗透压变化即可使细胞破裂。
4 结 论
BBR不但能够直接抑制MRSA,且与β-内酰胺类抗生素联合使用时能够恢复其对MRSA菌株的敏感性,大幅度降低抗生素的使用水平。BBR和左氧氟沙星联用对MRSA效果最佳,可降低左氧氟沙星的MIC至原来的1/16。联合抑菌的靶点为细胞壁和细胞膜,包括破坏细胞壁,增加细胞膜的通透性,上调和下调和表达水平,从而达到协同抑菌的目的。
