NAC通过抑制大鼠肺细胞凋亡缓解镉致肺组织损伤
2022-09-30仝锡帅余耿生李雅文顾建红卞建春刘宗平
仝锡帅,余耿生,李雅文,冉 迪,顾建红, 邹 辉,袁 燕,卞建春,刘宗平*
(1.扬州大学农业科技发展研究院(教育部农业与农产品安全国际联合研究实验室),扬州 225009; 2.扬州大学兽医学院,扬州 225009;3.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
镉(cadmium,Cd)是一种环境重金属污染物,半衰期长,具有多器官毒性,可引起肺、肾、肝、骨骼、心血管和生殖系统等器官或组织的损伤。Cd可通过饮水、食物和空气等途径进入动物机体,直接刺激或间接诱发肺相关疾病。体内研究表明,Cd可通过消化道途径引起SD大鼠肺组织的病理性改变,导致局灶性肺组织纤维增生、肺间质血管闭塞与肺泡腔变小。氯化镉(cadmium chloride,CdCl)溶液腹腔注射SD大鼠,能够引起Cd在肺组织中高度蓄积,导致肺泡Ⅱ型上皮细胞及毛细血管内皮细胞受损、肺泡间隔增厚及间质纤维增生。此外,Cd可显著上调肺细胞凋亡蛋白Bax、capase-3和细胞色素c(cytochrome-c,cyto-c)的表达,对肺产生损伤。体外研究发现,Cd可显著诱导人肺上皮细胞A549细胞中活性氧(reactive oxygen species,ROS)的产生,进一步诱导细胞凋亡。Cd(5 μmol·L)能够显著抑制人肺上皮细胞Beas-2B细胞的生长,降低胶原蛋白-I(collagen-I,Col-I)、Col-IV及Col-V的表达,促进ROS的产生及细胞凋亡。
N-乙酰半胱氨酸(N-acetyl-L-cysteine,NAC)是一种含巯基的抗氧化剂,可清除已生成的自由基离子,抑制细胞凋亡。NAC显著缓解Cd诱导的多器官或组织来源的细胞氧化应激或细胞凋亡。NAC能够刺激肺泡表面活性物质的分泌,亦可促进肺泡Ⅱ型上皮细胞的生成,明显改善肺的功能。然而,NAC如何缓解Cd暴露诱导大鼠肺组织损伤的作用机制尚未阐明。因此,本试验以去卵巢SD大鼠作为动物模型,通过测定肺组织中Cd含量、观察肺组织病理变化、检测肺组织Col-I和Col-III mRNA的转录水平及凋亡蛋白的表达,旨在探讨NAC通过抑制大鼠肺细胞凋亡缓解Cd致肺组织损伤的作用机理,为临床应用NAC防治Cd暴露引起的肺损伤提供理论依据。
1 材料与方法
1.1 实验动物
3月龄雌性SD大鼠40只,体重240 g±10 g,购自江苏大学实验动物中心。
1.2 主要试剂与仪器
NAC和CdCl购自美国Sigma-Aldrich公司。RIPA裂解液、BCA蛋白浓度测定试剂盒、5×SDS-PAGE蛋白上样缓冲液、苏木素伊红(HE)染色试剂盒和Masson染色试剂盒购自翌圣生物科技(上海)股份有限公司。HiScript Q RT SuperMix for qPCR (+gDNA wiper)、ChamQ Universal SYBR qPCR Master Mix和无RNA酶水购自南京诺唯赞生物科技有限公司。Bcl-2、Bax、cleaved caspase- 3(Asp175)、p-Akt、Akt、p53、β-actin抗体、辣根过氧化物酶(HRP)标记的羊抗兔二抗和HRP标记的兔抗小鼠二抗购自美国Cell Signaling technology公司。Trizol Reagent购自美国Invitrogen公司。其他试剂由实验室提供。
Milli-Q Biocel型超纯水系统购自美国Merck Millipore公司。5810R低温高速冷冻离心机购自德国Eppendorf公司。微波消解仪购自安东帕(上海)商贸有限公司。Nanodrop 2000型超微量分光光度计购自美国Thermo公司。Epoch型超微量微孔板分光光度计购自美国BioTek公司。电泳仪和电泳槽购自美国BIO-RAD公司。Tanon 5200型全自动化学发光成像分析系统购自上海天能科技有限公司。PinAAcle 900F火焰原子吸收光谱仪购自美国PerkinElmer公司。ABI7500型荧光定量PCR仪购自美国ABI公司。
1.3 试验分组与处理
40只雌性SD大鼠通过卵巢摘除术去除卵巢,饲养室控制昼夜时间均等(12 h/12 h),室温饲养,饲养环境清洁和安静,许可证号:SCXK(苏)2016-0020。40只雌性SD大鼠随机分为假手术对照(Control)组、Cd组、NAC组和NAC + Cd组,每组10只。各组按以下方法处理:对照组大鼠正常饲喂,自由饮用超纯水;NAC组与NAC + Cd组大鼠自由饮用NAC水(浓度为100 mg·L),持续1个月;预处理结束,Cd组与NAC+Cd组大鼠自由饮用镉水(浓度为50 mg·L)。18个月后,所有大鼠肌内注射2 %戊巴比妥钠(剂量60 mg·kg,根据体重计算用量),断颈处死大鼠,完整分离肺。分块装入离心管中,置于-80 ℃保存备用。
1.4 Cd含量测定
使用微波消解仪对大鼠肺组织进行消解。方法:将各组大鼠肺组织置于80 ℃烘箱内烘干、研磨粉碎,精确称取0.2 mg组织粉末置于消解管,添加4 mL硝酸(分析纯)。按照梯度温度(90 ℃、120 ℃至 170 ℃)的方法进行加热。冷却后,转移至离心管,每管定容至10 mL,置于室温。使用PinAAcle 900F火焰原子吸收光谱仪进行Cd含量测定。
1.5 HE染色与Masson染色
将新鲜肺组织置于4%多聚甲醛溶液,固定24 h。通过梯度乙醇脱水、二甲苯透明及石蜡包埋。利用切片机进行组织切片,漂浮于40 ℃温水,使切片铺开,将组织切片置于载玻片,置于60 ℃烘箱内烤片。经HE染色和Masson染色,封片,光学显微镜观察,并拍照。
1.6 qRT-PCR检测肺组织Col-I和Col-III mRNA的变化
利用Trizol试剂提取肺组织总RNA。Nanodrop 2000型超微量分光光度计对样品RNA进行纯度检测,即A/A比值。HiScript Q RT SuperMix for qPCR (+gDNA wiper)试剂反转录获取样品cDNA模板,以ChamQ Universal SYBR qPCR Master Mix试剂进行荧光定量PCR,检测肺组织-I和-III mRNA的表达。引物序列如表1,其中,-n为内参基因。20 μL反应体系:2×ChamQ Universal SYBR qPCR Master Mix 10 μL,上、下游引物各0.4 μL,cDNA模板2 μL,补充无RNA酶水至20 μL。PCR反应条件:预变性95 ℃ 30 s;循环反应95 ℃ 10 s和60 ℃ 30 s, 共40个循环。采用ABI7500型荧光定量PCR仪进行检测,采用2-ΔΔ法对试验结果进行数据分析。

表1 目的基因引物序列Table 1 The primers of sequence for target genes
1.7 Western blot
RIPA裂解液对组织样品进行裂解,BCA蛋白浓度测定试剂盒检测各组样品蛋白浓度,并将各组浓度调整一致。将5×SDS-PAGE蛋白上样缓冲液加入各组样品,沸水煮10 min。电泳条件为110 V,90 min;转膜条件为260 mA,90 min;5%脱脂乳封闭,室温2 h;加入相应一抗(Bcl-2、Bax、cleaved caspase-3、p-Akt、Akt、p53、β-actin抗体),4 ℃过夜;收集一抗抗体,加入二抗(HRP标记羊抗兔抗体、HRP标记兔抗小鼠抗体),室温孵育2 h。收集二抗抗体,通过Tanon 5200型全自动化学发光成像分析系统进行摄片。
1.8 统计分析
2 结 果
2.1 大鼠肺组织中Cd含量的测定
如图1所示。与Control组相比,Cd组大鼠肺组织中Cd的含量极显著(<0.01)增加,而NAC组无差异性(>0.05)。与Cd组相比,NAC+Cd组大鼠肺组织中Cd的含量极显著(<0.01)减少。
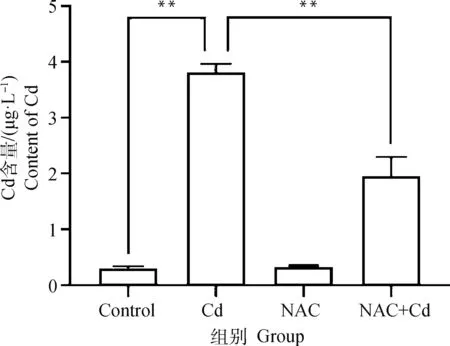
**.P<0.01;*.P<0.05,下同**.P<0.01;*.P<0.05,the same as below图1 大鼠肺组织中Cd含量变化Fig.1 The changes of cadmium (Cd) content of lung tissue in rats
2.2 大鼠肺组织病理学观察
如图2所示。对大鼠肺组织进行HE染色与Masson染色,与Control组相比,Cd组可见大鼠肺泡结构破坏,肺纤维组织增生。与Cd组相比,NAC+Cd组大鼠肺泡结构明显恢复,并缓解肺组织损伤。

图2 大鼠肺组织HE染色与Masson染色(200×)Fig.2 The observation of HE staining and Masson staining of lung tissue in rats (200×)
2.3 qRT-PCR检测大鼠肺组织Col-I和Col-III mRNA的表达水平
如图3所示。与Control相比,Cd组大鼠肺组织中-I和-III mRNA表达极显著(<0.01)升高,而NAC组无差异性(>0.05)。与Cd组相比,NAC+Cd组大鼠肺组织中-I和-III mRNA的表达极显著(<0.01)下降。
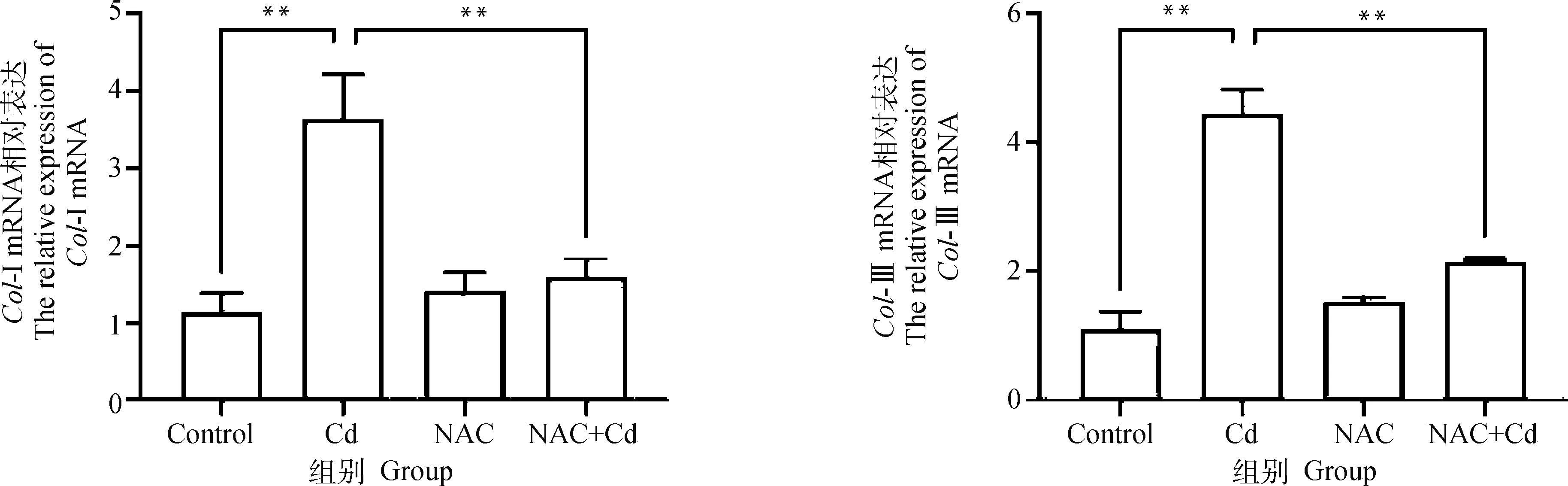
图3 NAC对Cd处理的大鼠肺组织纤维化关键蛋白Col-I和Col-III mRNA的影响Fig.3 The effect of NAC on fibrosis protein Col-I和Col-III mRNA of lung tissue treated by Cd in rats
2.4 Western blot检测大鼠肺组织凋亡蛋白Bcl-2、Bax及cleaved caspase-3的表达
如图4所示。与Control相比,Cd组大鼠肺组织中Bax/Bcl-2的比值和cleaved caspase-3的表达极显著(<0.01)升高,而NAC组无差异性(>0.05)。与Cd组相比,NAC+Cd组大鼠肺组织中Bax/Bcl-2的比值和cleaved caspase-3的表达显著(<0.01或<0.05)下降。

图4 NAC对Cd处理的大鼠肺组织凋亡蛋白(Bcl-2、Bax及cleaved caspase-3)表达的影响Fig.4 The effect of NAC on apoptosis-related protein (Bcl-2, Bax and cleaved caspase-3) expression of lung tissue treated by Cd in rats
2.5 Western blot检测大鼠肺组织Akt磷酸化及p53的表达
如图5所示。与Control相比,Cd组大鼠肺组织中p-Akt/Akt的比值极显著(<0.01)降低,p53的表达极显著(<0.01)升高,而NAC组无差异性(>0.05)。与Cd组相比,NAC+Cd组大鼠肺组织中p-Akt/Akt的比值极显著(<0.01)增加,而p53的表达极显著(<0.01)下降。
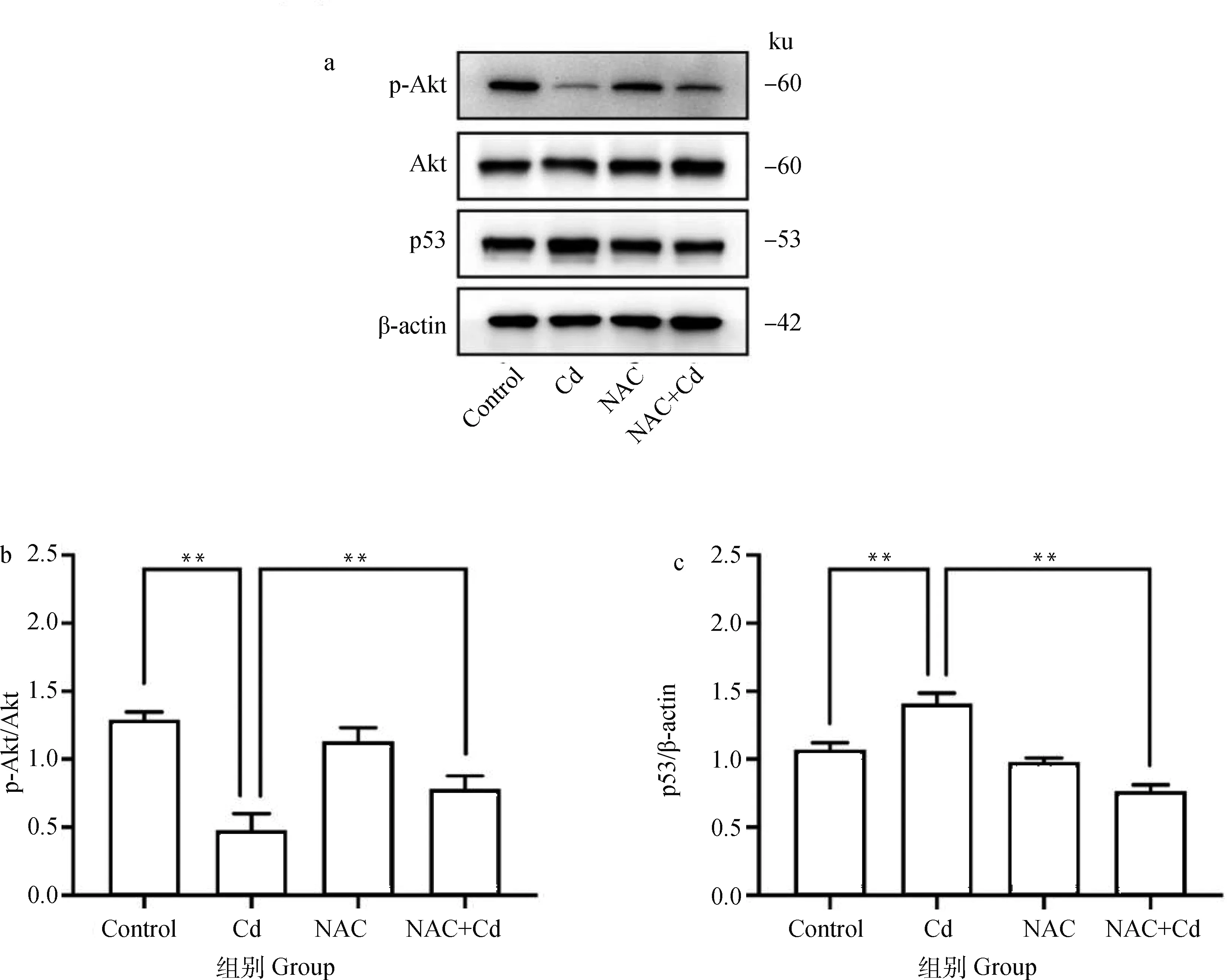
图5 NAC对Cd处理的大鼠肺组织Akt磷酸化及p53表达的影响Fig.5 The effect of NAC on Akt phosphorylation and p53 expression of lung tissue treated by Cd in rats
3 讨 论
环境中的重金属主要来源于工业废弃物的泄漏,并对动物的健康构成潜在的威胁。Cd作为一种无生理功能的重金属,被认为是损伤动物机体的有毒有害物质之一。在世界范围内,Cd及其化合物在环境中的生产和释放显著增加,但无有效的回收方式。Cd可在机体内长期积累,半衰期长。Cd作为一种环境性雌激素,通过“模仿”雌激素的功能,以高亲和力在受体激素结合域活化雌激素受体(estrogen receptor,ER),发挥内分泌干扰物的作用。然而,这种作用可被抗雌激素药物阻断。此外,动物的性别可影响肺相关疾病的患病率,一方面,与性激素是否直接相关尚不清楚;另一方面,性激素可调节肺的基本生理状态及其发育过程。因此,本试验以去卵巢SD大鼠作为动物模型,减少或排除雌激素的作用。
Cd及其化合物可引起水、土壤和空气的污染,最终进入植物、动物或人机体内。已知Cd是动物体内最易积累的毒性重金属之一,机体组织半衰期可长达30年,血液中半衰期为3~4个月。Cd可与机体内的氨基、巯基、硫蛋白等结合,损害酶防御系统,破坏肺、肝、肾等器官的正常结构,引发机体组织内Cd的蓄积。本试验结果证明Cd组大鼠肺组织中Cd含量显著增加,血清中Cd的含量也显著增加(数据未发表)。此外,Cd与特发性肺纤维化的发生密切相关,其通过触发波形蛋白瓜氨酸化,活化成纤维细胞,上调纤维化蛋白的表达,导致肺纤维化。成纤维细胞可活化细胞外基质Col-I和Col-III,后两者的过度沉积导致组织的纤维化。本试验结果显示,Cd组大鼠肺泡结构损伤、萎缩或消失,肺纤维组织增生,显著升高-I和-III mRNA的表达。这表明Cd暴露可增加大鼠肺组织中Cd含量,诱导肺组织纤维化胶原酶-I和-III mRNA表达的上调。
动物试验及临床数据分析表明,Cd可引起肺损伤,诱导肺细胞凋亡。Cd能够破坏动物机体的抗氧化系统,活化肺细胞线粒体凋亡途径,上调凋亡蛋白Bax、caspase-3、细胞色素C和p53 mRNA的表达,诱导细胞凋亡。低浓度(1~10 μmol·L)醋酸镉(CdAc)处理大鼠克拉拉细胞(Clara细胞)与肺泡II型细胞,能够以Bax与p53依赖的方式诱导细胞凋亡。Cd诱导人肺成纤维细胞MRC-5细胞的多种类型死亡,通过线粒体膜电位的“崩溃”,以caspase-3依赖的方式诱导细胞凋亡。如前所述,Cd作为一种环境性雌激素,可结合雌激素受体,后者始终存在于肺细胞与支气管上皮细胞中。其中,雌激素受体β能够活化PI3K/Akt/Bcl-XL信号通路,调节细胞增殖、侵袭、转移、线粒体合成及抗细胞凋亡的作用。然而,Cd可通过激活大鼠神经元细胞中Akt/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路,并诱导ROS的产生。Cd也可诱导氧化应激,通过活化猪淋巴结或鸡肾组织中PI3K/Akt信号通路,进一步诱导凋亡。本试验结果显示,Cd组大鼠肺组织中细胞凋亡蛋白Bax、cleaved caspase-3和p53的表达显著增加,Akt磷酸化受抑制(这与其他研究结果不太一致。分析认为本研究中动物模型为去卵巢SD大鼠,可能是雌激素受体在该过程中发挥了比较重要的调节作用,但仍需进一步研究证实)。这表明Cd暴露可诱导大鼠肺组织细胞凋亡蛋白Bax和cleaved caspase-3的表达,并通过p53途径进一步诱导凋亡。
NAC作为一种常用的小分子高效抗氧化剂,可通过增加细胞内谷胱甘肽-S-基转移酶的活性诱导还原型谷胱甘肽(GSH)的合成,清除氧自由基离子,发挥抗氧化的作用。本试验结果显示,NAC可显著降低大鼠肺组织中Cd含量,缓解肺组织病理变化,表明NAC对肺组织损伤有一定的缓解作用。此外,NAC能够缓解Cd诱导的大鼠肾上腺嗜铬细胞瘤细胞PC12细胞的损伤,上调凋亡蛋白Bcl-2/Bax的比值与cleaved caspase-3蛋白的表达,下调细胞凋亡率。郑嘉铭的研究也表明,NAC可显著下调Cd诱导的大鼠成骨细胞凋亡蛋白Bax/Bcl-2的比值与p53及cleaved caspase-3蛋白的表达。最近研究表明,NAC通过降低外周血结缔组织生长因子(connective tissue growth factor,CTGF)与纤维连接蛋白(fibronectin,FN)的表达,发挥抗肺纤维化的作用。本试验结果显示,NAC可显著下调Cd组大鼠肺组织中细胞凋亡蛋白Bax/Bcl-2的比值与cleaved caspase-3及p53蛋白的表达。这表明NAC可降低Cd致大鼠肺组织凋亡蛋白Bax和cleaved caspase-3的表达,进一步缓解Cd诱导的肺组织凋亡。
4 结 论
本研究从肺细胞凋亡的角度探讨了NAC对Cd致大鼠肺组织损伤的缓解作用,并通过p53途径减轻肺组织病理变化及下调肺细胞凋亡蛋白的表达。这为NAC缓解Cd诱导肺损伤相关的机理研究提供新的理论依据。
