丁酸钠通过AMPK通路调控LPS造成牛乳腺上皮细胞脂代谢紊乱的作用机制
2022-09-30宫彬彬张晓辉
李 林,曹 萌,宫彬彬,赵 梅,王 婕,张晓辉
(1.邢台学院生物科学与工程学院,邢台 054001; 2.河北医科大学附属邢台人民医院病理科,邢台 054000; 3.海南大学动物科技学院,海口 570100)
在反刍动物中,乳脂肪是由三酰甘油(triacylglycerols,TG,>95%)、磷脂、胆固醇以及少量的游离脂肪酸构成。乳脂肪不仅可以为幼崽提供生长发育所需的大部分能量、必需脂肪酸和生物活性物质,也可以满足人体营养和能量的需求。反刍动物在泌乳期间用于合成TG的脂肪酸,一部分通过乳腺自身从头合成,另一部分直接从血液中获取。
革兰阴性菌细胞壁中的脂多糖(lipopolysaccharides,LPS)也被称为细菌内毒素,在临床疾病如瘤胃酸中毒、乳腺和子宫感染以及热应激时,细菌均会释放大量LPS。LPS的大量释放会引起奶牛全身性和局部炎症反应,最终导致乳脂率严重下降,影响乳品质,给奶牛养殖业和加工业造成重大经济损失。LPS可以降低血液中乳脂合成前体物的含量,并且还会诱导肝的急性期反应,导致肝脂代谢紊乱,从而无法提供足够数量的极低密度脂蛋白用于组装合成乳脂前体物的载脂蛋白。
丁酸钠的有效成分为丁酸,由肠道菌群通过发酵不可吸收的碳水化合物和蛋白质(如纤维)产生。丁酸钠作为一种饲料添加剂,可用于改善动物生长性能、减少乳腺炎的发生,并且可以提高乳中乳脂肪的含量。目前,有关丁酸钠的研究大多集中在哺乳动物其肠道形态、乳品质改善和抗氧化能力等方面;在体外的研究主要多集中在炎症反应、细胞增殖等方面,而关于细胞代谢机制方面的研究较少。因此,本试验探讨体外添加丁酸钠对LPS诱导的MAC-T细胞脂代谢紊乱的保护作用与调节机制,旨在为养殖实践中改善反刍动物乳腺健康及调控乳脂肪合成等实际应用方面提供理论依据。
1 材料与方法
1.1 细胞来源
牛乳腺上皮细胞系(MAC-T):南京农业大学张源淑教授馈赠,本实验室冻存。
1.2 主要试剂
丁酸钠购于美国Sigma公司,TG试剂盒、油红O染色试剂盒、牛TNF-α、IL-6、IL-8 ELISA试剂盒购于南京建成生物技术有限公司,DMEM培养基、胎牛血清和青霉素/链霉素购于南京泽优生物科技有限公司,P-AMPK-兔/AMPK-兔抗体均购自艾博抗上海贸易有限公司,山羊抗兔IgG购于上海生工生物工程有限公司,BCA蛋白定量试剂盒购于上海碧云天生物技术公司。
1.3 MAC-T细胞脂代谢紊乱模型建立
根据前期预试验,分别用不同浓度的LPS(0、1、10、100、1 000、10 000 ng·mL)刺激MAC-T细胞1、3、6、9、12 h后,通过检测细胞相对活力,结果显示,LPS浓度为1 000 ng·mL刺激9 h后,其细胞活力显著下降。因此,本试验筛选出最佳LPS刺激浓度为1 000 ng·mL,最佳刺激时间为9 h,该结果用于后续试验处理。
将细胞按照合适密度接种于6孔板中,待细胞融合至80%时,弃去培养液,对细胞进行饥饿处理12 h后,加入1 000 ng·mLLPS的不完全培养液,在37 ℃、5% CO条件下培养9 h,收集上清和细胞。收集的细胞在冰浴环境下破碎,4 ℃离心,取细胞上清为待测样品。每个处理设3个平行孔,收集细胞上清通过试剂盒GPO-PAP法进行TG含量指标检测。
将细胞按照合适密度接种于6孔板中,待细胞融合至80%时,弃去培养液,对细胞进行饥饿处理,加入1 000 ng·mLLPS的不完全培养液,在37 ℃、5% CO条件下培养9 h,室温条件下,PBS冲洗3遍,10%福尔马林将细胞固定30 min;PBS冲洗3遍,室温条件下,用油红O染液染色10 min,PBS缓冲液洗2次;倒置显微镜观察细胞内脂滴染色情况,并通过Image Pro plus 6.0软件对脂滴面积进行统计分析。
1.4 丁酸钠对MAC-T细胞的影响
将MAC-T细胞培养于6孔板中,当细胞融合度达到80%~90%时,用2、8、16 μmol·L的丁酸钠处理细胞12 h。收集细胞,加入200 μL的Annexin V-异硫氰酸荧光素(FITC)原液重悬细胞,4 ℃避光孵育30 min,再加入10 μL碘化丙啶(PI),避光孵育15 min,采用美国BD FACS Calibur型流式细胞术检测荧光强度,计算细胞凋亡率。
1.5 丁酸钠对LPS诱导的MAC-T细胞的影响
将细胞按照合适密度接种于6孔板中,待细胞融合至80%时,弃去培养液,对细胞进行饥饿处理后,将细胞分为1) 空白对照组:加入同体积的无血清培养基;2) LPS处理组:终浓度为1 000 ng·mLLPS;3) 2 μmol·L丁酸钠+LPS处理组:终浓度为2 μmol·L丁酸钠以及终浓度为1 000 ng·mLLPS共同处理;4) 8 μmol·L丁酸钠+LPS处理组:终浓度为8 μmol·L丁酸钠以及终浓度为1 000 ng·mLLPS共同处理;5) 16 μmol·L丁酸钠+LPS处理组:终浓度为16 μmol·L丁酸钠以及终浓度为1 000 ng·mLLPS共同处理。在2 μmol·L丁酸钠+LPS处理组、8 μmol·L丁酸钠+LPS处理组和16 μmol·L丁酸钠+LPS处理组中,均为2 h后加入LPS。
每组处理设置3个平行孔,37 ℃、5% CO培养箱中处理9 h后,收集各孔细胞和细胞上清,用于后续ELISA检测肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-6、IL-8的含量及TG含量指标检测,操作步骤按照说明书进行。提取细胞总蛋白,BCA蛋白浓度测定试剂盒测定并计算出蛋白浓度。
1.6 Western blot分析MAC-T细胞AMPK通路蛋白
Western blot检测各处理细胞中P-AMPK/AMPK蛋白的表达变化,参照李林等的方法进行操作。用ECL发光液进行Western blot图像处理。用Image Lab 6.0分析条带灰度值。
1.7 MAC-T细胞脂代谢相关关键酶的表达
将收集的细胞采用TRIzol法直接提取总RNA,利用BioPhotometer测定样品总RNA浓度,分析OD/OD值,判断提取总RNA的纯度,OD/OD必需为1.8~2.0,并且OD/>2.0。取1 μg总RNA进行反转录得到cDNA,详细操作步骤参照说明书进行。
参照GenBank上牛的乙酰CoA羧化酶(Acetyl-CoA carboxylase,ACC)、牛的硬脂酰辅酶A去饱和酶-1(Stearyl coenzyme A desaturated enzyme-1,SCD-1)、山羊的脂肪酸合成酶(fatty acid synthetase,FAS)、山羊的肉碱脂酰转移酶I(Carnitine palmitoyltransferase-1,CPT-1)、牛的肉碱脂酰转移酶II(Carnitine palmitoyltransferase-2,CPT-2)、牛的脂酰辅酶A氧化酶(acyl-CoA oxidase,ACO)及-内参基因引物序列,用Primer Premier 5软件自行设计引物,并送上海Sangon公司合成,引物序列见表1。

表1 目的基因及β-Actin引物序列Table 1 Prime sequence of targeted gene and β-Actin
1.8 数据统计分析

2 结 果
2.1 LPS对MAC-T细胞脂滴及TG含量的影响
1 000 ng·mLLPS刺激细胞9 h后,图1A显示,与对照组相比,LPS处理组细胞总脂滴面积显著下降(<0.05);图1B显示,与对照组相比,细胞TG含量极显著下降(<0.01)。

与对照组比较,*. P<0.05; **. P<0.01Compared with control group,*.P<0.05;**.P<0.01图1 MAC-T细胞脂滴及TG含量变化Fig.1 The lipid droplets and TG content changes in the MAC-T cells
2.2 丁酸钠对MAC-T细胞总凋亡率的影响
分别用低(2 μmol·L)、中(8 μmol·L)、高(16 μmol·L)浓度的丁酸钠作用MAC-T细胞12 h后,通过流式细胞术检测细胞凋亡率,发现不同浓度的丁酸钠对细胞凋亡率均无影响(图2),证明丁酸钠对细胞无毒害作用,可以进行下一步试验。

图2 MAC-T细胞总凋亡率变化Fig.2 The total rate of apoptosis changes in the MAC-T cells
2.3 丁酸钠对LPS诱导的MAC-T细胞TG含量的影响
通过图3结果发现,与对照组相比,LPS处理组TG含量极显著下降(<0.01);而8 μmol·L丁酸钠+LPS处理组与LPS处理组相比,其TG含量显著上升(<0.05)。
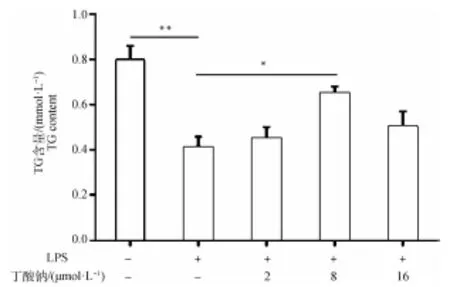
**. P<0.01;*.P<0.05图3 丁酸钠对MAC-T细胞TG含量的影响Fig.3 Effect of sodium butyrate on TG content in MAC-T cells
2.4 丁酸钠对LPS诱导的MAC-T细胞AMPK信号通路的影响
进一步检测细胞AMPK相关信号通路,结果发现(图4),与对照组相比,LPS处理组P-AMPK表达水平显著上升(<0.05);而2 μmol·L丁酸钠+LPS处理组、8 μmol·L丁酸钠+LPS处理组和16 μmol·L丁酸钠+LPS处理组与LPS处理组分别相比,其P-AMPK表达水平均显著下降(<0.05)。
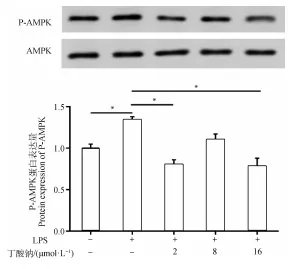
*.P<0.05图4 MAC-T细胞P-AMPK蛋白表达水平变化Fig.4 The P-AMPK protein expression level in the MAC-T cells
2.5 丁酸钠对LPS诱导的MAC-T细胞脂合成代谢的影响
通过检测与AMPK信号通路下游相关的关键脂合成代谢的基因,图5A发现,与对照组相比,LPS处理组ACC mRNA表达含量显著下降(<0.05);而8 μmol·L丁酸钠+LPS处理组和16 μmol·L丁酸钠+LPS处理组与LPS处理组相比,其TG含量显著上升(<0.05)。图5B发现,与对照组相比,LPS处理组SCD-1 mRNA表达含量极显著下降(<0.01);而8 μmol·L丁酸钠+LPS处理组和16 μmol·L丁酸钠+LPS处理组与LPS处理组相比,其TG含量显著上升(<0.05)。图5C发现,与对照组相比,LPS处理组FAS mRNA表达含量显著下降(<0.05);而8 μmol·L丁酸钠+LPS处理组与LPS处理组相比,其TG含量显著上升(<0.05)。

**. P<0.01;*.P<0.05图5 MAC-T细胞脂合成代谢相关基因表达水平变化Fig.5 The expression levels of genes related to lipid metabolism in the MAC-T cells
2.6 丁酸钠对LPS诱导的MAC-T细胞脂分解代谢的影响
进一步检测与AMPK信号通路下游相关的关键脂分解代谢的基因,图6A发现,与对照组相比,LPS处理组CPT-1 mRNA表达含量显著上升(<0.05);而8 μmol/L丁酸钠+LPS处理组和16 μmol·L丁酸钠+LPS处理组与LPS处理组相比,其TG含量显著下降(<0.05)。图6B发现,与对照组相比,LPS处理组CPT-2 mRNA表达含量显著上升(<0.05);而其它处理组与LPS处理组相比,其TG含量无明显变化。图6C发现,与对照组相比,LPS处理组ACO mRNA表达含量显著上升(<0.05);而16 μmol/L丁酸钠+LPS处理组与LPS处理组相比,其TG含量显著下降(<0.05)。
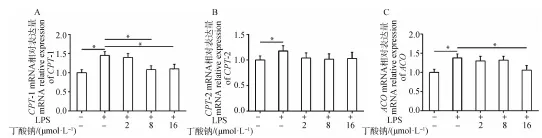
**. P<0.01;*.P<0.05图6 MAC-T细胞脂分解代谢相关基因表达水平变化Fig.6 The expression levels of genes related to lipid catabolism in the MAC-T cells
2.7 丁酸钠对LPS诱导的MAC-T细胞炎症因子指标的影响
如表1所示,与对照组相比,LPS处理组TNF-α和IL-6含量显著上升(<0.05);而经过丁酸钠处理后,发现8 μmol·L丁酸钠+LPS处理组和16 μmol·L丁酸钠+LPS处理组与LPS处理组相比,TNF-α和IL-6含量显著下降(<0.05)。
表1 MAC-T细胞炎症因子指标测定Table 1 Determination of inflammatory factors in MAC-T cells μg·L-1
3 讨 论
牛奶和乳制品,在人类日常饮食中起着重要的作用。乳脂肪是哺乳动物能量、脂溶性营养物质和生物活性脂质的重要来源。它不仅是一种具有生物活性的脂类成分的来源,也是重要的营养物质输送介质,包括脂溶性维生素。牛奶中的生物活性脂类包括TG、饱和脂肪酸和多不饱和脂肪酸以及磷脂。内源性的LPS会造成脂代谢紊乱,乳脂肪前体物合成的减少,进而导致乳脂肪含量降低,以及乳腺炎的发生。乳腺炎是奶牛最常见的疾病之一,其中,革兰阴性菌是牛乳腺炎的主要病因,乳腺炎会严重影响奶业的健康发展。目前,常规手段是通过抗生素来治疗该疾病。然而,过度使用抗生素会引起人们对负面影响以及人类健康的担忧。丁酸钠作为一种安全的抗生素替代品,在养殖业备受关注。丁酸钠作为一种有效的饲料添加剂,可改善高温气候条件下肉鸡的生产性能、肝功能和抗氧化应激能力。Ohira等研究发现,丁酸能减轻脂肪细胞和巨噬细胞相互作用产生的炎症(TNF-α、MCP-1、IL-6)和脂肪的分解作用。本研究发现,用1 000 ng·mLLPS刺激细胞9 h后,细胞总脂滴面积显著下降;细胞内TG含量极显著下降。进一步向正常的MAC-T细胞中添加丁酸钠,发现2、8、16 μmol·L丁酸钠处理下,细胞的生长状态良好,凋亡率与对照组无显著差异。本试验结果表明,LPS确实会造成MAC-T细胞的脂代谢紊乱。并且丁酸钠对MAC-T细胞无毒副作用,因而可用于后续试验的研究,并为丁酸钠作为一种绿色安全的饲料添加剂提供了理论基础。
用于合成乳脂肪的脂肪酸通常由乳腺从头合成或者由乳腺上皮细胞从血液当中摄取,当泌乳奶牛处于能量负平衡状态时,这时候就要动用体内内源性脂肪(脂肪或肝脂类)来满足泌乳的需要。邢媛媛等研究发现,丁酸钠可促进奶牛乳腺上皮细胞内TG的积累。本研究发现,在1 000 ng·mLLPS处理下,与对照组相比,TG含量极显著下降,而8 μmol·L丁酸钠与LPS共同孵育的情况下,与LPS处理组相比,其TG含量显著上升。本试验检测的是细胞上清中TG含量,而检测细胞内TG含量更能准确反映细胞真实产出的TG水平,因此后续研究中应对细胞内TG含量进行检测分析。AMPK(AMP-activated protein kinase)是能量稳态的中央调节因子,它协调代谢途径,从而平衡营养供应和能量需求。当AMPK磷酸化被激活时,会加快细胞能量的摄取以及脂肪的氧化。本试验通过研究与脂代谢相关的AMPK信号通路,发现在1 000 ng·mLLPS处理下,与对照组相比,P-AMPK蛋白表达水平显著上升,而2、8、16 μmol·L丁酸钠与LPS分别共同孵育的情况下,与LPS处理组相比,其P-AMPK蛋白表达水平均显著下降。说明丁酸钠通过AMPK途径调控了MAC-T细胞TG的合成。
用于合成TG的脂肪酸从头合成受多种酶调控,其中,包括ACC、SCD-1、FAS等关键酶的调节。在机体中当柠檬酸和乙酸转化为乙酰辅酶a后,ACC依赖ATP的羧化作用催化乙酰辅酶a生成丙二酰辅酶a用于脂肪酸的合成。SCD-1是一种存在于内质网中膜内的蛋白,它催化硬脂酰辅酶a(16:0)或棕榈酰辅酶a(16:0)生成单不饱和脂肪酸油酸(18:1)或棕榈油酸(16:1)。FAS是一种关键的脂肪生成酶,催化脂肪酸从头生成的最后一步。脂肪酸的分解代谢受到CPT-1、CPT-2等酶的调控,其中,CPT系统将脂肪酸转运到线粒体,这是脂肪酸在β-氧化过程中产生乙酰辅酶a的限速步骤。在泌乳期间,乳腺上皮细胞中与脂肪酸合成的关键酶,ACC等都会显著上调,而与脂肪酸分解的关键酶会受到相应的抑制。本研究在1 000 ng·mLLPS处理下,与对照组相比,脂肪酸合成代谢的相关酶、mRNA表达水平显著下降,并且-1极显著下降;而8 μmol·L丁酸钠与LPS共同孵育的情况下,与LPS处理组相比,其、-1 mRNA表达水平均显著上升;16 μmol·L丁酸钠与LPS共同孵育的情况下,mRNA表达水平显著上升。
另外,在1 000 ng·mLLPS处理下,与对照组相比,脂肪酸分解代谢的相关酶-1、-2和ACO mRNA表达水平显著上升;而8、16 μmol·L丁酸钠与LPS共同孵育的情况下,与LPS处理组相比,其-1 mRNA表达水平均显著下降;16 μmol·L丁酸钠与LPS共同孵育的情况下,mRNA表达水平显著下降。以上结果提示,丁酸钠可以通过AMPK信号通路调控脂代谢关键酶的活性,使脂肪酸的从头合成途径被激活,脂分解途径被抑制,进而提高MAC-T细胞TG的合成。
TNF-α、IL-6和IL-8是几种重要的促炎介质,由LPS激活的巨噬细胞产生,在体内外均发挥着重要的介导和调节炎症的作用。其中,TNF-α主要由活化的巨噬细胞产生的细胞因子之一,通过调节某些黏附分子促进炎症活性。IL-6由角化细胞、表皮细胞、成纤维细胞和真皮内皮细胞分泌,可促进T和B淋巴细胞的分化和某些炎症细胞因子的释放,通过调节细胞的生长、存活和分化,参与各种生物反应的调节,包括免疫反应、炎症、造血和肿瘤发生。TNF-α、IL-6和IL-8是导致组织功能障碍和代谢紊乱的主要因素,这些功能障碍和紊乱是疾病发展的重要原因。本试验发现,用1 000 ng·mLLPS刺激细胞9 h后,会造成细胞内的TNF-α和IL-6显著升高,而不同浓度丁酸钠和LPS共同孵育MAC-T细胞后,发现8和16 μmol·L丁酸钠对LPS造成的细胞炎症损伤有保护作用,可大大减少TNF-α和IL-6炎症因子的分泌。该试验提示,丁酸钠对细胞炎症损伤具有保护作用,能够抵抗炎症因子的侵袭。
4 结 论
LPS会造成MAC-T细胞脂代谢紊乱,并且相关炎症因子升高;而不同浓度丁酸钠的加入不仅会通过AMPK通路抑制脂分解代谢,激活脂合成代谢,进而增加TG的合成,而且可以抑制LPS对炎症反应的上调效应并对细胞的炎症损伤具有一定的保护作用。
