黄芪多糖降低脂多糖对鸡巨噬细胞促炎细胞因子和TLRs mRNA转录水平影响的效应分析
2022-09-30李大鹏王学智李建喜杨孝朴张景艳
刘 倩,李大鹏,张 宏,刘 琴,王学智, 李建喜,杨孝朴*,张景艳*
(1.甘肃农业大学动物医学院,兰州 730070; 2.中国农业科学院兰州畜牧与兽药研究所,兰州 730050; 3.河北农业大学中兽医学院,保定 071001; 4.甘肃省兽药饲料监察所, 兰州 730000)
黄芪性甘,微温,入脾、肺、肝、肾经,有“补气之长”之称。作为补气要药,其调节免疫的作用已被广为认知。黄芪主要包含生物碱、皂苷类、葡萄糖醛酸、黄酮类、多糖等生物活性物质,其中,黄芪多糖(Astragalus polysaccharides,APS)作为一类生物大分子成分,具有免疫调节、抗氧化、抗肿瘤、保护心血管系统,抗糖尿病、抗动脉粥样硬化等多种生物学作用。在临床应用中,APS常作为免疫增强剂与疫苗联合,用于提高幼畜天然免疫的调节能力和疫苗保护效果。巨噬细胞作为机体重要的天然免疫效应细胞,是机体造血系统中可塑性最强的一类细胞,具有极强的功能多样性,在机体正常发育、体内平衡、组织修复和抗感染中发挥重要作用。巨噬细胞主要分为M1和M2型,其中,M1型巨噬细胞通过分泌促炎性细胞因子和趋化因子,并专职提呈抗原,参与正向免疫应答,发挥免疫监视的功能,对于早期抵御畜禽感染性疾病至关重要,它能被集落刺激因子(GM-CSF)、TNF-α和 IFN-γ单独或与细菌的LPS 一起极化,表达促炎细胞因子IL-1β、IL-6、IL-12、IL-23 和 TNF-α等;M2型巨噬细胞在组织修复和恢复过程中大量存在,会被Th2 细胞因子(如 IL-4、IL-10和IL-13)极化,并产生抗炎细胞因子[如IL-10和转化生长因子β (TGF-β)]等。中药有效成分对巨噬细胞极化及功能的影响是近年来的研究热点。已有研究表明,APS可抑制炎症损伤小鼠或人巨噬细胞中炎症因子的过度释放,保护和调节巨噬细胞免疫功能,发挥抗炎、抗感染的生物学作用。禽类天然免疫系统与哺乳类动物有一定差异,但鲜见APS对鸡巨噬细胞调节作用及其分子机制的研究报道。因此,本试验建立LPS诱导损伤鸡巨噬细胞(HD11)细胞模型,开展APS对LPS炎症损伤HD11细胞形态、LDH活性、NO释放、炎症因子(TNF-α、IL-1β、IL-6、iNOS、IFN-α、IL-10)mRNA水平表达的调控作用和s mRNA转录水平的影响,以期为中药多糖对禽类天然免疫的调节作用及其相关机制研究提供数据支撑。
1 材料与方法
1.1 试验材料与仪器
HD11细胞由西北农林科技大学动物医学院王晶钰老师馈赠,BCA蛋白定量试剂盒购自北京康为世纪生物科技有限公司,内毒素测定试剂盒、苯酚购自北京索莱宝科技有限公司,1%青链霉素、胰酶、DMEM培养基、鸡血清购自美国Gicbo公司,LDH试剂盒购自北京索莱宝科技有限公司,Griess试剂购自美国Thermo Fisher公司,LPS(大肠杆菌O55∶B5)购自美国Sigma公司,CCK-8试剂盒购自上海泽塔生物科技有限公司。
超净工作台(北京东联哈尔仪器制造有限公司),恒温培养箱(Heal Force,HE90),超声波细胞粉碎机(JY99-IIDN)。立式压力蒸汽灭菌锅(LDZM-60KCS-II,上海申安医疗器械厂),多功能酶标仪(Enspire,铂金埃尔默企业管理(上海)有限公司),CO细胞培养箱(美国 Thermo Fisher Scientific,HERA cell 150i),实时荧光定量 PCR仪(美国 Thermo Fisher Scientific,ABI Q5)。
1.2 黄芪多糖的提取与表征
参考秦哲关于APS的提取方法,称取一定量的黄芪粉于烧杯中,加入蒸馏水80 ℃温浸提取3次,合并上清液,过滤并浓缩,加入Sevag试剂处理至无蛋白质层出现,流水透析(截留分子量为7 ku)处理48 h,加入无水乙醇静置过夜,取沉淀物依次用适量无水乙醇、丙酮、乙醚洗涤,待溶剂挥干后蒸馏水冲洗,最后冷冻干燥,并称重。所得提取物即为试验用APS样品。采用苯酚硫酸法,测定APS样品中还原糖的含量。采用3,5-二硝基水杨酸比色法,测定APS样品中还原糖的含量。采用BCA蛋白试剂盒说明书进行样本配制,测定APS样品中蛋白质含量。
1.3 HD11细胞复苏及培养
取冻存HD11细胞在37 ℃水浴融解,1 000 r·min离心5 min, 弃上清,加入完全培养液(89% DME高糖培养液+10%鸡血清+1%青链霉素)重悬并移入细胞瓶,37 ℃、5 % CO培养至细胞密度为90%以上时,消化后传代培养。
1.4 LPS诱导HD11细胞炎症模型的建立
将消化的HD11细胞离心,调整细胞浓度为5×10·mL,按100 μL·孔完全培养液(89% DMEM高糖培养液+10%鸡血清+1%青链霉素)接种于96孔板,37 ℃、5% CO条件培养 6 h,弃上清。分别加入100 μL LPS溶液(用含97%DMEM高糖培养液+2%鸡血清+1%青链霉素培养液稀释至0、2.44、4.88、9.76、19.53、39.06、78.12 μg·mL),另外,以含89% DMEM高糖培养液+10%鸡血清+1%青链霉素培养液培养HD11细胞为对照组1,以含97% DMEM高糖培养液+2%鸡血清+1%青链霉素培养液培养HD11细胞为对照组2,在37 ℃、5%CO条件下,孵育32 h,每个浓度设置8个重复,观察细胞形态,采用CCK-8试剂盒检测细胞增殖活性,确定诱导HD11细胞炎症模型的LPS工作浓度。
1.5 APS工作浓度范围的筛选
将消化后的HD11细胞离心,调整细胞浓度为5×10·mL,按100 μL·孔89%DMEM高糖培养液+10%鸡血清+1%青链霉素培养液接种于96孔板,37 ℃、5% CO条件培养 6 h,弃上清。分别加入100 μL APS溶液(用含97%DMEM高糖培养液+2%鸡血清+1%青链霉素培养液稀释至0、6.25、12.5、25、50、100、200、400、800 μg·mL),在细胞中按100 μL·孔添加APS溶液,37 ℃、5% CO培养箱中孵育24 h,每个浓度设置8个重复,采用CCK-8试剂盒检测细胞增殖活性,确定APS工作浓度范围。
1.6 APS干预LPS诱导损伤HD11细胞的处理方法
将消化后的HD11细胞离心,调整细胞浓度为5×10·mL,按1 mL·孔(89%DMEM高糖培养液+10%鸡血清+1%青链霉素)培养液接种于6孔细胞培养板,37 ℃、5% CO条件培养 6 h,弃上清。试验分为空白对照组、APS组、LPS组、APS+LPS组。APS组细胞中加入100 μg·mLAPS 溶液孵育12 h,弃上清,用预热PBS清洗两遍,再加入(97% DMEM高糖培养液+2%鸡血清+1%青链霉素)培养液培养32 h。LPS组细胞中加入(97% DMEM高糖培养液+2%鸡血清+1%青链霉素)培养液孵育12 h,弃上清,用预热PBS清洗两遍,再加入9.76 μg·mLLPS溶液,孵育32 h。APS+LPS 组细胞中加入100 μg·mLAPS溶液,孵育12 h,弃上清,用预热PBS清洗两遍,再加入9.76 μg·mLLPS溶液,孵育32 h。收集上清液或细胞进行后续试验。
1.7 APS对LPS诱导损伤HD11细胞NO释放的影响
按“1.6”方法收集各处理组的细胞上清液,采用Griess法用 NO 检测试剂盒测定各组细胞中 NO 含量,绘制标准曲线,并计算各组细胞中NO 浓度。
1.8 APS对LPS诱导损伤HD11细胞乳酸脱氢酶(LDH)含量的影响
按“1.6”方法处理后,弃上清,加入细胞提取液,超声波破碎细胞后,8 000 g 4 ℃离心10 min,取上清,应用LDH检测试剂盒进行样本处理,450 nm下测定吸光度,制备标准曲线,计算细胞中LDH含量。
1.9 APS对LPS诱导损伤HD11细胞炎症因子mRNA水平的表达
收集“1.6”方法中各组细胞,采用Trizol-Reagent法提取细胞总RNA并测定其浓度以及OD/OD比值,检测合格后,保存备用。如表1合成引物,严格按照反转录方法加样,并进行扩增。采用RQ-PCR检测后,通过2-ΔΔ方法计算干扰素α(IFN-α)、一氧化氮合酶(iNOS)、肿瘤坏死因子(TNF-α)、白介素6(IL-6)、白介素1β(IL-1β)、白介素10(IL-10)基因的相对表达量,以β-肌动蛋白(β-actin)为内参基因。引物的合成由北京奥科鼎盛生物科技有限公司完成。

表1 炎症因子及内参基因的PCR引物序列Table 1 PCR primer sequences of inflammatory factors and internal reference genes
1.10 APS对LPS诱导损伤HD11细胞TLRs基因mRNA水平的影响
收集“1.6”方法中各组细胞,采用Trizol-Reagent法提取细胞总RNA并测定其浓度以及OD/OD比值,检测合格后,保存备用。如表2合成引物,严格按照反转录方法加样,并进行扩增。采用RQ-PCR检测后,通过2-ΔΔ方法计算Toll样受体1(TLR1)、Toll样受体2(TLR2)、Toll样受体4(TLR4)、Toll样受体15(TLR15) 基因的相对表达量,以β-肌动蛋白(β-actin)为内参基因。引物的合成由北京奥科鼎盛生物科技有限公司完成。

表2 TLRs及内参基因的PCR引物序列Table 2 PCR primer sequences of TLRs and internal reference genes
1.11 统计学分析
用 Graph PadPrism 9.0.0 软件绘制柱状图,并进行数据分析,柱状图中的“*”或“**”表示与空白组相比,差异显著或极显著(<0.05 或<0.01),“#”或“##”表示与 LPS 组相比,差异显著或极显著(<0.05 或<0.01)。
2 结 果
2.1 APS的提取与表征
测得试验用 APS总多糖含量为95.31%±3.55%;APS还原性多糖含量1.96%±0.03%;APS蛋白质含量为6.50%±0.80%。
2.2 不同LPS浓度对HD11细胞的影响
如图1所示,与对照组(CON1)相比,2%鸡血清+1%双抗的完全培养液对HD11细胞(CON2)的增值活力无显著变化(>0.05)。随着LPS浓度的增加(>2.44 μg·mL),在2%鸡血清+1%双抗的完全培养液中培养的HD11细胞的增值活力持续下降。与CON2组相比,9.76~78.13 μg·mLLPS在37 ℃、5% CO下作用32 h可极显著降低HD11细胞的增值活力(<0.01)。因此,在后续试验中选择9.76 μg·mLLPS刺激HD11细胞32 h作为HD11细胞过度损伤的炎症模型。
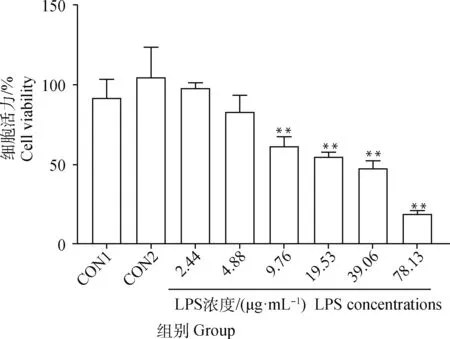
与空白组相比,*.P<0.05, **.P<0.01Compared with blank group, *.P<0.05, **.P<0.01图1 LPS对HD11细胞活力的影响Fig.1 Effect LPS on cell viability of HD11
2.3 APS工作浓度范围的筛选
如图2所示,为了评价不同浓度APS对HD11细胞增殖活力的影响并确定APS工作浓度,本研究用不同浓度APS(6.25~800 μg·mL)在37 ℃、5% CO作用HD11细胞24 h。与对照组相比,当APS浓度>50 μg·mL时,细胞增殖活性持续上升,其中在APS浓度>200 μg·mL时细胞增殖活性极显著上升(<0.01)。本试验中选择100 μg·mL为APS后续试验的工作浓度。
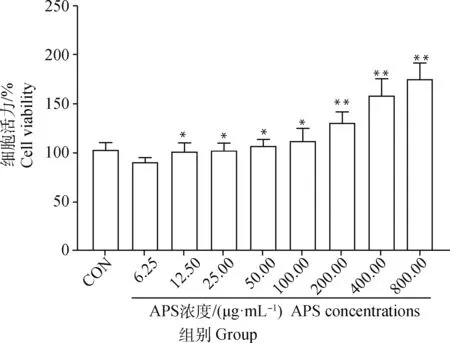
与空白组相比,*.P<0.05, **.P<0.01Compared with blank group, *.P<0.05, **.P<0.01图2 APS对HD11细胞活力的影响Fig.2 Effect APS on cell viability of HD11
2.4 APS对LPS诱导损伤HD11细胞NO含量的影响
如图3所示,与对照组细胞相比,LPS处理组细胞中NO释放量极显著高于对照组(<0.01);100 μg·mLAPS处理组细胞NO释放量极显著高于对照组(<0.01),但极显著低于LPS处理组(<0.01);APS+ LPS处理组细胞NO释放量极显著小于LPS处理组(<0.01),极显著高于对照组(<0.01)。

与空白组相比,*.P<0.05, **.P<0.01;与LPS组相比,#.P<0.05或##.P<0.01Compared with blank group *.P<0.05, **.P<0.01. Compared with LPS group, #.P<0.05, ##.P<0.01图3 APS对LPS刺激HD11细胞NO的含量Fig.3 Effect of APS on NO content of HD11 stimulated by LPS
2.5 APS对LPS刺激HD11细胞LDH含量的影响
如图4所示,与对照组细胞相比,LPS处理组细胞LDH释放量显著高于对照组(<0.05);APS处理组HD11细胞LDH释放量显著高于对照组(<0.05),但显著低于LPS处理组(<0.05);APS+LPS处理组细胞NO释放量显著小于LPS处理组(<0.05),显著高于对照组(<0.05)。结果表明,100 μg·mLAPS可促进HD11细胞LDH的释放;其预先处理HD11细胞12 h,可抑制9.76 μg·mLLPS引起LDH释放升高。
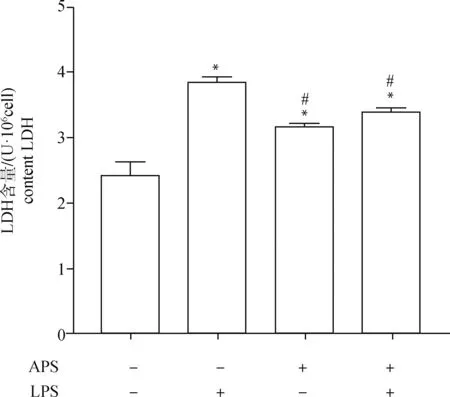
与空白组相比,*.P<0.05,**.P<0.01,与 LPS 组相比,#.P<0.05或##.P<0.01Compared with blank group, *.P<0.05, **.P<0.01. Compared with LPS group, #.P<0.05, ##.P<0.01图4 APS对LPS刺激巨噬细胞LDH含量的影响Fig.4 Effect of APS on LDH content of HD11 stimulated by LPS
2.6 APS对LPS刺激HD11细胞促炎症因子mRNA水平的表达
如图5所示,与对照组相比,LPS处理组细胞中,-α、-1β、-6、、-α mRNA转录水平极显著高于对照组(<0.01),-10 mRNA转录水平显著高于对照组(<0.05);APS处理组细胞中,-α、-10 mRNA转录水平极显著低于对照组(<0.01),-1β mRNA转录水平极显著高于对照组(<0.01),-6 mRNA转录水平与对照组相比无显著性差异(>0.05);APS+LPS处理组细胞-1β、-6、mRNA转录水平显著小于LPS处理组(<0.05),APS+LPS处理组细胞-α、-α、-10 mRNA转录水平极显著低于LPS处理组(<0.01);TNF-α mRNA显著高于对照组,IFN-α和IL-10 mRNA显著低于对照组(<0.05)。

与空白组相比,*.P<0.05, **.P<0.01。与LPS组相比,#.P<0.05,##.P<0.01Compared with blank group, *.P<0.05, **.P<0.01. Compared with LPS group, #.P<0.05, ##.P<0.01图5 APS对LPS刺激HD11细胞炎症因子基因mRNA转录水平的影响Fig.5 Effect of APS on mRNA transcription levels of inflammatory factor gene in LPS-stimulated HD11 cells
2.7 APS对LPS刺激HD11细胞TLRs信号通路相关基因表达的影响
如图6所示,与对照组相比,LPS处理组2、4 mRNA转录水平显著高于对照组(<0.05);APS处理组细胞中,2、4、15 mRNA转录水平显著低于对照组(<0.05),极显著低于LPS处理组(<001);APS+LPS处理组细胞2、4和TLR15 mRNA转录水平极显著低于LPS处理组(<0.01),显著低于对照组(<0.05)。
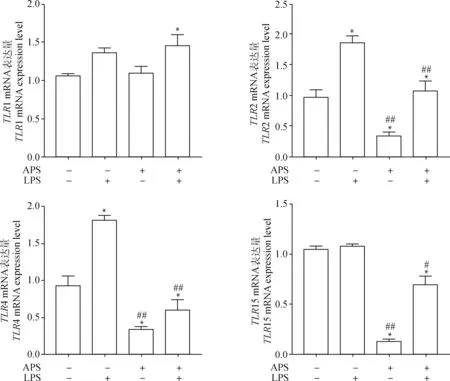
与空白组相比,*.P<0.05,**.P<0.01。与LPS组相比,#.P<0.05,##.P<0.01Compared with blank group, *.P<0.05, **.P<0.01. Compared with LPS group, #.P<0.05, ##.P<0.01图6 APS对LPS刺激HD11细胞TLRs信号通路mRNA转录水平的影响Fig.6 Effects of APS on mRNA transcription levels of TLRs signaling pathway of HD11 stimulated by LPS
3 讨 论
巨噬细胞作为机体重要的天然免疫效应细胞,具有极强的功能多样性,在机体正常发育、组织修复和抗感染中发挥重要作用。研究表明,APS可促进鼠源正常巨噬细胞中促炎因子的表达,激活M1型巨噬细胞分化,具有与低浓度(不引起毒性反应)LPS相似的生物学作用。如Wei等研究发现,分子量为1 334 ku,总糖含量为76.5%,浓度为30 ~ 300 μg·mL的APS可刺激RAW 264.7细胞中TNF-α、IL-6和NO(iNOS)蛋白与基因转录水平的表达升高。本试验用100 μg·mLAPS预先处理HD11细胞12 h,可显著降低-α、-10 mRNA的表达。结果表明,APS可促进鸡巨噬细胞向M1型分化,增强巨噬细胞的免疫监视功能。
炎症反应大多与免疫机制相关,其中巨噬细胞是启动炎症的关键细胞,它通过激活机体的免疫系统,释放细胞因子等一系列炎症介质,参与炎症反应。文献报道,APS可抑制炎症损伤下小鼠巨噬细胞中促炎因子的过度释放,保护和调节巨噬细胞免疫功能,发挥抗炎、抗肿瘤的生物学作用。由于鸡缺少LPS特异性的TRAM-TRIF(与TRIF相关的适配分子/包含诱导IFN-β适配体的TIR结构域的)信号通路,因此鸡对LPS刺激引起的免疫反应相比哺乳类动物耐受。本试验通过摸索LPS诱导HD11细胞炎症损伤模型,确定9.76 μg·mLLPS处理培养于2%鸡血清+1%双抗的完全培养液中HD11细胞32 h后,细胞出现明显的炎症损伤,并引起-α、-1β、-6、、-α、-10 mRNA表达均显著升高。该剂量比小鼠巨噬细胞炎症损伤模型所用LPS的剂量要高。结果提示,HD11细胞对LPS存在一定程度的耐受。试验中用100 μg·mLAPS预先处理HD11细胞12 h,可显著抑制LPS刺激引起的细胞NO、LDH释放及炎症因子mRNA表达的升高。结果表明,APS可保护LPS诱导损伤的鸡巨噬细胞,发挥抗炎的生物学作用。
Toll样受体是一类天然免疫模式识别受体,在病原微生物免疫和诱导快速防御反应激活中具有重要作用。TLRs在不同宿主中存在多态性,且由于宿主生存环境存在的差异,导致TLRs信号途径介导的宿主免疫系统调节分子机制具有差异性。此外,鸡缺少在大多数哺乳动物中存在的TLRs(TLR8、TLR9),且chT LR15和chT LR21是禽类特有的。研究显示,用多态性膜蛋白D(PmpD-N)刺激 HD11 细胞可上调 TLR2、TLR4、MyD 88 和 NF-κB的表达,并受到TLR2/MyD 88/NF-κB 通路的调控,表明TLR2 受体在鸡免疫反应中的重要作用。此外,有研究发现,用LPS刺激HD11细胞建立炎症模型,对刺激组和对照组样本进行GO 富集分析和 KEGG 分析,发现TLR2 信号通路受到主要富集,这可能暗示着 TLR2 在鸡抗炎症免疫反应中的重要作用。本试验通过研究APS对LPS诱导损伤HD11细胞1、2、4、15基因转录水平的影响,发现LPS可诱导巨噬细胞2、4 mRNA转录水平显著上升,但对1、15 mRNA表达影响不显著;发现APS干预的HD11细胞能显著降低LPS诱导损伤HD11细胞2、4、15 mRNA转录水平,调节炎症因子的过度释放,使HD11细胞发挥组织炎症损伤的修复功能。上述结果表明,APS对鸡巨噬细胞TLR2、TLR4、TLR15均有调节作用,但其中TLR2、TLR4可能是其发挥对LPS诱导损伤HD11细胞保护作用的关键受体。相关分子机制有待于进一步的研究证实。
4 结 论
黄芪多糖对鸡巨噬细胞的免疫调节作用存在双向性,能通过识别TLR2、TLR4、TLR15促进鸡巨噬细胞增殖与极化,发挥免疫增强的调节作用;还可通过抑制2、4 mRNA水平表达,发挥对LPS诱导损伤HD11细胞免疫损伤的调节作用。
