转录和蛋白质组学分析热空气处理对桃果实采后冷藏期间糖酸和酚类物质代谢的影响
2022-09-30周丹丹李婷婷吴彩娥
周丹丹,李婷婷,吴彩娥,屠 康
(1.南京林业大学轻工与食品学院,江苏 南京 210037;2.南京农业大学食品科学技术学院,江苏 南京 210095)
水蜜桃属于呼吸跃变型果实,采收多集中于高温高湿的夏季,常温贮藏过程中受病菌侵染易腐败变质,造成品质严重劣变。桃果实采后极不耐贮,严重限制了桃产业的发展。低温有利于延缓桃果实后熟过程,但桃属于冷敏型果实,低温贮藏易发生冷害,从而引起一系列生理生化和品质变化,如果实风味变淡、可溶性糖和有机酸含量下降、果肉木质化、组织发生褐变等,影响了果实的正常后熟。采后处理技术等外界因素对果实品质具有重要影响,因此,研究釆后保鲜技术对桃果实生理代谢的影响具有重要意义。
热空气(hot air,HA)处理指将样品置于35~50 ℃环境中进行短时处理,目前已广泛应用于果蔬的采后贮藏保鲜中。HA处理可以有效延缓果实的成熟衰老,抑制果实的腐败变质,提高果实的抗冷性,延长果实的货架期。研究表明,HA处理可以通过增强热激蛋白的表达量协同提高果实细胞膜的流动性和完整性,从而提高果实的抗冷害能力。同时,HA处理能够诱导果实次级代谢物的合成和抗氧化酶的活性,激活植物组织的抗病性,从而提高果蔬的抗病能力。
转录组和蛋白质组研究可以鉴定基因/蛋白的功能、探索基因/蛋白的调控过程、鉴定差异基因/蛋白,为探索果实采后生理变化的机理提供有利的工具,目前已在番茄、桃、葡萄、黄皮、石榴和马铃薯等果蔬中广泛应用。考虑到HA处理激发桃果实多条代谢途径的复杂性,本研究采用转录组学和蛋白质组学研究HA处理对桃果实采后糖酸和酚类物质代谢的影响,以期从基因水平和蛋白水平揭示HA处理对桃果实采后冷藏过程中的分子调控机制。
1 材料与方法
1.1 材料与试剂
‘霞晖8号’水蜜桃采自江苏省农科园,选取开花后110 d左右的商业成熟期桃果实于当天采收立即运回实验室,挑选大小一致,着色均匀,成熟度一致且无病虫害和机械损伤的果实作为实验对象(720 个果实),于4 ℃环境下预冷过夜。
葡萄糖、果糖、蔗糖、柠檬酸、苹果酸(标品)上海源叶生物科技有限公司;乙腈(色谱纯) 美国Sigma公司。
1.2 仪器与设备
CTHI-250B恒温恒湿箱 施都凯仪器设备(上海)有限公司;BGISEQ-500通用测序仪 深圳华大基因股份有限公司;ABI 7500型定量聚合酶链式反应核酸扩增仪 美国Applied Biosystems公司;LC 20AB高效液相色谱 日本岛津公司;UltiMate 3000超高效液相色谱、Q Exactive HF X串联质谱仪 美国赛默飞公司。
1.3 方法
1.3.1 桃果实分组与处理
热空气(HA)组:将桃果实置于聚乙烯(polyethylene,PE)保鲜袋中后于40 ℃、相对湿度90%~95%的恒温恒湿箱中处理4 h。
对照(CK)组:将桃果实置于PE保鲜袋中后于20 ℃,相对湿度90%~95%的恒温恒湿箱中处理4 h。
将上述处理后的桃果实于(1±1)℃冷库中贮藏35 d,每隔7 d取样进行指标(可溶性糖、有机酸、总酚、总黄酮、花色苷含量)测定。实验每组处理设置3 个平行,每个平行包含20 个果实,整个实验重复3 次。将贮藏至第0、7、21、35天的样品用于转录组分析,将贮藏至第0、7、35天的样品用于蛋白质组分析。
1.3.2 可溶性糖和有机酸含量测定
桃果实糖酸含量的测定参考Yu Lina和Tang Mi等的方法并稍作修改。取5 g桃果肉样品充分研磨,加入30 mL蒸馏水充分溶解,在80 ℃的水浴锅中采用超声波提取1 h。将上述样品8 000×离心10 min后取上清液并用0.45 μm水系滤膜过滤备用。
可溶性糖含量测定:色谱柱为碳水化合物柱(250 mm×4.6 mm,5 μm),柱温为40 ℃,流动相为体积分数75%乙腈溶液,流速为1 mL/min,采用配有蒸发光散射检测器检测。
有机酸含量测定:色谱柱为Atlantis T3柱(150 mm×4.6 mm,5 μm),柱温为40 ℃,流动相为磷酸二氢钾(20 mmol/L,pH 2.5),流速为0.6 mL/min。根据光电二极管阵列检测器的扫描模式,在210 nm波长处对果实有机酸组分进行检测。
通过与相应标准品的保留时间比较,对糖和有机酸进行定性和定量,每种化合物含量的单位为mg/g。样品测定设置3 个重复,每个重复进行3 次平行测定。
1.3.3 总酚和总黄酮含量测定
总酚含量测定采用福林-酚法,以没食子酸为标准物质绘制标准曲线。总黄酮含量采用NaNO-Al(NO)-NaOH比色法测定,以芦丁为标准品绘制标准曲线。总酚含量和总黄酮含量单位为mg/g。样品测定设置3 个重复,每个重复设置3 次平行测定。
1.3.4 花色苷含量测定
桃果实总花色苷含量的采用pH值示差法进行测定,花色苷含量单位为μg/g。样品测定设置3 个重复,每个重复设置3 次平行测定。
1.3.5 转录组测序检测
1.3.5.1 总RNA的提取与cDNA建库
采用植物总RNA提取试剂盒提取桃RNA,经过凝胶电泳和Nanodrop超微量分光光度计测定吸光度以检测RNA的完整性和浓度,检测合格的RNA由华大基因通过BGISEQ-500平台进行测序,构建cDNA文库。每个取样点样品分别设置3 个重复。
1.3.5.2 测序数据过滤和比对
使用过滤软件SOAPnuke进行统计,过滤去除低质量、接头污染以及未知碱基N含量过高的reads。得到clean reads后将其比对到参考基因组序列(NCBI_Prunus_persica_NCBIv2),之后再使用FPKM计算基因和转录本的表达水平。
1.3.5.3 差异表达基因的鉴定
基因表达量采用FPKM值表示,显著差异表达基因的筛选条件为差异倍数两倍以上(即|logFC|>1)并且≤0.001。
1.3.5.4 差异表达基因的GO分析和京都基因与基因组百科全书分析
使用R软件中的phyper函数进行富集分析,计算值,然后进行错误发现率(false discovery rate,FDR)校正,通常≤0.05的功能视为显著富集。根据基因本体(gene ontology,GO)注释结果及官方分类,将差异基因进行功能分类。根据京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)注释结果以及官方分类,将差异基因进行生物通路分类。
1.3.5.5 差异表达基因实时荧光定量聚合酶链式反应分析
随机选取9 个差异表达的基因进行实时荧光定量聚合酶链式反应(real time quantitative polymerase chain reaction,qPCR)分析,利用NCBI数据库查找桃果实相关基因的CDS序列,利用Primer 5.0软件设计引物(表1),qPCR采用AceQqPCR SYBRGreen Master Mix试剂盒,使用ABI 7500 PCR系统,采用两步法反应程序:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火/延伸34 s,共40 个循环。数据分析以作为内参基因,采用2法进行基因相对定量计算。每组处理重复3 次。

表1 qPCR引物设计列表Table 1 Primers used for real time quantitative polymerase chain reaction (qPCR) analysis
1.3.6 蛋白质组学分析
1.3.6.1 蛋白质的提取与酶解分离
桃果肉加入2 mL Lysis Buffer 3(含1 mmol/L的苯甲磺酰氟和2 mmol/L的乙二胺四乙酸),涡旋振荡后静置5 min,添加0.5 mL 10 mmol/L的二硫苏糖醇后振荡2 min。样品25 000×离心20 min,取上清液加入0.5 mL 10 mmol/L二硫苏糖醇,56 ℃水浴1 h后加入0.2 mL 55 mmol/L碘乙酰胺暗室静置45 min。加入4 倍体积冷丙酮,-20 ℃静置2 h,样品25 000×离心20 min,向沉淀中加入适量的Lysis Buffer 3,然后超声处理使沉淀溶解后25 000×离心20 min,取上清液,进行蛋白浓度定量。利用Bradford法和聚丙烯酰胺凝胶电泳法对提取的蛋白质进行定量。将符合质量要求的蛋白质采用胰蛋白酶酶解,将酶解后的肽段利用Strata X柱进行除盐后取样品进行分离,采用LC-20AB液相色谱系统,分离柱为Gemini C柱(4.6 mm×250 mm,5 μm)对样品进行分离,于214 nm波长处监测洗脱峰并分别收集组分,然后冻干。每个取样点样品分别设置3 个重复。
1.3.6.2 数据依赖采集模式建库和数据非依赖采集定量检测
将肽段样品用流动相A(2%乙腈、0.1%甲酸)复溶,20 000×离心10 min后,取上清液通过UltiMate 3000超高效液相色谱仪进行分离。样品进入trap柱富集并除盐,随后与自装C柱串联,以300 nL/min流速通过如下条件进行分离:0~5 min,5%流动相B(98%乙腈、0.1%甲酸);5~120 min,5%~25%流动相B;120~160 min,25%~35%流动相B;160~170 min,35%~80%流动相B;170~175 min,80%流动相B;175~10 min,5%流动相B。
数据依赖采集模式(data independent acquisition,DDA)检测:经过液相分离的肽段离子化后进入到串联质谱仪进行检测。参数设置:离子源电压1.9 kV;一级质谱扫描范围350~1 500/;分辨率为120 000;二级质谱起始/固定为100;分辨率30 000。二级碎裂的母离子:电荷2到6。离子碎裂模式为HCD,碎片离子在Orbitrap质谱仪中进行检测。
数据非依赖采集(data independent acquisition,DIA)检测:离子源电压设置为1.9 kV;一级质谱扫描范围/400~1 250;分辨率设置为120 000;最大离子注入时间50 ms;将/400~1 250均分为50 个窗口进行连续窗口碎裂及信号采集。离子碎裂模式为HCD,碎片离子在Orbitrap质谱仪中进行检测。
1.3.6.3 质谱数据鉴定与分析
将满足FDR≤1%的信息用于建立最终的谱图库,以差异倍数≥1和<0.01作为显著性差异的标准进行差异表达蛋白筛选,同时对差异表达蛋白进行GO富集分析(http://www.geneontology.org)和KEGG通路(http://www.genome.jp/)功能注释分析。基于定量结果,完成不同比较组差异表达蛋白的查找,最后进行相应差异富集蛋白的功能分析。
1.4 数据处理与分析
利用Excel 2013软件对实验数据进行统计分析,采用SAS 9.2软件Duncan多重比较法进行差异显著性分析。
2 结果与分析
2.1 HA处理对桃果实糖酸、总酚、总黄酮含量和花色苷含量的影响
如表2所示,共检测到3 种可溶性糖,分别为蔗糖、葡萄糖和果糖,其中蔗糖的含量最高。不同处理组随着贮藏时间的延长,蔗糖含量呈现明显下降的趋势,而葡萄糖和果糖含量呈现明显上升的趋势。与CK组相比,HA处理显著抑制了桃蔗糖含量的下降(<0.05),并抑制了果糖和葡萄糖含量的上升,这与Yu Lina等的研究结果是一致的。柠檬酸和苹果酸是桃果实中的主要有机酸,不同处理组2 种有机酸随着贮藏时间的延长整体呈现下降的趋势,其中CK组柠檬酸含量下降了0.17 mg/g,苹果酸含量下降了0.41 mg/g。与CK组相比,HA处理可在第7、14、28、35天显著抑制柠檬酸含量的下降(<0.05)。经过HA处理14~35 d后桃果实苹果酸的含量显著高于CK组(<0.05)。Chen Ming等研究表明HA处理可以显著抑制椪柑果实柠檬酸和苹果酸含量的下降。总酚含量和总黄酮含量整体呈现先上升后下降的趋势,CK组和处理组桃果实总酚含量于贮藏第21天达到最大值,分别为0.80 mg/g和1.07 mg/g,CK组总黄酮含量于贮藏第14天达到最大值(1.43 mg/g),而处理组总黄酮含量于第21天达到最大值,为1.93 mg/g。与对照组相比,HA处理显著提高桃果实总酚含量和总黄酮含量,这与Wei Yingying等的研究结果一致。对照组桃果实花色苷含量变化比较稳定,而HA处理组花色苷含量呈现先上升后下降的趋势,HA处理显著提高了桃果实花色苷含量。Zhou Dandan等研究结果表明,HA处理可显著提高桃果肉花色苷含量不仅与苯丙烷代谢途径关键酶活力有关,同时与果实中可溶性糖和有机酸含量密切相关。研究表明,蔗糖、葡萄糖和果糖与果实花色苷的合成呈现正相关性,糖不仅是合成花色苷重要的前体物质,也是调节花色苷合成的重要信号物质。Liu Xiaojuan等研究表明,蔗糖可以通过调控和转录因子,从而促进苹果花色苷的积累和果实色泽形成。有机酸含量决定了果实液泡内pH值的变化,花色苷以阳离子的形式存在于果实液泡内,颜色随液泡中的pH值改变而变化。Noro等研究发现柠檬酸和苹果酸是苹果花色苷合成的潜在刺激物。本研究表明,HA处理显著提高桃果肉花色苷的含量与蔗糖、柠檬酸含量和苹果酸含量密切相关,HA处理可以通过抑制桃果实蔗糖、柠檬酸和苹果酸的降解从而提高花色苷的含量。
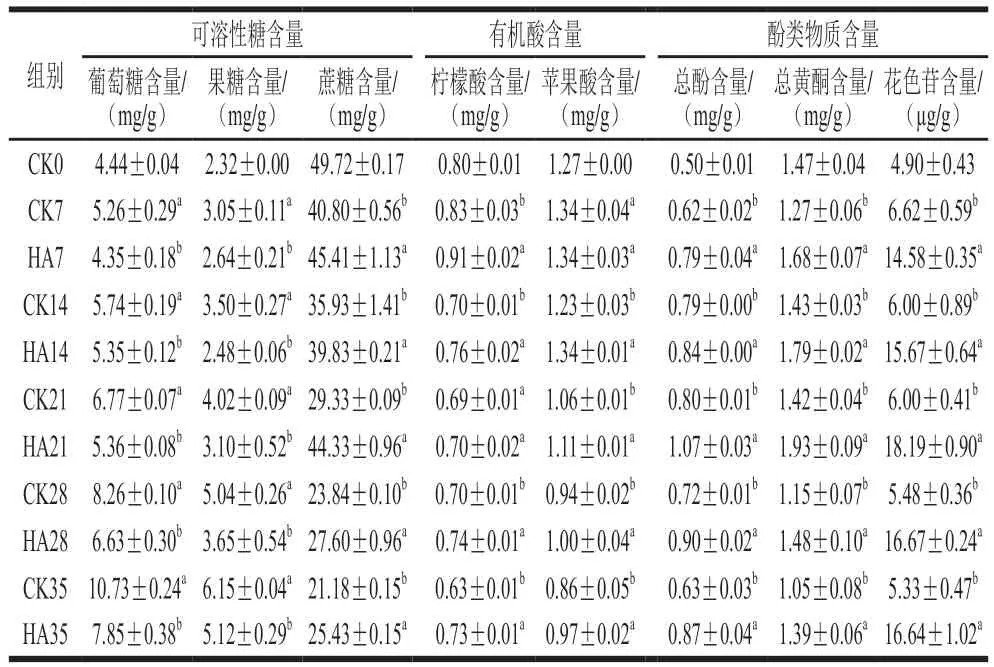
表2 HA处理对桃果实可溶性糖、有机酸和酚类物质含量的影响Table 2 Effect of HA treatment on the contents of soluble sugars,organic acids and phenolic compounds in peach fruit
2.2 转录组分析结果
2.2.1 转录组测序数据质量
对桃果实测序后进行统计,总共获得了518.05 Mb 个原始的reads片段,过滤后的clean reads片段为478.02 Mb 个,包含了47.81 Gb 个碱基数。其中过滤后质量不低于20的reads比例大于97%,不低于30的reads比例约为90%。由此可以看出,测序质量较好,可以满足后续数据组装及处理的要求。同时,利用qPCR验证了转录组数据的准确性,由图1可知,qPCR检测的9 个基因的相对表达量与转录组检测的FPKM值具有较高的相关性,的最低值为0.795 1,最高值0.975 9,说明转录组测序数据可靠性较高。
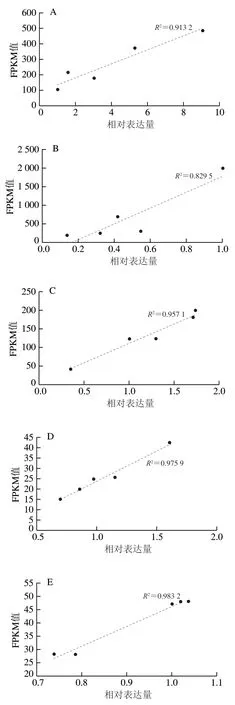
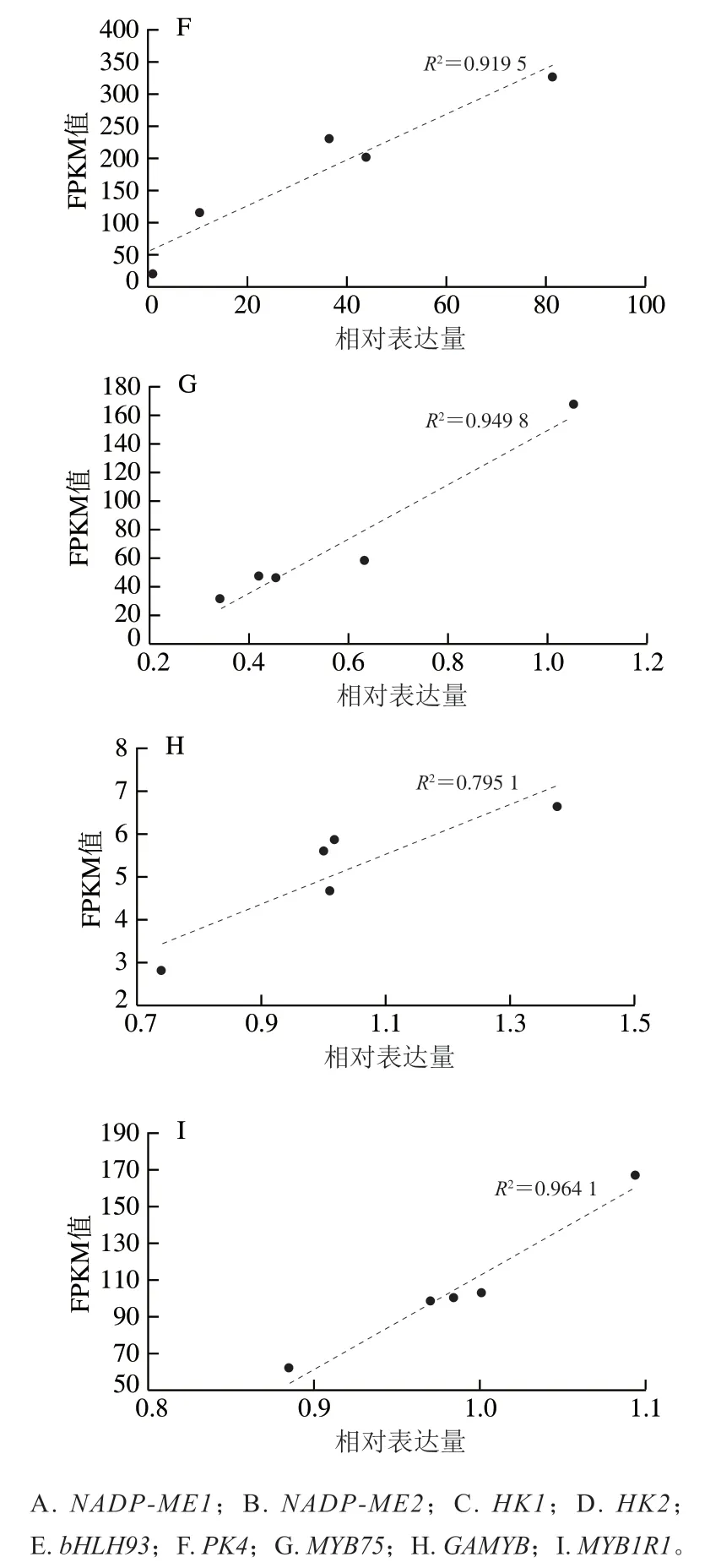
图1 基因表达量的qPCR验证分析Fig. 1 qPCR validation analysis of gene expression
2.2.2 差异表达基因的筛选
桃果实采后贮藏期间差异表达基因数量如图2所示。以采收当天的桃果实(CK0)为对照,分析不同贮藏时间下的差异表达基因。由图2A可知,随着贮藏时间的延长,差异表达基因的数量不断上升,CK0 vs CK7、CK0 vs CK21、CK0 vs CK35 3 组差异基因总数分别为8 182、11 345、11 884 个。且随着贮藏时间的延长,下调差异基因总数始终高于上调差异基因总数,其中CK0 vs CK7、CK0 vs CK21和CK0 vs CK35分别有3 059、3 257 个和3 721 个基因上调,有5 123、8 088 个和8 163 个基因下调。图2B为同一贮藏时间下CK组与HA处理组差异表达基因的数量,随着贮藏时间的延长,CK组与HA处理组差异基因表达总数逐渐减少,CK7 vs HA7、CK21 vs HA21和CK35 vs HA35分别为2 424、2 287 个和746 个。贮藏前期(7 d),HA处理下调表达的差异基因数量高于上调的差异基因数量,但是在贮藏中期(21 d)和贮藏后期(35 d),HA处理上调的差异基因数量高于下调的差异基因数量。
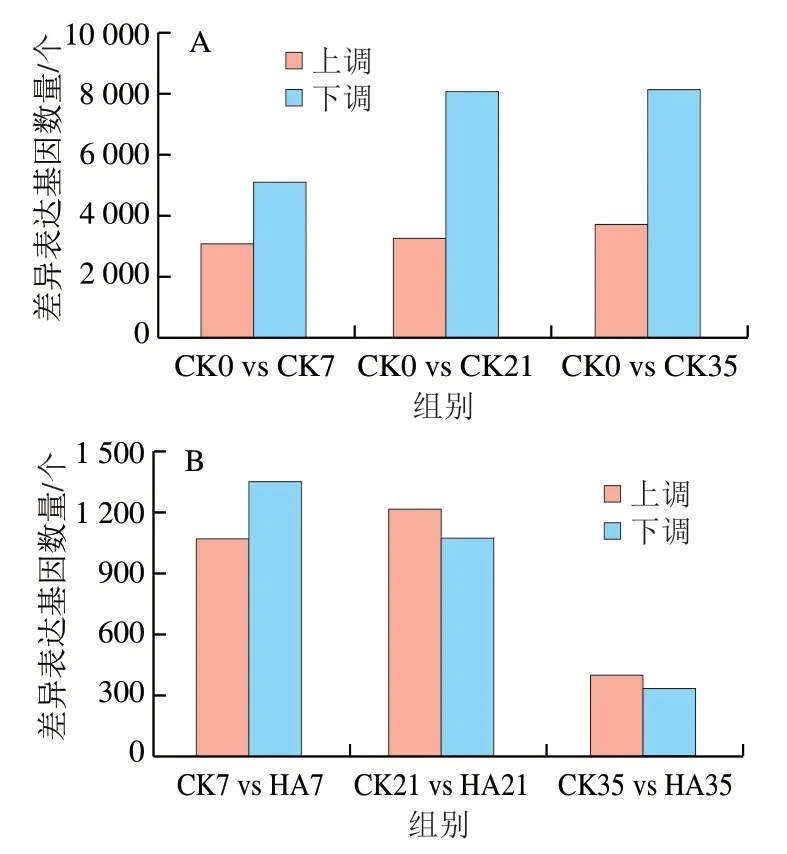
图2 桃果实贮藏过程中差异表达基因数量(A)和HA处理与对照组差异表达基因数量(B)Fig. 2 Number of DEGs in control group among storage times (A) and number of DEGs between HA treated and control groups (B)
2.2.3 差异表达基因GO功能分析结果
将上述差异基因进一步进行GO功能分析,主要分为贮藏期间差异基因GO分析以及CK组和HA处理组差异基因GO分析。这些GO信息被进一步被归纳为基因的分子功能、细胞组分、生物学过程3大类。图3为对照组与HA组差异基因的GO分析结果,主要对比了CK7 vs HA7、CK21 vs HA21和CK35 vs HA35。由图3可知,对于生物进程中,差异基因主要聚集于细胞代谢过程、生物调控、刺激响应和代谢过程这4 个亚类中。对于细胞组分归类中,差异基因主要聚集于细胞、细胞膜、细胞膜组分和细胞器这4 个亚类中。对于分子功能,差异基因主要聚集于结合功能和催化活性这2 个亚类中。
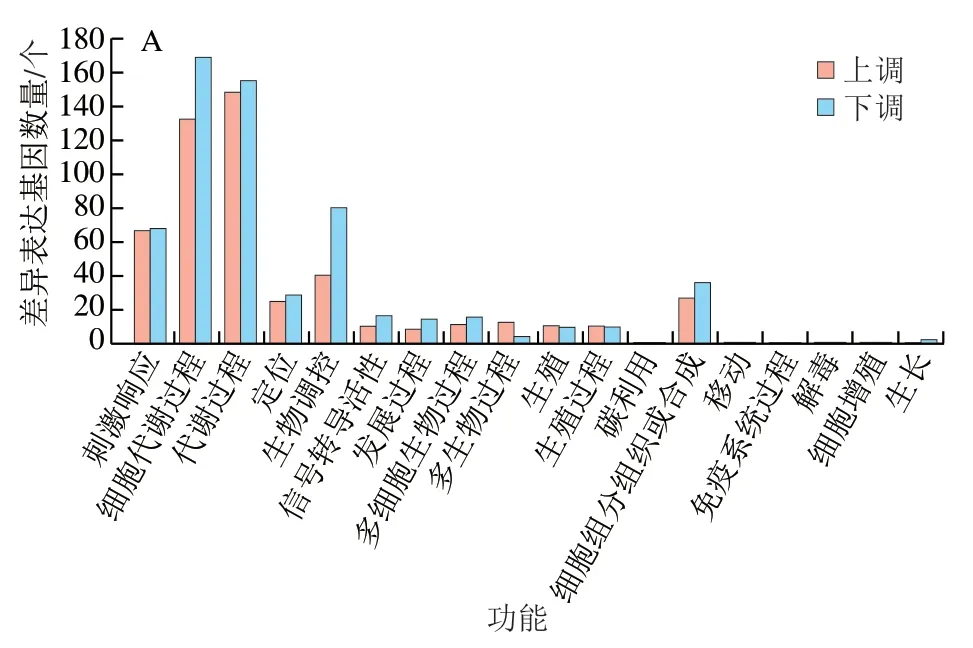

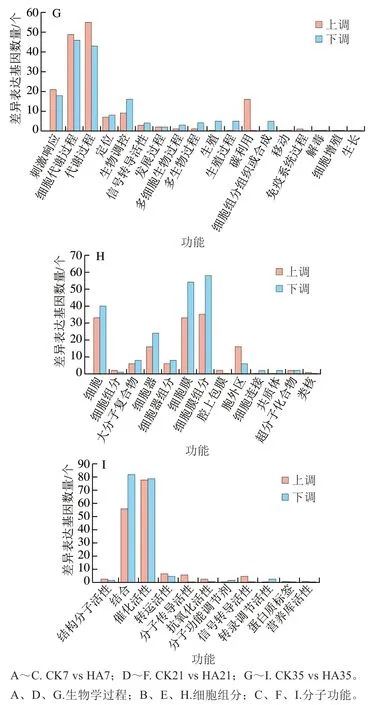
图3 桃果实HA组和对照组差异表达基因GO功能分类Fig. 3 Gene ontology (GO) term assignment of DEGs between control and HA-treated groups
2.2.4 差异表达基因代谢通路富集
通过KEGG通路分析可以进一步了解相关基因的生物功能和相互间的作用。KEGG分类主要包括6大类,分别为细胞过程、环境信息处理、遗传信息处理、人类疾病、代谢和有机体系统。图4为CK组和HA处理组差异基因的KEGG富集分析。CK组和HA处理组的差异基因在KEGG数据库中共映射到20 个不同的代谢通路。在6 个分类中,CK组和HA处理组差异基因在代谢中占比最多,其次为遗传信息处理。在代谢这一分类中,差异基因主要集中在总概,其次为碳水化合物代谢、次级产物代谢、氨基酸代谢和脂质代谢。在遗传信息处理分类中,差异基因主要聚集在翻译、折叠、分类和降解。此外HA处理组和CK组差异基因在信号转导途径中占比也较多。
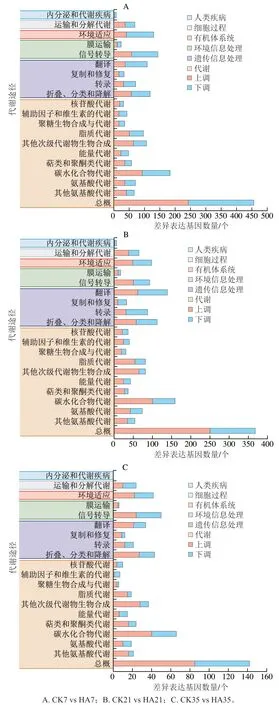
图4 桃果实HA组和CK组差异表达基因KEGG代谢途径分类分析Fig. 4 KEGG classification of DEGs between control and HA-treated groups
2.2.5 参与调控糖酸和酚类物质代谢的差异基因
根据转录组测序结果,对集中于糖酸代谢和酚类物质代谢的差异基因的表达量进行了进一步的分析。图5为参与调控果实可溶性糖、有机酸和酚类物质代谢的差异表达基因。
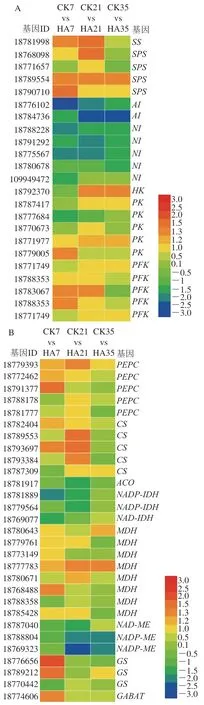
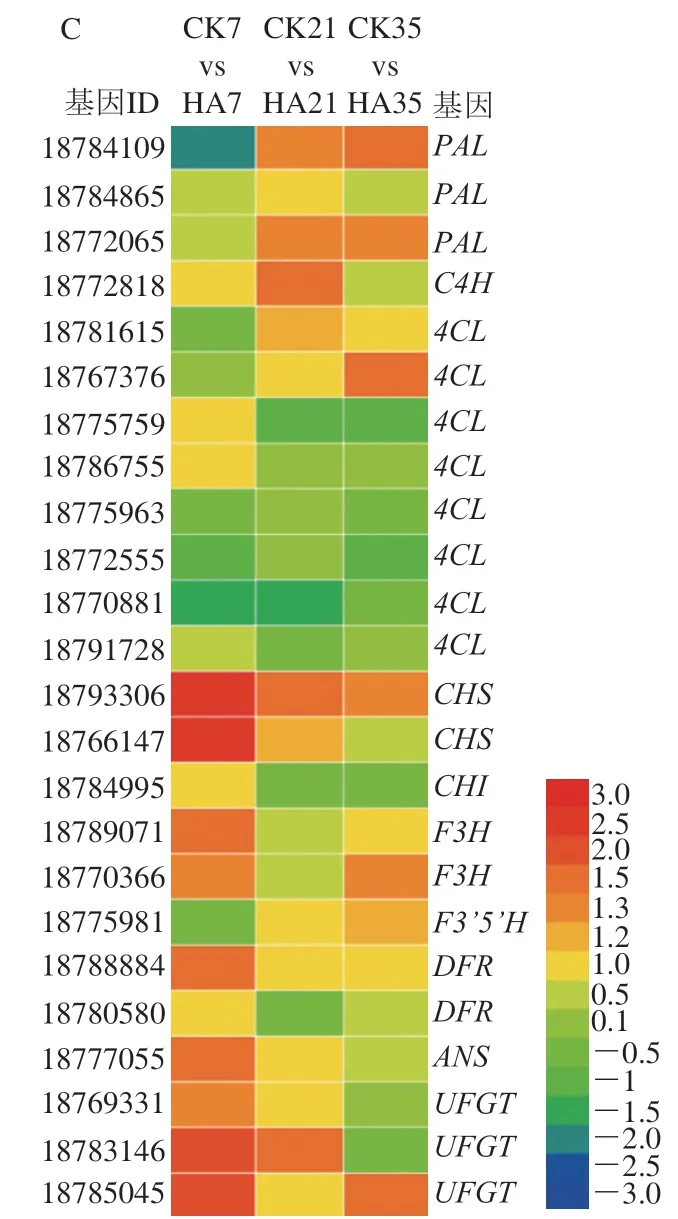
图5 参与桃果实糖代谢(A)、有机酸代谢(B)和酚类物质代谢(C)的差异表达基因Fig. 5 DEGs involved in the metabolisms of soluble sugars (A), organic acids (B) and phenols (C) in peach fruit
如图5A所示,共检测到22 个参与调控桃果实糖代谢的差异表达基因,差异基因主要为、、、I、、和。蔗糖合酶(sucrose synthase,SS)和蔗糖磷酸合酶(sucrose phosphate synthase,SPS)可以促进葡萄糖和果糖转化为蔗糖,而蔗糖可在转化酶的催化下降解生成葡萄糖和果糖;己糖激酶(hexokinase,HK)、丙酮酸激酶(pyruvate kinase,PK)和磷酸果糖激酶(phosphofructokinase,PFK)参与果实糖酵解途径,与果糖和葡萄糖的磷酸化反应密切相关。贮藏前期,HA处理上调了、、、基因的表达量,其logFC均大于1;贮藏中后期,HA处理上调了基因的表达量。同时,HA处理抑制了桃果实和基因的表达量,其logFC均小于1。Yu Lina等研究表明,HA处理可以抑制桃蔗糖含量的降解主要与低表达量的和基因密切相关,同时HA处理抑制了葡萄糖和果糖含量的上升与高表达量的和密切相关。与上述结果一致,本研究发现HA处理可以通过抑制和基因的表达,提高、和基因的表达,从而抑制了蔗糖的降解并抑制了葡萄糖和果糖的合成。
如图5B所示,共检测到29 个参与桃有机酸代谢的差异基因,主要参与苹果酸和柠檬酸的代谢,差异基因主要为、、、、、和。可以催化柠檬酸的合成,而和促进柠檬酸的降解,和参与柠檬酸的转运。和参与果实苹果酸的合成,而促进了苹果酸的降解。贮藏前期,HA处理提高了桃果实、、、和基因的表达量,同时HA处理显著抑制了、和基因的表达量。以上结果表明,HA处理通过提高桃果实、和基因的表达量,并抑制基因的表达量从而抑制桃果实柠檬酸含量的下降。对于苹果酸代谢的影响,HA处理通过上调和的表达量,并抑制基因的表达,从而抑制桃苹果酸含量的下降。
参与调控酚类物质代谢的差异基因共检测到24 个,主要集中于苯丙烷代谢途径中,差异基因主要为、、、、、、、、和。、、可以催化果实苯丙氨酸转化为酚酸类物质,后经过、和进一步催化生成黄酮类和黄烷醇类物质,、和参与果实花色苷的合成,促进果实颜色的积累。本研究表明HA处理上调酚类代谢相关基因的表达量,尤其是在贮藏的前期。对、、和基因表达量影响较为显著,logFC均大于2。以上结果表明,HA处理可以通过调控基因的表达量从而促进桃果实苯丙氨酸向酚类物质转化,同时通过上调、、和基因的表达量从而提高果实黄酮类物质的含量,最后通过提高、和基因的表达量,从而促进桃果实花色苷的合成。
2.3 蛋白质组学分析结果
2.3.1 差异表达蛋白的筛选
桃果实采后贮藏期间差异表达蛋白数量如图6所示。以采收当天的桃果实为对照,分析了不同贮藏时间下的差异表达蛋白。由图6A可知,随着贮藏时间的延长,差异表达蛋白的数量不断上升,CK0 vs CK7组和CK0 vs CK35组的差异表达蛋白总数分别为160 个和951 个。在贮藏前期,上调蛋白数量和下调蛋白数量基本相等,贮藏后期,下调蛋白数量明显高于上调蛋白的数量。图6B为同一贮藏时间下CK组与HA处理组差异蛋白的数量,随着贮藏时间的延长,CK组与HA处理组差异表达蛋白总数逐渐减少,CK0 vs HA7组和CK0 vs HA35组分别为401 个和339 个。贮藏前期和贮藏后期,HA处理下调表达的差异表达蛋白数量高于上调的差异表达蛋白的数量。
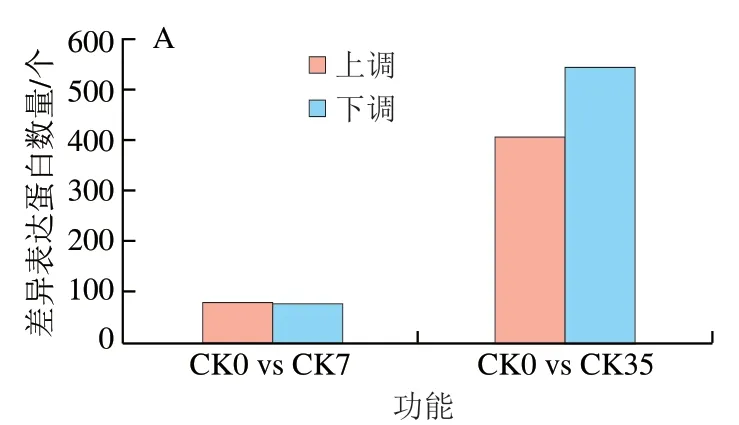

图6 桃果实贮藏过程中差异表达蛋白数量(A)和HA处理与CK组差异表达蛋白数量(B)Fig. 6 Number of DEPs in control group among storage times (A) and number of DEGs between HA treated and control groups (B)
2.3.2 差异表达蛋白GO功能分析结果
将CK组与HA处理组差异基因进行GO功能分析,这些GO信息被进一步归纳为基因的分子功能、细胞组分、生物学过程3大类。图7为CK组与HA处理组差异表达蛋白的GO功能分析结果,主要对比了CK7 vs HA7和CK35 vs HA35。在3大类中,CK组和HA处理组差异表达蛋白数量在生物学过程中最多,其次为细胞组分,分子功能中差异表达蛋白数量最少。在43 个亚类中,细胞代谢过程、代谢过程、细胞、细胞组分、结合和催化活性中差异表达蛋白数量较多。
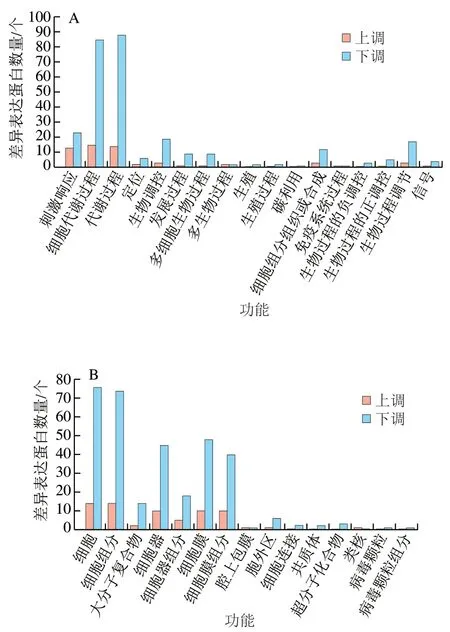
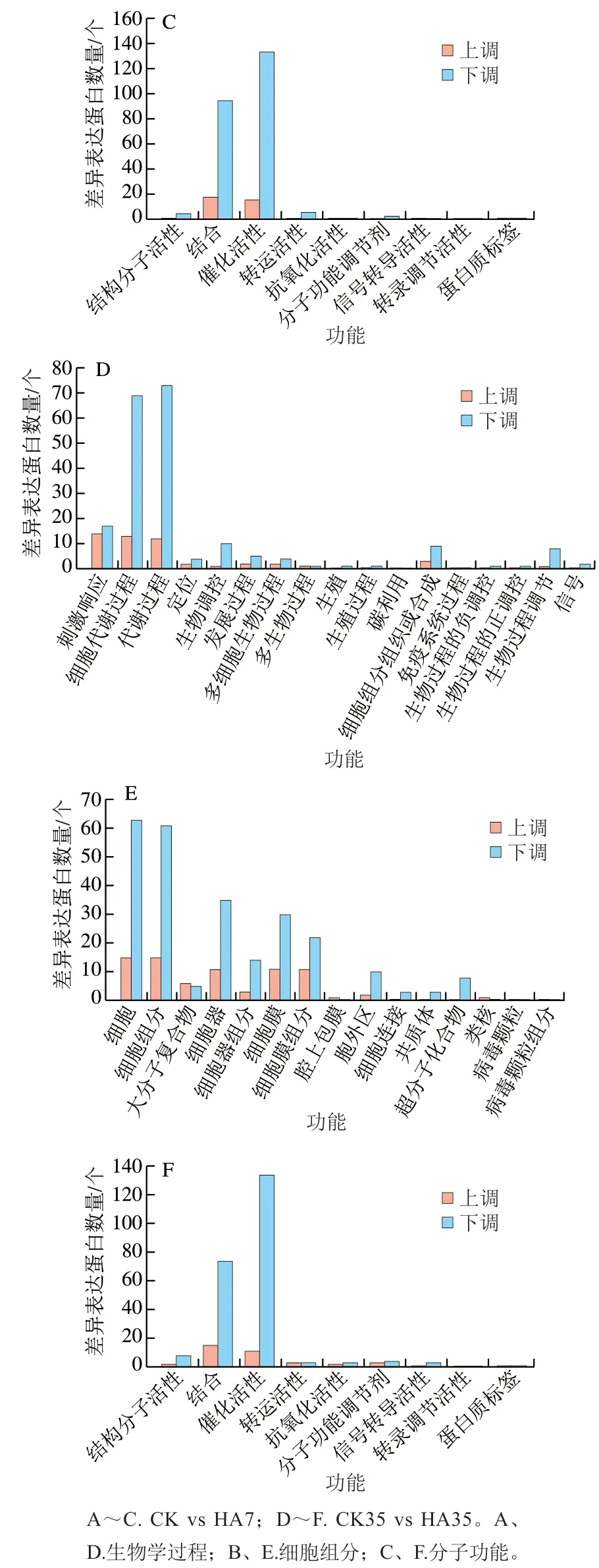
图7 桃果实HA组和对照组差异表达蛋白GO功能分类分析Fig. 7 Gene ontology (GO) term assignment of DEPs between control and HA-treated groups
2.3.3 差异表达蛋白代谢通路富集
KEGG分类主要包括细胞过程、环境信息处理、遗传信息处理、人类疾病、代谢和有机体系统6大类。CK组和HA处理组差异表达蛋白的KEGG富集分析如图8所示。CK组和HA处理组的差异表达蛋白共映射到20 个不同的代谢通路。在6 个分类中,代谢中差异基因的占比最多,差异表达蛋白主要参与了碳水化合物代谢、其他次级产物代谢、氨基酸代谢和脂质代谢等代谢途径。差异表达蛋白在遗传信息处理分类中占比也较多,主要集中在翻译、折叠、分类和降解。
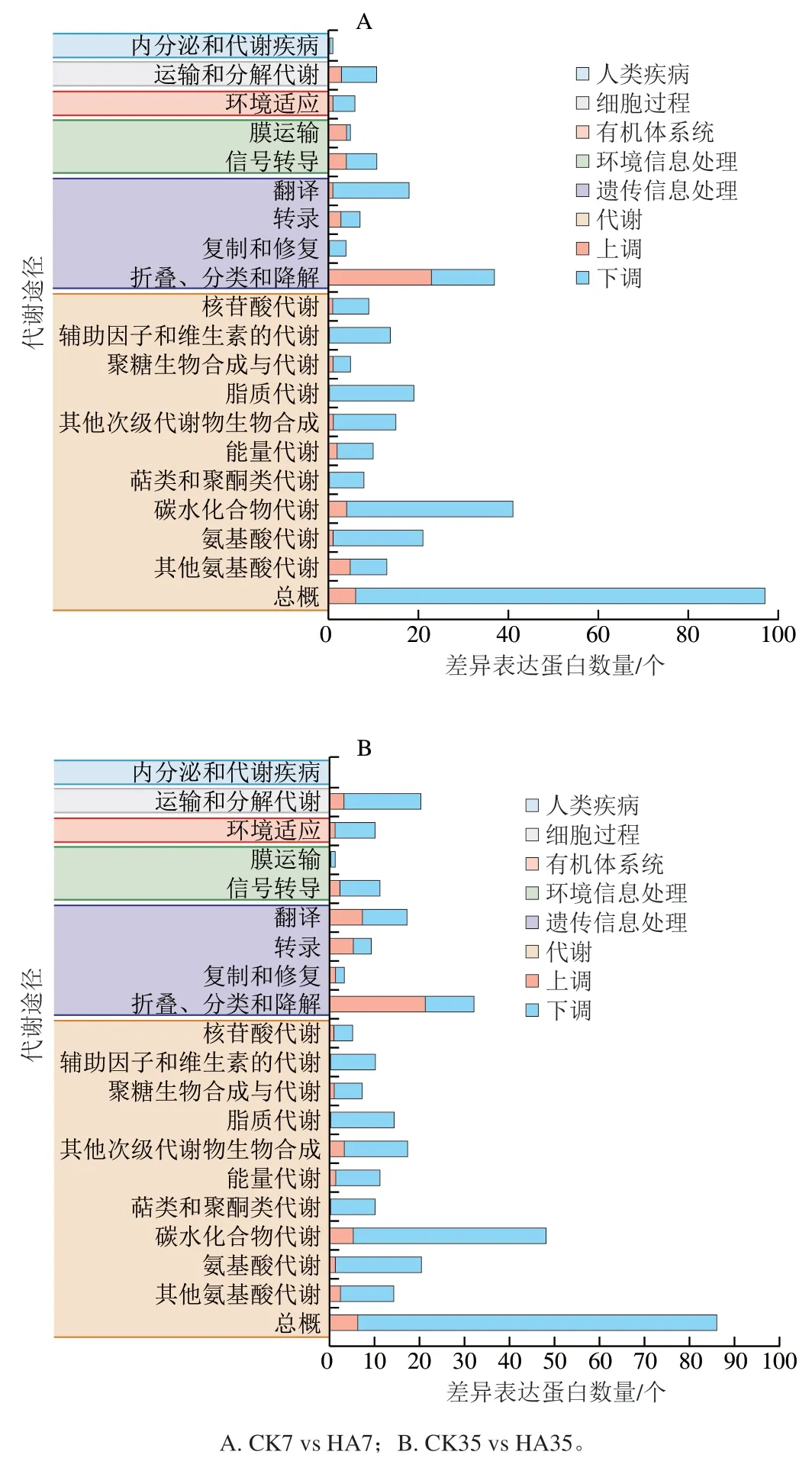
图8 桃果实HA组和CK组差异表达蛋白KEGG代谢途径分类Fig. 8 KEGG classification of DEPs between control and HA-treated groups
2.3.4 参与调控碳水化合物和次级代谢物代谢的差异表达蛋白
图9为参与桃果实碳水化合物代谢和次级代谢物代谢的差异表达蛋白,共鉴定出44 个具有差异表达的蛋白,其中碳水化合物代谢差异表达蛋白有28 个,次级代谢物代谢差异表达蛋白有16 个。
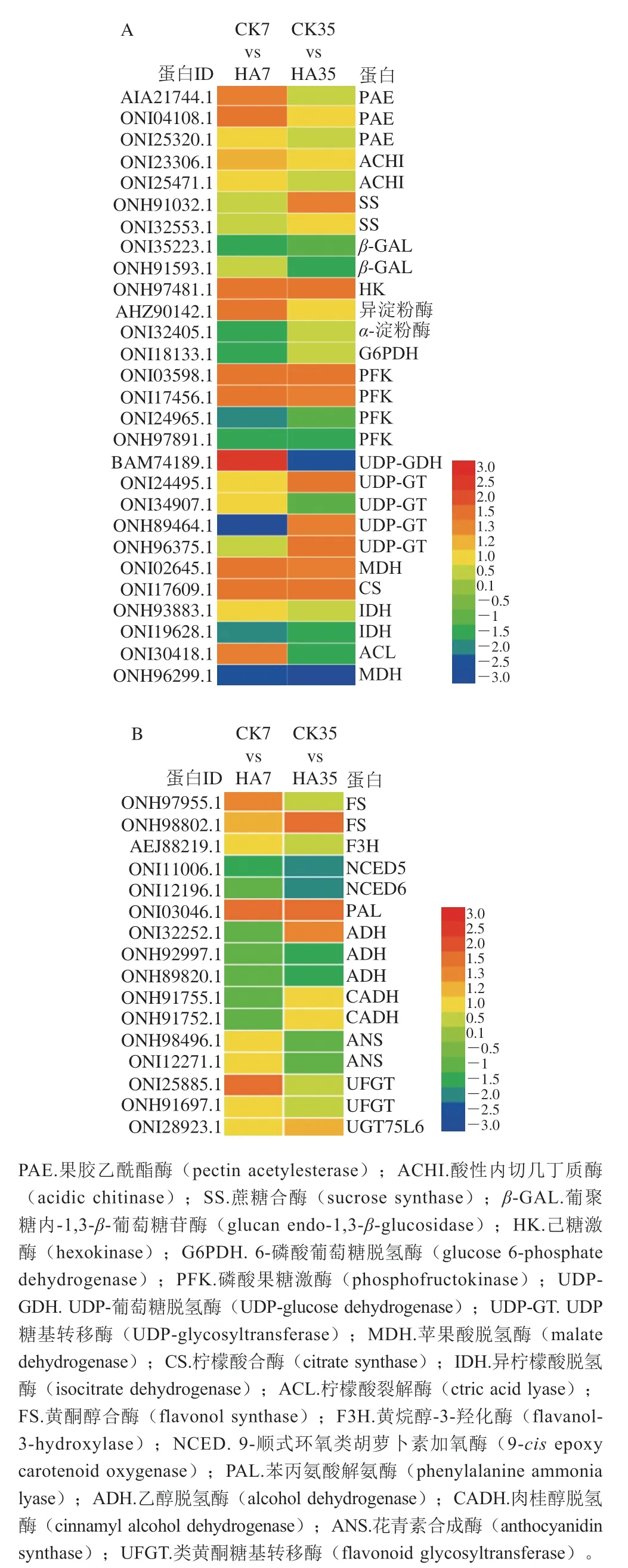
图9 参与桃果实碳水化合物(A)和次级代谢物(B)代谢的差异表达蛋白Fig. 9 DEPs involved in the metabolisms of carbohydrates (A) and secondary metabolites (B) in peach fruit
碳水化合物代谢中,差异表达蛋白主要集中在糖代谢、有机酸代谢及果实抗病防御系统酶。在果实抗病防御系统中,果胶乙酰酯酶(pectin acetylesterase,PAE),酸性内切几丁质酶(acidic chitinase,ACHI)和葡聚糖内-1,3--葡萄糖苷酶(glucan endo-1,3-glucosidase,-GAL)主要参与了植物抗病胁迫进程,经过HA处理后的桃果实CHI和-GAL的表达量高于CK组,说明HA处理可以诱导果实的抗病性。在糖代谢过程中,鉴定到的差异表达蛋白主要包括SS、淀粉酶、HK、PFK、6-磷酸葡萄糖脱氢酶(glucose 6-phosphate dehydrogenase,G6PDH)、UDP糖基转移酶(UDP-glycosyltransferase,UDP-GT)和UDP-葡萄糖脱氢酶(UDP-glucose dehydrogenase,UDP-GDH)。与CK组相比,HA处理上调了SS、PFK、UDP-GT和UDP-GDH蛋白的表达量,说明HA处理可以抑制蔗糖含量的降解,并促进果糖和葡萄糖的代谢。结合转录组学数据分析,共有3 个糖代谢差异表达蛋白与相应的差异表达基因变化相同,分别为HK(18792370、ONI32405.1)、PFK(18771749、ONH97891.1)和PK(18777684、ONI06129.1)。在有机酸代谢过程中,差异表达蛋白主要参与柠檬酸和苹果酸的代谢,鉴定的差异表达蛋白主要为苹果酸脱氢酶(malate dehydrogenase,MDH)、柠檬酸合酶(citrate synthase,CS)、异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)、柠檬酸裂解酶(ctric acid lyase,ACL)和苹果酸异丙酯脱氢酶(isopropyl malate dehydrogenase,IMDH)。HA处理上调了MDH和CS蛋白的表达量,并下调了IDH、ACL和IMDH蛋白的表达量。其中MDH、IDH和CS蛋白的表达量变化与转录组中CS(18782404)、NAD-IDH(18781889)和MDH(18773149)基因的表达量变化相同,HA均提高了MDH和CS的表达,并抑制了IDH的表达。
图9B为参与桃果实次级代谢物代谢的差异表达蛋白,共鉴定到16 个具有差异表达的蛋白,主要为苯丙烷代谢途径关键蛋白和糖苷转移蛋白,差异表达蛋白主要为黄酮醇合酶(flavonol synthase,FS)、黄烷醇-3-羟化酶(flavanol-3-hydroxylase,F3H)、9-顺式环氧类胡萝卜素加氧酶(9-epoxy carotenoid oxygenase,NCED)、苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)、乙醇脱氢酶(alcohol dehydrogenase,ADH)、肉桂醇脱氢酶(cinnamyl alcohol dehydrogenase,CADH)、花青素合成酶(anthocyanidin synthase,ANS)和类黄酮糖基转移酶(flavonoid glycosyltransferase,UFGT)。与CK组相比,HA处理提高了FS、PAL、UFGT等蛋白的表达量,从而促进了桃果实苯丙氨酸向花色苷类物质的合成。其中,PAL蛋白(ONI03046.1)与基因(18772065)的表达量变化一致;UFGT蛋白(ONI25885.1)和基因(18785045)表达量的变化相同,说明HA处理均能显著提高PAL和UFGT蛋白和基因的表达。同时,HA处理明显下调了ADH、NCED的表达量,说明HA处理可以显著抑制果实类胡萝卜素等物质的降解。
3 结 论
HA处理(40 ℃、4 h)对桃果实糖代谢、有机酸代谢和酚类物质代谢影响较大。HA处理可以有效抑制蔗糖、柠檬酸和苹果酸含量的下降,并抑制了葡萄糖和果糖含量的上升。同时,HA处理显著提高了桃果实总酚、总黄酮和总花色苷的含量。转录组学和蛋白质组学分析结果表明,大多数的差异表达基因和蛋白主要集中在碳水化合物代谢和次级代谢物代谢途径中。对于糖代谢途径,HA处理通过抑制酸性转化酶(acid invertase,AI)和中性转化酶(neutral invertase,NI)的表达,并上调SS、SPS和PFK表达,从而抑制桃果实蔗糖含量的降解及果糖和葡萄糖含量的上升。对于有机酸代谢,柠檬酸和苹果酸是桃果实的主要有机酸,HA处理通过上调CS表达并下调IDH和乌头酸酶(aconitase,ACO)的表达量,从而抑制柠檬酸含量的下降,同时HA处理通过上调磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase,PEPC)和MDH并下调ME的表达量,从而抑制桃果实苹果酸含量的下降。对于酚类和花色苷代谢,HA处理可以通过上调PAL和肉桂酸羟化酶(cinnamate hydroxylase,C4H)的表达量,从而促进苯丙氨酸向下游酚类物质转化,通过上调查耳酮合成酶(chalcone synthase,CHS)、查耳酮异构酶(chalcone isomerase,CHI)和F3H表达量促进桃果实黄酮类物质的合成,并通过上调二氢黄酮醇还原酶(dihydroflavonol reductase,DFR)、ANS和UFGT表达量,从而提高桃果实花色苷的含量。
