鲜黄花菜衰老机制与采后贮藏保鲜技术研究进展
2022-09-30李可昕张超凡刘佩冶赵玉梅曹建康
李可昕,张超凡,刘佩冶,赵玉梅,曹建康
(中国农业大学食品科学与营养工程学院,北京 100083)
黄花菜(Baroni)又称“金针菜”“忘忧草”,一般被认为是百合科、萱草属的多年生草本植物。但是根据《中国植物志》和黄花菜叶绿体全基因组的报道,黄花菜已被更新为阿福花科(Asphodelaceae)萱草属植物。黄花菜常以新鲜花蕾或干制品食用。黄花菜富含多种生物活性化合物,具有防治炎症、失眠和抑郁症等功能。黄花菜开花时正值6—8月高温多雨季节,新鲜黄花菜(花蕾)采摘后生命活动仍非常旺盛,具有强烈的呼吸作用和蒸腾作用,极易发生花蕾开放和衰老,出现变黄、失水、萎蔫、甚至腐烂等现象,从而严重影响商品价值。为此,本文系统地综述了近年来鲜黄花菜采后衰老的生物学变化、生理生化代谢机制、影响因素,以及贮藏保鲜技术等方面的研究进展,以期为鲜黄花菜采后衰老机制研究与贮藏保鲜技术开发探索发展方向。
1 鲜黄花菜衰老的生物学特性
1.1 外观及品质变化
黄花菜的花由3 片花瓣、3 片萼片组成。花粉通常为棕色、红色或黄色。黄花菜划分为白天开花类群和夜间开花类群。生产上一般于花蕾开放前采收。黄花菜花蕾(可食用部分)一旦开放后迅速进入衰老阶段(图1)。随着衰老,花的鲜质量和干质量下降,花瓣组织呈水浸状。黄花菜采后在常温下很快失水,容易出现花蕾松动、萎蔫;第2天,大部分花蕾开放,花瓣颜色变黄,部分褐变;第3天时出现严重褐变、腐败变质,甚至有霉菌生长和异味。研究表明,保持黄花菜鲜嫩状态和成熟花蕾开放所需的膨胀压力是由原生质膜的半渗透性来提供的,组织衰老过程中因细胞膜完整性的破坏和水分散失,从而出现萎蔫现象。

图1 不同发育与开放时期的黄花菜[5]Fig. 1 Photographs of daylily in different stages of development and blooming[5]
研究表明,果聚糖代谢在黄花菜的发育与开花过程中起着重要作用,在花朵开放时,果聚糖水解为葡萄糖和果糖,导致渗透压增加,能够吸收水分和维持花瓣膨胀舒张状态。研究还发现,在衰老时,花中的大多数可溶性碳水化合物和氨基酸通过韧皮部转移,被植株其他部位吸收,尤其花瓣中碳水化合物的流出量明显增加。蛋白质组学分析表明,在黄花菜衰老过程中,己糖(主要是半乳糖、果糖和葡萄糖)代谢在基因本体(gene ontology,GO)分类上显著富集,其中,半乳糖代谢可能是与黄花菜短暂寿命相关的核心途径。黄花菜采收后品质迅速劣变,总糖、可溶性糖、还原糖、可溶性固形物、VC、叶绿素含量呈不断下降趋势。但也有研究认为,采后黄花菜还原糖、可溶性固形物含量呈先上升后下降的趋势。因此,对于鲜黄花菜采后衰老过程内在品质变化的研究还有待深入。
1.2 细胞结构变化
在黄花菜的衰老过程中花瓣细胞的大小、形状和细胞间黏附作用发生了很大的变化。微观结构观察结果表明,开花前36 h,花瓣细胞呈圆形并紧紧地包裹在一起;在开花前12 h时,细胞扩大,横截面变厚但包裹不紧密;在开花后12 h,细胞仍然较大但形状不规则,形成了网状图案;在开花后的24 h,细胞之间的空隙开始消失,细胞开始降解。黄花菜衰老可能是一种遗传调控的程序性细胞死亡(programmed cell death,PCD)。PCD是多细胞真核生物用来清除系统中多余和受损细胞的基本机制,受多种途径控制。在发生PCD时出现细胞皱缩、DNA片段化、凋亡小体形成和吞噬作用。黄花菜衰老过程中会出现由蛋白酶激活引起的蛋白质降解,由核酸酶激活导致的核酸损失、DNA片段化以及由酶介导的碳水化合物多聚物的改变。但是,目前黄花菜PCD机制涉及的许多复杂生化途径多为研究者们的推测,仍缺乏直接的证据。
在鲜黄花菜采后衰老过程中,细胞壁物质相关酶活性变化很大,使细胞壁结构与强度改变,从而导致了花瓣细胞形态结构的改变。黄花菜开花后多聚半乳糖醛酸酶、-半乳糖苷酶和纤维素酶活性增加,内切-1,4--葡聚糖酶转录物的丰度增加。这些酶可能参与了细胞壁物质的降解,使碳水化合物转移到植株的其他部位。研究发现兼产果胶酶和纤维素酶的黑曲霉可刺激黄花菜花瓣的衰老,伴随着糖醛酸物质含量的增加和离子泄漏,这些变化与脂氧合酶活性增加导致的脂质过氧化和膜通透性丧失有关。黄花菜衰老早期(开花后10~13 h),细胞膜磷脂合成过程被抑制,磷酸己糖的比例下降,磷脂前体的比例大幅增加,花瓣的表观自由空间从30%增加到38%。目前缺乏采后衰老过程中鲜黄花菜微观结构变化的报道。生长期黄花菜衰老的细胞组织学变化可为采后研究提供理论依据和思路。
2 鲜黄花菜采后衰老的影响因素
2.1 黄花菜品种
黄花菜在湖南、山西、甘肃、陕西、浙江、四川等地都有种植,形成了众多的地方特色品种,现有栽培种近50 种、野生种10余种。湖南省祁东县主栽品种为‘祁珍花’‘白花’‘猛子花’;四川省渠县主栽品种为‘渠县花’‘武坪早’‘冲里花’;甘肃庆阳以‘马蔺黄花’质量最佳;‘沙苑金针’为陕西大荔县主栽品种。各品种采后衰老进程存在一定的差异,但缺乏系统的研究。总地来说,中、晚熟品种黄花菜采收期相对较晚,采后衰老进程稍慢,比较适宜贮藏,可以延长鲜黄花菜的供应时间。从目前的研究来看,栽培较广泛的‘猛子花’‘白花’‘大乌嘴’等采后衰老较慢,在贮藏过程中质量损失率、开花率、腐烂率低,还原糖含量维持在较高的水平,较耐贮藏。而‘蕃龙花’‘明针针’等采后衰老相对较快,贮藏时间较短。
2.2 黄花菜生长发育程度
黄花菜一般在抽薹现蕾期后进行采收,采收时生长发育程度会影响其贮藏性。采收过早,生长发育程度过低,花蕾生长发育不完全,食用品质和风味未形成。采收过晚,生长发育程度过高,花蕾膨大,采收后极易开花、衰老。研究发现,以花表皮颜色1/3转黄、平均花长7.5~9.0 cm的八成黄花菜最适宜采收和贮藏。黄花菜具体采收时的生长发育程度因品种、产地、用途而异。
2.3 贮藏温度
温度是影响黄花菜开花与采后衰老最重要的环境因素。鲜黄花菜在采后常温(20~35 ℃)条件下放置1 d时花蕾就会全部开放,发生明显黄化,采后3 d时严重失水干缩。低温(0~5 ℃)贮藏能够有效地抑制鲜黄花菜的衰老进程,但是不同研究者报道的结果差异非常大。许国宁等研究表明新鲜黄花菜在3 ℃条件下贮藏6~7 d开始腐烂;龚吉军报道黄花菜在2 ℃下贮藏,外加保鲜剂处理,28 d时仍有商品价值;高建晓等发现在0~2 ℃条件下贮藏黄花菜,保鲜期可达14 d;张欣等报道0~1 ℃条件下贮藏鲜黄花菜,30 d时好花率达99.47%。研究发现黄花菜花蕾在低温下仍具有伸长、开放的能力,但对其低温生长开花的机制尚不清楚。因此,黄花菜采后低温生物学特性仍需深入研究。
2.4 贮藏相对湿度
相对湿度是影响黄花菜采后衰老、失水萎蔫的重要环境因素之一。较高相对湿度可以降低黄花菜蒸腾速度,减缓水分的散失,延迟黄花菜的萎蔫与褐变,但是有利于微生物的繁殖,会促进黄花菜的腐烂。相对湿度过低会引起黄花菜过快失水萎蔫。贮藏湿度的选择与贮藏温度、包装材料等因素相关。普遍在较高的相对湿度条件下贮藏黄花菜,如相对湿度70%~80%或80%~90%。
2.5 贮藏环境气体成分
贮藏环境中适宜的O、CO气体成分比例能够起到良好的保鲜作用。研究表明,当O体积分数为2.5%时能够有效抑制黄花菜的采后衰老。黄花菜对CO气体耐受程度较高,采用较高体积分数CO(14%~16%)处理可以明显地降低黄花菜采后的质量损失率,抑制退绿变黄和开花衰老进程,降低腐烂率,形成较好的保鲜效果。但是,目前尚缺少对黄花菜O、CO耐受的临界点以及适宜的气体成分组合的深入研究。
3 鲜黄花菜衰老生理及机制
3.1 呼吸代谢
Bieleski等研究发现,黄花菜开花时呼吸速率稳定地保持在480 mg CO/(kg·h),呼吸速率在开花16 h时开始增加,在20 h完全开花时达到峰值,约为600 mg CO/(kg·h),然后缓慢降低至约320 mg CO/(kg·h),黄花菜的品质随之明显劣变。黄花菜开花过程中呼吸代谢受到授粉的影响,可能出现抗氰呼吸,但是还缺少实验证实。不同的研究表明,采后黄花菜呼吸强度的变化趋势多样,这可能是受到发育程度和贮藏温度的影响。如黄花菜在2 ℃贮藏时,前3 d呼吸强度迅速下降,之后呼吸强度变化很小。使用带孔聚乙烯薄膜袋包装的黄花菜置于冷库(0~2 ℃)贮藏21 d,呼吸强度整体也呈现下降趋势。另有研究发现,黄花菜在室温保鲜袋贮藏7 d,呼吸强度整体呈现先上升后下降的趋势;新鲜黄花菜于(4.0±0.5)℃贮藏12 d,呼吸强度也呈先上升后下降的趋势。采后及时预冷能够显著降低贮藏过程中黄花菜的呼吸强度。在适宜的低温、低O和CO浓度条件下贮藏可以有效抑制黄花菜的呼吸强度,延缓采后衰老进程。
3.2 激素代谢
乙烯可以调节许多植物的开花、成熟与衰老进程。花瓣衰老过程中乙烯生成速率快速增加,授粉可导致乙烯产量的激增,乙烯合成途径中的关键基因表达上调。黄花菜从花芽生长到花朵开放,乙烯产量极低,但是随着花开始衰老,乙烯的产量瞬间提高,随后又维持在较低水平,其中的乙烯大部分来自花瓣。Lay-Yee等认为黄花菜属于乙烯不敏感型,外源乙烯或乙烯生物合成抑制剂处理都不会改变黄花菜衰老进程。关于乙烯在黄花菜发育与衰老过程中的作用还有待深入研究。黄花菜内源乙烯的代谢规律、相关基因的表达与调控、外源乙烯对黄花菜呼吸作用和内源乙烯合成的影响尚不清楚。
脱落酸可促进植物器官的衰老和脱落,在切花的衰老中具有重要的调控作用,脱落酸含量越高,切花寿命越短,切花衰老时脱落酸含量增加。脱落酸可能是介导乙烯不敏感型物种花瓣衰老过程的重要激素信号。Panavas等研究表明,脱落酸参与了黄花菜花瓣的衰老,内源脱落酸含量在黄花菜开花前增加,在花瓣衰老期间继续增加;外源脱落酸会引起黄花菜衰老,促进脂质过氧化作用和离子泄漏,增强蛋白酶和核糖核酸酶活性。研究发现,在采后贮藏过程中黄花菜中脱落酸含量不断增加,外源2,4-表油菜素内酯处理可以有效地抑制内源脱落酸的产生,延缓黄花菜的衰老。
植物激素对黄花菜采后衰老进程的调控是一个复杂的过程,该过程不止取决于某一种激素绝对浓度的变化,内源激素间的相互平衡及协同作用更为重要。有关黄花菜内源激素的代谢水平、消长平衡与基因表达的关系,以及植物激素对黄花菜采后衰老调控的分子机理还有待进一步研究。
3.3 衰老相关基因表达
一些基因在非衰老组织中以基础水平表达,而在衰老组织中或衰老过程中表达量明显增加,这类基因被称为衰老相关基因(senescence-associated gene,SAG)。在黄花菜衰老过程中,DNA片段化的细胞核数目增加,各种核酸酶的活性也明显增加。Panavas等分析了黄花菜花瓣中与衰老相关的6 个cDNA,通过同源分析推测DSA3为含有细胞色素P450的脂肪酸羟化酶,DSA4为天冬氨酸蛋白酶,DSA5未鉴定,DSA6为核酸酶,DSA12为丙二烯氧合酶,DSA15为脂肪酸延伸酶,并且这些DSA的mRNA主要在花瓣衰老过程中积累,而不是在所有衰老器官中积累。Yang Huanhuan等通过转录组学分析了黄花菜6 个发育阶段(其中花的开放和衰老是黄花菜发育中最重要的过程)的相关基因,将23 019 个基因归属于8 个生物学过程,包括DNA代谢、脂质代谢、转运、细胞间信号传导、多细胞生物发育、昼夜节律、细胞死亡、花的发育。
环境因素(包括光周期、温度)和内源信号都影响植物从营养生长向生殖生长的转变。春化是指将植物暴露在寒冷环境中一定时间来促使其开花。春化作用会通过降低开花抑制基因的表达、激活开花控制基因来促进开花,能将光周期、春化和自主途径所感知的信号整合在一起,编码触发成花的诱导信号,以正确响应不断变化的环境。基因是典型的R1类MYB转录因子,研究表明,黄花菜生物钟基因在开花前12 h时在花瓣中表达量最高,显著高于叶片、雌蕊、雄蕊、花萼及根。黄花菜开花节律及光周期调节的关键基因能在光暗交替时期呈现出高表达,该基因的表达具有明显时间差异性和生物钟调节特性。采后低温贮藏期间黄花菜的开花与衰老是否也受到和、、的调控非常值得研究,对于从根本上深入揭示黄花菜采后衰老进程具有重要意义。
3.4 蛋白质合成与降解
PCD依赖于蛋白质的合成与降解。黄花菜开花后可溶性蛋白、微粒体蛋白、质体蛋白水平降低。黄花菜花瓣的PCD涉及蛋白酶的活性增加,而羧肽酶的活性在整个衰老过程中保持相对不变;亮氨酸氨基肽酶的活性增加,并且比内肽酶提前数小时达到峰值。推测亮氨酸氨基肽酶可能在开花期间参与了蛋白质的运输,且在花瓣衰老相关蛋白质水解的起始过程中起作用,而内肽酶可能负责开花后期大部分蛋白质的水解。Guerrero等发现,在黄花菜花瓣衰老过程中两个巯基蛋白酶基因(和)表达量增加;使用赤霉素处理开花的黄花菜时和的转录本增加。Valpuesta等分离鉴定出了一个与花衰老密切相关的半胱氨酸蛋白酶基因。Ma Guangying等发现,在黄花菜衰老过程中至少有2 种转化酶(催化蔗糖转化为果糖和葡萄糖的酶)、3 种天冬氨酸蛋白酶、1 种半胱氨酸蛋白酶和1 种巯基蛋白酶的表达量上升。黄花菜衰老过程中表达的天冬氨酸蛋白酶、半胱氨酸蛋白酶和枯草杆菌类丝氨酸蛋白酶可能是氨基酸重组所需的水解蛋白酶,也可能是引发花序PCD的凋亡蛋白酶,蛋白磷酸酶的表达可能参与了PCD的信号转导途径。泛素-蛋白水解途径对于黄花菜花发育和衰老过程中特定蛋白质的选择性分解代谢很重要。在黄花菜发育和衰老过程中,在花瓣中检测到多达100 种泛素-蛋白质结合物,随着衰老过程的进行,蛋白质泛素化的模式发生了变化。环己酰亚胺作为蛋白质翻译的抑制剂,能够抑制黄花菜的开放和呼吸跃变,延缓衰老。用环己酰亚胺处理黄花菜,可以阻止大多数蛋白质的泛素化并抑制蛋白质的水解。
3.5 活性氧代谢
Panavas等研究发现黄花菜开放之前,脂质过氧化作用增加,并伴随着脂氧合酶活性的增加以及HO含量的升高,在开花后10 h时HO含量再次升高,此时花已经衰老。这表明ROS不仅在花开放中起作用,在衰老中也起作用。黄花菜在衰老过程中HO等自由基的积累能诱发脂质过氧化作用增强和丙二醛(malondialdehyde,MDA)积累,造成细胞膜透性增加和电解质外泄。黄花菜衰老过程中ROS水平的变化与自由基清除系统的作用密切相关。黄花菜ROS水平的升高与过氧化氢酶(catalase,CAT)和抗坏血酸过氧化物酶(ascorbate peroxidase,APX)比活力降低、抗坏血酸含量降低以及超氧化物歧化酶(superoxide dismutase,SOD)和过氧化物酶(peroxiredoxin,POX)比活力的增加有关。Chakrabarty等从黄花菜中检测到3 种SOD同工酶,其中SOD-III同工酶的活性最大,检测到3 种APX同工酶,它们在衰老的不同阶段差异表达,并且发现黄花菜在衰老过程中内源性HO含量显著下降。
4 鲜黄花菜采后贮藏保鲜技术
4.1 低温贮藏保鲜
低温(0~5 ℃)贮藏可有效延长黄花菜采后寿命,其中,以0~2 ℃较为适宜。黄花菜的最低冷藏温度可达-1 ℃。如果贮运温度不适宜,可能引起黄花菜出现褐变、组织溃烂和品质下降。采后及时预冷、低温贮藏和冷链运输是鲜黄花菜贮运保鲜的适宜方式,而且经真空预冷的黄花菜呼吸强度明显低于冷库预冷。
4.2 气调包装保鲜
气调包装(modified atmosphere packaging,MAP)又称自发气调保鲜包装。当包装薄膜对于O和CO的气体渗透率与果蔬自发呼吸代谢消耗O和产生CO的速率达到一定的比值时,会在包装中建立平衡的气体比例。MAP中的气体混合比例取决于产品的种类、包装材料和贮藏温度。黄花菜MAP微环境中可形成较高CO和较低O的比例,能够抑制呼吸强度,起到延缓衰老的作用。不同条件下MAP贮藏黄花菜的保鲜效果见表1。黄花菜的MAP保鲜操作方便、效果显著,具有一定的实际应用价值。
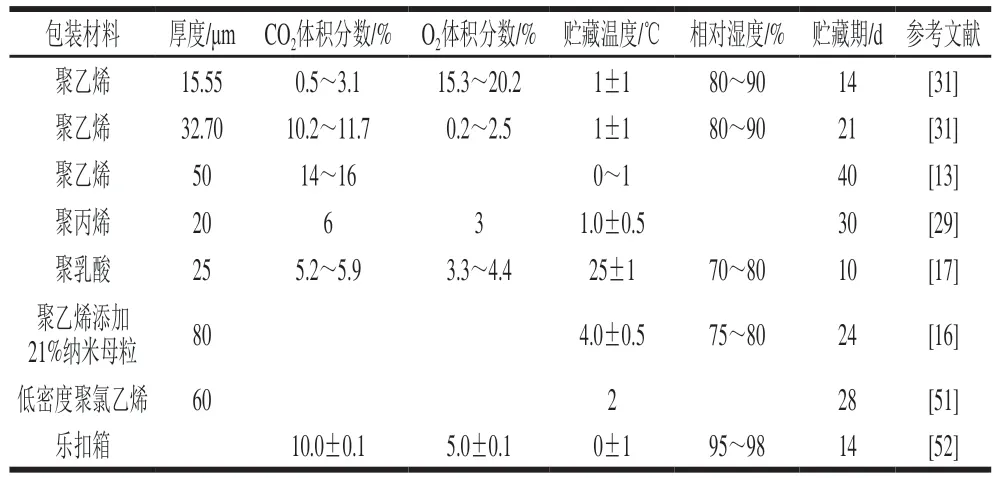
表1 不同条件下MAP贮藏黄花菜的保鲜效果Table 1 Different modified atmosphere packaging conditions for postharvest preservation of daylily
4.3 化学保鲜
4.3.1 1-甲基环丙烯
1-甲基环丙烯(1-methylcyclopropene,1-MCP)能够不可逆地与果蔬细胞的乙烯受体结合,通过阻断乙烯的作用与信号转导,强烈地抑制乙烯的生理效应,从而对呼吸代谢等多种生理代谢过程产生抑制。1-MCP处理能够减缓果蔬的成熟和软化,延缓花瓣组织膨胀压力的丧失和衰老。研究发现,经过250 μL/L 1-MCP处理的黄花菜可在室温(22~25 ℃)下贮藏7 d。1.5 μL/L 1-MCP结合冷库预冷处理的黄花菜可贮藏18 d,好花率提高,质量损失率、开花率和腐烂率降低。
4.3.2 植物生长调节剂
4.3.3 小分子信号物质干预保鲜
近年来研究证实,一些小分子信号物质对植物体具有重要的生理调节作用。Liu Dan等研究发现黄花菜在采后衰老过程中,内源性硫化氢(HS)产生量逐渐减少,HS动态平衡受到破坏。外源施用硫氢化钠(NaHS)释放HS熏蒸处理可降低黄花菜MDA含量,激活抗氧化酶,保持较高水平的总叶绿素和可溶性蛋白,延迟PCD,从而延缓黄花菜采后的衰老。甲烷(CH)也是一种信号分子,可以在多种非生物胁迫中保护植物组织免受氧化损伤。研究发现,内源性CH水平的升高能减缓黄花菜的衰老进程,而其水平降低会加剧衰老进程。外源施用CH可以显著降低黄花菜的呼吸速率,抑制组织褐变,极大地减缓黄花菜采后衰老进程。
4.4 辐照保鲜
通常使用γ射线、X射线或电子束对新鲜果蔬进行辐射处理,可抑制贮藏过程中发芽、微生物繁殖和病虫害的发生。研究发现,低剂量(0.5~1.0 kGy)Co放射源γ射线辐照相比高剂量(4.0~8.0 kGy)辐照,可以延长黄花菜贮藏时间,在相同辐射剂量时,不同剂量率(0.500、0.250、0.167 kGy/h)对保鲜效果没有影响。但有研究认为,1.0 kGy或更高剂量的γ射线辐照会使黄花菜花瓣表皮细胞受损。因此,黄花菜的辐照保鲜技术需更加细致地进行研究。
5 结 语
黄花菜营养丰富、品质独特,具有极高的食用价值与医疗保健作用。但鲜黄花菜采后极易泛黄、褐变、枯萎、腐烂,严重影响其经济价值。经过近年来的研究,人们对鲜黄花菜的生长、开放、衰老生物学机制有了一定的认识,从细胞学、分子生物学等方面解释了黄花菜衰老机制,探讨了采后保鲜的机理,开发了物理、化学的采后处理保鲜技术。然而,鲜黄花菜采后生物学研究还不够深入。目前,主要通过低温处理来延长贮藏期。因此研究鲜黄花菜采后衰老机制与贮藏保鲜技术对于促进黄花菜产业的发展具有重要意义。
基于黄花菜采后衰老的机制以及贮藏保鲜特性,建议应从以下几个方面着重研究:1)深入研究黄花菜内源激素的代谢水平和变化规律,以及外源激素对其采后衰老调控机理;2)加强黄花菜采后衰老分子水平的研究,筛选采后衰老等关键的调控因子,利用基因组学、转录组学、代谢组学等技术,从分子生物学层面揭示黄花菜采后衰老调控机制;3)开发新的贮藏保鲜技术,尝试低温贮藏与其他保鲜技术联合应用,通过协同作用达到更好的保鲜效果,并结合规范的冷链物流措施,延长鲜黄花菜的供应期。
