食源性晚期糖基化终末产物检测技术研究进展
2022-09-30李华韬张巧智倪皓洁王彦波刘福奇傅玲琳
李华韬,张巧智,倪皓洁,王彦波,刘福奇,傅玲琳,*
(1.浙江工商大学食品与生物工程学院,浙江食品质量安全工程研究院,浙江 杭州 310018;2.浙江工商大学实验室与资产管理处,浙江 杭州 310018)
热加工是食品工业中最为常见的处理手段,以此改善食品的风味、质地并保障产品安全性。在热加工过程中会发生一系列物理、化学和生物学变化。其中,美拉德反应(非酶糖基化反应)是一类发生在还原糖羰基与蛋白质(多肽/氨基酸)自由氨基间的聚合、缩合反应,常见于各类食品的热加工和贮藏过程中。美拉德反应进入中期阶段后,还原糖与游离氨基经过缩合、重排、裂解及氧化修饰等一系列复杂反应最终生成一类稳定的共价化合物,统称为晚期糖基化终末产物(advanced glycation end products,AGEs)。研究发现,食源性AGEs摄入后可在体内蓄积,导致体内AGEs水平的升高,进而危害人体健康。临床证据表明,高AGEs食物的摄入与糖尿病、慢性肾病、心脑血管疾病和神经退行性疾病等多种疾病的发生密切相关。
食物是人体摄入AGEs的主要来源,因此开展食源性AGEs的检测分析十分必要。目前,已针对各类AGEs开发出不同的检测方法,但随着对AGEs研究的不断深入,以及食品成分、加工手段和贮存方式的不断变化,有必要系统梳理各类AGEs检测手段的特点和应用情况,以便有针对性地开展分析和机理研究。鉴于此,本文结合国内外研究现状对食源性AGEs的产生与危害、结构与类型以及AGEs的检测分析技术进行综述,在此基础上,深入探讨不同检测技术的特点和优劣势,以期为后续食源性AGEs的检测技术发展和研究体系的形成提供参考依据。
1 AGEs的产生与危害
美拉德反应是一种非酶糖基化反应,主要发生在还原糖和带有游离氨基的分子,如氨基酸、多肽、蛋白质和核酸之间。美拉德反应作为食品加工过程中最常见的化学反应之一,广泛发生于各类食品的加工和贮藏过程中。通常,美拉德反应可分为3 个阶段:初期阶段、中期阶段和晚期阶段。在初期阶段,氨基与羰基通过缩合形成Schiff碱,进一步重排产生Amadori产物。在中期阶段,Amadori重排产物通过断裂、环化、Strecker降解等一系列反应生成醛、酮、二羰基和杂环类化合物。在晚期阶段,这些化合物进一步发生复杂的反应,包括缩合、脱氢、重排和异构化,最终转化为类黑素。在美拉德反应进入中期阶段后,会形成一系列可与蛋白质/多肽/氨基酸共价结合的异质性稳定化合物,统称为AGEs。
AGEs根据来源可分为外源性AGEs和内源性AGEs,其中食物是外源性AGEs的主要来源,也称作膳食AGEs,内源性AGEs是指在人体器官、组织和体液中发生糖基化反应形成的AGEs。膳食AGEs的摄入是机体内AGEs的主要来源,在现代饮食模式下,高温烹饪和过度食品加工使得食物中常伴有大量AGEs的形成,尤其是加工肉制品、精细加工谷物和高热量食物(如甜食、煎炸食品、快餐等)。大量研究表明,食品中的AGEs摄入并在体内蓄积后会对人体健康产生危害,这与衰老和多种慢性非传染性疾病的发生发展有关,如糖尿病、慢性肾病、心脑血管疾病、视网膜病变等。一般认为,AGEs进入体内后可以通过两种方式产生负面影响:一种是直接与体内的蛋白质发生交联反应,影响蛋白质的结构和正常生理功能;另一种是通过与多种细胞表面的AGEs特定受体(如AGEs受体(receptor for AGE,RAGE))结合,介导下游细胞信号通路,间接影响细胞的代谢和功能活性。常见的AGEs受体包括可诱导氧化应激和炎症反应的RAGE、负责清除AGEs的AGE-R1和清道夫受体等。AGEs与受体结合后,可激活多条下游信号通路,影响一系列细胞因子、趋化因子、生长因子和黏附分子的转录合成,进而影响细胞趋化、氧化应激、细胞增殖和程序性死亡等多种生理、病理学进程。在正常生理条件下,人体抗糖化防御机制会通过乙二醛酶等酶的作用和细胞内蛋白质的快速更新降解AGEs,减轻其造成的化学损伤。然而,在病理条件下这些防御机制会失效,AGEs开始累积并造成一系列不良后果,最终导致各种疾病的发生。Cai Weijing等分别用高水平和低水平AGEs饲料喂养小鼠,在第3代小鼠中发现,高水平AGEs饲料使小鼠体内AGE-R1水平显著降低,体质量增加并出现胰岛素抵抗,最终诱发糖尿病。Ying Lingwen等对1 471 名2型糖尿病患者进行研究发现,糖尿病视网膜病变与患者体内AGEs水平密切相关,AGEs可作为监测糖尿病视网膜病变进展的重要指标。除糖尿病患者,在对卵巢功能障碍等代谢性疾病患者的研究中也得到类似的结果,即高AGEs饮食与患者体内高水平的雄激素、抗缪勒管激素等具有统计学相关性。此外,氨基酸、肽和蛋白质的糖基化可增加血管壁胶原蛋白交联程度,这可能是AGEs与心血管疾病及其并发症密切相关的原因,如Fishman等发现AGEs在激活受体后会通过介导复杂的信号转导通路,诱发并加重炎症、氧化应激、增加钙沉积和血管平滑肌细胞的凋亡,从而促进动脉粥样硬化的发生。此外,临床证据还表明AGEs水平是阿尔茨海默症和帕金森症等神经退行性疾病的关键影响因素,大脑中过量的AGEs蓄积会诱导Tau蛋白磷酸化,加重氧化应激,造成脑细胞氧化损伤。综上可知,体内AGEs的过量积累可诱发多种慢性疾病,但关于AGEs在体内的生物利用度、代谢以及与生物大分子相互作用的机制尚未阐明,有待进一步研究。
2 AGEs的结构和类型
AGEs结构复杂多样,目前已被鉴定和表征的AGEs超过40 种,其中在食品中发现的约有15 种。从反应进程上看,AGEs是由还原糖自氧化和初期美拉德产物裂解形成的活性羰基中间体与蛋白质(多肽/氨基酸)自由氨基反应形成。常见的羰基中间体有4 种:乙二醛(glyoxal,GO)、甲基乙二醛(methyglyoxal,MGO)、3-脱氧葡萄糖醛酮(3-deoxyglucosone,3-DG)和丁二酮。不同的羰基化合物与不同的氨基反应会生成不同物质,最终形成复杂的AGEs产物(图1)。根据AGEs连接基团是游离氨基酸还是蛋白质/多肽,可将其分为游离态和结合态AGEs;根据所交联氨基酸(残基)种类可将其分为赖氨酸衍生AGEs、精氨酸衍生AGEs以及赖氨酸和精氨酸共同衍生的AGEs;而根据所交联氨基酸个数又可将其分为非交联型AGEs和交联型AGEs。
在赖氨酸衍生的AGEs中,GO作为中间体形成的羧甲基赖氨酸(-(carboxyethyl)-lysine,CML)是食品中发现的第一种AGEs,同时也是食品中普遍存在的一种AGEs;与其他AGEs相比,CML具有更高的酸稳定性,其含量与食品中AGEs总含量直接相关,因此可被作为衡量食品中AGEs含量的主要指标。羧乙基赖氨酸(N-(carboxyethyl)-lysine,CEL)是CML的结构类似物,是由MGO与赖氨酸反应形成。此外,吡咯啉是食品中另一种主要的AGEs,属于吡咯衍生物,其结构含有赖氨酸的N-氨基。除赖氨酸衍生的AGEs外,精氨酸分别与MGO、GO和3-DG反应可生成甲基乙二醛-羟基咪唑酮异构体(methyglyoxal-derived hydroimidazolones,MG-H)1、MG-H2、MG-H3、乙二醛-氢咪唑酮(glyoxal-derived hydroimidazolone,G-H1)和3-脱氧葡萄糖醛酮-二羟基咪唑啉(3-deoxyglucosone-derived dihydroxyimidazoline,3DG-H1);此外,两个MGO与精氨酸反应可衍生出精嘧啶。上述AGEs只连接一个氨基酸残基,均为非交联型产物,而交联型AGEs可与多肽链内或多肽链间的两个氨基酸基团连接。例如,MGO、GO和3-DG分别与两个赖氨酸反应可形成甲基乙二醛-赖氨酸二聚体(methylglyoxal-derived lysine dimer,MOLD)、乙二醛-赖氨酸二聚体(glyoxal-derived lysine dimer,GOLD)和3-脱氧葡萄糖醛酮-赖氨酸二聚体(3-deoxyglucosonederived lysine dimer,DOLD),类似反应发生在一个赖氨酸和一个精氨酸残基之间可形成甲基乙二醛赖氨酸-精氨酸二聚体(imidazolium cross-link derived from methylglyoxal and lysine-arginine,MODIC)、乙二醛赖氨酸-精氨酸二聚体(imidazolium cross-link derived from glyoxal and lysine-arginine,GODIC)和3-脱氧葡萄糖酮赖氨酸-精氨酸二聚体(imidazolium cross-link derived from 3-deoxyglucosone and lysine-arginine,DODIC)。同样地,戊糖素由戊糖与蛋白质的赖氨酸和精氨酸残基共同反应产生,其本身具有杂环结构,因而具有自发荧光。值得注意的是,目前两个精氨酸残基之间的交联结构还未被发现,有待进一步研究。由此可见,AGEs种类复杂繁多,各类AGEs由于侧链结构的不同而具有不同的紫外和荧光光学特性。Poulsen等对各类食品中的AGEs进行系统性综述。图2所示为常见的15 种食源性AGEs结构,表1汇总了各类食源性AGEs的光学特性。
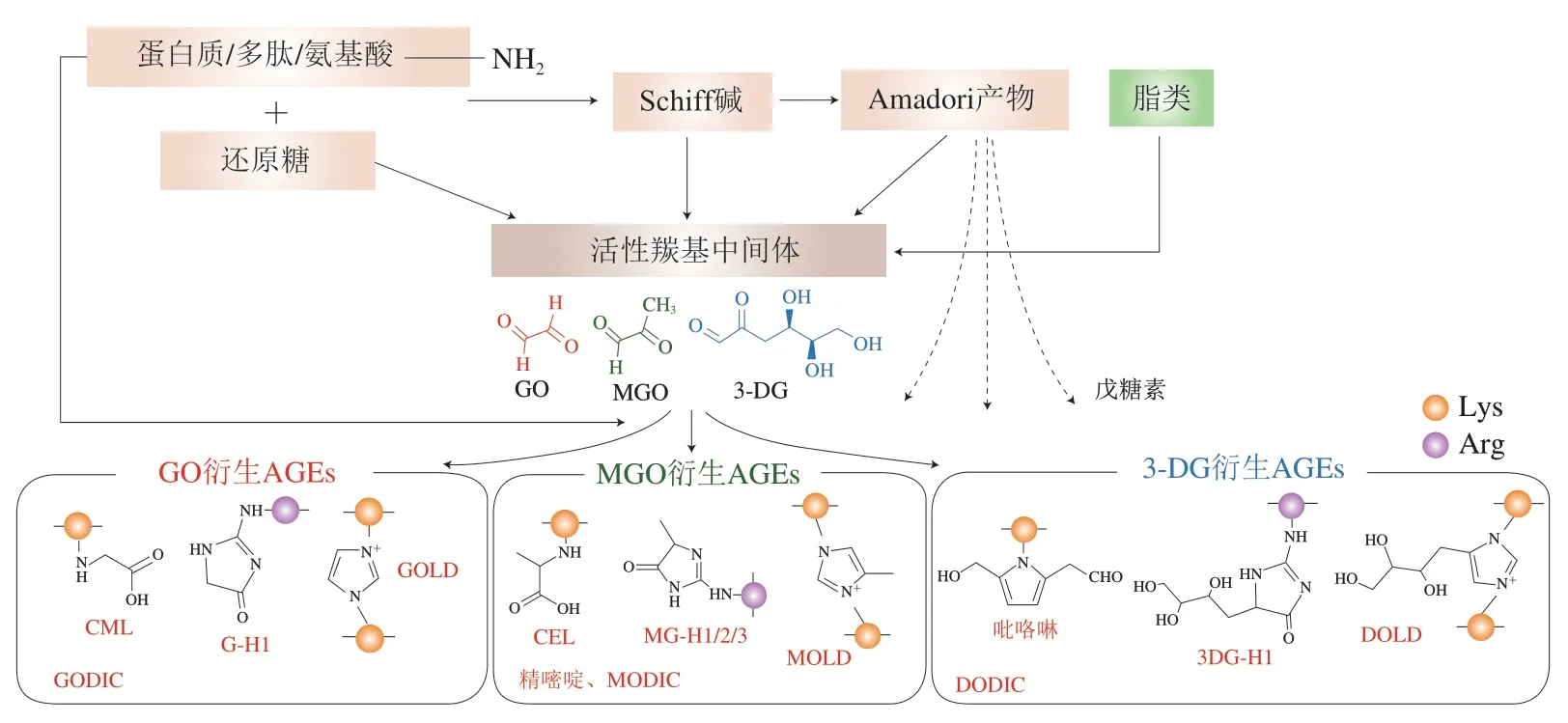
图1 不同活性羰基中间体与各典型AGEs的形成关系Fig. 1 Relationship between different dicarbonyl compounds and down-stream formation of typical AGEs

图2 常见15 种食源性AGEs的结构示意图Fig. 2 Structures of 15 common dietary AGEs
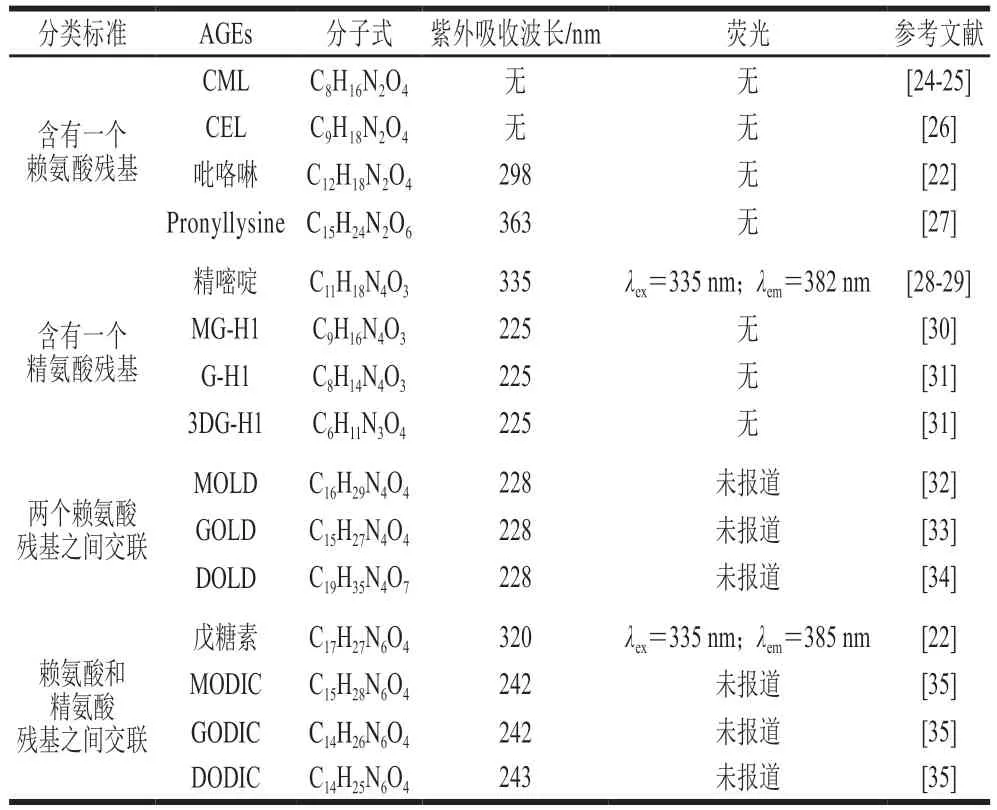
表1 常见15 种食源性AGEs的光学特性Table 1 Dietary AGEs and their optical properties
3 食源性AGEs的检测分析技术
针对食源性AGEs开展检测分析和危害控制等方面的研究十分必要。食品基质复杂,不同原料成分如蛋白质或糖类等可能通过多种途径产生AGEs。目前已知的AGEs化合物种类繁多,其结构和存在形式各异,因此需要有针对性地建立合适的分析技术检测食品中的不同AGEs。
3.1 样品预处理方法
为准确定量食品中的AGEs,检测前需先对样品中的AGEs进行分离和纯化。AGEs通常以游离态或与蛋白质/多肽交联的结合态形式存在。对于游离态AGEs,因其具有较强的极性和优异的水溶性,一般用水或极性溶剂提取即可。如有需要,还需先分离除去样品中的脂肪,沉淀蛋白质,取上清液进行固相萃取除杂后进行检测。Nomi等在检测酱油和啤酒中的游离AGEs时,使用磺基水杨酸水溶液作为提取溶剂,将样品离心沉淀后除去蛋白质,取上清液通过C固相萃取柱纯化后进行色谱定量分析。Scheijen等分别使用三氟乙酸和氯仿-甲醇(2∶1,/)进行脱脂,通过比较在牛乳、白面包和番茄酱基质中的回收率,发现采用后者的脱脂效果更佳。除此之外,正己烷、丙酮和三氯乙酸等也可用作预处理中脂肪的萃取溶剂。
为全面准确定量AGEs,不仅需要检测游离态AGEs,还需提取结合态AGEs,因此需要将蛋白质彻底水解成短链肽或游离氨基酸,以释放其中的结合态AGEs。常用的水解方法有酸水解法和酶解法两种。酸水解法一般使用盐酸,在酸水解前,需向样品中加入还原剂硼氢化钠(NaBH)以防止水解过程中早期美拉德反应产物果糖赖氨酸氧化生成CML造成结果误判,然后用6 mol/L HCl溶液在110 ℃下水解20~24 h。该方法适用于对酸稳定的AGEs(如CML、CEL),但不适用于酸性条件下不稳定的AGEs(如吡咯啉)。酶解法常用的酶有胃蛋白酶、链霉蛋白酶E、脯氨酸肽酶和氨基肽酶等,实际操作时往往会将特异性不同的蛋白酶组合以保证蛋白质彻底水解。Zhu Rugang等采用胃蛋白酶等多种蛋白酶水解婴儿配方乳粉,分析并测定AGEs(游离态和结合态)总含量。Jost等在检测面包中AGEs时将每个样品同时经酸水解和酶水解处理,比较后发现,对于酸稳定的AGEs,酸水解法的效率高于酶解法。
3.2 酶联免疫吸附测定法
酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)作为一种常见的免疫分析方法,其原理是基于抗原-抗体特异性结合和酶促底物反应产生的吸光度变化定量样品中的目标物。以竞争ELISA法检测AGEs时,首先将抗原包被在微孔板上,加入食物样品和酶标抗体,待抗原-抗体反应发生后,添加酶反应底物,底物被酶催化发生颜色变化,利用酶标仪检测吸光度,通过AGEs含量与吸光度关系得到定量结果。由于酶催化效率很高,免疫反应结果被间接放大,因此ELISA具有很好的灵敏度和特异性。1999年Tauer等首次报道了一种无需对样品净化处理即可直接检测加热乳制品中CML含量的竞争ELISA法,但该方法使用的抗体特异性表位表征不充分,容易造成假阳性结果,且无法检测不溶性组分中的CML。对此方法进行改进后,Goldberg等将食品样品均质化并溶解在磷酸盐缓冲液中,使用充分表征的抗CML单克隆抗体,通过竞争ELISA法测定250 种常见食品中的CML含量,初步构建了膳食AGEs数据库。在此基础上,Uribarri等将食品种类增加到549 种,同时使用抗CML和抗MGO单克隆抗体,进一步丰富了膳食AGEs数据库,证明了食品原料中宏量营养素的组成和加工方式是影响AGEs形成的关键因素。值得指出的是,ELISA法容易受到样品预处理方法、食品基质以及抗体与非靶向表位交叉反应的影响,导致检测结果发生偏差。例如,Tareke等发现酸水解预处理会使ELISA法检测燕麦粥样品中的CML含量偏低。此外,有研究发现,因抗体在亲脂性基质中的溶解性较低,富含脂肪的食品基质会导致AGEs含量测定结果偏高,富含淀粉的基质则会导致AGEs含量测定结果偏低。
3.3 仪器分析法
3.3.1 荧光光谱
各类AGEs由于化学结构不同而具有不同的光学特性。一般含有氧杂萘邻酮、喹喔啉酮和苯并噁嗪酮结构的AGEs具有荧光特性(如精嘧啶、戊糖素等(表1)),因此可以通过荧光光谱法检测这类AGEs的含量。房红娟等利用荧光光谱法检测当地19 种日常消费食品中的AGEs含量,采用激发波长370 nm、发射波长440 nm,结果表明高蛋白和高脂肪食品(如肉类、饼干、巧克力等)相较于高水分和高碳水化合物食品(如苹果、可乐、方便面等)的荧光AGEs含量更高。Chhabra等使用荧光光谱法,在激发波长355 nm、发射波长440 nm下检测食用油中的荧光AGEs含量。AGEs荧光光谱的激发波长一般在300~420 mm,发射波长在350~600 mm。Wu Runlin等将仪器参数设置为激发波长345 nm、发射波长350~550 nm,对油炸鱼块中的荧光AGEs进行检测,发现随油炸时间延长鱼块表面形成的AGEs含量增加,表明加工条件对AGEs含量影响显著。荧光光谱法操作简单但缺乏特异性,使用荧光强度间接反映AGEs含量,检测结果容易受到其他荧光物质的干扰。
3.3.2 高效液相色谱
高效液相色谱(high performance liquid chromatography,HPLC)是一种高灵敏度的色谱检测技术,所用检测器有二极管阵列检测器(diode array detector,DAD)、荧光检测器(fluorescence detection,FLD)等。Poojary等将牛乳样品经酶水解处理后,采用HPLC-DAD检测其中吡咯啉含量。然而此方法仅适用于具有紫外光吸收特性的AGEs(如吡咯啉、GOLD、MOLD等)。对于具有荧光特性的AGEs,可使用HPLCFLD进行检测。但对于非荧光AGEs(如CML),则需先通过衍生化得到具有荧光特性的AGEs衍生物,然后在反相柱中分离,最后使用FLD分析相应AGEs衍生物。Chen Gengjun等以邻苯二甲醛为衍生剂,分别与鸡、猪、牛和鱼肉的水解产物混合反应5 min,然后采用HPLC-FLD进行检测,根据衍生物峰面积确定不同样品中的CML含量。样品在酸水解和衍生化等复杂预处理后容易引入杂质造成干扰,为考察方法的准确度,Kul等利用HPLC-FLD检测熟肉制品中的CML含量,通过添加CML标准品和同位素内标物验证该方法的回收率为95.92%~105.16%,具有良好的准确度。总体上,HPLC检测方法稳定、可靠,但由于许多常见的AGEs不具有紫外或荧光光学特性,需要衍生化处理,因此其应用范围受到限制。
3.3.3 气相色谱-质谱联用技术
由于样品在气相中流动速率较快,样品组分经过色谱柱后可被迅速分离,因此气相色谱(gas chromatography,GC)分析效率较高。经GC分离后的气体化合物联合质谱(mass spectrometer,MS)鉴定可对目标物进行定量分析。GC-MS已被用于测定不同食品中CML含量,如油炸鱼饼、烤荞麦等。衍生化是GC-MS分析前的关键步骤,对检测结果的准确性影响显著,Prestel等在检测牛乳中CML含量时,对衍生化试剂、溶剂、温度和时间进行优化,最终选择乙腈为溶剂,将样品在80 ℃下甲硅烷基化45 min,然后采用GC-MS进行分析,得到最佳衍生物峰,计算结果具有更高准确度。GC-MS具有高效率、高分辨和高灵敏度等优点,但是在分析前需通过三氟甲基酯等试剂对AGEs进行衍生化,预处理过程复杂且回收率低,因此GC-MS不适用于大批量食品中AGEs的检测分析。
3.3.4 液相色谱-串联质谱技术
近年来,越来越多的研究人员将液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LCMS/MS)应用于食源性AGEs的检测。LC-MS/MS将LC对复杂样品组分的高分离能力与MS/MS的高灵敏度、高选择性和高准确度相结合,可高效准确地检测食品中的AGEs。常见的MS技术包括离子阱质谱(ion trap mass spectrometer,ITMS)、三重四极杆质谱(triple quadrupole mass spectrometer,QqQ-MS)和四极杆飞行时间质谱(quadrupole time-of-flight mass spectrometry,Q-TOF-MS)等。ITMS和QqQ-MS结构不同但原理类似,均通过选择母离子和子离子将特异性子离子的强度信号转化为色谱峰面积进行定量;而Q-TOF-MS则根据不同质荷比离子穿过飞行管的速率不同达到分离效果,将飞行时间转化为信号强度进行定量。在定量分析物时,MS/MS常采用多反应监测模式,即在样品离子化后选择特异性母离子,通过碰撞将其分裂成子离子,然后仅选择特异性子离子采集MS信号,最后通过统计分析获得定量结果。Gomez-Ojeda等采用不同烹饪方式处理马铃薯、肉类和鱼类,采用传统ELISA法无法检测出其中CML含量的变化,但是利用LC-ITMS/MS可以测出样品CML含量的微小差异,表明方法灵敏度较高,但该方法相对标准偏差为1.20%~16.40%,精密度有待提高,这是由于ITMS存在空间电荷效应,样品中杂质越多效应越强,因此对于复杂食品基质,QqQ-MS是更优的选择。基于此,Yu Jingjing等使用HPLC-QqQ-MS/MS建立烟草产品中CML和CEL的定量分析方法,该方法的检出限分别为0.36 ng/mL和0.25 ng/mL,日内和日间精密度分别低于6.3%和9.7%,加标回收率为88.7%~120.0%。
上述研究工作的色谱分离均采用C色谱柱。由于AGEs为高极性化合物,在C色谱柱中的保留效果和分离度均不理想,通常需要添加离子对试剂(如全氟戊酸)提高其保留性,但离子对试剂对色谱柱和仪器会造成一定损害。鉴于此,杨明等建立煎炸植物油中CML和CEL含量的HPLC-MS/MS检测方法,比较C、HILIC和氨基酸3 种色谱柱的分离效果,发现氨基酸色谱柱不仅对AGEs有较好的保留效果,而且实现了有效分离。此外,该方法还优化了流动相体系、MS条件等,提高了检测结果的准确性和可靠性。HPLC-MS/MS虽然准确可靠,但在面对日常食品的大批量检测时,需要更加快捷高效的检测方法。
为实现大批量样品中AGEs的高效定量分析,超高效液相色谱-质谱联用(ultra-performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)技术受到研究者们的关注。相较HPLC,UPLC系统可承受103~124 MPa高压,可在更宽的液体流量范围内工作,在很大程度缩短分析周期的同时确保有良好的分离效果,是一种灵敏度和效率更高的检测技术。Hull等根据西方饮食模式选择了257 种食物,采用UPLC-MS/MS法检测各类食品中的CML含量,并结合膳食调查评估人均CML摄入水平,为消费者减少膳食CML的摄入提供了重要参考。在此基础上,Scheijen等对方法学进行调整,实现了一次性分析食品中CML、CEL和MG-H1这3 种主要AGEs的含量,然后对190 种食品中3 种AGEs进行定量分析,进一步丰富了膳食AGEs数据库,为设计低AGEs和高AGEs饮食干预研究奠定了基础。上述研究结果表明UPLC-MS/MS可用于谷物、肉类、蔬菜和乳制品等10余种加工食品类别,具有广泛且良好的适用性。除此之外,该方法也可用于研究烹饪方式对食品中AGEs的影响。朱玉洁采用UPLC-MS/MS方法并优化样品预处理条件(加入还原剂并用固相萃取柱除杂),发现煎炸食品中CML和CEL的生成量与煎炸温度和时间存在显著相关性。随着食品工业的发展,越来越多的新型加工方式相继出现,针对不同烹饪方式影响膳食AGEs形成还有待深入研究。
与其他色谱方法相比,UPLC-MS/MS检测食品中AGEs的优势突出,但仍存在不足,在检测一些复杂基质样品时会受到基质效应的干扰导致误差。因此,基于同位素稀释法的UPLC-MS/MS成为目前检测食品中AGEs的最佳方法。通过在样品中定量添加稳定同位素内标,使其与样品充分混合,通过MS法测定同位素丰度比,再依据同位素稀释原理定量待测物质含量。该技术可有效避免样品基质中其他因素的干扰,具有绝对定量性质,且灵敏度、分析精度高(图3)。Poojary等建立一种基于同位素稀释法的UPLC-MS/MS方法,用于同时定量加工食品和生物样品中的各类AGEs化合物。该方法采用反相C色谱柱分离,添加9 种稳定同位素标记的内标,使用Orbitrap对15 种AGEs及其他美拉德反应产物共20 种分析物进行定量,并在超高温瞬时灭菌乳、烤鸡胸肉、烤鸡皮和牛血浆等6 种基质中验证方法的准确性,结果表明,该方法具有良好的线性、准确度、精密度和重现性,为全面分析食品和生物基质中多种AGEs提供了重要手段。此外,该团队通过此方法探究绿茶提取物对牛乳贮藏过程中14 种AGEs含量的影响,揭示了多酚对AGEs衍生过程的影响,这为利用天然化合物抑制食品中美拉德反应和AGEs形成的机制研究提供了新思路。Cheng Weiwei等建立了基于稳定同位素稀释的UPLCQqQ-MS/MS方法,用于同时检测烘焙和油炸食品中CML、CEL和丙烯酰胺的含量,通过计算基质效应参数,进一步验证了该方法的准确性和适用性。该研究创新性地将AGEs与丙烯酰胺进行同步测定,有助于更准确地评估食品安全性。此外,利用该方法高灵敏度等特点,徐正华等对来自不同国家三文鱼中的AGEs含量进行检测,发现CEL含量可作为挪威三文鱼的产地特征因子用于区别智利和法罗群岛三文鱼,其检出限为0.032 7 ng/g,该研究成果为食品产地信息溯源以及真伪鉴别提供了新思路。

图3 基于同位素稀释法的LC-MS/MS原理示意图Fig. 3 Schematic illustration of the principle of isotope dilution LC-MS/MS
表2汇总了若干仪器分析方法测定不同食品中AGEs含量的结果。
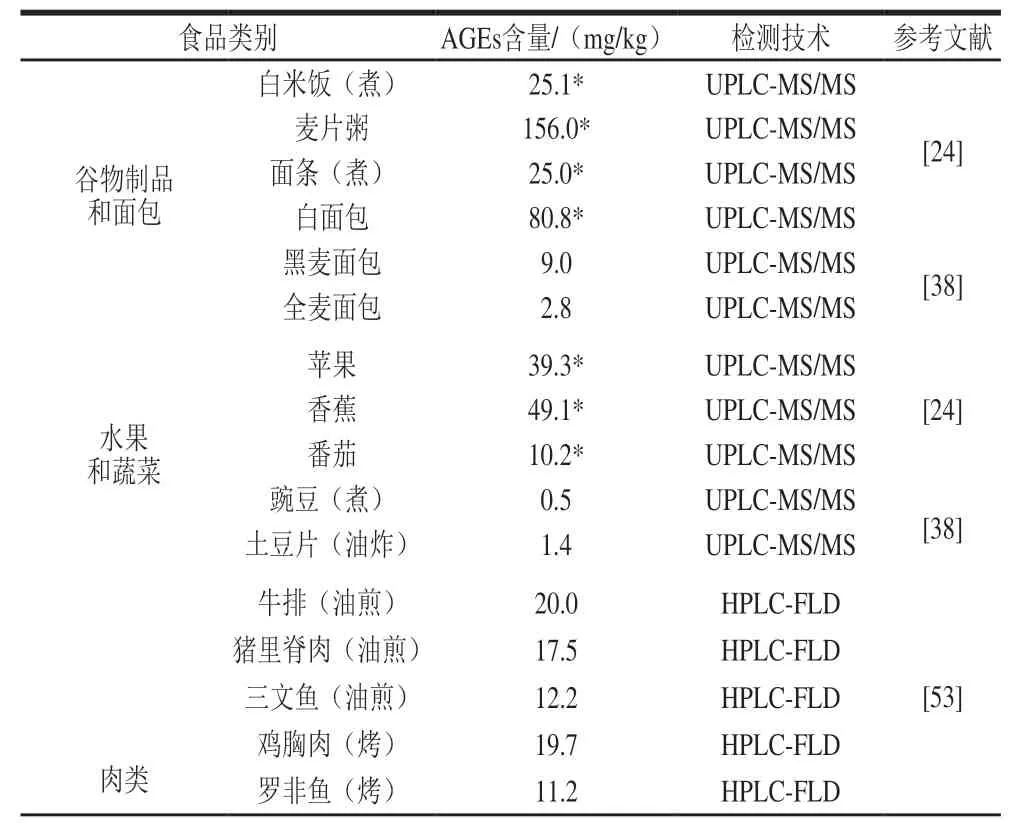
表2 仪器分析方法测定不同食品中AGEs含量的结果Table 2 Instrumental determination of AGEs in different foods
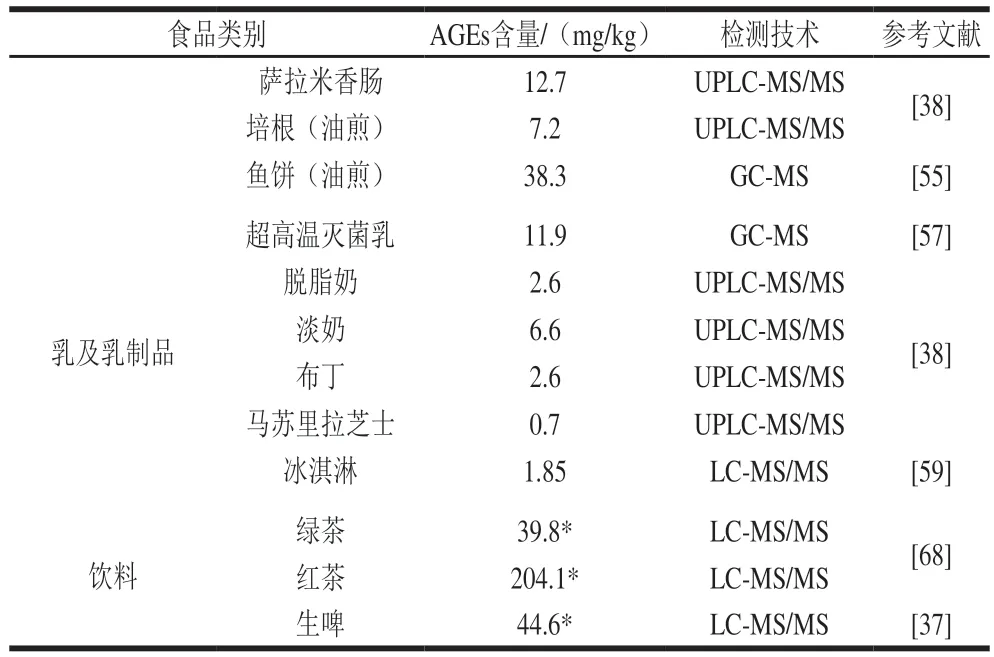
续表2
3.3.5 生物传感器技术
近年来,基于分子印迹的生物传感器技术作为一种低成本、简单快速的检测方法,已被应用于检测食品中特定AGEs的含量。通过分子印迹技术制备的分子印迹聚合物(molecularly imprinted polymer,MIP)对模板分子具有特异性识别能力,可以实现高选择性的精确定量检测。Liu Huilin等通过反相微乳液法以CML为模板分子制备基于半导体纳米材料-疏水性量子点的新型MIP,开发基于此MIP的荧光传感器用于测定面包、巴氏杀菌乳和婴幼儿配方乳粉中的CML含量,通过HPLC-MS进一步验证该方法的准确性和重现性。结果表明,该荧光传感器易于制备且成本较低、特异性和灵敏度高,待测样品预处理步骤简单,这为方便、快速、准确定量食品中的AGEs提供了新技术方案。相较于其他方法,上述生物传感器检出限较高,不建议检测食品中痕量AGEs。
4 食源性AGEs检测技术应用优势比较
目前可用于食源性AGEs的检测方法很多。ELISA法灵敏度高、检测速率快,适用于大量样品检测,但是需要选择特定抗体,目前市场中商业化抗体均为针对检测CML制备,暂无针对其他类型AGEs的特异性抗体可供使用。此外,利用ELISA定量的结果均以KU/100 g(以食品质量计)表示,并非样品中AGEs的绝对含量,而使用LC-MS/MS等仪器分析的结果一般表示为mg/kg(以蛋白或食品质量计),两种方法对结果的表达方式不同,数据间难以分析比较。同时,有研究指出ELISA检测结果往往无法通过仪器分析方法重现,这可能是因为美拉德反应产物复杂多样,样品基质中存在交叉反应物质,而ELISA易受到这些杂质干扰导致假阳性/假阴性的出现。因此,对于免疫分析方法,有必要针对特异性抗体的靶向表位、交叉反应性、基质效应和前处理方法等方面进行改良和优化,以提升这类方法在检测食品中AGEs时的适用性和准确性。
在仪器分析方法中,荧光光谱法虽然成本较低、灵敏度和选择性好,但仅能分析具有自发荧光特性的AGEs,不能分析非荧光类AGEs。此外,荧光光谱对检测样品试剂要求严格,检测时需注意避免被外界环境因素污染荧光影响准确度,这一定程度限制了该方法的应用。目前,色谱类技术因其出色的灵敏度、准确性和精密度受到研究人员青睐。HPLC-DAD或HPLC-FLD可以对具有特定紫外吸收或荧光特性的AGEs进行定量分析;其他AGEs则需经过衍生化,使其具备特有的光学特性才能被定量检测。在使用GC-MS时,测试样品同样需要繁琐的柱前衍生化处理,而衍生化试剂等的选择不当会导致衍生化不完全、衍生物不稳定等,影响检测结果。
LC-MS/MS技术具有适应性广、分离和定性定量能力强等优势,在AGEs检测领域的应用备受关注。与HPLC-MS/MS相比,UPLC-MS/MS具有更好的选择性、灵敏度、精密度和回收率,而且分析周期大大缩短,这极大提高了分析效率。但是上述方法的样品预处理过程均较复杂,在检测时也易受到不同食品基质的干扰和影响。基于同位素稀释法的UPLC-MS/MS法可以有效规避基质效应和其他样品处理过程带来的误差,提高检测准确性,因此被认为是同步准确定量食品中多种AGEs的最佳手段。但是,这类大型仪器分析设备成本高、价格昂贵、耗时长,且对操作人员要求高,这在一定程度限制了其推广应用。因此,有必要开发方便快速、低成本、高灵敏度的AGEs检测技术。例如,基于MIP的荧光传感器成本低且易于制备,是近年来新兴的AGEs检测方法之一,这类方法具有良好的发展前景,或将成为未来AGEs检测技术的发展方向。
不同AGEs检测方法的优缺点如表3所示。

表3 不同AGEs检测技术的优缺点比较Table 3 Comparison of different techniques for detecting AGEs
5 结 语
食品加工过程中美拉德反应赋予了食品独特的风味、颜色和质地,但这一过程往往伴随着大量AGEs的形成。消费者摄入过量食源性AGEs会对机体健康构成潜在危害,因此检测加工食品中AGEs含量对保证食品品质和人体健康方面至关重要。随着研究的深入,各类检测方法的准确度和灵敏度逐步得到提升,与免疫分析方法相比,仪器分析方法尤其是LC-MS联用技术具有更好的选择性、回收率、重复性和准确性等。然而,现有研究大多局限于少数几种代表性AGEs,如CML、CEL等,如何全面快速检测食品中各类AGEs含量,探究不同食源性AGEs的形成机理和分布特征仍是该领域面临的挑战。此外,简化样品预处理方法,优化针对不同基质的预处理手段,提升AGEs检测效率,也是当前亟需解决的问题。本文针对各种检测方法进行讨论并对优缺点和发展方向进行总结,可为进一步改进现有检测手段或开发新的AGEs检测技术提供参考和借鉴。
