乳铁蛋白调控脂肪细胞发育代谢的研究进展
2022-09-30王文利程智美戴蕴平张雅丽
安 芹,汪 雄,王文利,程智美,戴蕴平,张雅丽,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.中国农业大学生物学院,北京 100083)
肥胖是世界范围内一种主要的流行病,通常与代谢异常有关,主要特征是由前脂肪细胞的增殖和分化引起的脂肪细胞体积膨大以及脂肪细胞数量增加,从而导致脂肪组织过度积累。成熟的脂肪细胞可以分泌多种脂肪细胞因子和炎症因子,过量的炎症因子则会导致机体产生多种代谢性疾病,如高血压、高血脂、胰岛素抵抗、糖尿病、冠心病、脂肪肝和心脑血管疾病等并发症。
近年来,研究发现作为母乳中重要成分的乳铁蛋白(lactoferrin,LF)具有多功能生物活性,可能是母乳喂养有利于婴儿健康的原因之一。临床研究发现,LF成功完整地通过人体上消化系统并非难以实现,这取决于食物摄入形态是液态还是固态,以及与什么食物同时摄入有关。婴幼儿的消化系统发育尚未成熟,所以LF更容易完整地到达肠道。LF作为一种高附加值的食品配料越来越受到重视,除了可以添加到婴儿配方奶粉中之外,LF还被认为在对抗肥胖方面可能起到重要作用。采用药物、手术和饮食控制等方法治疗肥胖大多存在降低机体免疫力、毒副作用大、容易反弹等缺点。全面地了解导致肥胖的机制可以促进更加有效的靶向治疗技术发展。因此,探讨LF对脂肪细胞的增殖分化、脂质代谢、炎症反应的调节作用及其分子机制具有重要的意义。
1 乳铁蛋白
LF是一种多功能的单多肽链糖蛋白,在生物体中广泛存在,如乳汁、唾液、精液和黏膜表面等,几乎所有的体液中都含有LF,LF最丰富的来源是乳汁,特别是初乳。LF在结构上与血清转铁蛋白相似,具有大约60%的序列同源性,可以可逆地结合铁离子(Fe),所以LF也被归类为转铁蛋白。来自哺乳动物的LF具有相似的氨基酸序列,人乳铁蛋白与牛乳铁蛋白(bovine lactoferrin,BLF)的序列同源性约为70%,而人与黑猩猩乳铁蛋白的序列同源性约为97%。LF一级结构的相似性提示其在不同物种中具有类似的生物学功能。LF除了对铁具有高亲和性外,还具有抗菌、抗病毒、抗炎和抗癌等多种生物学活性。因其多种免疫功能,LF被视为是一种宿主防御介质。LF被越来越多地认为是一种安全且有效的活性成分,商业上可用的LF主要是从牛乳中提取,被广泛应用于食品、医疗、化妆品等领域。例如,LF添加到婴儿配方奶粉中可以有效提高婴儿免疫力,预防婴儿体质变弱;LF制备的纳米粒子载体可以有效保护铁等微量营养素;LF还可以通过抑制黑色素的产生、促进胶原蛋白的生成,达到美白、护肤的效果。
研究发现在肥胖患者中,LF基因在脂肪组织中的表达水平明显偏低,其表达水平与脂肪生成和胰岛素相关基因表达有关,并且与炎症标志物表达水平呈负相关。脂肪组织中LF的来源主要是脂肪细胞,LF基因在脂肪组织中的表达可能与脂肪细胞生理活动有关。动物研究表明,LF可以参与调节脂肪细胞的生长和分化,对于脂质代谢具有调控作用,可能与调控脂肪发育代谢相关基因的表达水平有关,但是具体的调节机制需要进一步验证。
2 脂肪细胞
脂肪组织被认为是内分泌器官,在2型糖尿病和癌症等疾病中起着重要作用。脂肪组织缺乏又称脂肪营养不良,而脂肪组织过量会导致肥胖。脂肪组织在调节人体能量平衡和营养稳态方面发挥着重要作用,主要由脂肪细胞、成纤维细胞、血管内皮细胞、组织细胞和间充质干细胞等组成。根据沉积部位,可以将脂肪组织分为皮下脂肪组织、内脏脂肪组织和异位脂肪组织。皮下脂肪组织主要起到提供热量以及储存能量的作用,内脏脂肪组织分布在脏器周围,对内脏器官具有支撑、稳定和保护的作用。相较于皮下脂肪组织,内脏脂肪组织具有更强的代谢活性,被认为是主要的促炎组织,可以产生多种脂肪因子和炎症介质,更容易引起高血压、血脂异常等代谢综合征。异位脂肪组织的产生是由于脂代谢紊乱,如高脂饮食导致产生过多游离脂肪酸,进而导致脂质在肝脏、肌肉等非脂肪组织中沉积。皮下脂肪组织无法扩张时会引起内脏和异位脂肪组织的堆积,内脏脂肪组织和异位脂肪组织均具有明显的代谢特性,是导致心血管疾病和代谢风险的主要因素。根据颜色、形态、结构和功能的不同,脂肪组织又可以分为白色脂肪组织(white adipose tissue,WAT)和棕色脂肪组织(brown adipose tissue,BAT)。皮下白色脂肪有腹股沟脂肪、腋下脂肪和甲状腺旁脂肪等,内脏白色脂肪有附睾旁白色脂肪、肠系膜周围脂肪和肾周脂肪等。其中,典型的皮下白色脂肪为腹股沟脂肪,典型的内脏白色脂肪为附睾脂肪,肩胛下棕色脂肪为典型的棕色脂肪。WAT是一种重要的内分泌器官,其中的脂肪细胞主要是由圆形的大脂滴和边缘的细胞质和细胞核组成,以甘油三酯的形式储存多余的能量,主要通过分泌脂肪因子、炎症因子影响机体代谢。而BAT中的脂肪细胞主要是通过线粒体解偶联蛋白-1(uncoupling protein-1,UCP-1)发挥产热、耗能作用。脂肪组织可以从体质量的2%~3%增加到60%~70%,其质量增加涉及多种机制,包括脂肪干细胞增殖、脂肪细胞数目增加、脂肪细胞体积增大等。
脂肪细胞来自于脂肪组织中存在的与骨髓基质一样的间充质干细胞,此干细胞被称为脂肪源性干细胞(adipose-derived stem cells,ADSCs),具有活力持久、能够自我更新和多向分化等特征。脂肪细胞寿命有限,ADSCs会不断分化为新的脂肪细胞,成年人的脂肪细胞数量处于动态平衡状态。ADSCs可以在保持干细胞活跃增殖特性的同时,在成脂信号因子的刺激下分化为脂肪细胞前体,也称为前脂肪细胞。脂肪细胞前体经过反复接触抑制及细胞融合等阶段,在成脂诱导条件下开始分化为不成熟的脂肪细胞,并最终完成向成熟脂肪细胞的完全分化。即脂肪细胞的成脂分化过程为ADSCs、脂肪细胞前体、不成熟的脂肪细胞、成熟脂肪细胞,具体过程如图1所示。在分化的过程中,脂肪细胞形态发生改变,开始是成纤维细胞样,之后细胞体积变大成圆形或者类似圆形,细胞质中出现小脂滴,因此这个阶段的细胞也被称为多小室脂肪细胞,即不成熟的脂肪细胞;在脂肪细胞分化后期,脂滴逐渐增大并合并成大的脂滴,引起脂质堆积,从而获得成熟脂肪细胞的形态特征,即脂肪细胞形态由梭形完全变成圆形,并失去分裂增殖能力,此阶段细胞称为单室脂肪细胞,即成熟的脂肪细胞。成熟的脂肪细胞可以表达分泌多种脂肪细胞因子和炎症因子,如瘦素、脂联素、白细胞介素(interleukin,IL)-6、IL-8、单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等,作用于不同的组织器官,引发炎症,进而引起疾病。
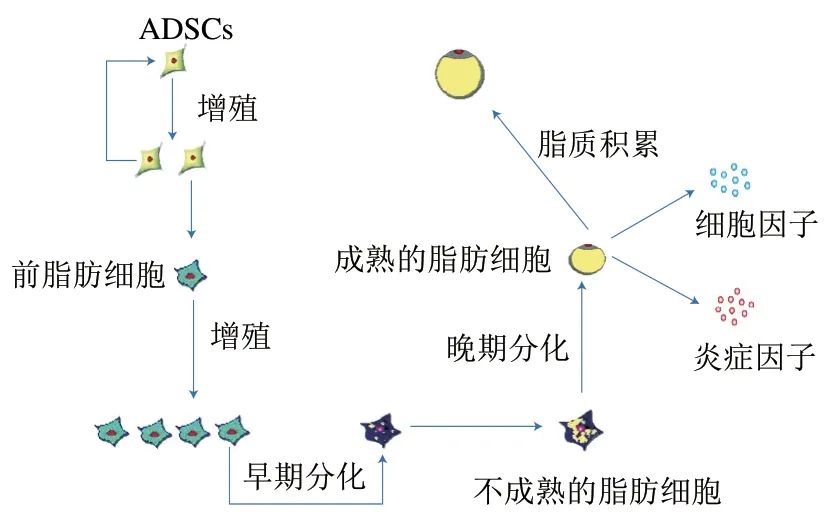
图1 脂肪细胞生命周期Fig. 1 Life cycle of adipocytes
研究发现,肥胖可以改变ADSCs的多向分化能力、增殖能力以及能量代谢。在脂肪细胞增殖分化及代谢相关研究中,常用脂肪细胞系或原代脂肪细胞进行实验,最常用的研究脂肪细胞的方法为体外培养。3T3-L1小鼠胚胎成纤维细胞系是一种被广泛用来研究对脂肪生成影响的细胞系,它是从3T3细胞中经克隆分离得到的可以连续传代的亚系。原代脂肪细胞分离自脂肪组织中的血管基质组分细胞,血管基质组分细胞是一个细胞群,其中包含ADSCs等多种细胞。
3 乳铁蛋白调控脂肪干细胞的增殖分化
动物脂肪组织中分布着处于各个分化阶段的脂肪细胞。脂肪细胞从脂肪细胞前体向成熟脂肪细胞发展过程中,细胞数量逐渐增多,细胞体积逐渐增大,脂质逐渐沉积。脂肪细胞数量过多或脂肪细胞体积过大会导致肥胖,脂肪质量的过度增加导致脂肪组织功能失调。高脂饮食所致动物肥胖模型与人类因能量摄入过多而形成的肥胖最为接近,目前也已经得到广泛应用。动物实验表明LF可以降低肥胖小鼠内脏脂肪的质量,改善高脂饮食诱导的肥胖。
ADSCs位于血管周围,其分裂分化受到各种抑制和刺激因素的严格调控。ADSCs具有稳定生长和增殖的能力,在不同的诱导条件下可以定向分化为各种中胚层细胞,如脂肪细胞、软骨细胞、心肌细胞、甚至神经细胞。研究发现LF可以促进兔脂肪干细胞以及人脂肪干细胞的成骨分化。细胞膜相关酶碱性磷酸酶(alkaline phosphatase,ALP)在成骨细胞分化过程的早期出现,是最广泛用于识别成骨细胞分化的标志,其活性与矿化开始前成骨细胞基质形成相关。骨钙素(osteocalcin,OCN)参与控制骨矿化过程,出现在成骨细胞分化的晚期;I型胶原蛋白(type I collagen,COL-I)是骨基质中最丰富的蛋白质,在增殖过程中mRNA高水平表达。研究发现LF干预可以显著增加ALP活性,并且ADSCs的OCN和COL-I表达水平经LF干预之后均显著增加。这些结果均表明LF可以增强ADSCs的成骨分化能力。
通过对脂肪生成的转录途径研究发现,一些转录因子,如过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors,PPARs)、CCAAT增强子结合蛋白(CCAAT-enhancer binding proteins,C/EBPs)、固醇调节元件结合蛋白(sterol regulatory element binding proteins,SREBPs),在脂肪细胞分化所需的转录激活中起着关键作用。其中,PPARγ对脂肪生成必要且充分,是脂肪细胞分化的主要调节因子。C/EBPs包含多种亚型,其中主要是C/EBPα、C/EBPβ、C/EBPδ参与脂质代谢过程,这些转录因子可以与PPARγ在脂肪生成过程中形成级联反应。脂肪生成的刺激信号使脂肪细胞分化的早期调节因子C/EBPβ、C/EBPδ表达量增加,进一步激活PPARγ,PPARγ反过来促进C/EBPα的表达,这些分子共同诱导脂肪细胞分化以及脂质储存。研究发现,灌胃BLF导致大鼠肠系膜脂肪组织的前脂肪细胞C/EBPα、PPARγ的基因表达降低,并且显著降低C/EBPδ的基因表达水平,说明BLF可能参与调控前脂肪细胞的早期和晚期分化。Moreno-Navarrete等研究发现外源性LF添加可以降低3T3-L1细胞分化过程中PPARγ及其下游与脂肪生成有关的基因表达水平。这些结果可能揭示了LF抑制脂肪细胞分化的基础机制。
然而,在人脂肪细胞培养实验中发现,LF可以上调人皮下和内脏前脂肪细胞中PPARγ的表达。因此,LF通过PPARγ调控脂肪生成的确切机制需要进一步确定。
4 乳铁蛋白调控脂质代谢
脂质代谢分为分解代谢和合成代谢,脂质代谢过程受多种转录因子的调控,脂质合成与降解之间的平衡决定脂肪细胞的脂质含量。研究发现,在脂肪细胞分化过程中脂肪生成相关基因表达水升高。而另外有研究发现,在人脂肪细胞分化过程中LF表达水平增加,LF基因的表达与脂肪生成相关基因的表达水平呈正相关,表明LF参与脂肪细胞代谢。
4.1 脂质分解
激素敏感性脂肪酶(hormone-sensitive triglyceride lipase,HSL)是甘油三酯降解的主要酶,GHSL催化是脂肪分解的限速步骤。研究发现LF可以上调HSL的表达水平从而促进脂肪分解。在环腺苷酸-蛋白激酶A(cyclic adenosine monophosphate-protein kinase A,cAMP-PKA)信号通路中,标准的脂质分解途径为:G蛋白偶联受体激活腺苷酸环化酶(adenylate cyclase,AC),激活的AC可以合成cAMP,进一步激活PKA,而PKA可以磷酸化并激活HSL,最终导致脂滴分解。脂滴包被蛋白(perilipin,PLIN)位于脂滴表面,对脂滴具有保护作用,可以阻止HSL与甘油三酯接触,抑制HSL的脂解作用。脂肪细胞在脂解刺激下,激活后的PKA可以磷酸化PLIN,并将HSL由细胞质转移到脂滴表面,导致脂解反应。Ikoma-Seki等研究发现LF可以激活脂肪细胞PKA活性,并且增加HSL以及PLIN的磷酸化水平。这些研究结果表明LF可以激活成熟脂肪细胞的标准脂解途径。cAMP响应元件结合蛋白(cAMP response element binding protein,CREBP)是一种转录因子,位于cAMP-PKA信号通路下游,可以被PKA磷酸化激活。HSL和AC的5′-非翻译区(5′-untranslated region,5′-UTR)含有cAMP响应元件(cAMP response element,CRE)或类似于CRE的位点,可以被转录因子识别。Ikoma-Seki等研究发现LF能够激活CREBP,并且上调HSL的表达水平以及诱导AC的合成。研究发现低密度脂蛋白受体相关蛋白1(low density lipoprotein receptor-related protein 1,LRP1)可能是LF位于脂肪细胞中的受体。LF可以通过LRP1控制细胞外信号调节激酶信号通路的活性,调节参与脂解的蛋白质的表达水平来促进成熟脂肪细胞的脂解。Nakamura等研究发现BLF可以借助LRP1受体通过cAMP-PKA信号通路促进棕色脂肪细胞中基因的表达,导致能量消耗增加。其中,UCP-1在棕色脂肪细胞的线粒体内膜高度表达,它通过将质子梯度耗散为热来消耗游离脂肪酸产生的能量。另外,沉默基因之后可以减轻LF促进大鼠肠系膜脂肪细胞脂质分解的作用,这进一步表明了LRP1可以作为脂肪细胞中LF的受体。
因此,LF调控脂肪细胞脂代谢模式如图2所示,LF可能经受体LRP1进入脂肪细胞,通过上调AC的表达激活cAMP-PKA信号通路,PKA通过磷酸化并激活参与脂质分解的酶HSL,从而促进脂肪细胞的脂质分解。但是,LF诱导脂肪细胞脂解的具体机制需要进一步研究。
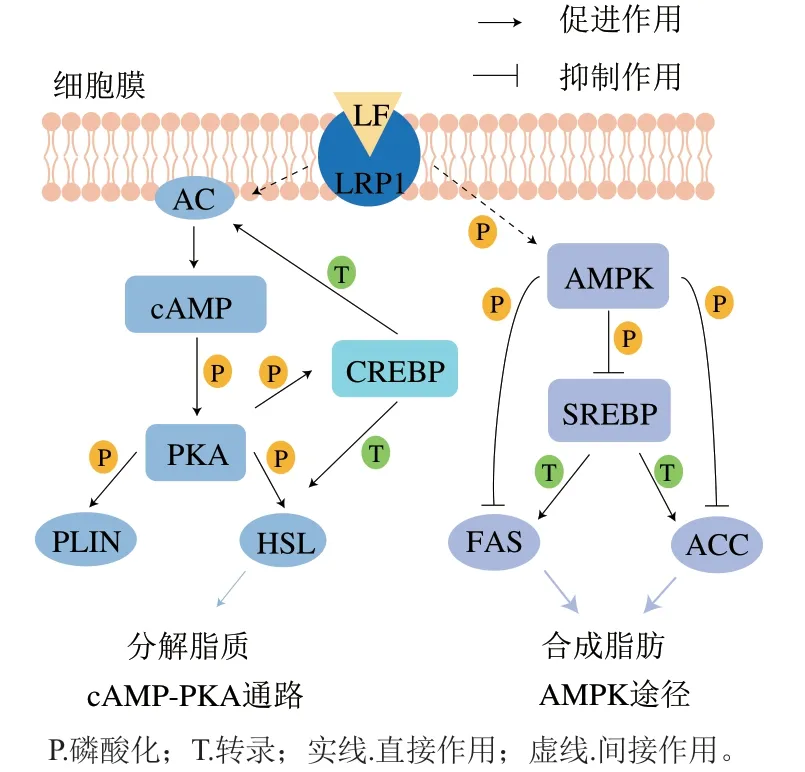
图2 LF调控脂肪细胞脂代谢模式图(基于大、小鼠等模式动物)Fig. 2 Patterns by which LF regulates lipid metabolism of adipocytes(based on model animals such as rats and mice)
4.2 脂肪生成
FAS和ACC是脂肪酸合成的关键酶,其合成基因是SREBPs的下游基因,SREBPs是脂质代谢的主要参与者,控制着脂质合成和转运相关的重要基因的表达,SREBP-1是SREBP的一种亚型,在诱导脂肪基因表达中起着重要作用。Min Qingqing等研究发现外源性LF给药可以显著下调SREBP-1及其下游脂肪酶FAS和ACC的表达水平,调节脂质代谢。Xiong Ling等研究同样表明LF可以抑制肥胖小鼠肝脏和附睾脂肪组织FAS表达。如图2所示,研究发现LF可以通过增加3T3-L1细胞中腺苷酸激活蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)磷酸化水平来抑制脂肪合成。AMPK可以作为一种传感器感知能量状态并根据代谢需要调节代谢通路。AMPK被磷酸化激活,激活后的AMPK可以增强补充细胞ATP供应的信号转导通路,如脂肪酸氧化,并且抑制消耗ATP的生物合成过程,如脂质合成。AMPK可以通过直接磷酸化SREBP-1而影响其下游靶基因转录,或者是磷酸化FAS和ACC而影响其酶活性,在脂质代谢中发挥关键性作用。Moreno-Navarrete等研究发现LF可以通过增加AMPK的磷酸化水平,并且抑制FAS和ACC的表达来减少脂滴的形成。研究人员通过动物研究发现脂肪细胞中脂滴过量积累会造成肝脏变性,而外源性LF可以通过减少脂滴的形成从而降低这一不利影响。与此一致,视网膜母细胞瘤(retinoblastoma,RB)过磷酸化导致活性降低,促进3T3-L1细胞克隆扩张和脂肪细胞分化,而LF可以通过增加低磷酸化的RB水平来抑制3T3-L1的脂肪生成。研究发现经胰蛋白酶处理的LF因产物较大继续表现出抑制脂肪生成的作用,而用胃蛋白酶处理LF产生非常小的肽导致其失去抗脂肪生成的活性。因此,在将LF作为口服内脏减脂剂时有必要将肠溶涂层纳入考虑范围。
然而,研究发现在人原代脂肪细胞中,LF可以通过增强胰岛素信号传导并且抑制RB和AMPK活性来促进脂肪生成。前列腺六次跨膜蛋白2(six transmembrane protein of prostate 2,STAMP2)在脂肪细胞生理活性中起着重要作用,敲除基因可以破坏胰岛素敏感性和脂肪生成。研究发现LF可以显著上调基因表达,这也是LF增强人前脂肪细胞胰岛素信号传导和脂肪生成的原因之一。另一个原因可能是人原代前脂肪细胞暴露于糖皮质激素增加了对胰岛素的敏感性,并且增强了对脂肪生成刺激因素的后续响应,而且这种效应在3T3-L1细胞中并没有观察到。而LF基因敲除可以导致人脂肪生成相关基因的表达量显著降低,这说明内源性LF生物合成是调控人脂肪细胞分化的关键。LF作为一种转铁蛋白,其对铁平衡具有调节作用。研究发现铁过量可诱导脂肪细胞中铁的积累,导致胰岛素抵抗,减少脂联素的生成。而铁稳态的破坏,无论是铁过量还是铁缺失均可以导致脂肪细胞功能受损,降低其脂肪生成能力。因此,LF对于铁稳态的调节作用可能是其促进人脂肪细胞分化及脂肪形成的原因之一。
除此之外,LF对脂肪细胞脂质生成的双重作用可能与LF受体不同有关。研究发现LRP1作为一种假定的LF受体,与脂滴发育的基因标记以及主要的成脂转录因子PPARγ的表达有关。而在大鼠肠系膜脂肪的前脂肪细胞中发现了LRP1的表达,并且结合LF对大鼠肠系膜脂肪组织的前脂肪细胞分化的抑制作用,可得出LRP1可能参与了LF对脂肪生成的抑制作用。但是,目前对人脂肪细胞中LF相关受体的研究较少。
无论是LF在3T3-L1小鼠胚胎成纤维细胞系和鼠原代脂肪细胞中的抑制脂肪生成作用,还是在人原代脂肪细胞中促进脂肪生成作用,均表明LF参与调节脂肪细胞的生理功能。因此,LF给药可能是肥胖相关脂肪组织功能障碍或代谢紊乱的有效治疗靶点,但是还需要进一步确定LF调控脂肪细胞脂质代谢的相关信号通路,以及探究LF基因对于鼠原代脂肪细胞生理功能的调控作用,即LF自分泌是否与外源性添加LF的效果一致。
5 乳铁蛋白调控脂肪细胞因子
脂肪细胞具有内分泌功能,大量的脂肪细胞构成了脂肪组织。脂肪组织不仅能够储存能量,还可以保护内脏器官,缓冲剧烈运动对器官造成的损伤,但是脂肪组织沉积过多时,可能会由于过度的内分泌作用干扰内脏器官的正常运转,从而导致疾病。脂肪组织慢性炎症是肥胖相关疾病的重要病理过程。先天免疫系统由免疫细胞和体液免疫分子等组成,是抵御微生物入侵的首要防线之一,而LF作为一种先天免疫蛋白,具有抗炎特性,是哺乳动物宿主防线的重要组成部分。除脂肪细胞中含有LF受体之外,特定的LF受体还存在于多种细胞中,包括单核细胞、淋巴细胞、干细胞和内皮细胞。研究发现,LF可以通过调控脂肪细胞因子的分泌而参与调节机体健康。
脂肪组织是重要的内分泌器官,脂肪组织拥有独特的免疫细胞库,这些免疫细胞可以分泌各种细胞因子,如瘦素、脂联素等。瘦素是脂肪组织特异表达的脂肪因子,是一种有助于抵抗肥胖的多肽类激素,可以调节食物摄入和能量消耗。Xiong Ling等研究表明LF可以通过增加血清中的瘦素水平,改善肝脏脂质代谢,进而改善肝脏脂肪变性。脂联素是脂肪组织分泌的一种蛋白质,能够通过脂联素受体进入细胞,减少游离脂肪酸进入肝脏,是目前发现的唯一一个与肥胖呈负相关的细胞因子。而研究发现LF可以增加人皮下和内脏脂肪细胞中脂联素基因和蛋白质表达水平。
脂肪细胞是促炎细胞因子的重要来源,成熟的脂肪细胞可以分泌表达多种炎症因子,如MCP-1、TNF-α等,这些炎症因子会导致全身性慢性炎症,进而引发疾病。MCP-1是炎症反应重要的趋化因子,通过募集单核细胞/巨噬细胞,以及介导靶细胞对细胞因子的分泌参与病理性新血管的生成。研究发现LF可以抑制肥胖小鼠肝脏和附睾脂肪组织中MCP-1的表达。同样地,LF还可以恢复3T3-L1细胞中炎症诱导的AKT磷酸化水平的降低,减少内脏脂肪细胞和皮下脂肪细胞中、和基因的表达水平。Mohamed等研究发现LF可以通过降低核因子-κB(nuclear factor-κB,NF-κB)下游相关指标从而降低炎症介质的表达水平。脂多糖(lipopolysaccharide,LPS)可以诱导NF-κB与TNF-α启动子的结合导致炎症,而LF能够结合LPS从而减少炎症因子的产生。这可能是LF可以减轻炎症的原因之一。
6 结 语
综上所述,LF可以有效调控脂肪细胞的发育和代谢,其作用机制主要包括LF参与调节脂肪细胞增殖分化相关基因和参与脂代谢相关蛋白的表达水平等,表明LF可能是调节脂肪组织功能障碍或代谢紊乱的有效靶点。但目前LF确切的作用机制以及相应的表达受体等一系列问题需要继续深入研究。人体内许多细胞可以表达分泌LF,这些内源性的LF对机体代谢可能存在着调控作用。其次,通过饮食补充LF从而影响机体脂肪细胞生理作用的详细机制尚不明确。婴幼儿的消化系统相较于成年人尚未成熟,并且肠道屏障不完善,很多蛋白质可以被直接吸收,所以研究LF在进入婴幼儿体内后对其脂肪细胞的发育和代谢的影响意义重大。最后,目前LF调节脂肪细胞生理功能的研究主要集中在细胞和动物领域,而在人体临床方面的研究较少。动物和人体在有效剂量和吸收代谢方面差异较大,体外实验、动物实验与人体临床试验的效果还存在差距,婴幼儿、青少年和成人分别所需的LF有效剂量有待研究。
