不同毒力副猪嗜血杆菌生物被膜形成能力及特性
2022-09-29赵瑞利于恩远荣睿璠王心如张东超武玮卓孙英峰
赵瑞利 , 曾 君 , 于恩远 , 荣睿璠 , 王心如 , 李 颖 , 张东超 , 武玮卓 , 张 清 , 孙英峰
(1.天津农学院动物科学与动物医学学院天津市农业动物繁育与健康养殖重点实验室 , 天津 西青 300392 ;2. 天津市动物疫病预防控制中心 , 天津 北辰 300402)
副猪嗜血杆菌(Haemophilusparasuis, HPS)是一种革兰阴性短小杆菌,生长时严格需要烟酰胺腺嘌呤二核苷酸(NAD)或V因子,有15个以上血清分型[1]。临床引起以多发性纤维素性浆膜炎和关节炎为特征的猪格氏病(Glasser's disease),呈世界性分布。Ni 等于2020 年综合分析了5 个国内外数据库中关于 HPS 血清流行病学及病原流行病学的数据,结果显示,2005—2019年HPS在我国猪群中的综合平均阳性率约为27.8%, 2011—2015年综合平均阳性率高达41.0%[2]。猪格氏病无季节性,且全年龄段的猪均易感,呈地方流行性,我国以5 型(26.6%)、4 型(22.4%)、7 型(9.1%)、13 型(6.3%)、12 型(5.6%)和未分型(8.4%) HPS菌株为优势流行血清型[3]。
细菌生物被膜(Biofilm)是细菌及其分泌的糖、蛋白质和核酸等多种基质组成的细菌群落,是造成病原细菌抵御不良生存环境、持续性感染、毒力和耐药性的重要原因之一[4]。细菌生物被膜基质由复杂的胞外聚合物(Extracellular polymer substances,EPS)构成,包括胞外多糖、蛋白质、胞外DNA (eDNA)和胞外 RNA (eRNA)。黏附素CdrA和凝集素LecB等主要的结构蛋白通过影响多糖的定位和聚集,从而增加了生物被膜结构支架的强度,能固定生物被膜中的微生物群落,维持一系列高度复杂的动态变化[5]。胞外聚合物在生物被膜结构和功能方面均发挥重要作用,包括表面黏附、空间和化学异质性、生物被膜毒力构成,可减弱抗菌剂的影响并促进细胞间相互作用,从而增强生物被膜中细胞的代谢能力和耐药性[6]。
本试验以不同毒力HPS的生物被膜形成能力差异为切入点,探究生物被膜动态形成过程、被膜基因含量与表型的相关性、胞外多糖含量、对宿主细胞黏附性和耐药情况分析,为深入研究不同毒力HPS与生物被膜形成能力和相关特性研究,以及临床副猪嗜血杆菌病的防治提供理论依据。
1 材料与方法
1.1 菌株和细胞 副猪嗜血杆菌血清型4型(HPS-4)、5型(HPS-5)地方分离株,由吉林大学惠赠;副猪嗜血杆菌血清型7型(HPS-7)、未分型(HPS-NT)菌株和猪肾上皮细胞(PK-15),由天津农学院兽医学实验室保存。
1.2 主要试剂 胰蛋白胨大豆琼脂培养基(TSA)、胰蛋白胨大豆肉汤培养基(TSB)、胎牛血清、氧化型辅酶Ⅰ、结晶紫染液、磷酸盐缓冲液(PBS)和双抗溶液,均购自北京索莱宝科技有限公司;巧克力平板培养基,购自北京陆桥技术股份有限公司;脱纤绵羊血,购自天津晟佰昊生物技术有限公司;Taq酶和PCR反应溶液,均购自高良生物医药科技(北京)有限公司;抗菌药药敏纸片,购自杭州微生物试剂有限公司;三氯乙酸、胰蛋白酶和DMEM培养基,均购自赛默飞世尔科技有限公司。本试验所用引物序列由生工生物工程(上海)股份有限公司合成,信息见表1。
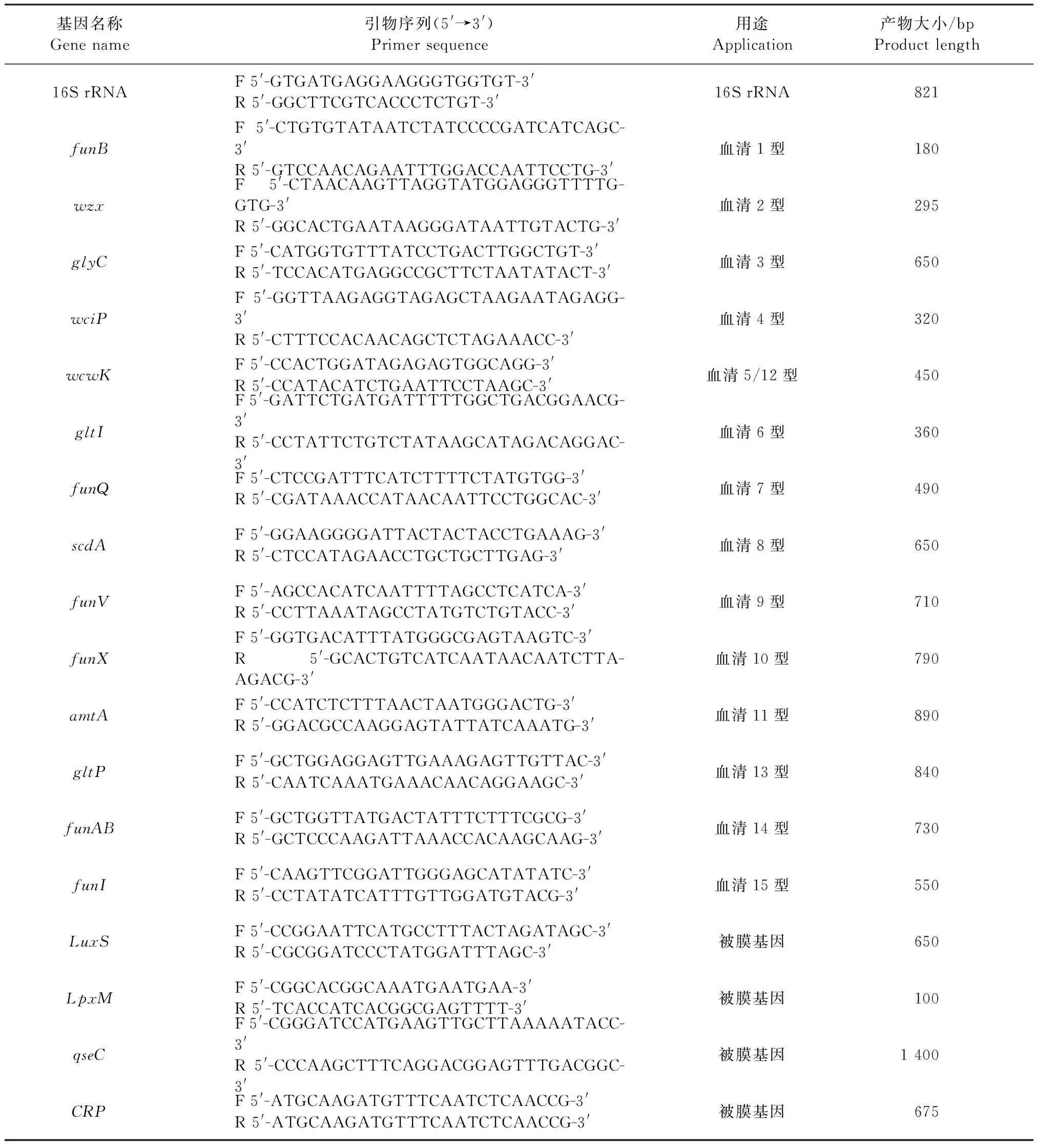
表1 本试验所用引物信息[7-8]Table 1 Primers used in this study
1.3 主要仪器 恒温培养箱,上海福玛实验设备有限公司;显微镜,尼康映像仪器销售(中国)有限公司;普通PCR仪、iMax酶标仪和凝胶成像仪,美国Bio-Rad公司。
1.4 试验方法
1.4.1 细菌分离与鉴定 将病料接种于巧克力平板,置于37 ℃含5%CO2的培养箱中培养16~24 h。挑取疑似HPS的单菌落涂布于TSA固体培养基(含5%胎牛血清和0.1% NAD),37 ℃含5% CO2的培养箱中培养16~24 h[9],革兰染色、镜检。
1.4.2 HPS血清型的鉴定 挑取分离纯化后的单菌落洗脱于含100 μL无菌水(60 ℃预热)的EP管中悬浮,涡旋后沸水浴10 min,冻融1次后,10 000 r/min离心2 min,取上清液为PCR模板[10]。PCR扩增体系(25 μL):模板5 μL,10×Buffer 2.5 μL,dNTP 2.0 μL,Taq酶 0.5μL,上、下游引物各 1 μL,ddH2O 13 μL。PCR扩增程序:94 ℃预变性4 min; 94 ℃变性 30 s,退火温度(根据引物Tm值确定)退火30 s, 72 ℃延伸45 s,35个循环;72 ℃终延伸10 min,4 ℃结束反应。
1.4.3 药敏试验 利用K-B 纸片扩散法检测不同血清型分离菌株对常见14种抗菌药的敏感性。将纯化后的HPS培养至对数中期,菌液均匀涂布于TSA固体培养基(含5%胎牛血清和0.1% NAD),将药敏纸片平整地贴在平板上,37 ℃倒置培养18~24 h,测定抑菌圈直径并参照参考文献[11]进行统计分析。
1.4.4 结晶紫法检测HPS生物被膜动态形成过程 将对数培养的副猪嗜血杆菌用TSB液体培养基(含5%胎牛血清和0.1%NAD)稀释至OD值为0.02,每孔菌液200 μL,每种血清型24个重复,37 ℃进行生物被膜形成培养。分别在第12、24、36、48、60、72、84小时和第96小时取不同血清型培养物3个重复吸除菌液,用磷酸盐缓冲液200 μL洗2次,风干;甲醇200 μL固定15 min,风干;0.1%结晶紫溶液200 μL染色10 min,风干;95%乙醇200 μL溶解色素后,酶标仪检测630 nm吸光度值。取各血清型OD630nm平均值绘制生物被膜形成曲线[12]。
1.4.5 HPS胞外多糖含量的测定 标准曲线的制定:葡萄糖标准溶液:准确称取干燥葡萄糖1 g溶解于1 L超纯水中,使其终浓度为1 mg/mL。取干净的玻璃试管按表2配置溶液,在不同浓度的葡萄糖标准溶液中,加6%苯酚溶液1 mL,然后快速加浓硫酸5 mL,在90~95 ℃水浴20 min 并冷却,紫外分光光度计测量490 nm吸光度值,根据吸光度值绘制标准曲线[13]。
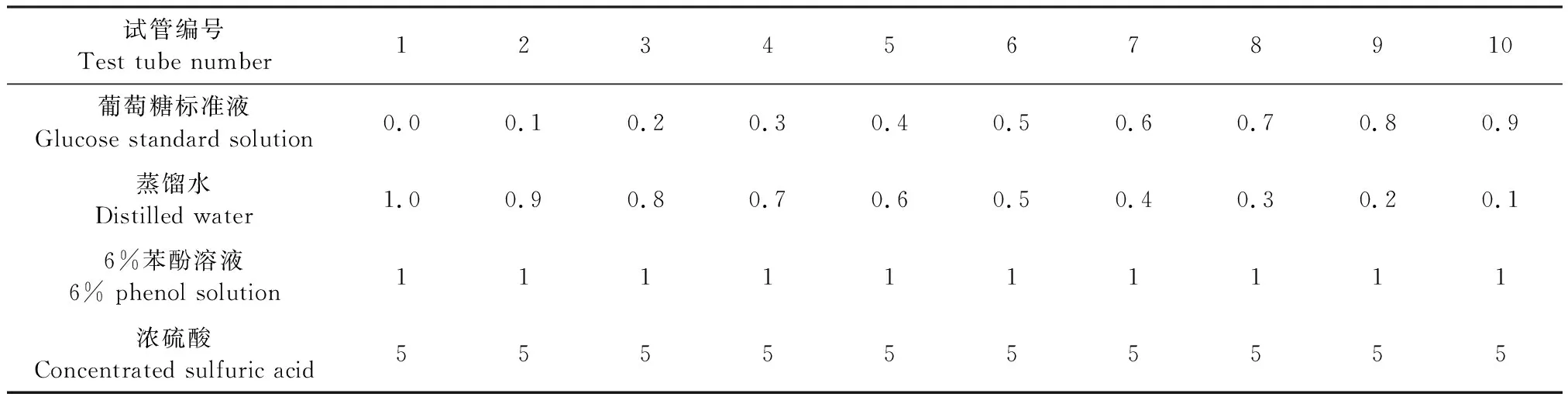
表2 葡萄糖溶液标准曲线绘制所用溶液Table 2 Reagents used for drawing the standard curve of glucose solution (mL)
样品测定采用苯酚-硫酸法,操作方法同标准曲线制定,挑取纯化的单菌落于TSB液体培养基(含5%胎牛血清和 0.1% NAD)中,37 ℃、180 r/min摇床振荡过夜培养,取菌液2.5 mL于50 mL液体培养基再次于37 ℃、180 r/min摇床振荡培养 18~24 h。取若干菌液置于水浴锅95 ℃作用5 min ,去除酶活性,10 000 r/min 离心20 min,取上清液;加4%(w/v)的三氯乙酸振荡20 min后静置40 min,12 000 r/min 离心30 min ,取上清液;将收集的上清液中加入3倍体积的95%乙醇,4 ℃过夜;12 000 r/min离心15 min,去上清液,沉淀用锡箔纸封口扎小孔,冷冻干燥24 h,得到细菌胞外多糖。称取干燥的不同毒力副猪嗜血杆菌胞外多糖1 mg溶于1 mL超纯水中,加入6%苯酚溶液1 mL、浓硫酸5 mL上下轻柔颠倒混匀使之充分反应,90~95 ℃水浴20 min,静置至室温后用紫外分光光度计检测490 nm吸光度值,设3次重复取平均值,并依据标准曲线一次方程计算胞外多糖含量[14]。
1.4.6 被膜基因数量的检测 采用PCR方法检测被膜基因,PCR模板制作、PCR扩增体系和PCR扩增程序参考1.4.2,PCR引物信息见表1。
1.4.7 细胞黏附试验 将5×105个PK-15接种于24孔细胞培养板中,每孔含10%热灭活胎牛血清的DMEM培养基200 μL。细胞在37 ℃、5%CO2的湿式培养箱中培养24 h至细胞生长到100% 融合后,用磷酸盐缓冲液冲洗3次,感染约1×107CFU的HPS。培养板在37 ℃孵育最多2 h,以允许细菌黏附。细胞用磷酸盐缓冲液洗涤5次以消除未黏附细菌,然后加入0.25%胰蛋白酶100 μL在37 ℃孵育10 min。孵育结束后,将细胞从每个孔底重新悬浮。将贴壁细菌的细胞悬液稀释10倍,平铺于TSA固体培养基(含5%胎牛血清和0.1% NAD)上37 ℃培养12 h进行菌落计数,计算黏附率[15-16]。
黏附率/%=(黏附细胞细菌数/添加细菌数)×100%
1.5 数据统计分析 采用SPSS 21.0软件对试验结果进行统计分析,采用方差分析和t检验进行分析比较数据,数据用平均值±标准差表示,P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 细菌分离与鉴定 纯化的HPS培养20 h后在固体培养基上呈表面光滑、无色透明的小菌落(图1),为革兰阴性短杆菌(图2)。
图1 副猪嗜血杆菌的TSA琼脂平板培养Fig.1 TSA AGAR plate culture ofHaemophilus parasuis
图2 副猪嗜血杆菌革兰染色 (1 000×)Fig.2 Gram staining of Haemophilus parasuis (1 000×)
2.2 HPS血清型的鉴定 通过HPS 16S rRNA 和各血清型特异性引物进行PCR扩增,得到大小为821 bp的16S rRNA、320 bp的血清型4型wciP基因、450 bp的血清型5型wcwK基因、490 bp的血清型7型funQ基因的特异性条带(图3和图4),与预期的片段大小相符。
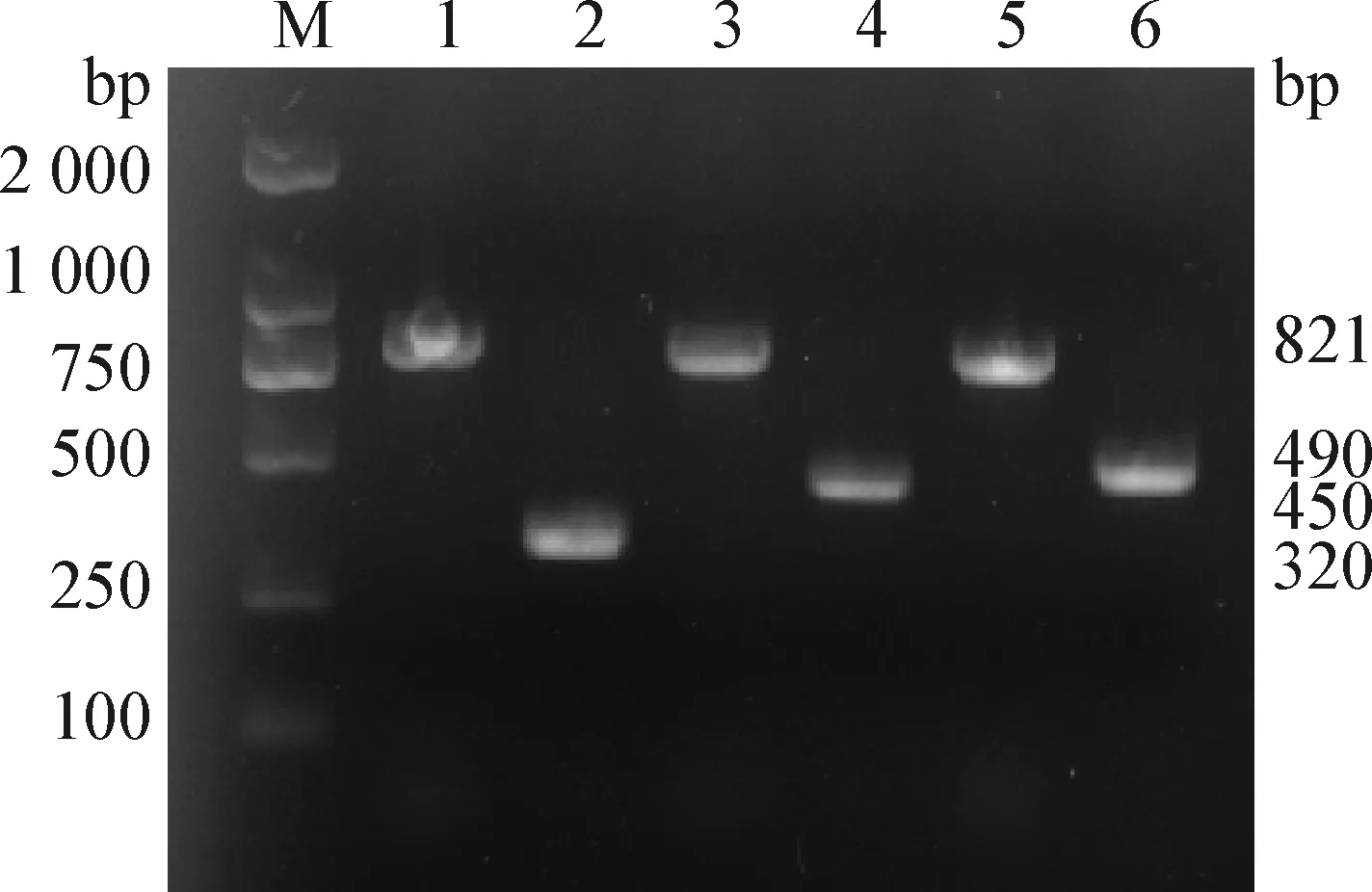
图3 副猪嗜血杆菌血清型4、5、7的PCR鉴定Fig.3 PCR identification of Haemophilus parasuis serotypes 4, 5 and 7M:DL-2 000 DNA相对分子质量标准; 1、3、5: 阳性对照; 2: wciP基因片段; 4: wcwK基因片段; 6: funQ基因片段M: DL-2 000 DNA Marker; 1,3,5: Positive control; 2: wciP gene fragment; 4: wcwK gene fragment; 6: funQ gene fragment

图4 副猪嗜血杆菌未分型菌株血清型的PCR鉴定Fig.4 PCR identification of the unclassified Haemophilus parasuis strainsM:DL-2 000 DNA相对分子质量标准; 1: funB基因片段; 2: wzx基因片段; 3: glyC基因片段; 4: wciP基因片段; 5: wcwK基因片段; 6: gltI基因片段; 7: funQ基因片段; 8: scdA基因片段; 9: funV基因片段; 10: funX基因片段; 11: amtA基因片段; 12: gltP基因片段; 13: funAB基因片段; 14: funI基因片段; 15: 阳性对照M:DL-2 000 DNA Marker; 1: funB gene fragment; 2: wzx gene fragment; 3: glyC gene fragment; 4: wciP gene fragment; 5: wcwK gene fragment; 6: gltI gene fragment; 7: funQ gene fragment; 8: scdA gene fragment; 9: funV gene fragment; 10: funX gene fragment; 11: amtA gene fragment; 12: gltP gene fragment; 13: funAB gene fragment; 14: funI gene fragment; 15: Positive control
2.3 药敏试验 由表3可知,HPS-4仅对四环素、头孢噻肟、林可霉素、多西环素耐药,其余均敏感或中等耐药;HPS-7仅对林可霉素耐药;HPS-5对测试抗生素均敏感;HPS-NT仅对多西环素敏感,耐药性强且主要集中在β-内酰胺类、氨基糖苷类药物。
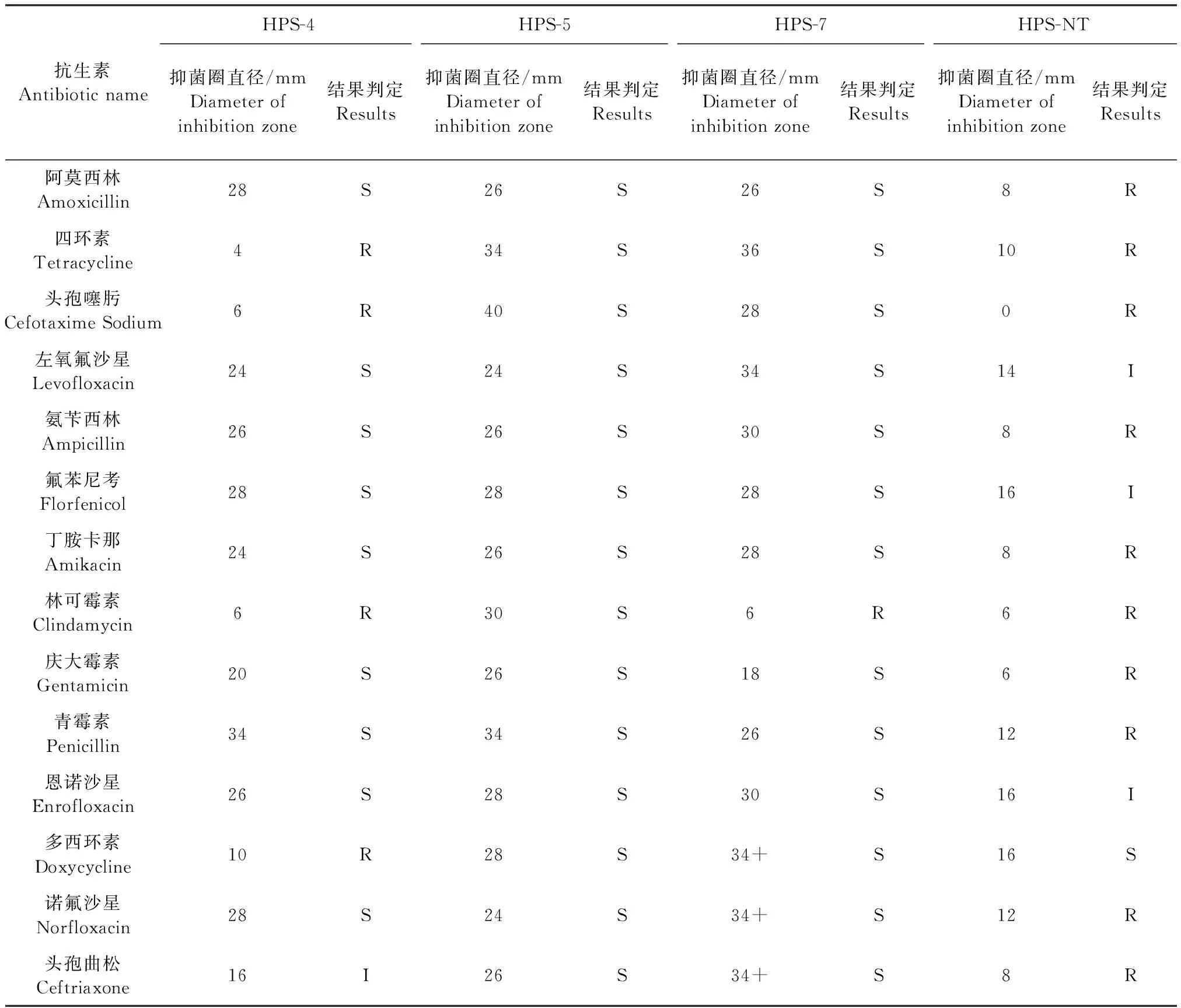
表3 不同毒力副猪嗜血杆菌的药敏试验Table 3 Drug sensitivity testing of Haemophilus parasuis of varying virulence
2.4 生物被膜动态形成过程 不同毒力HPS生物被膜形成曲线结果见图5,各血清型HPS在培养36 h后生物被膜含量开始明显增多,特别是微菌落形成阶段(48~60 h)和生物被膜成熟阶段(60~72 h)增加显著,并且第60小时和第72小时之间生物被膜含量呈极显著差异(P<0.01)。在72 h时生物被膜形成量达到峰值,随后减少,生物被膜逐渐消散。在生物被膜形成过程中,强毒菌株(HPS-5)的生物被膜形成量在36 h后始终多于中等毒力菌株(HPS-4)、无毒型菌株(HPS-7)和未分型菌株(HPS-NT)。但在细菌初始黏附阶段(0~24 h)、生物被膜黏附阶段(24~48 h),无毒型菌株(HPS-7)生物被膜形成量多于中等毒力菌株(HPS-4)。在生物被膜散播期(72~96 h),不同毒力HPS生物被膜量均减少,并且第72小时和第84小时之间生物被膜含量减少呈极显著差异(P<0.01),第84小时后四者差异不显著(P>0.05)。

图5 不同毒力副猪嗜血杆菌的生物被膜形成Fig.5 Biofilm formation of Haemophilus parasuis of varying virulence** :P<0.01,差异极显著** :P<0.01,extremely significant difference
2.5 胞外多糖含量测定 葡萄糖标准曲线制作结果见图6,线性回归方程:y=0.609 3x-0.011 4,R2=0.998 8表明线性关系良好。不同毒力HPS胞外多糖含量测定结果表明:中等毒力菌株(HPS-4)胞外多糖含量最多,为0.929 6,强毒株(HPS-5)胞外多糖含量最少,为0.854 1,但差异不显著(P>0.05)。

图6 葡萄糖标准曲线Fig.6 Standard curve of glucose
2.6 生物被膜相关基因检测 通过PCR检测生物被膜相关基因,扩增得到675 bp的CRP基因、650 bp的LuxS基因、100 bp的LpxM基因、1 400 bp的qseC基因的特异性条带(图7和图8),与预期片段大小相符。中等毒力菌株(HPS-4)被膜基因CRP、LpxM呈阳性;强毒株(HPS-5)被膜基因LpxM、LuxS、qseC呈阳性;无毒型菌株(HPS-7)被膜基因LpxM呈阳性;未分型菌株(HPS-NT)被膜基因LpxM、CRP呈阳性。

图7 副猪嗜血杆菌血清型4、5、7被膜基因的PCR检测Fig.7 PCR detection of envelope genes of Haemophilus parasuis serotypes 4, 5 and 7M:DL-2 000 DNA相对分子质量标准; 1: 阳性对照; 2~5: HPS-4 CRP、LuxS、LpxM、qseC基因片段; 6~9: HPS-5 CRP、LuxS、LpxM、qseC基因片段; 10~13: HPS-7 CRP、LuxS、LpxM、qseC基因片段M:DL-2 000 DNA Marker; 1: Positive control; 2-5: CRP、LuxS、LpxM、qseC gene fragment of HPS-4; 6-9: CRP、LuxS、LpxM、qseC gene fragment of HPS-5; 10-13: CRP、LuxS、LpxM、qseC gene fragment of HPS-7
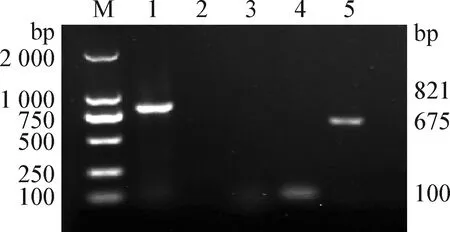
图8 未分型副猪嗜血杆菌被膜基因的PCR检测Fig.8 PCR detection of envelope genes of unclassified Haemophilus parasuis M:DL-2 000 DNA相对分子质量标准; 1: 阳性对照; 2: LuxS基因片段; 3: qseC基因片段; 4: LpxM基因片段; 5: CRP基因片段M:DL-2 000 DNA Marker; 1: Positive control; 2: LuxS gene fragment; 3: qseC gene fragment; 4: LpxM gene fragment; 5: CRP gene fragment
2.7 细胞黏附试验 各血清型HPS黏附PK-15细胞后菌落计数和黏附率见图9,中等毒力菌株(HPS-4)菌落计数为2.63×106CFU/mL,细胞黏附率为26.3%;强毒菌株(HPS-5)菌落计数为3.00×106CFU/mL,细胞黏附率为30.0%;无毒型菌株(HPS-7)菌落计数为2.39×106CFU/mL,细胞黏附率为23.6%;未分型菌株(HPS-NT)菌落计数为2.20×106CFU/mL,细胞黏附率为22.0%。结果表明,强毒和中等毒力HPS对宿主细胞黏附能力更强。副猪嗜血杆菌黏附细胞的能力与该细菌毒力呈正相关。

图9 不同血清型HPS对PK-15黏附率Fig.9 Adhesion rates of different HPS serotypes to PK-15
3 讨论
细菌生物被膜(Bacterial biofilm,BF)是指细菌黏附于接触表面,分泌多糖基质、纤维蛋白、脂质蛋白等,将其自身包绕其中而形成的大量细菌聚集膜样物[4]。生物被膜对细菌黏附、定殖和侵袭宿主细胞过程中至关重要,临床约 80%的慢性感染性疾病与细菌生物被膜有关[17]。不同细菌生物被膜形成能力与其毒力是否呈正相关结论不一致[18-19],本试验HPS-5强毒株生物被膜形成能力最强。本试验中强毒菌株(HPS-5)对宿主细胞黏附率为30.0%,中等毒力菌株(HPS-4)为26.3%,无毒型菌株(HPS-7)为23.6%,未分型菌株(HPS-NT)为22.0%,结果表明,毒力越强对宿主细胞黏附能力越强,更有利于细菌定植。生物被膜形成是一个复杂而有规律的动态过程,包括细菌起始黏附期、生物被膜黏附期、生长期、成熟期和播散期5个阶段[20]。本试验结果显示,不同毒力副猪嗜血杆菌在培养36 h后生物被膜含量开始明显增多,并且第60小时和第72小时之间生物被膜含量呈极显著差异(P<0.01)。在生物被膜散播期(72~96 h)不同毒力HPS生物被膜量均减少,并且第72小时和第84小时之间生物被膜含量减少呈极显著差异(P<0.01),第84小时后四者差异不显著(P>0.05)。由此推测,由于起始黏附、黏附阶段是可逆的,抗菌药物在黏附阶段对细菌的抑制效果相对较好,播散期后可适当延长用药期或联合用药加强清除生物被膜。
微菌落形成是起始吸附阶段进入生物被膜成熟阶段经历的过渡期,胞外多糖是这一过程中必不可少的物质,其含量多少与生物被膜形成量和黏附、侵入黏膜上皮细胞有关[21]。成熟生物被膜中形成的胞外多糖可使用酶或其他抑菌剂降解,破坏基质的物理完整性,促进生物被膜的破坏和清除[22]。使用糖苷水解酶 PslG 靶向分解胞外聚合物中的胞外多糖,在体外可破坏铜绿假单胞菌的成熟生物被膜[23]。胞外多糖降解酶可作为常规抗菌剂的辅助剂,增强药物渗透性和微生物杀灭活性[24]。本试验中中等毒力菌株(HPS-4)胞外多糖含量最多,强毒株(HPS-5)胞外多糖含量最少,但两者差异不显著(P>0.05),与预期生物被膜形成能力越强胞外多糖含量越高不符,可能与细菌生物被膜的形成不仅受到外界因素的影响,同时也受细菌自身基因的调控有关[25]。本试验中中等毒力菌株(HPS-4)有2个被膜基因呈阳性;强毒株(HPS-5)有3个被膜基因呈阳性;无毒型菌株(HPS-7)有1个被膜基因呈阳性;未分型菌株(HPS-NT)有2个被膜基因呈阳性,结合基因数量和被膜形成量以及毒力来看,生物被膜形成量与被膜基因数量相关,但与文献报道弱毒株比强毒株生物被膜形成量多这一观点不相符,可能与研究菌株来源不同有关,因为生物被膜形成是细菌适应环境保护机制,不同区域HPS生长环境不同,形成生物被膜的能力就有所区别。
生物被膜的形成降低了细菌对抗菌药的敏感性,与游离菌相比,其耐药性提高10~1 000倍,微菌落进一步发展并分泌胞外基质,形成具有不同三维结构的成熟生物被膜,这个阶段内的生物被膜对药物、紫外线等抗性最强[26],是引起临床上细菌性疾病难以治疗的主要原因之一。HPS-4对常见14种抗菌药耐药率为28.6%, 而HPS-5的敏感性为100%,这可能是不同地区猪场用药情况不同导致的。其中,中等毒力菌株(HPS-4)来源于吉林省,耐抗生素种类较多,集中于广谱杀菌、抑菌药,为避免耐药性的产生和水平传播,应及时调整更换抗菌药或用抗菌肽等生物活性物质替抗。
