睾丸恶性支持细胞瘤1例临床病理观察及分子特征分析
2022-09-28张天铭湛玉东
张天铭,范 维,湛玉东,余 方
睾丸支持细胞瘤(sertoli cell tumor, SCT)是一种罕见的睾丸性索-间质细胞瘤,占睾丸所有肿瘤的比例不足1%。WHO(2016)泌尿系统和男性生殖器官肿瘤分类将SCT分为3类:非特殊型SCT(包括硬化性SCT)、大细胞钙化性SCT和小管内大细胞玻璃样变SCT[1]。睾丸非特殊型SCT发病率较低,组织形态和免疫表型存在明显异质性,在常规诊断工作中常对其认识不足。恶性支持细胞瘤(malignant sertoli cell tumor, MSCT)的分子病理改变与非特殊型SCT相似,但更为罕见。本文回顾性分析1例睾丸MSCT的临床病理学特征、免疫表型等,并结合分子检测进行分析,以提高临床和病理医师对其的认识水平。
1 材料与方法
1.1 临床资料患者男性,54岁,因左侧睾丸占位1年余入院。专科体检发现左侧睾丸占位,大小10 cm×8 cm×5 cm,质地较硬,活动度较差,与周围组织界限不清。实验室检查:相关肿瘤标志物(CEA、AFP、TPSA、FPSA、β-HCG等)均无特殊改变。影像学提示左侧阴囊内实性包块伴部分区域出血(睾丸来源可能),考虑肿瘤性病变。临床诊断为左侧睾丸肿瘤,遂行“左侧睾丸肿物切除术”。
1.2 方法
1.2.1免疫组化 标本经10%中性福尔马林固定,常规脱水、石蜡包埋,3 μm厚切片,HE染色,镜下观察。免疫组化染色采用EnVision两步法,具体操作步骤严格按试剂盒说明书进行。
1.2.2基因检测 选取3 μm厚肿瘤切片及正常组织各10张(对应HE切片无坏死、出血),由北京诺禾致源公司采用高通量测序法对体细胞基因的全部外显子、内含子、启动子等区域进行高深度测序,测序深度在10×以上,将测序结果与人参考基因组序列(human_B37)进行比对分析,进行易感基因的筛查及已知驱动基因的筛选。利用SWISS-MODEL网站(https: //swissmodel.expasy.org)及The PyMOL Molecular Graphics System软件分析蛋白结构改变。
2 结果
2.1 病理检查眼观:完整睾丸组织1个,大小9 cm×8 cm×4 cm;精索组织长12 cm;附睾组织,大小3 cm×1 cm×0.5 cm。鞘膜与白膜分离,切面内紧邻白膜及睾丸实质内见一最大径为7.5 cm的灰黄、灰褐色肿块,切面部分呈囊状,质软,肿块累及整个睾丸。睾丸外表面光滑,附睾与精索组织未见明显异常。镜检:肿瘤边界不清,肿瘤细胞主要呈实性片状、结节状及缎带状,局部可见分化好及分化不全的小管和微囊样结构,分布于多少不等的纤维性间质中,部分区域见明显的硬化性间质及玻璃样变(图1);肿瘤细胞中等大小,细胞核多形性,核仁不明显,核分裂易见(>5/10 HPF);可见坏死(图2)、出血及脉管内瘤栓(图3)。
2.2 免疫表型肿瘤细胞CD56、Cyclin D1、vimentin均阳性,S-100、Calretinin部分阳性,SF-1、CD99弱阳性,β-catenin核阳性(图4);CK、EMA、SALL4、OCT3/4、PLAP、CK7、CD30、HMB-45、Melan-A、CD45、Syn、CgA、Myogenin和MyoD1均阴性;多次检测α-inhibin、WT-1及D2-40均阴性;Ki-67增殖指数约20%。
2.3 高通量测序检测本实验检测出肿瘤易感基因16个及驱动基因4个,通过CGC数据库、FACD数据库等进行筛选,最终筛选出6个易感基因(FN1、KCNJ5、ROBO2、AHNAK、MLLT4、ACSL6)、3个驱动基因(RSRC1、ARID1A、SEPT6)发生错义突变及1个驱动基因(CTNNB1)非移码缺失。其中FN1(c.C5294T:p.T1765I;c.C5294T:p.T1765I)、ROBO2(c.G3914A:p.R1305Q)、AHNAK(c.C5216T:p.A1739V)、ACSL6(c.G1050A:p.M350I;c.G1008A:p.M336I)及ARID1A(c.A317C:p.N106T)基因编码的蛋白可表达于睾丸。CTNNB1基因8号外显子发生缺失突变(c.1082_1099del:p.361_367del),导致蛋白结构发生改变(图5A、B)。
2.4 随访患者术后随访至2022年2月,身体状态良好,定期复查,未行其余治疗。
3 讨论
SCT起源于生精小管内的支持细胞,其组成细胞表现为胎儿期、青春前和成人的不同时期的支持细胞,占睾丸肿瘤的比例不足1%,发病率次于睾丸间质细胞瘤。WHO(2016)泌尿系统和男性生殖器官肿瘤分类根据组织学特征及基因改变的不同,将SCT分为三类:(1)非特殊型SCT:最为常见,约占70%,无遗传特征性,常见CTNNB1基因突变。(2)大细胞钙化性SCT:可为双侧多发病变,60%以上为散发病变,约1/3病例与Carney综合征有关[2-3]。(3)小管内大细胞玻璃样变SCT:几乎见于Peutz-Jeghers综合征的男孩[4],常与STK11基因突变有关。
文献报道[5]SCT发病年龄较为广泛(0.6~88岁),中位年龄约26岁。非特殊型SCT大部分为单侧发病,临床上通常表现为无痛性睾丸肿物或增大,实验室检查未见明显特殊。组织学特征与卵巢支持细胞瘤十分相似[6],低倍镜下肿瘤呈结节状,最具特征性的表现为中空或实性的小管分布于多少不等的纤维性间质中,可见弥漫实性片状、巢团状、缎带样、梁索状和单个细胞等不同结构的组合[7];细胞异型性较小,核仁不突出;胞质一般淡染或嗜酸,常有丰富的类脂,胞质透亮。免疫表型上,非特殊型SCT可显示多种表达和分化,肿瘤细胞通常表达vimentin、Calretinin、SF-1、CD99、SOX-9、WT-1等,上皮标记、神经内分泌标记、S-100等不同程度表达。2014年,Perrone等[8]在14例睾丸SCT中发现10例出现CTNNB1基因第3号外显子突变,免疫组化标记大部分病例β-catenin(71.4%)和Cyclin D1(87.5%)染色出现核表达。Zhang等[9]报道33例睾丸非特殊型SCT中有21例β-catenin核阳性(良性非特殊型SCT为14例,MSCT为7例)。因此,β-catenin核异常表达被认为对诊断非特殊型SCT具有较好的灵敏度和高度特异度。
CTNNB1基因位于3q22.1上,编码的β-catenin蛋白是一种细胞膜表面的黏附连接蛋白,参与细胞骨架的形成。β-catenin是致癌Wnt信号通路下游重要的共激活因子[10],CTNNB1基因突变已被证实与多种肿瘤的发生有关。在非肿瘤性的Sertoli细胞中,β-catenin表达于细胞膜和(或)细胞质,当Wnt信号通路被激活,β-catenin被转运至细胞核[10]。同时,调节和激活多种下游靶基因的表达,包括编码Cyclin D1蛋白的CCND1基因,此时免疫组化检测表现为β-catenin细胞核阳性和Cyclin D1阳性。本例与文献报道一致,肿瘤细胞β-catenin胞核阳性和Cyclin D1阳性。
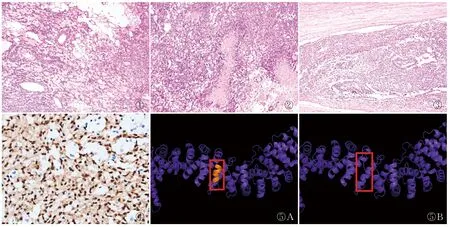
①②③④⑤A⑤B
目前,有关非特殊型SCT的研究均显示在CTNNB1基因的3号外显子即N末端的突变,本例高通量测序技术检测出CTNNB1基因8号外显子缺失突变,导致蛋白结构发生改变,这在非特殊型SCT的报道中尚属首次。8号外显子属于CTNNB1基因的中央编码区[10],其突变仅在肝细胞腺瘤中有报道[11]。赵明等[7]对7例非特殊型SCT进行分析发现,5例β-catenin弥漫异常核表达中4例检测出CTNNB1基因第3外显子点突变,提示可能存在非3号外显子点突变的突变类型。该研究与本例检测结果表明SCT存在更多的突变位点。
同时,本例高通量基因测序检测还发现FN1、ROBO2、AHNAK、ACSL6及ARID1A基因发生错义突变,并且其编码的蛋白可在睾丸中表达。其中需要注意是:ARID1A基因在机体中起肿瘤抑制作用,编码的ARID1A是染色质重组复合物SWI/SNF家族成员,也是SWI/SNF的核心亚基,参与了DNA复制、转录、修复等过程,并与组蛋白共价修饰复合物等进行染色质重塑,在调节基因组结构中起重要作用,其突变或缺失往往与多种肿瘤的发生、发展相关[12]。在生殖系统已被证实40%~50%的卵巢透明细胞癌存在ARID1A基因突变[13]。本例首次在SCT中发现ARID1A基因突变。结合相关文献和对本例的测序结果进行分析表明,除CTNNB1基因外其他的驱动基因改变可能在MSCT的发生、发展过程中同样发挥了重要作用,结果仍需更多的研究及病例积累进一步证实。
睾丸非特殊型SCT的鉴别诊断:(1)睾丸间质细胞瘤,常发生于21~59岁成人,出现睾丸无痛性增大,30%的患者有男性乳腺发育、性欲和性功能受损;形态学上可见中等到大的多角形细胞,胞质丰富嗜酸,胞界清楚,胞质可呈空泡状或泡沫状,部分病例可见特征性的Reinke结晶;免疫组化染色β-catenin无核着色[14-16]。(2)精原细胞瘤,肿瘤细胞较一致,核大、居中、染色质粗糙,可见核仁,胞质丰富呈淡染或透亮,常见肉芽肿反应,间质伴有明显淋巴细胞浸润;肿瘤细胞表达SALL4、OCT3/4等生殖细胞肿瘤标志物有助于鉴别。(3)间皮来源肿瘤,肿瘤细胞可呈多样性,且免疫组化标记Calretinin、CK、WT-1两者均可阳性,易造成诊断困扰,但间皮来源肿瘤细胞D2-40、CK5/6及HBME-1呈阳性,同时不表达性索-间质标志物。
绝大多数非特殊型SCT为惰性或低危性肿瘤,预后较好[1]。当非特殊型SCT组织学标准满足以下5项时诊断为MSCT[1-2]:肿瘤最大径>5 cm、核分裂象>5个/10 HPF、中~重度核非典型性、脉管侵犯及肿瘤性坏死。此外,睾丸MSCT与非特殊型SCT在免疫表型上几乎无差异。本例肿瘤细胞主要呈实性片状、结节状及缎带状,但局部可见分化好及分化不全的小管和微囊样结构,且β-catenin异常核阳性和Cyclin D1阳性,符合非特殊型SCT诊断标准,同时存在上述所有的恶性特征,因此结合形态学本例最终诊断为MSCT。
综上,睾丸MSCT较为少见,组织学和免疫表型需与其他类型的睾丸肿瘤区分。其分子特征中,MSCT与良性非特殊型SCT均可出现CTNNB1基因改变,免疫组化组化标记β-catenin核阳性及Cyclin D1阳性有助于该病的诊断与鉴别诊断。
