甲状腺细针穿刺细胞学诊断中滤泡性肿瘤的临床病理分析
2022-09-28王珏,何杰
王 珏,何 杰
滤泡性肿瘤/可疑滤泡性肿瘤(follicular neoplasm/suspicious follicular neoplasm, FN/SFN)是甲状腺细胞病理学Bethesda报告系统(The Bethesda System for Reporting Thyroid Cytopathology, TBSRTC)总体分类中Bethesda Ⅳ类诊断。FN/SFN的诊断首次在2007版TBSRTC中被提出,主要是指在涂片中出现一定数量的滤泡细胞,且主要以滤泡结构、微滤泡结构排列为特征的病变,当时并未将具有乳头状癌核型的标本纳入此类诊断。2017版TBSRTC依据WHO分类对甲状腺肿瘤的新分类做出部分改动,将细胞出现轻微乳头状癌核型特征,且同时以滤泡结构为排列特征的病例归入FN/SFN[1]。由于FN/SFN包括了在形态上有互相重叠的多种病变,因此细胞学水平的鉴别困难,继而导致了这部分病变的临床管理困难[2]。本文通过回顾性分析36例细胞学诊断为SFN后经手术切除的病例,对比分析细胞学形态及组织学诊断结果,旨在探讨FN/SFN的诊断及临床管理。
1 材料与方法
1.1 一般资料收集2020年1月~2021年12月中国科学技术大学附属第一医院(安徽省肿瘤医院)病理科行细针穿刺细胞学(fine needle aspiration cytology, FNAC)检查诊断为SFN且行手术切除治疗的病例,合计36例。所有病例B超检查均提示3级及以上的甲状腺结节。
1.2 方法涂片制备:在B超引导下穿刺针刺入甲状腺结节,不同方向来回2~3次穿刺,保持负压抽吸,涂片后立即放入95%乙醇中固定,行HE染色及封片。组织学切片制备:标本均经10%中性福尔马林固定,常规取材,有包膜的结节进行垂直包膜全面取材,脱水、石蜡包埋后切片,行HE染色及封片。根据WHO(2022)甲状腺肿瘤分类标准观察组织学切片。细胞学涂片及组织学切片均由两名高年资病理医师复核诊断。
2 结果
2.1 临床特征36例中,男性8例,女性28例,年龄25~75岁,平均(46.3±11.9)岁。术前B超检查:3级5例,4a级28例,4b级3例,术后结节直径0.4~5.2 cm,其中17例手术切除标本显示结节境界清楚或有完整/不完整的包膜。
2.2 SFN的组织学诊断结果本组36例SFN的组织学诊断结果:滤泡性腺瘤5例(13.9%)、嗜酸细胞腺瘤3例(8.3%)、恶性潜能未定的滤泡性肿瘤(follicular thyroid tumor, uncertain malignant potential, FT-UMP)2例(5.6%)、具有乳头状核特点的非浸润性甲状腺滤泡性肿瘤(noninvasive follicular thyroid neoplasm with papillary-like nuclear features, NIFTP)1例(2.8%)、滤泡性癌3例(8.3%)、乳头状癌5例(13.9%)、良性滤泡性结节15例(41.7%)及甲状旁腺肿瘤2例(5.6%)。
2.3 SFN的细胞学形态分类36例FNAC标本均为合格的细胞学标本,行甲状腺部分切除术后组织学诊断结果多样。镜下细胞涂片均以滤泡结构为主。大部分(91.7%)病例可以观察到排列拥挤的细胞,部分(50.0%)病例伴微滤泡形成,少数(19.4%)可见乳头状结构。其中部分病例可见核增大、淡染、核沟等非典型改变,细胞核增大更常见(41.7%),少数可见局限性核沟等甲状腺乳头状癌(papillary thyroid carcinoma, PTC)核型(11.1%),另有部分病例可见嗜酸细胞(19.4%)(表1)。

表1 36例SFN的细胞学特征[n(%)]
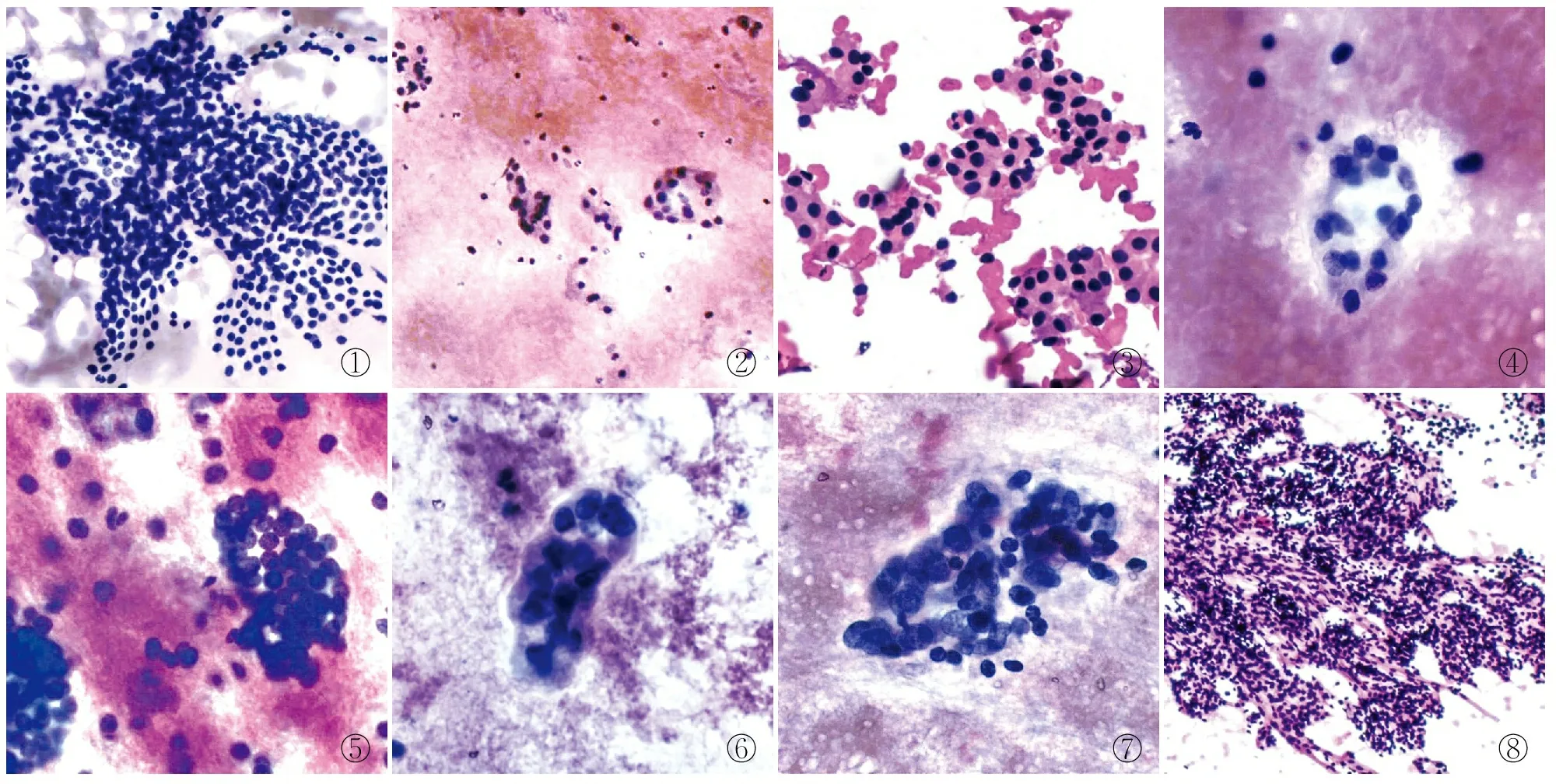
15例SFN(41.7%)术后组织学检查证实为非肿瘤性病变,大部分为结节性甲状腺肿的增生性结节,镜下可见排列拥挤的滤泡结构,少数也可见乳头状结构(图1),大部分细胞形态属良性改变,但部分病例也可观察到局灶性的核非典型性改变,大部分病例的细胞量仍然较典型的肿瘤性病例少。
①②③④⑤⑥⑦⑧
14例SFN(38.9%)术后组织学检查证实为真正的滤泡性肿瘤,包括5例滤泡性腺瘤(图2),3例嗜酸细胞腺瘤(图3),3例滤泡性癌,2例FT-UMP(图4、5)以及1例NIFTP(图6、7)。3例嗜酸细胞腺瘤中1例诊断SFN,Hürthle细胞型;2例诊断SFN,涂片中可见伴嗜酸性变的滤泡上皮细胞,但Hürthle细胞量不够丰富且无明显异型性。14例滤泡性肿瘤中7例(50.0%)涂片均可见局灶或弥漫的核增大,包括良性、恶性及低风险肿瘤。
NIFTP和滤泡性甲状腺乳头状癌(follicular variant of papillary thyroid carcinoma, FVPTC)的诊断至少需要有轻微的PTC核型出现。本组1例NIFTP中局灶可见PTC核型特点细胞。PTC核型细胞的数量稀少及形态不典型是造成该类病例细胞涂片鉴别诊断困难的主要原因。本组未出现FVPTC病例。
5例SFN(13.9%)组织学诊断结果为乳头状癌,涂片内细胞排列拥挤及核增大均易见,仅3例经仔细复查可见少数细胞具有PTC核型的细微特征。手术标本可见病灶直径0.2~0.4 cm,均属于微小癌诊断。
2例甲状旁腺肿瘤术前FANC诊断为SFN,其中1例为甲状旁腺腺瘤(图8),1例为甲状旁腺癌。细胞学涂片极为类似肿瘤性滤泡病变的结构与细胞形态,可见梁状排列的细胞滤泡,排列拥挤,细胞一致,细胞界限不清,瘤细胞核轻度增大,易见裸核样改变。其中1例组织学切片镜下见明显的包膜血管侵犯及多结节状生长模式,诊断甲状旁腺癌。
3 讨论
3.1 FN/SFN诊断标准变更对诊断的影响WHO(2017)甲状腺肿瘤新分类中新增了交界性肿瘤[3],WHO(2022)甲状腺肿瘤分类将这部分肿瘤更名为低风险肿瘤,强调这些肿瘤具有极低的转移可能性,包括NIFTP、UMP和透明变梁状肿瘤(hyalinizing trabecular tumor, HTT)[4]。NIFTP被认为是一种甲状腺滤泡原位癌或异型增生[5],临床病程缓慢。有可疑的包膜、血管浸润的滤泡性腺瘤为UMP。UMP中有PTC核型细胞者诊断为恶性潜能未定的高分化肿瘤(well-differentiated tumor of uncertain malignant potential, WDT-UMP),无PTC核型细胞的为FT-UMP。甲状腺肿瘤分类的变更对甲状腺FNAC诊断产生了影响[6]。2017版TBSRTC将排列方式有滤泡性肿瘤特征,但出现了轻微至中度PTC核型特征的病例归入FN/SFN范畴[7]。这表示在细胞学诊断中,NIFTP及WDT-UMP被纳入FN/SFN中,而FVPTC被排除至FN/SFN之外。
NIFTP及UMP同属于需要提示临床给予手术处理的FN/SFN病变。NIFTP涂片PTC核特征往往比浸润性PTC更为轻微和局灶。与浸润性PTC相比,NIFTP的细胞核偏小,偏圆,轻度拉长,不如PTC细胞拥挤,核沟纤细或局灶可见。NIFTP通常无乳头、砂粒体和核内假包涵体。
FVPTC中只要出现典型的PTC核型细胞,无论数量多少,均容易作出BethesdaⅤ类或Ⅵ类诊断,而不会将其归入FN/SFN。但当涂片中部分细胞呈现轻微核改变时则需要谨慎考虑,因为这些改变亦可伴发于良性反应性及低风险病变。
这些病变在组织学水平的鉴别需要关注细胞PTC核型的程度及范围,浸润及可疑浸润的表现,而在细胞学水平的鉴别则只有依据镜下特征,并紧密结合超声影像。因此,具有PTC核型的甲状腺结节如果在影像学上表现为包膜完整或境界清楚,缺乏浸润证据,细胞学鉴别诊断往往较困难,此时病理报告需要描述PTC核型细胞的数量及程度,提示该结节有NIFTP、UMP或FVPTC的可能。
3.2 临床操作对FN/SFN诊断的影响本组FN/SFN组织学诊断为乳头状癌的病例均属经典型微小癌,病灶直径均<5 mm,这种微小癌的漏诊可能与穿刺操作相关。
对于甲状旁腺肿瘤,可能因临床及影像学均无法明确病变的确切位置,同时因细胞涂片内甲状旁腺腺瘤的细胞与拥挤重叠的滤泡细胞极为相似,因此最常误诊为甲状腺FN/SFN。文献总结发现甲状旁腺肿瘤穿刺涂片中常有多量裸核,斑块状染色质、血管增生,胶质的完全缺失,这些表现需警惕甲状旁腺组织及病变[8]。另外,需密切结合影像及临床血清学甲状旁腺素水平进行综合判断。
嗜酸细胞病变可以出现在甲状腺增生到肿瘤的病变中,嗜酸细胞的高比例是嗜酸细胞肿瘤在FNAC的重要特点,穿刺操作的局限性可能导致细胞学诊断有偏差。
3.3 FN/SFN的临床管理FN/SFN鉴别诊断的主要目的不是得出绝对诊断,而是对患者进行正确管理。根据2017版TBSRTC,FN/SFN恶性风险为10%~40%。本组36例FN/SFN患者全部行手术治疗,其中12例(33.3%)组织学诊断为低风险或恶性肿瘤,9例(25.0%)为良性肿瘤,另有高达15例(41.7%)病例为结节性甲状腺肿中增生的滤泡结节。因此对所有FN/SFN病例进行腺叶切除可能会导致许多不必要的手术。2015年美国甲状腺协会(American Thyroid Association, ATA)指南建议综合考虑临床、超声以及包括BRAF、RAS等在内的基因检测,进行选择性手术治疗[9]。
有研究者将诸如结节触诊硬度、生长迅速、疼痛及直系亲属甲状腺癌病史等因素用于细胞学诊断不明确的风险评估中[10]。
甲状腺结节的恶性超声征象包括低回声、边缘不规则不清晰、微钙化、结节纵横比>1等特征。有关于Hürthle细胞瘤的研究发现[11],在多变量分析中超声等级和肿瘤大小是组织学恶性的独立预测因素。在滤泡性癌的研究中亦发现肿瘤直径>4 cm预示预后不良,因此尽管外科医师对细胞学诊断怀疑为滤泡性肿瘤的手术指征有一定的差异,但肿瘤大小和超声等级仍然是是否选择手术治疗的重要指征。
BRAF V600E检测对FN/SFN中恶性疾病诊断有一定的辅助作用,但敏感性较低[12],滤泡性肿瘤中较常出现RAS突变[13]。文献报道滤泡性腺瘤、30%~40%的滤泡性癌及一少部分的嗜酸性细胞癌中均可发现PAX8/PPARγ重排,另外可以通过FISH检测RET/PTC易位。
综上所述,虽然FN/SFN术后组织病理类型范围广泛,且由于细胞学的局限性无法做到完全的鉴别诊断,但仍然可以结合细胞学形态、结构特点及超声、检验、分子检测结果进行综合评估,最大程度避免漏诊及过度诊断。细胞学医师客观的诊断及描述更利于FN/SFN准确的临床管理。
