热浸镀锌层界面的微区电化学腐蚀行为
2022-09-27林学亮王友彬辛延琛高锋韦悦周ToyohisaFUJITA
林学亮,王友彬,辛延琛,高锋,韦悦周,Toyohisa FUJITA
热浸镀锌层界面的微区电化学腐蚀行为
林学亮,王友彬,辛延琛,高锋,韦悦周,Toyohisa FUJITA
(广西大学 a.广西有色金属及特色材料加工重点实验室 b.资源环境与材料学院,南宁 530004)
探究钢铁热浸镀锌的镀层/钢基体界面的微区电化学特性及腐蚀行为。采用扫描电化学显微镜(SECM)分析技术,研究镀层/钢基体界面在0.1 mol/L NaCl溶液腐蚀过程中微区电流的演变过程,结合扫描电镜(SEM)、能谱仪(EDS)、3D显微镜以及X射线衍射技术(XRD)等分析腐蚀产物的物相组成与分布规律。在腐蚀过程中,镀锌钢的腐蚀产物主要分布在热浸镀锌层界面处靠近钢基体的一侧,在镀锌层表面的分布较少,腐蚀产物主要由Zn5(OH)8Cl2、Zn5(OH)6(CO3)2与ZnO等物相组成。在腐蚀开始阶段,钢基体区域的SECM还原电流(=1.2)大于镀锌层(=1.1)。随着腐蚀时间的延长,镀层/钢基体界面处的SECM还原电流整体降低,同时在界面靠近钢基体一侧存在电流凹陷区(=1.0),表明腐蚀产物主要沉积在此处,并对镀层的腐蚀起到保护作用。此外,在腐蚀过程中氧气的消耗主要发生在钢基体区域,随着腐蚀时间的增加,镀层和钢基体表面的溶解氧含量都逐渐降低。在浸泡腐蚀过程中,镀锌层作为阳极,溶解生成Zn2+,并向钢基体区域扩散,同时钢基体表面消耗氧气,还原形成OH–向镀锌层区域扩散。Zn2+与OH–以及溶液中其他离子结合,生成腐蚀产物,在靠近镀层/钢基体界面处的钢基体一侧沉淀,对钢基体起到一定的保护作用。
微区电化学;热浸镀锌;界面;扫描电化学显微镜;腐蚀行为;
热浸镀锌是钢铁腐蚀防护最常用的表面处理技术,钢铁表面的热浸镀锌层由表层的纯锌层(η-Zn)和内部的锌铁合金层组成。表面镀锌层主要通过隔离防护与牺牲阳极性能来防止钢基体的腐蚀[1-2],因其耐腐性较强,而广泛应用于各种行业,如汽车板材、输电铁塔、石油化工输油管及海洋装备等[3]领域。
镀锌钢在服役使用前,不可避免地要进行切割组装,切割边缘的钢基体将失去镀锌层的隔离防护而暴露在环境中,可能导致钢基体的腐蚀。此时,镀锌层将向钢基体提供电化学阳极保护,其中钢基体为大阴极,锌镀层为小阳极,两者面积差距较大。关于镀锌层在这种情况下如何提供电化学阳极保护的研究较少,因此需要深入探究镀锌钢横截面的电化学腐蚀行为,特别是镀锌层/钢基体界面的微区电化学行为。宏观电化学分析方法[4-7](如电化学阻抗谱和极化曲线等),空间分辨率较低,只能得到镀锌钢横截面的平均腐蚀信息[8],无法深入表征镀层/钢基体界面的微区腐蚀行为。因此,需要借助具有高空间分辨率的微探针电化学系统来分析热浸镀锌层界面的腐蚀行为。
目前用来分析微区腐蚀的微探针电化学技术有扫描电化学显微镜(SECM)[9-10]、局部电化学交流阻抗谱(LEIS)[11-12]、扫描开尔文探针(SKP)[13-14]、扫描参比电极技术(SRET)[15-16]和扫描振动电极技术(SVET)[17-20]等。其中扫描电化学显微镜技术(SECM)具有较高的空间分辨率,可用于表征各种微区的电化学反应,如金属表面钝化膜的降解过程[21-22]、有机涂层的缺陷行为[23-24],金属的点蚀行为[25-26]以及金属之间的电偶腐蚀[27-28]等。已有研究人员采用SECM研究镀锌钢的电化学腐蚀行为,如Marques等[29]利用SECM和SVET技术联合研究了不同pH溶液中镀锌钢界面微区腐蚀电化学电流的分布。Fernández- Pérez等[30]利用SECM分析了镀锌钢在浸泡腐蚀过程中溶液的氧气与pH值的分布规律。目前关于钢铁热浸镀锌界面的微区腐蚀研究主要集中在探究微区电流和pH值的分布规律,对微区腐蚀过程中腐蚀产物形成行为的探究较少。腐蚀产物的沉淀分布状态将影响热浸镀锌界面的微区电化学行为,进而影响微区腐蚀电流的分布。因此,探究腐蚀产物在热浸镀锌层界面的分布和形成机理,有助于深入理解热浸镀锌界面的微区电化学腐蚀机理。
本工作旨在利用SECM探究热浸镀锌层界面在0.1 mol/L NaCl溶液中的微区电化学腐蚀行为,分析了浸泡腐蚀过程中,镀锌层/钢基体界面区域的反应活性电流、氧气的分布规律及原因,探讨腐蚀产物在界面区域的分布规律及形成机理,揭示镀锌层/钢基体界面的微区电化学腐蚀机理。
1 试验
1.1 样品的制备
试验采用的Q235钢板(化学成分见表1),厚度为2 mm,用锌锭(0#,≥99.995%)熔融后作为热浸镀镀液。采用溶剂法浸镀工艺制备镀锌层,首先用10%(质量分数)NaOH水溶液碱洗Q235钢板,去除钢铁表面的油脂,用蒸馏水清洗干净。接着在16%HCl水溶液中酸洗,除去表面的氧化物,用蒸馏水清洗干净。将Q235钢片在15%ZnCl2+15%NH4Cl的水溶液中进行助镀处理,在120 ℃下烘干Q235钢板表面的助镀剂。最后将钢片放入450 ℃的锌液中热浸镀3 min,获得的Q235钢表面镀锌层厚度约为80 μm。
表1 Q235钢化学成分

Tab.1 Chemical composition of Q235 steel wt.%
将镀锌钢加工为10 mm×10 mm×2 mm的尺寸,试样用环氧树脂密封,只保留镀锌钢的横截面裸露。将镀锌钢横截面试样依次用320#、600#、1200#、2500#和5000#砂纸磨抛,然后用0.3 μm的金刚石抛光膏抛光至镜面,用纯水超声清洗去除表面吸附物,最后用酒精清洗,并在空气中干燥。
1.2 SECM测试
采用上海辰华CHI920d扫描电化学显微镜系统(如图1所示)对样品进行表征,采用双恒电位仪四电极测试体系,10 μm的Pt丝为探针工作电极,镀锌钢为基底工作电极,Pt丝为对电极,Ag/AgCl电极为参比电极。镀锌钢基底工作电极在测试中设置为开路,腐蚀溶液为1 mmol/L FcMeOH+0.1 mol/L NaCl,分别进行SECM反馈模式和竞争模式分析。测试结束后,使用无量纲电流对SECM电流数据进行归一化,用=/lim绘制电流分布图,即探针线扫描电流值与探针远离基底的稳态电流之比,表示探针的测试电流,lim表示探针远离样品时的稳态电流。
1.3 结构及形貌分析
采用SEM(SU8220,Hitachi,Japan)分析浸泡腐蚀前后热浸镀锌层界面的微观形貌,并采用能谱仪(QUANTAX,Bruker,Germany)分析镀锌钢及其腐蚀产物的元素成分组成。将热浸镀锌层界面的腐蚀产物剥离收集,然后采用XRD(D/MAX 2500 V,Rigaku,Japan)分析腐蚀产物的物相结构,XRD工作时采用Cu靶Kα线,电压为40 kV,电流为200 mA,扫描角度为10°~80°,扫描速率为8 (°)/min,数据分析用Jade 6.5软件完成。采用3D显微镜(DVM6,Leica,Germany)获得浸泡腐蚀不同时间后热浸镀锌层界面的三维腐蚀形貌。

图1 SECM实验装置
2 结果与讨论
2.1 热浸镀锌层界面腐蚀产物的分布
Q235钢/镀锌层的界面微观组织及相应的EDS成分的线扫描如图2所示。在热浸镀过程中,Fe和Zn相互扩散,在钢表面形成锌铁合金镀层。根据镀锌层中Fe与Zn的含量分布,可将镀锌层分为δ-FeZn10子层、ζ-FeZn13子层以及最外层的η-Zn子层[3]。
热浸镀锌层界面区域的三维腐蚀形貌随浸泡时间的变化如图3所示。在浸泡腐蚀刚开始时,镀层/钢基体界面的高度差较小。经过1 h的浸泡腐蚀后,腐蚀产物开始沉积到钢基体的表面。随着浸泡时间的增加,越来越多的腐蚀产物沉积到钢基体表面。浸泡腐蚀3 h后,腐蚀产物与镀锌层的高度差约10 μm。腐蚀产物主要分布在热浸镀锌层界面处靠近钢基体的一侧,在镀锌层表面的分布较少。

图2 热浸镀锌层界面的形貌(a)及相应的EDS线扫描成分(b)
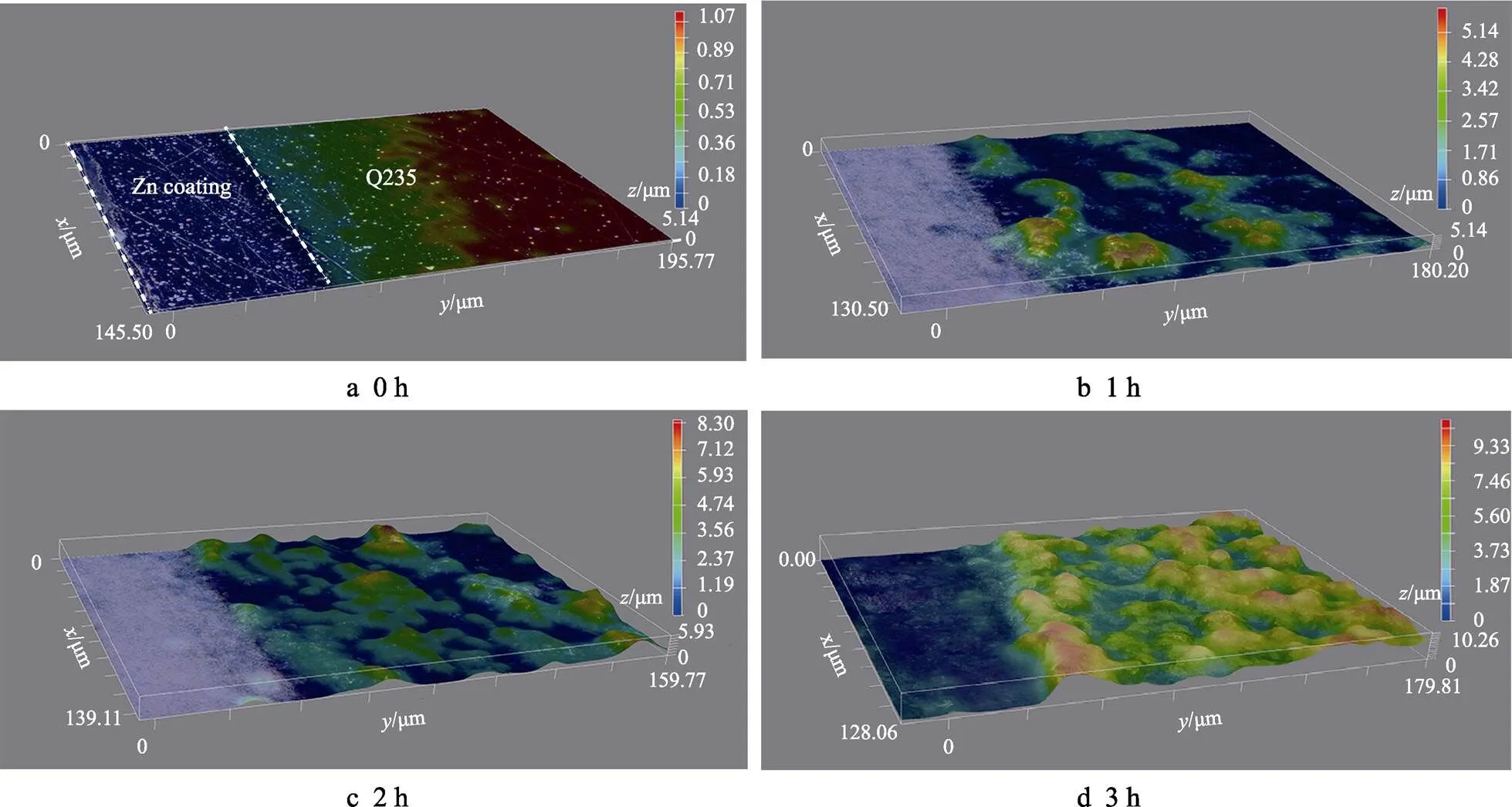
图3 热浸镀锌层界面浸泡腐蚀不同时间后的三维形貌
2.2 热浸镀锌层界面的SECM微区电化学分析
为了确定FcMeOH在NaCl溶液中的稳定性,并选择合适的SECM探针电位,对溶液进行循环伏安分析。图4描绘了溶液中FcMeOH的电化学氧化还原反应,电位高于0.2 V时,对应于二茂铁的氧化反应[31];在电位值高于0.3 V时,FcMeOH极限扩散电流基本趋于稳定。据此,将SECM探针电极电位设置在0.5 V,此时的反应见式(1)。
FcMeOH→FcMeOH++e–(1)

图4 SECM探针在0.1 mol/L NaCl + 1 mmol/L FcMeOH溶液中的循环伏安曲线(扫描速率为0.1V/s)
由于SECM探针上施加的电位能够使FcMeOH氧化成FcMeOH+,通过探针电流的大小可以分析溶液中FcMeOH的含量。同时,镀锌钢基底电极可将FcMeOH+还原为FcMeOH,但热浸镀锌层界面不同区域的电化学还原能力不同,使得溶液中FcMeOH的分布出现差别,引起探针电流的变化。因此,此方法可用于跟踪热浸镀锌层界面腐蚀过程中表面的还原电流随时间的演变,从而判断热浸镀锌层界面不同区域的电化学活性。
氧还原电流采用Pt丝探针工作电极进行检测,铂丝探针电极在腐蚀液中较稳定,不易被腐蚀而改变表面状态。在0.1 mol/L NaCl溶液中,溶解氧的电化学还原反应如图5所示。在–0.4 V时,开始发生溶解氧的还原,见式(2)。当电位低于–0.9 V时,出现析氢现象。因此,检测溶液中氧气的分布时,可将探针电位设置在–0.4~–0.9 V。本试验的探针电极的电位设置为–0.7 V,在此电位只发生氧的还原反应,探针的电流大小仅与溶解氧的含量有关,通过分析氧还原电流的大小来表征探针位置溶解氧含量的高低[32]。
O2+4e–+H2O→4OH–(2)
对于镀锌钢基底电极,在发生电化学腐蚀反应时,阴极发生氧气的还原反应,在微观尺度上,导致镀层/钢基体界面溶解氧分布不均匀。通过探针电流的变化,可表征镀层/钢基体界面溶解氧含量的分布,从而分析热浸镀锌层界面的微区电化学腐蚀行为。
在0.1 mol/L NaCl溶液中,热浸镀锌层界面不同浸泡时间下的SECM线扫描曲线。电流分布曲线显示,SECM电流的最大值位于钢基体的上方,且距离镀锌层有一定的距离,靠近镀层/钢基体界面区域的钢基体上方电流值较小,存在明显的电流凹陷区。镀层/钢基体界面分为3个不同电化学行为的区域:镀锌层表面的阳极区(A),2个金属表面之间的低活性区域(B)以及钢基体中间区域的阴极区(C)。从图3腐蚀产物的分布可知,腐蚀产物主要分布在B区域,其电流较小可能是腐蚀产物的覆盖导致的。随着腐蚀时间的增加,探针电流值逐渐减小,说明电化学反应逐渐变慢,是由于热浸镀锌层界面逐渐沉积腐蚀产物,使表面导电性降低。钢基体两侧镀锌层的电流分布不一致,线扫描开始侧镀层的电流高于结束侧。这可能是由于样品在制备过程中的细微差异[33]或者探针在扫描的过程中吸附物质,降低了探针对FcMeOH的氧化速率,导致电流下降[29]。

图5 SECM探针在0.1 mol/L NaCl溶液中的循环伏安曲线(扫描速率为0.1 V/s)

图6 热浸镀锌层界面在0.1 mol/L NaCl + 1 mmol/L FcMeOH溶液中浸泡不同时间的SECM线扫描电流分布(探针电位为 0.5 V,探针–基底距离为30 μm,扫描速率20 μm/s)
为了进一步探究热浸镀锌层界面整体的反应活性电流随时间的变化,进行了SECM面扫描测试,其结果如图7所示。图7中的颜色变化代表不同电流值的大小,可以看出,钢基体中间区域的反馈电流值最大,且随着腐蚀时间的增加,整体的反馈电流逐渐减小。与图6的SECM线扫描的结果基本一致,证明了这些线扫描电流可以代表整个界面的扫描电流,用于快速跟踪发生的腐蚀过程导致表面活性随时间的演变。

图7 热浸镀锌层界面在0.1 mol/L NaCl+0.1 mmol/L FcMeOH溶液中SECM面扫描电流分布
0.1 mmol/L FcMeOH solution with different time
通过分析SECM 探针氧还原电流的分布来探究热浸镀锌层界面的溶解氧分布情况。如图8所示,当探针经过热浸镀锌层界面边缘两侧的环氧树脂上时,其氧气浓度接近于电解液中溶解氧的浓度。在钢基体的中间区域,探针的氧还原电流值最小,表明此处的氧气分布较少。钢基体的中间区域在腐蚀过程中作为阴极还原消耗氧气,镀锌层主要发生阳极反应,氧气含量不受影响。随着腐蚀时间的延长,热浸镀锌层界面相同位置的氧还原电流呈下降趋势,说明经过长时间的氧气消耗,热浸镀锌层界面的氧浓度在整体下降。
为了确定热浸镀锌层界面整体的氧气浓度随腐蚀时间的变化,进行了SECM面扫描。热浸镀锌层界面在0.1 mol/L NaCl溶液中浸泡不同时间后的面扫描电流如图9所示。图9中的颜色变化代表不同电流值的大小,可表征微区电化学阳极和阴极行为。从图9中可以看出,随着腐蚀时间的增加,钢基体表面的电流值最小,这主要是由于该区域发生氧气的还原反应,溶液中溶解氧的含量减少,与图8的SECM线扫描的结果基本一致。
2.3 腐蚀产物微观形貌及相组成分析
热浸镀锌层界面浸泡腐蚀4 h后的微观形貌以及腐蚀产物的EDS图谱见图10。从图10a可以看出,在靠近镀层/钢基体界面处的钢基体表面形成了一层腐蚀产物膜,远离界面的钢基体没有明显的腐蚀产物。图10b显示,镀锌层的腐蚀溶解较为明显,存在明显的腐蚀坑,且镀锌层上没有腐蚀产物的覆盖。图10c显示,腐蚀产物膜较为致密,在镀层/钢基体界面靠近钢基体一侧形成连续分布,保护该区域的钢基体不受腐蚀。腐蚀产物的EDS结果显示,其主要由Zn、O、Cl和C等元素组成。对腐蚀产物进行剥离收集,然后进行XRD分析(如图11所示),腐蚀产物为Zn5(OH)8Cl2)、Zn5(OH)6(CO3)2和ZnO。

图8 热浸镀锌层界面在0.1 mol/L NaCl溶液中浸泡不同时间的SECM线扫描电流分布图(探针电位为– 0.7 V,探针–基底距离为30 μm,扫描速率20 μm/s)
Fig.8 SECM line scan image of interface of the hot-dip galvanized coating after immersion in 0.1 mol/L NaCl solution at different time (the tip potential is –0.7 V, the distance between tip and substrate is 30 μm, the scan rate is 20 μm/s)

图9 热浸镀锌层界面在0.1 mol/L NaCl溶液中SECM面扫描电流分布

图10 镀锌钢浸泡腐蚀4 h后的微观组织
图11 热浸镀锌层界面在0.1 mol/L NaCl溶液中浸泡腐蚀4 h后的X射线衍射图谱
Fig.11 XRD pattern of interface of the hot-dip galvanized coating after corrosion in 0.1 mol/L NaCl solution for 4 h
2.4 热浸镀锌层界面的腐蚀机理
热浸镀锌层界面在0.1 mol/L NaCl溶液中的电化学腐蚀如图12所示。由图12a可知,在浸泡腐蚀的初始阶段,镀锌层发生阳极反应,见式(3),溶解产生Zn2+,并向钢基体扩散,随着距离镀锌层区域的增加,Zn2+的浓度逐渐降低。钢基体区域发生氧还原反应,见式(4)。从图8的氧浓度分析可知,在离镀层/钢基体界面较远的区域氧还原反应较快,OH–的浓度较高,逐渐向镀锌层区域扩散。Zn2+与OH–以及溶液中的Cl–、CO32–等离子发生式(5)—(7)所示的反应,在靠近镀层/钢基体界面处钢基体一侧沉淀形成腐蚀产物,对钢基体起到保护作用。由于扩散到镀锌层表面的OH–与镀层表面过量的Zn2+主要形成ZnOH+,见式(8),导致镀锌层表面沉淀的腐蚀产物较少。随着腐蚀时间的增加,Zn2+的浓度增加,扩散的距离更远,腐蚀产物也逐渐向远离钢/镀层界面处沉淀,覆盖区域逐渐变宽变厚,如图12b所示。
Zn→Zn2++2e–(3)
O2+4e-+H2O→4OH–(4)
5Zn2++6OH-+2CO32–→Zn5(OH)6(CO3)2(5)
5Zn2++8OH-+2Cl–→Zn5(OH)8Cl2(6)
Zn2++2OH–→Zn(OH)2(ZnO + H2O) (7)
Zn2++OH–→ZnOH+(8)
图12 热浸镀锌层界面在0.1 mol/L NaCl溶液中的腐蚀示意图
Fig.12 Schematic diagrams of corrosion process of interface of the hot-dip galvanized coating in 0.1 mol/L NaCl solution
3 结论
1)钢基体区域的SECM还原电流大于镀锌层,说明钢基体的还原活性大于镀锌层。在镀层/钢基体界面靠近钢基体一侧存在电流凹陷区,是由于此区域被腐蚀产物覆盖,导致其表面还原活性降低。与钢基体两侧的镀锌层相比,溶解氧在钢基体区域分布较低,因为在腐蚀过程中钢基体作为阴极,发生溶解氧的还原反应,随着反应时间的增加,镀层和钢基体表面的氧含量都逐渐降低。
2)镀锌层发生阳极溶解产生Zn2+,并向钢基体扩散,钢基体区域发生阴极氧还原形成OH-,逐渐向镀锌层区域扩散,Zn2+与OH-以及溶液中的其他离子结合形成腐蚀产物,主要沉积在钢/镀层界面处靠近钢基体的一侧。腐蚀产物膜连续致密,主要由Zn5(OH)8Cl2、Zn5(OH)6(CO3)2与ZnO等物相组成。
[1] HAMAD B S, JUMAA G K. Bond Strength of Hot-Dip Galvanized Hooked Bars in High Strength Concrete Structures[J]. Construction and Building Materials, 2008, 22(10): 2042-2052.
[2] PADILLA V, GHODS P, ALFANTAZI A. Effect of De-Icing Salts on the Corrosion Performance of Galvanized Steel in Sulphate Contaminated Soil[J]. Construction and Building Materials, 2013, 40: 908-918.
[3] MARDER A R. The Metallurgy of Zinc-Coated Steel[J]. Progress in Materials Science, 2000, 45(3): 191-271.
[4] MANSFELD F. Use of Electrochemical Impedance Spectroscopy for the Study of Corrosion Protection by Polymer Coatings[J]. Journal of Applied Electrochemistry, 1995, 25(3): 187-202.
[5] DUBUISSON E, LAVIE P, DALARD F, et al. Study of the Atmospheric Corrosion of Galvanised Steel in a Micrometric Electrolytic Droplet[J]. Electrochemistry Communications, 2006, 8(6): 911-915.
[6] 刘胜林, 孙亮, 袁毅, 等. 热镀锌层在模拟湿热酸性大气环境中的耐蚀性研究[J]. 表面技术, 2015, 44(2): 99-104.
LIU Sheng-lin, SUN Liang, YUAN Yi, et al. Research on the Corrosion Resistance of Hot Dip Galvanized Coating in Simulated Hot and Humid Acidic Atmospheric Environment[J]. Surface Technology, 2015, 44(2): 99-104.
[7] 李新梅, 李秀莲, 张忠文, 等. 输电塔塔腿镀锌层电化学腐蚀性能研究[J]. 表面技术, 2018, 47(2): 189-194.
LI Xin-mei, LI Xiu-lian, ZHANG Zhong-wen, et al. Electrochemical Corrosion Resistance of Cold Galvanized Coating on Transmission Tower Legs[J]. Surface Technology, 2018, 47(2): 189-194.
[8] VÖLKER E, INCHAUSPE C G, CALVO E J. Scanning Electrochemical Microscopy Measurement of Ferrous Ion Fluxes during Localized Corrosion of Steel[J]. Electrochemistry Communications, 2006, 8(1): 179-183.
[9] AMEMIYA S, BARD A J, FAN F R F, et al. Scanning Electrochemical Microscopy[J]. Annual Review of Analytical Chemistry (Palo Alto, Calif), 2008, 1(2): 95-131.
[10] 周亚茹, 朱泽洁, 聂林林, 等. 氯离子浓度对Ni-P合金涂层失效过程影响的SECM实验和COMSOL模拟研究[J]. 表面技术, 2016, 45(7): 8-16.
ZHOU Ya-ru, ZHU Ze-jie, NIE Lin-lin, et al. The Effect of Chloride Ion on Corrosion Behavior of Ni-P Alloy Coating Using SECM Experiment and COMSOL Simulation[J]. Surface Technology, 2016, 45(7): 8-16.
[11] DONG C F, SHENG H, AN Y H, et al. Corrosion of 7A04 Aluminum Alloy under Defected Epoxy Coating Studied by Localized Electrochemical Impedance Spectroscopy[J]. Progress in Organic Coatings, 2010, 67(3): 269-273.
[12] SINEBRYUKHOV S L, GNEDENKOV A S, MASHTALYAR D V, et al. PEO-Coating/Substrate Interface Investigation by Localised Electrochemical Impedance Spectroscopy[J]. Surface and Coatings Technology, 2010, 205(6): 1697-1701.
[13] PAN Tong-yan. Corrosion Behavior of a Duplex Stainless Steel under Cyclic Loading: A Scanning Kelvin Probe Force Microscopy (SKPFM) Based Microscopic Study[J]. Journal of Applied Electrochemistry, 2012, 42(12): 1049-1056.
[14] SYKES J M, DOHERTY M. Interpretation of Scanning Kelvin Probe Potential Maps for Coated Steel Using Semi-Quantitative Current Density Maps[J]. Corrosion Science, 2008, 50(10): 2773-2778.
[15] MAILE F J, SCHAUER T, EISENBACH C D. Evaluation of the Delamination of Coatings with Scanning Reference Electrode Technique[J]. Progress in Organic Coatings, 2000, 38(2): 117-120.
[16] AKID R, MILLS D J. A Comparison between Conventional Macroscopic and Novel Microscopic Scanning Electrochemical Methods to Evaluate Galvanic Corrosion[J]. Corrosion Science, 2001, 43(7): 1203-1216.
[17] HE J, GELLING V J, TALLMAN D E, et al. A Scanning Vibrating Electrode Study of Chromated-Epoxy Primer on Steel and Aluminum[J]. Journal of the Electrochemical Society, 2000, 147(10): 3661-3666.
[18] KHOBAIB M, RENSI A, MATAKIS T, et al. Real Time Mapping of Corrosion Activity under Coatings[J]. Progress in Organic Coatings, 2001, 41(4): 266-272.
[19] ALVAREZ-PAMPLIEGA A, TARYBA M G, DEN BERGH K V, et al. Study of Local Na+ and Cl– Distributions during the Cut-Edge Corrosion of Aluminum Rich Metal-Coated Steel by Scanning Vibrating Electrode and Micro-Potentiometric Techniques[J]. Electrochimica Acta, 2013, 102: 319-327.
[20] ALVAREZ-PAMPLIEGA A, LAMAKA S V, TARYBA M G, et al. Cut-Edge Corrosion Study on Painted Aluminum Rich Metallic Coated Steel by Scanning Vibrating Electrode and Micro-Potentiometric Techniques[J]. Electrochimica Acta, 2012, 61: 107-117.
[21] GAO Shu-jun, DONG Chao-fang, LUO Hong, et al. Scanning Electrochemical Microscopy Study on the Electrochemical Behavior of CrN Film Formed on 304 Stainless Steel by Magnetron Sputtering[J]. Electrochimica Acta, 2013, 114: 233-241.
[22] XIAO Yi, GU Jian-feng, ZHANG Jun-xi. Semiconductor Property and Corrosion Behavior of Passive Film Formed on Steel with Zinc Coating in 5% NaCl Solution[J]. Arabian Journal for Science and Engineering, 2017, 42(10): 4273-4280.
[23] JENSEN M B, PETERSON M J, JADHAV N, et al. SECM Investigation of Corrosion Inhibition by Tungstate- and Vanadate-Doped Polypyrrole/Aluminum Flake Composite Coatings on AA2024-T3[J]. Progress in Organic Coatings, 2014, 77(12): 2116-2122.
[24] XIA Da-hai, WANG Jian-qiu, WU Zhong, et al. Sensing Corrosion within an Artificial Defect in Organic Coating Using SECM[J]. Sensors and Actuators B: Chemical, 2019, 280: 235-242.
[25] LIU Xiao-lan, ZHANG Tao, SHAO Ya-wei, et al. Effect of Alternating Voltage Treatment on the Corrosion Resistance of Pure Magnesium[J]. Corrosion Science, 2009, 51(8): 1772-1779.
[26] YE Zhen-ni, ZHU Ze-jie, ZHANG Qin-hao, et al. In Situ SECM Mapping of Pitting Corrosion in Stainless Steel Using Submicron Pt Ultramicroelectrode and Quantitative Spatial Resolution Analysis[J]. Corrosion Science, 2018, 143: 221-228.
[27] XAVIER J R. Galvanic Corrosion of Copper/Titanium in Aircraft Structures Using a Cyclic Wet/Dry Corrosion Test in Marine Environment by EIS and SECM Techniques[J]. SN Applied Sciences, 2020, 2(8): 1-10.
[28] SIMÕES A M, BASTOS A C, FERREIRA M G, et al. Use of SVET and SECM to Study the Galvanic Corrosion of an Iron-Zinc Cell[J]. Corrosion Science, 2007, 49(2): 726-739.
[29] MARQUES A G, IZQUIERDO J, SOUTO R M, et al. SECM Imaging of the Cut Edge Corrosion of Galvanized Steel as a Function of pH[J]. Electrochimica Acta, 2015, 153: 238-245.
[30] FERNÁNDEZ-PÉREZ B M, IZQUIERDO J, GONZÁLEZ S, et al. Scanning Electrochemical Microscopy Studies for the Characterization of Localized Corrosion Reactions at Cut Edges of Coil-Coated Steel[J]. Journal of Solid State Electrochemistry, 2014, 18(11): 2983-2992.
[31] WIPF D O, BARD A J. Scanning Electrochemical Microscopy: VII. Effect of Heterogeneous Electron-Transfer Rate at the Substrate on the Tip Feedback Current[J]. Journal of the Electrochemical Society, 1991, 138(2): 469-474.
[32] SOUTO R, FERNÁNDEZ-MÉRIDA L, GONZÁLEZ S. SECM Imaging of Interfacial Processes in Defective Organic Coatings Applied on Metallic Substrates Using Oxygen as Redox Mediator[J]. Electroanalysis, 2009, 21(24): 2640-2646.
[33] OGLE K, MOREL S, JACQUET D. Observation of Self-Healing Functions on the Cut Edge of Galvanized Steel Using SVET and pH Microscopy[J]. Journal of the Electrochemical Society, 2005, 153(1): B1-B5.
Localized Electrochemical Corrosion Behavior of the Interface of Hot-dip Galvanized Coating
1,21,2,1,2,1,2,1,2,1,2
(1. Guangxi Key Laboratory of Processing for Non-Ferrous Metallic and Featured Materials, Guangxi University, Nanning 530004, China; 2. School of Resources, Environment and Materials, Guangxi University, Nanning 530004, China)
This work aims to explore the localized electrochemical characteristics and corrosion behavior of the Zn coating/steel substrate interface of the hot-dip galvanized steel. The evolution of the localized electrochemical current of the Zn coating/steel substrate interface in the 0.1 mol/L NaCl solution is studied by scanning electrochemical microscope (SECM). The distribution and composition of corrosion products are analyzed by scanning electron microscopy (SEM), energy dispersive spectrometer (EDS), 3D microscopy, and X-ray diffraction (XRD). In the corrosion process, the corrosion products are mainly distributed on the surface of the steel substrate close to the interface of coating/steel substrate, and the corrosion products are less distributed on the surface of Zn coating. XRD results show that the corrosion products are mainly composed of Zn5(OH)8Cl2, Zn5(OH)6(CO3)2and ZnO. The SECM reduction current of the steel substrate (=1.2) is larger than that of the Zn coating (=1.1) at the beginning of corrosion, and the whole reduction current of the Zn coating and steel decreases with the prolonging of corrosion time. There is a current depression area (=1.0) on the steel substrate close to the interface, indicating that the corrosion products are mainly deposited in this area and play a protective role in the steel corrosion. In addition, oxygen consumption mainly occurs on the steel substrate area during the corrosion process. With the prolonging of corrosion time, the dissolved oxygen content on the coating and steel substrate gradually decreases. During the process of immersion corrosion, the Zn coating acts as an anode, dissolving to generate Zn2+and spreading to the steel substrate area. At the same time, the OH-forms on the surface of the steel substrate by the oxygen reduction, and diffuses to the Zn coating area. Zn2+combines with OH-and other ions in the solutionto form corrosion products, which will deposit on the steel substrate near the interface of coating/steel substrate, and play a protective role in the steel substrate.
localized electrochemistry; hot-dip galvanized; interface; scanning electrochemical microscopy (SECM); corrosion behavior
2021-09-12;
2021-11-17
LIN Xue-liang (1996-), Male , Master, Research focus: metal corrosion and protection.
王友彬(1985—),男,博士,讲师,主要研究方向为金属的腐蚀与防护。
WANG You-bin (1985-), Male, Doctor, Lecturer, Research focus: metal corrosion and protection.
林学亮, 王友彬, 辛延琛, 等. 热浸镀锌层界面的微区电化学腐蚀行为[J]. 表面技术, 2022, 51(9): 217-225.
TG172
A
1001-3660(2022)09-0217-09
10.16490/j.cnki.issn.1001-3660.2022.09.000
2021–09–12;
2021–11–17
广西自然科学基金面上项目(2021GXNSFAA196046);国家自然科学基金(11975082)
Fund:Guangxi Natural Science Foundation (2021GXNSFAA196046); The National Natural Science Foundation of China (11975082)
林学亮(1996—),男,硕士研究生,主要研究方向为金属的腐蚀与防护。
LIN Xue-liang, WANG You-bin, XIN Yan-chen, et al. Localized Electrochemical Corrosion Behavior of the Interface of Hot-dip Galvanized Coating[J]. Surface Technology, 2022, 51(9): 217-225.
责任编辑:刘世忠
